Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
26. Gripe
Capítulo 26 - Gripe
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de vacunas de uso pediátrico, composición y presentación
4.1. Vacunas inactivadas de administración intramuscular
4.2. Vacuna atenuada de administración intranasal
4.3. Vacuna antigripal para la estación epidémica 2025-2026
4.4. Preparados disponibles de vacuna antigripal para menores de 18 años
- Efectividad de la vacunación antigripal
- Vías de administración
- Indicaciones y esquemas de vacunación
8.1. Recomendaciones sobre vacunación antigripal en niños alérgicos al huevo
8.2. Inmunodepresión y pacientes crónicos
8.3. Vacunación en la embarazada
8.4. Vacunación de los profesionales sanitarios
- Administración con otras vacunas y otros productos
- Efectos adversos
- Contraindicaciones y precauciones
11.1. Contraindicaciones
11.3. Precauciones
12.1. Agentes antivirales utilizados en la quimioprofilaxis de la gripe
12.2. Indicaciones de la quimioprofilaxis
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figura incluidas en el capítulo:
Tabla 26.1. Cepas de la vacuna antigripal para la temporada 2025-2026 (recomendaciones de la OMS)
Tabla 26.2. Vacunas antigripales autorizadas en menores de 18 años comercializadas en España (Fichas técnicas CAV-AEP)
Tabla 26.3. Posología recomendada de la vacunación frente a la gripe estacional para la temporada 2025-2026, según la edad del niño, condición de riesgo y los antecedentes de vacunación antigripal
Tabla 26.4. Recomendaciones de vacunación antigripal del Comité Asesor de Vacunas de la AEP (CAV-AEP) que deben ser consideradas prioritarias para la campaña 2025-2026
Tabla 26.5. Vacunación antigripal universal en la infancia en algunos países relevantes (recomendaciones vigentes a 25 de septiembre de 2025)
Tabla 26.6. Contraindicaciones generales de la vacunación antigripal
Tabla 26.7. Dosis recomendadas de oseltamivir para la profilaxis de la gripe en niños menores de 1 año de edad
Tabla 26.8. Dosificación de los inhibidores de la neuraminidasa para la prevención de la gripe en niños y adolescentes
Figura 26.1. Prevalencia de factores de riesgo por grupos de edad en hospitalizados por gripe confirmada
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Gripe. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-26
1. Puntos clave
- La gripe es una amenaza constante, pone a prueba cada año el sistema sanitario en forma de epidemias, constituyendo un enorme problema de salud pública con elevadas implicaciones socioeconómicas.
- En el niño puede cursar de forma subclínica, aunque en ocasiones puede ser de extremada gravedad, así como complicarse con sobreinfecciones bacterianas graves. En neonatos y lactantes la gripe puede presentarse como un síndrome febril sin foco.
- Los niños son los principales transmisores de la enfermedad. Las tasas de hospitalización en los niños sanos menores de 2 años son similares o incluso superiores a las de las personas de 65 años en adelante.
-
En el momento actual, las vacunas disponibles autorizadas para menores a partir de los 6 meses de edad en España son las vacunas inactivadas trivalentes como propone la OMS bien sean en cultivos en huevos de gallina embrionados o procedentes de cultivos celulares, para su administración por vía intramuscular. A partir de los 2 años está autorizada una vacuna atenuada trivalente de administración intranasal.
-
El CAV-AEP recomienda preferentemente (salvo contraindicación) la vacuna atenuada intranasal a los niños de 2 o más años por su mayor aceptabilidad al evitar los pinchazos, por facilitar la mejora de las coberturas y por su mayor efectividad, particularmente después de una única dosis.
- La eficacia protectora de la vacuna antigripal en pediatría en estudios recientes se ha mostrado generalemente superior a la de los adultos.
- El CAV-AEP recomienda la vacunación sistemática en pediatría entre 6 meses y 17 años inclusive y, por tanto, también a los niños y adolescentes pertenecientes a los grupos de riesgo a partir de los 6 meses de edad; a las personas que puedan transmitir la gripe a los grupos que tienen riesgo de gripe complicada y a los miembros del entorno familiar, cuando existan lactantes menores de 6 meses, ya que estos no pueden recibir la vacuna antigripal.
- Es especialmente importante la recomendación de la vacunación antigripal de todos los profesionales sanitarios, especialmente a los que están en contacto con población pediátrica o con personas vulnerables.
- Es igualmente importante la recomendación de la vacunación antigripal de las embarazadas en cualquier momento del embarazo, con el fin de proteger al niño en los primeros meses de vida mediante los anticuerpos transplacentarios, además de protegerlas a ellas.
- Muchos niños y adolescentes pertenecientes a grupos de riesgo no reciben, por distintas razones, dicha vacunación anual. Es necesario hacer un esfuerzo para transmitir la recomendación de la vacunación antigripal anual frente a la gripe estacional en estos pacientes, así como al personal sanitario en contacto con ellos y a sus cuidadores.
- El CAV-AEP considera que la vacunación antigripal de los niños entre 6 meses y 17 años no incluidos en grupos de riesgo debe ser estimada como sistemática por las autoridades sanitarias por cuanto esta práctica preventiva proporciona al niño y adolescente protección individual y favorece la protección familiar y comunitaria.
- El CAV-AEP considera asimismo que se deben poner todas las medidas disponibles por parte de Salud Pública, personal sanitario y sociedades científicas para conseguir como objetivo principal el aumento de coberturas de todos los niños y adolescentes, especialmente las del grupo de 6 a 59 meses y todos los que pertenezcan a grupos de riesgo.
- La principal medida profiláctica frente a la gripe es la vacunación antigripal. La quimioprofilaxis no es un sustituto de la vacunación antigripal cuando está disponible.
- La quimioprofilaxis frente a la gripe puede usarse para prevenir la infección gripal en niños de alto riesgo expuestos con casos confirmados o durante brotes epidémicos intensos y que no han sido o están incompletamente inmunizados.
- La quimioprofilaxis frente a la gripe puede usarse para prevenir la infección gripal en niños de alto riesgo que no han sido o están incompletamente inmunizados.
- La quimioprofilaxis se puede administrar simultáneamente con la vacuna antigripal inactivada, para proporcionar protección hasta que se desarrolla una respuesta inmune tras la vacunación.
- Los individuos inmunizados con la vacuna de la gripe atenuada administrada por vía intranasal no deben recibir quimioprofilaxis de la gripe durante los 14 días siguientes a recibir la vacuna debido a que las cepas vacunales son susceptibles a los fármacos antivirales utilizados en la quimioprofilaxis.
- Existen 4 fármacos antivirales para el tratamiento de la gripe. Solo el oseltamivir y el zanamivir son los agentes antivirales recomendados para la prevención de la gripe en el niño. El oseltamivir (Tamiflu, Ebilfumin) está aprobado en Europa para el tratamiento de la gripe en adultos y niños, incluidos los recién nacidos a término, cuando el virus gripal está circulando en la comunidad, y para la profilaxis posexposición en personas de 1 año o más y se administra por vía oral, aunque se admite el uso por debajo de un año en caso de posexposición en brotes intensos. El zanamivir (Relenza) está aprobado para la profilaxis de la gripe en niños a partir de 5 años y se administra por vía inhalatoria.
- La amantadina y rimantadina no son activos contra los virus influenza tipo B y existen altos niveles de resistencia frente a los virus A circulantes, por lo que no se recomiendan para la profilaxis de la gripe.
2. Introducción
Los virus de la gripe pertenecen a la familia Orthomyxoviridae y forman los géneros Influenzavirus A, Influenzavirus B, Influenzavirus C e Influenzavirus D. Los causantes de epidemias estacionales son los virus gripales del tipo A y del B. Basándose en sus antígenos de membrana (hemaglutinina [HA] y neuraminidasa [NA]) se clasifican en subtipos. Los causantes de las epidemias estacionales de gripe son los virus influenza de los tipos A y B
Existen dos mecanismos que dan lugar a cambios antigénicos de los virus gripales; los cambios antigénicos menores (deriva antigénica o drift) que dan lugar a los brotes epidémicos anuales y los cambios antigénicos mayores (salto antigénico o shift) responsables de la aparición de las pandemias.
3. Epidemiología de la enfermedad
La gripe se contagia con facilidad de persona a persona a través de las secreciones respiratorias y a través de las manos contaminadas con estas secreciones. Cada año es responsable de unos 1000 millones de casos y entre 300 000 y 650 000 muertes, la mayoría de ellas en personas de más de 65 años. La proporción de población infantil afectada durante las epidemias anuales de gripe varía entre el 30 y 40 % a nivel general, lo que supone más de 100 millones de episodios, cerca de 900 000 hospitalizaciones y 35 000 muertes. Los niños son, por otra parte, los principales vectores de transmisión de la enfermedad, debido a que excretan virus durante más tiempo que los adultos y también porque la carga viral de virus excretados es mucho mayor en estos que en el adulto, lo que los convierte en los principales vectores de la enfermedad. Los causantes de las epidemias estacionales de gripe son los virus influenza de los tipos A y B.
Las tasas de hospitalización asociadas a la gripe varían según los grupos de edad, siendo más elevadas en los primeros meses de la vida. En niños sanos menores de 2 años las tasas de hospitalización son similares o incluso superiores a las de las personas de 65 a 79 años. La morbilidad y mortalidad atribuible a la gripe es enorme, siendo responsable anualmente de la hospitalización de casi 900 000 niños menores de 5 años en todo el mundo. Sin embargo, la letalidad, ocasionada fundamentalmente por complicaciones respiratorias, es muy superior en las personas de edad avanzada (mayores de 79 años) o con enfermedades de base que condicionan un alto riesgo de infección.
Cada temporada los menores de 17 años presentan las mayores tasas de incidencia de gripe, hecho que se repite temporada tras temporada. Hasta el inicio de la vacunación sistemática, las tasas de hospitalización en menores de 4 años eran similares a las de los adultos de más de 65 años con excepción de los mayores de 79 años. Además, una importante proporción de los niños que ingresan por gripe no tienen ningún factor de riesgo conocido. Ver figura 26.1. Al mismo tiempo la gripe estacional es responsable de un gran número de visitas médicas en atención primaria (AP) y consumo de antibióticos. Casi la mitad de los fallecimientos por gripe en niños sucede en pacientes sin factores de riesgo, y se ha estimado que la vacunación antigripal tiene una efectividad del 65 % para prevenir las muertes asociadas a gripe en estos niños.
Figura 26.1. Prevalencia de factores de riesgo por grupos de edad en hospitalizaciones por gripe confirmada en España, 2019-2020.
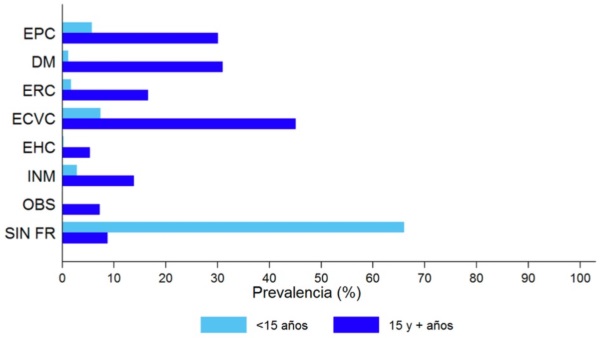
Fuente: CNE.SVGE. Red Nacional de Vigilancia Epidemiológica. Informe de Vigilancia de la Gripe en España Temporada 2019-2020.
EPC: enfermedad pulmonar crónica; DM: diabetes mellitus; ERC: enfermedad renal crónica; ECVC: enfermedad cardiovascular crónica; EHC: enfermedad hepática crónica; INM: inmunodepresión; OBS: obesidad; SIN FR: sin factores de riesgo.
En la temporada 2024-2025, con datos de SIVIRA, la actividad gripal fue similar en incidencia a los años prepandémicos. De manera consistente en AP, los menores de 15 años, y sobre todo los menores de 5 años, tienen las mayores tasas de gripe. Sin embargo, tras la instauración de la vacunación sistemática en niños entre 6 y 59 meses, y especialmente tras la segunda campaña (temporada 2024-25), se observa que en el grupo vacunado la tasa de incidencia es inferior al grupo 5-19 años, probablemente por el efecto de la vacunación. En la actual temporada 2025-26 ha impactado enormemente el subclado K de la gripe A H3N2, siendo la edad mas afectada el grupo de 1 a 6 años seguido de menores de 1 año y de 5 a 19 años. En cuanto a las tasas de hospitalización asociadas a la gripe varían según los grupos de edad, siendo más elevadas en los primeros meses de la vida. Por lo general en niños sanos menores de 4 años, las tasas son similares a las de las personas de 65 o más años, con excepción de los mayores de 79 años. Sin embargo en la actual campaña aun sin concluir, la gripe grave (hospitalización) en el grupo de menos de 1 año es prácticamente similar a la del grupo de 80 o más años. Por otra parte, en los últimos años, en EE. UU. se aprecia un aumento de la carga de enfermedad en el grupo de 5 a 17 años, y en Australia ha aumentado el número de casos y de ingresos en cuidados intensivos en el grupo de 5 a 16 años.
En cuanto a los virus circulantes en la temporada 2024-25 fueron mayoritariamente B, seguido del virus H1N1pdm09 y con menor intensidad de H3N2 al final de temporada. Como en temporadas anteriores no se han aislado cepas B linaje Yamagata.
En la presente temporada 2025-26 se constata un inicio precoz y abrupto dominada por la cepa A(H3N2), con un nuevo subclado K (antes J.2.4.1) que ya supone más del 50 % de las secuencias A(H3N2) en la UE/EEE y del 33 % a nivel global. Este subclado muestra divergencia genética y antigénica significativa respecto a la cepa vacunal A(H3N2) recomendada para la campaña 2025‑26, con datos in vitro que sugieren mala concordancia antigénica. A pesar de ello, el ECDC considera que la vacuna seguirá protegiendo frente a enfermedad grave, gracias a la inmunidad cruzada y la respuesta celular, y mantiene la recomendación de vacunar sin retraso a los grupos de riesgo.
Entre las complicaciones de la gripe destacan la exacerbación del asma, las complicaciones bacterianas como la neumonía y la otitis media aguda, las complicaciones cardiovasculares y las neurológicas, como la encefalopatía necrotizante aguda. Esta última complciación está adquiriendo una relevancia preocupante y, asi, se ha publicado recientemente una serie de 41 casos pediátricos en EE. UU. durante las temporadas gripales 2023-2024 y 2024-2025, en la que la mayoría de los niños eran previamente sanos, con inicio brusco de fiebre alta, alteración grave del nivel de conciencia y convulsiones, y evolución fulminante que requirieron ingreso en UCIP. Además, la gripe es un motivo frecuente de consulta por fiebre sin foco, sobre todo en niños más pequeños.
Un aspecto relevante y reciente en la epidemiología de la gripe es la importancia que está adquiriendo la gripe aviar. Es debida a un influenza alfavirus, siendo la mayoría de los casos por un virus H5N1, aunque existen otros virus posibles como H7N9, H5N2 y H9N2, entre otros. Este virus de alta patogenicidad (HPAI, Highly Pathogenic Avian Influenza) ha causado, según los registros, desde el año 2003 hasta diciembre del año 2024, 954 casos en seres humanos en 23 países y 464 muertes, mostrando una letalidad del 52,1 %. Hasta el 7 de julio de 2025 en EE.UU. se han comunicado 70 casos de gripe aviar y un fallecimiento en humanos. Se han detectado más de 10 000 casos en aves salvajes y 160 millones de aves de corral afectadas. Todos los casos humanos documentados, a excepción de tres en los que se desconoce la fuente de contagio, habían tenido contacto previo con animales de granja (41 en ganado lechero, 24 en granjas de aves y 2 en otros animales). Aun cuando no se ha demostrado hasta la fecha transmisión entre humanos, la OMS, el ECDC y el Ministerio de Sanidad han establecido recientemente recomendaciones para aumentar la vigilancia epidemiológica y promover el diagnóstico etiológico completo.
4. Tipos de vacunas de uso pediátrico, composición y presentación
4.1. Vacunas inactivadas de administración intramuscular
- Vacunas inactivadas en cultivo de huevo: el virus se replica en huevos de gallina embrionados y, tras alcanzar suficientes títulos, se purifica e inactiva químicamente (p. ej. con formaldehído o beta‑propiolactona) para que no pueda replicarse, conservando sus antígenos superficiales. Están autorizadas a partir de los 6 meses de edad.
- Vacunas inactivadas en cultivo celular: el virus se replica en líneas celulares (por ejemplo, MDCK o células de riñón de perro/humano) en biorreactores, y luego se purifica e inactiva de forma análoga; la diferencia clave es que no se usan huevos, por lo que no contienen proteínas de huevo residuales y pueden adaptarse mejor a ciertas variantes virales. Existe evidencia limitada (estudios observacionales) en la que, al no sufrir cambios adaptativos durante el proceso de síntesis ofrecen, según la temporada, entre un 7 y un 19 % de incremento en la efectividad comparada con las vacunas procedentes de huevo embrionado, aunque sería deseable disponer de ensayos clínicos comparativos (head to head) que abarcasen varias temporadas para corroborar la evidencia de los estudios observacionales. Está autorizada a partir de los 6 meses de edad.
- Vacunas recombinantes. Se producen utilizando tecnología recombinante por la cual da como resultado un virus "recombinante" que transmite las instrucciones de ADN a una célula huésped y que después reproduce rápidamente el antígeno de la HA. Este método no requiere de un virus cultivado en huevos. Actualmente aun no está disponible en España y su uso está aprobado para mayores de 18 años.
4.2. Vacuna trivalente atenuada de administración intranasal
Esta vacuna se obtiene a base de huevos embrionados y tiene la capacidad de simular la infección natural y, de este modo, producir una respuesta humoral y celular que incluye la inmunidad de mucosas. La vacuna atenuada presenta la ventaja de una mayor aceptabilidad al no ser parenteral y a su vez la administración es más sencilla. Actualmente, la vacuna está autorizada en personas de 2 a 17 años de edad, en toda Europa.
En la temporada 2024-2025 esta vacuna estuvo presente en todas las CC. AA., mostrando una mayor aceptación por parte de los profesionales y niños al tiempo que facilitó la aplicación en el ámbito escolar. En la temporada actual 2025-2026 sigue utilizándose en todas las CC. AA.
4.3. Vacuna antigripal para la estación epidémica 2025-2026
Cada año, la OMS recomienda las cepas para las vacunas de la gripe estacional, adaptándolas a cada hemisferio. Busca concordancia con los virus en circulación, basándose en vigilancia epidemiológica y disponibilidad de cepas. Desde la última temporada, recomienda vacunas trivalentes sin el linaje B/Yamagata, que no circula desde 2020. En la presente temporada 2025-26 se han modificado las cepas H3N2 respecto a las recomendadas en la temporada anterior, de modo que en las vacunas inactivadas procedente de huevos la cepa H3N2 cepa similar a A/Croatia/10136RV/2023 sustituye cepa similar a A/Thailand/8/2022; en las vacunas atenuadas la cepa H3N2 similar a A/Perth/722/2024 V1 sustituye a la cepa A/Thailand/8/2022 y en las vacunas inactivadas de cultivo celular la cepa H3N2 similar a A/District of Columbia/27/2023 sustituye a la cepa Massachusetts/18/202 de la temporada 2024-25 (tabla 26.1).
Tabla 26.1. Cepas de la vacuna antigripal tetravalente para la temporada 2025-2026 en el hemisferio norte (recomendaciones de la OMS).
|
Vacunas trivalentes |
Producida en huevos embrionados | Recombinante o producida en cultivo celular | |
| Inactivadas | Atenuadas |
|
|
|
|
||
| Vacunas tetravalentes | Misma composición, pero incluye una cepa B, del linaje Yamagata: cepa similar a B/Phuket/3073/2013 | ||
* En la vacuna atenuada, la cepa A H1N1 Norway 31694 y la cepa A H3N2 Perth 722 son cepas similares a las cepas A H1N1 Victoria 4897 y A H3N2 Croatia 10136RV incluidas en las vacunas inactivadas producidas en huevo
Fuente: WHO Feb 25
4.4. Preparados disponibles de vacuna antigripal para menores de 18 años
Para esta temporada, existen aprobadas para su comercialización hasta 5 preparados de vacunas antigripales diferentes autorizados para la infancia en España, todos con la misma composición antigénica y autorizados para la infancia.
En la temporada 2025-26 todas las vacunas inactivadas disponibles para menores de 18 años en nuestro medio son vacunas trivalentes (sin componente Yamagata). Las vacunas inactivadas, tres de ellas son procedentes de cultivos en huevos embrionados de gallina y una de cultivo celular. Todas se pueden administrar a partir de los 6 meses.
La vacuna atenuada intranasal es trivalente también, procede de cultivo en huevos embrionados de gallina, está autorizada a partir de los 2 años y se puede adquirir en farmacia en envase individual.
En la tabla 26.2 se exponen todas las vacunas antigripales disponibles para menores de 18 años autorizadas actualmente en España para la temporada 2025-2026. Todas estas vacunas en su composición cumplen con la recomendación de la OMS para el hemisferio norte.
Tabla 26.2. Vacunas antigripales autorizadas en menores de 18 años comercializadas en España.
Para conocer otros componentes se recomienda consultar las fichas técnicas de vacunas de la gripe.
5.Efectividad de la vacuna antigripal
La vacunación es la medida de elección más efectiva para prevenir la gripe estacional. La efectividad de la vacunación (EV), en general alrededor del 60 % (en algunas temporadas, incluso superior), tiene resultados muy variables en distintas poblaciones, según el virus circulante cada temporada y la discordancia de éste con las cepas contenidas en la vacuna, entre otros factores. También existe diferencia en tanto se considere la eficacia frente a gripe confirmada, visitas a urgencias, hospitalización y evitar el fallecimiento.
Un metanálisis de las vacunas atenuadas contra la gripe estacional y pandémica A(H1N1) en países de medio y bajo índice de desarrollo humano, mostró una eficacia de la vacuna contra la gripe confirmada por laboratorio del 72 % después de 1 año (IC95 %: 65 a 77 %) y del 81 % después de 2 años (IC95 %: 69 a 89 %), sin revacunación en el segundo año. Los estudios que compararon vacuna inactivada y atenuada en niños de 2 a 17 años generalmente encontraron que las vacunas atenuadas fueron más eficaces.
Considerando la efectividad para evitar la hospitalización una revisión sistemática muestra una EV por cualquier tipo de gripe del 57,48 % (IC95 %: 49,46 a 65,49). Cuando examina la EV por tipo y cepa, es más alta contra H1N1 (74,07 %; IC95 %: 54,85 a 93,30) que contra gripe B (50,87 %; IC95 %: 41,75 a 59,98), y moderada contra H3N2 (40,77 %; IC95%: 25,65 a 55,89). En particular, la vacunación contra la gripe ofreció una mayor protección en los niños con dos dosis (61,79 %; IC95 %: 54,45 a 69,13), en comparación con los de una dosis (33,91 %; IC95 %: 21,12 a 46,69). Además, la EV fue alta en niños menores de 5 años (61,71 %; IC95 %: 49,29 a 74,12), así como en niños de 6 a 17 años (54,37 %; IC 95 %: 35,14 a 73,60).
En la temporada 2022-23, la efectividad de la vacunación antigripal en Andalucía en la temporada inaugural mostraron mostró una EV del 51 % (IC95 %: 48 a 53) para prevenir la infección y del 69 % (IC95 %: 56 a 79) para prevenir la hospitalización relacionada con la gripe. En niños de 6 a 23 meses, la EV fue del 53 % (IC95 %: 48 a 57) para prevenir la gripe y del 76 % (IC95·%: 57 a 87) para prevenir la hospitalización por gripe. En ambas subpoblaciones, la EV fue significativamente mayor con el programa de vacunación de dos dosis.
En la temporada 2023-24, un estudio realizado a nivel nacional en España en el que todos los niños de 6 a 59 meses fueron vacunados contra la gripe estacional usando un diseño de test negativo de caso-control con datos de vigilancia centinela, mostró una EV eficacia ajustada contra la gripe del 70 % (IC95 %: 51 a 81) para los pacientes de atención primaria con enfermedad tipo gripe (ILI) y del 77 % (IC95 %: 21 a 93) para los pacientes hospitalizados. En la atención primaria, donde la mayoría de los virus subtipados (61 %) eran A(H1N1), la EV ajustada fue del 77 % (IC 95 %: 56 a 88%).
En una publicación de efectividad en 10 países europeos en la temporada 2023-2024, entre ellos España, la EV frente a la gripe A para todas las edades, fue del 51 % (IC95 %: 41 a 59) en AP y del 38 % (IC95 %: 27 a 48) en hospitales. Sin embargo, la EV entre los niños, fue del 85 % (IC95 %: 71 a 93) para casos atendidos en AP, no ofreciendo datos de eficacia frente a hospitalización en este grupo de edad.
En EE. UU., que estableció la recomendación de vacunación antigripal universal desde los 6 meses de edad en 2008, una revisión sistemática de la evidencia en el periodo 2023-24 mostró en niños una EV frente a gripe grave y hospitalización del 67 % (IC95 %: 58 a 75) y del 55 % (IC 95 %: 52 a 68) frente a gripe atendida médicamente; los datos de la protección frente a ingreso en UCI fueron menos precisos debido a la baja frecuencia del evento. Con todo, la EV en niños fue sustancialmente superior a la de los adultos. Los datos provisionales de efectividad de la vacunación en niños y adolescentes de la temporada 2024-25 han mostrado la una EV en atención primaria contra cualquier tipo de gripe de entre el 32 % y el 60 % y contra la hospitalización asociada a gripe entre ael 63 % y el 78 %.
Un aspecto relevante en la consideración de la efectividad de la vacunación antigripal en el niño es el impacto de la misma en la población vacunada o no que se relaciona con los niños. Tal y como se ha demostrado en varios estudios, la vacunación de los niños sanos interrumpe la cadena de transmisión y protege indirectamente a otros miembros de la comunidad, incluidos aquellos más vulnerables como los ancianos, personas inmunodeprimidas y menores de 6 meses. La instauración de la vacunación antigripal universal en los niños del Reino Unido se basó, precisamente, en modelos matemáticos que demostraban que la vacunación de entre el 50 al 80 % de los niños de 2 a 18 años con la vacuna intranasal, evitaría miles de casos de gripe en todas las edades y, lo que es más importante, miles de hospitalizaciones y muertes asociadas a la enfermedad en las personas mayores de 65 años. Considerando el efecto de la vacunación antigripal en las muertes asociadas a gripe, el número evitado es 20 o 30 veces mayor que en los no vacunados.
6. Vías de administración
La administración de vacunas inactivadas se realiza mediante inyección intramuscular profunda o bien subcutánea profunda, siendo la vía IM la preferible. Los preparados trivalentes Fluarix, de GSK, y Flucelvax, de Seqirus, solo admiten la vía intramuscular. Para los niños pequeños que aún no andan, el sitio preferido para la administración de la vacuna es la zona anterolateral externa del muslo, en su tercio medio, y para el resto es el deltoides.
En los pacientes con alteraciones de la coagulación o que reciben terapia anticoagulante se recomienda la administración de las vacunas antigripales no adyuvadas por vía subcutánea.
La vacuna parenteral debe conservarse entre +2 ºC y +8 ºC y aplicarse preferiblemente a temperatura ambiente. El periodo de validez es de un año.
La vacuna atenuada intranasal precisa la aplicación de 0,1 ml en cada fosa nasal. Su administración es sencilla y muy bien tolerada por los niños. No debe ser inyectada en ningún caso. Esta vacuna debe también conservarse entre +2·ºC y +8 ºC, pudiendo permanecer, como máximo, 12 horas a una temperatura de hasta 25·°C. A partir de este tiempo debe desecharse. El periodo de validez es de 18 semanas.
7. Indicaciones y esquemas de vacunación
En algunos países, desde hace varios años, se están llevando a cabo diferentes estrategias de vacunación antigripal en niños, fundamentalmente en algunos países europeos (Reino Unido, Finlandia), en Norteamérica (EE.·UU., Canadá) y Australia. Su experiencia es de gran valor para la comunidad científica, ya que pueden influir en la toma de decisiones de otros países.
La vacunación frente a la gripe es anual. La vacuna debe ser administrada durante el otoño de cada año (de octubre a diciembre en el hemisferio norte), preferentemente antes del inicio de la temporada gripal, pero puede prolongarse el intervalo mientras el virus esté circulando para aquellos que no la hayan recibido a tiempo.
En consonancia con las recomendaciones del Ministerio de Sanidad de vacunación frente a la gripe para la temporada 2024-2025 y 2025-2026, la pauta consta de una sola dosis a partir de los 6 meses de edad, salvo si es menor de 9 años, pertenece a grupo de riesgo y es el primer año que se vacuna, en cuyo caso se aplicarán 2 dosis separadas por 4 semanas (tabla 26.3). Este esquema de vacunación en la infancia sustituye al anterior, que consistía en dos dosis de vacuna, separadas, al menos, 4 semanas, cuando el niño, sano o de riesgo, era menor de 9 años y éste se vacunaba por primera vez. La vacuna ha de administrarse tan pronto como esté disponible.
Aunque la efectividad frente a la infección observada en la población infantil no previamente vacunada muestra mejores resultados tras la administración de dos dosis comparado con la administración de una sola dosis, esta pauta puede facilitar la logística de la vacunación universal y lograr mejores coberturas
La administración de la dosis debe ser completa (0,5 ml) en cada acto de vacunación para todas las edades, desde los 6 meses de edad.
La vacuna atenuada intranasal se administra directamente a través de las narinas, 0,1 ml en cada fosa nasal, en dosis única (salvo menor de 9 años perteneciente a grupo de riesgo, que no suponga una contraindicación para vacuna atenuada, y primer año que se vacuna, que recibirá una segunda dosis a las 4 semanas).
El programa de vacunación de Reino Unido con vacuna atenuada intranasal establece una única dosis de independientemente de la edad (2 a 17 años) y número de dosis previas.
La posología puede consultarse en la tabla 26.3.
Tabla 26.3. Posología recomendada de la vacunación frente a la gripe estacional para la temporada 2025-2026, según la edad del niño, condición de riesgo y los antecedentes de vacunación antigripal.
| Edad | Posología | |
|---|---|---|
| Número de dosis | Volumen por dosis | |
| Vacunas inactivadas | ||
| De 6 meses a 8·años |
|
A cualquier edad 0,5 ml |
| De 9 años en adelante |
|
|
| Vacuna atenuada | ||
| De 24 meses a 8 años |
|
0,1 ml intranasal en cada narina |
| De 9 años en adelante |
|
|
7.1. Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) para la campaña antigripal 2025-2026.
Con relación a la infancia y a la adolescencia, el CAV-AEP recomienda la vacunación antigripal en las situaciones reflejadas en la tabla 26.4.
Desde hace años, y siguiendo las recomendaciones de la Organización Mundial de la Salud, el CAV-AEP en sus recomendaciones anuales de gripe ha venido recomendando la inclusión de la vacunación sistemática antigripal infantil. En las recomendaciones para la temporada 2021-22 y posteriormente en el Calendario de Inmunizaciones de 2022 ya se hizo una recomendación explícita de vacunación sistemática en niños de 6 a 59 meses. Posteriormente lo hizo el Consejo Interterritorial del Sistema Nacional de Salud español (CISNS). Algunas CC. AA. se adelantaron en la implantación del programa en la temporada 2022-23 (Andalucía, Galicia y Murcia) y el resto lo iniciaron en la temporada 2023-24 (cobertura global en España 37,22 %), programa que continuó en la campaña 2024-25, mejorando la cobertura a 48,16 % con comunidades como Galicia, Cantabria y Asturias superando el 60 %.
Es bien conocido que la vacunación de los niños tiene una importante repercusión en la transmisión del virus gripal y en la disminución de casos y de sus complicaciones, y que la epidemia gripal comienza cada temporada con el aumento de casos en los niños entre 0 y 14 años, anticipando en unas pocas semanas la infección en edades ulteriores. Es por ello que algunos países extienden la vacunación más allá de los 5 años que por otra parte se ha mostrado como una medida coste efectiva. Existe evidencia así mismo del impacto directo e indirecto en cuanto a la disminución de consultas en AP, urgencias y hospitalización en el grupo de niños y adolescentes de 5 a 17 años, al tiempo que reduce las visitas a AP por enfermedad similar a la gripe en personas adultas no vacunadas. Por otra parte, es un grupo también vulnerable y, así, datos recientemente publicados de la campaña 2024-25 en EE.UU. apuntan a un incremento del 145 % en los ingresos por gripe en niños entre 5 y 17 años.
En las recomendaciones del CAV AEP para la temporada 2025-2026 y en el Calendario de Vacunaciones e Inmunizaciones de 2026, se ha hecho una recomendación extensiva de la vacunación sistemática hasta los 17 años. En esta temporada algunas CC.AA. como Islas Baleares, Canarias y Comunidad Valenciana (6 años), Aragón (7 años), Castilla León (8 años), Murcia (9 años), La Rioja y Galicia (11 años) han prolongado la recomendación de edad más allá de los 5 años, incluso una de ellas, Melilla, lo ha anunciado hasta los 17 años para la temporada 2026-2027.
Por todo ello, el CAV de la AEP considera conveniente la vacunación extendida en toda la edad pediátrica, hasta los 17 años inclusive, haciendo hincapié en centrar el esfuerzo en incrementar las coberturas de 6 a 59 meses e iniciar una recomendación de vacunación sistemática en niños y adolescentes de 5 a 17 años de edad, todo ello sin olvidar la importancia de priorizar a los colectivos pediátricos para los que exista una especial indicación de la vacunación, ya sea por poseer ellos mismos la condición de vulnerables o bien por buscar la protección indirecta de convivientes con niños con factores de riesgo. La vacunación extendida también contribuiría a incrementar las coberturas vacunales en estos colectivos, y, por tanto, a la protección indirecta de los mismos, a la vez que hace la recomendación más comprensible para las familias. Estas recomendaciones se han consensuado con la Asociación Española de Vacunología (AEV) y la Sociedad Española de Infectología Pediátrica (SEIP) en un Documento de Consenso recientemente publicado.
La recomendación para la vacunación antigripal debe hacerse en cinco grupos de personas (tabla 26.4), considerando que, en los niños menores de 6 meses, no está autorizada la vacuna.
Es un deber de todos los profesionales sanitarios implicados informar y recomendar la vacunación antigripal a las personas en las que está indicada, tan pronto como esté disponible la vacuna, obteniéndose el máximo beneficio si la aplicación se produce antes del inicio de la estación gripal.
Es de especial relevancia asimismo tener en especial consideración la vacunación de niños y adolescentes pertenecientes a grupos de riesgo que paradójicamente alcanzan coberturas inferiores a los de la vacunación sistemática. No debemos olvidar que estos pacientes están en situación de especial vulnerabilidad ante la gripe, bien por descompensación de su patología de base, o por la gravedad de la infección misma o de sus complicaciones. La vacunación en esta población debe ser pues una prioridad que no debe quedar diluida en la implementación de la vacunación universal en los grupos etarios pediátricos establecidos. Con todo, la evidencia demuestra que los programas de vacunación sistemática financiada aumentan las coberturas de la población de riesgo para la gripe y en este sentido cobra singular importancia la vacunación sistemática extendida hasta los 17 años como propone el CAV de la AEP.
Este comité, al igual que otras sociedades científicas de España, desea hacer un especial énfasis en la vacunación antigripal de todos los profesionales sanitarios en contacto con pacientes.
También, como en años anteriores se indica la vacunación de niños y adolescentes institucionalizados o tutelados por la administración a cualquier edad, acorde con las recomendaciones del CISNS.
Asimismo, se recomienda vacunar a las mujeres en el puerperio, hasta los 6 meses tras el parto y que no hubieran sido vacunadas durante el embarazo. Este comité considera, al igual que otros organismos, que todos los contactos domésticos de menores de 6 meses deben ser vacunados, incluidas sus madres, entendiendo esta indicación como una vacunación de rescate si no se vacunaron de embarazadas. La vacunación de los padres tendría tanto sentido como vacunar a las madres debido a que las bajas por paternidad permiten la implicación de los padres en el cuidado de sus hijos.
Se puede consultar el documento completo aquí.
Tabla 26.4. Recomendaciones de vacunación antigripal del Comité Asesor de Vacunas de la AEP (CAV-AEP) que deben ser consideradas prioritarias para la campaña 2025-26.
|
1. Todos los niños entre 6 meses y 17 añosa, recomendación sistemática 2. Niños de a partir de los 6 meses de edad y adolescentes en riesgo de sufrir una gripe complicada debido a las siguientes circunstancias o enfermedades de base:
3. Personas que pueden transmitir la gripe a grupos de riesgo:
4. Otros. Trabajadores esenciales o personas con exposición laboral
|
|
|
Notas: a 17 años, 11 meses y 29 días b Debe hacerse un especial énfasis en la vacunación antigripal de todos los profesionales sanitarios en contacto con pacientes, incluido el personal de las farmacias |
Se puede consultar en este enlace la infografía resumen de estas recomendaciones.
Más de una tercera parte de los países del mundo realizan vacunación universal en niños sanos, aunque en diferentes periodos etarios y con diferentes vacunas, como Estados Unidos, Canadá, Australia, Reino Unido, Austria, Estonia, Eslovaquia, Eslovenia, Finlandia, Italia, Israel, Letonia, Malta y Polonia, entre otros. Ver tabla 26.5.
Tabla 26.5. Vacunación antigripal universal en la infancia en algunos países relevantes (recomendaciones vigentes a 25 de septiembre de 2025).
| País | Edad | Tipo de vacuna |
| Estados Unidos (CDC 2025-2026) | ≥6 meses |
- 6-23 meses: inactivada intramuscular trivalente (cultivo en huevo o celular)
- ≥24 meses: inactivada intramuscular trivalente, o atenuada intranasal trivalente (sin preferencia por una de ellas)
|
| Canadá (NACI 2025-2026) | ≥6 meses |
- 6-23 meses: inactivada intramuscular tetravalente
- ≥24 meses: inactivada intramuscular tetravalente o atenuada intranasal tetravalente (sin preferencia por una de ellas)
|
| Australia (ATAGI 2025) | ≥6·meses-59 meses | Inactivada intramuscular |
| Dinamarca (DHA 2025-2026) | 2-6 años | Atenuada intranasal tetravalente |
| Finlandia (FIHW 2025-2026) | ≥6 meses |
Según edad:
- 6-23 meses: inactivada intramuscular
- 2 a 6 años: atenuada intranasal
|
| Italia (MS 2025-2026) | ≥6 meses a 6 años | 6 -23 meses: inactivada intramuscular 2 a 6 años: atenuada intranasal |
| Reino Unido (PHE 2025-2026) | 2-16 años |
Atenuada intranasal trivalente a partir de 2 años de edad (alternativa inactivada de cultivo celular si la intranasal está contraindicada)
- 6-23 meses: inactivada intramuscular de cultivo celular
|
8. Consideraciones y recomendaciones sobre vacunación antigripal en situaciones especiales
8.1. Recomendaciones sobre vacunación antigripal en niños alérgicos al huevo
8.2. Inmunodepresión y pacientes crónicos
8.3. Vacunación en la embarazada
8.4. Vacunación de los profesionales sanitarios
8.1. Recomendaciones sobre vacunación antigripal en niños alérgicos al huevo
La alergia al huevo no se considera una contraindicación de la vacuna antigripal. Esto se ha comprobado tanto con la vacuna inactivada como con la atenuada. Las vacunas antigripales actualmente disponibles inactivadas que proceden de cultivos en huevos de gallina, contienen mínimas cantidades de huevo. Las vacunas cultivadas en medios celulares y, por tanto, exentas totalmente de proteínas de huevo que se pueden administrar desde los 6 meses de edad, en algunas CC.AA. si están disponibles se administran preferencialmente en estos casos.
A pesar de que las fichas técnicas incluyen la contraindicación de uso de las vacunas antigripales en estos pacientes, se considera que incluso los pacientes que padezcan una alergia grave al huevo pueden ser vacunados en centros sanitarios con experiencia en el reconocimiento y tratamiento de reacciones alérgicas graves, y cualificados para realizar una resucitación cardiopulmonar. En personas con alergia al huevo es muy poco probable que se produzca una reacción alérgica a la vacunación. Esto se ha comprobado tanto en la vacuna inactivada como en la atenuada.
En la ficha técnica de algunas vacunas antigripales se especifica la cantidad de proteína de huevo (ovoalbúmina) que llevan en su composición que por aspectos regulatorios debe ser inferior a 1 mcg/dosis:
- Fluarix: ≤0,05 mcg/dosis
- Influvac: ≤0,1 mcg/dosis
- Vaxigrip: ≤0,05 mcg/dosis
- Fluenz: <0,024 mcg/dosis
Actualmente se recomienda actuar según la historia previa de alergia al huevo:
- Los sujetos con reacciones leves al huevo, como urticaria, pueden ser vacunados de la gripe con cualquiera de las vacunas disponibles
- Las personas con reacciones graves tras la toma de huevo como angioedema, dificultad respiratoria o síntomas que hayan requerido adrenalina, pueden ser vacunadas con cualquiera de las vacunas disponibles, pero deberán ser vacunadas en centros, no necesariamente hospitalarios, con medios y preparación para atender eventuales reacciones graves, por personal con experiencia y supervisión durante 30 minutos tras la administración
- Una reacción alérgica grave a la vacuna antigripal, independientemente del componente que sea la causa de la reacción es una contraindicación para recibir futuras dosis de la vacuna
- Una revisión del tema propone ni tan siquiera indagar sobre la posible alergia al huevo previo a la vacunación dada la escasa relevancia de esta ya que podría ser causa de un hipotético rechazo
8.2. Inmunodepresión y pacientes crónicos
Los pacientes inmunodeprimidos y con patologías crónicas tienen indicación de recibir la vacuna de la gripe en cada temporada a partir de los 6 meses de edad. Estos pacientes presentan una mayor morbilidad y mortalidad en el caso de enfermedad por el virus influenza e ingresan con más frecuencia en el hospital que los menores sanos. Un estudio realizado en nuestro medio demuestra que hasta un 45 % de los niños que ingresan por gripe en los hospitales presentan alguna comorbilidad subyacente de riesgo en la que está indicada la vacunación, siendo llamativa la falta de vacunación en el 74 % de estos niños.
Los pacientes inmunodeprimidos que se infectan por los virus de la gripe ingresan con más frecuencia en el hospital que los no inmunodeprimidos. La mortalidad de la neumonitis en estos pacientes, dependiendo del tipo y grado de inmunosupresión, oscila entre el 3 % y el 10 %. La vacunación antigripal ha demostrado disminuir la mortalidad en los pacientes inmunodeprimidos.
Aunque la inmunogenicidad de las vacunas antigripales es menor en los pacientes inmunodeprimidos, una proporción sustancial de estos alcanzan respuestas protectoras capaces de prevenir la enfermedad. No se ha demostrado que vacunas de alta carga antigénica supongan un beneficio en estos pacientes. Como quiera que muchas veces estos pacientes no consiguen respuestas protectoras, resulta muy importante la vacunación antigripal anual de las personas que conviven con ellos.
Se recomienda, por tanto, la vacunación antigripal anual de todos los pacientes inmunodeprimidos y de sus convivientes (así como cuidadores y sanitarios) con vacunas inactivadas por vía intramuscular, siempre que tengan más de 6 meses de edad. La vacunación de contactos domiciliarios cobra especial importancia si el inmunodeprimido es menor de 6 meses, al no poder ser vacunado.
La vacuna atenuada intranasal está contraindicada en inmunodeprimidos, pero puede emplearse en sus contactos de 2 a 17 años, siempre que el paciente inmunocomprometido no lo sea por haber recibido un trasplante de progenitores hematopoyéticos (TPH) en los 2 meses previos, padezca enfermedad injerto contra huésped o bien sufra una inmunodeficiencia combinada grave (IDCG). En estos casos, si un contacto recibe la vacuna atenuada, deberá evitar el contacto con estos pacientes en los 7 días posteriores a la recepción de la vacuna. En niños con infección VIH estable, en tratamiento antiviral combinado o de gran actividad y con función inmunológica adecuada, la vacuna nasal atenuada parece igual de segura que la inactivada.
En niños con deficiencia selectiva de IgA, aunque las vacunas vivas atenuadas aplicadas en mucosas, como la vacuna contra la fiebre tifoidea oral o la vacuna antigripal intranasal, se consideran seguras y pueden utilizarse, dado que no producen la inmunidad mucosal y teniendo en cuenta que la respuesta sérica de tipo IgM e IgG es inferior que la originada tras la inmunización con vacunas parenterales, con el fin de obtener una mayor efectividad, se recomienda el uso preferente de vacunas de aplicación vía parenteral.
8.3. Vacunación en la embarazada
Las embarazadas tienen un elevado riesgo de enfermedad y hospitalización por gripe que condiciona un mayor riesgo de resultados perinatales adversos, como mayor probabilidad de prematuridad y bajo peso al nacimiento. Se recomienda la vacunación durante el embarazo, en cualquier momento de este, por parte de todos los organismos internacionales (OMS, CDC, ECDC) y nacionales (Ministerio de Sanidad y sociedades científicas), por una triple motivación:
- Beneficio para la madre: el embarazo es una situación de mayor riesgo de complicaciones (hasta 18 veces más que las mujeres no embarazadas) y de ingreso hospitalario (hasta 8 veces más), fundamentalmente por complicaciones respiratorias, sobre todo a partir del segundo trimestre de la gestación, que pueden provocar problemas tanto a la madre como al feto, describiéndose un incremento de la mortalidad materna. A nivel obstétrico, la vacunación ha demostrado disminuir la probabilidad de aborto y de cesárea.
- Beneficio para el feto: la gripe en embarazadas aumenta el riesgo de prematuridad y de muerte perinatal. La vacunación antigripal de la embarazada ha demostrado que disminuye significativamente la probabilidad de prematuridad y de bajo peso al nacer.
- Beneficio para el niño: debido al efecto protector en la madre e indirectamente del niño, por el paso trasplacentario de anticuerpos de origen materno, se ha observado que vacunando a las embarazadas se consigue reducir los casos de gripe en los niños. En un reciente metanálisis, se encontró una disminución del 48 % (IC 95 %: 33 a 59) de los casos de gripe confirmada y del 72 % (IC 95 %: 39 a 87) de las hospitalizaciones también por gripe confirmada en los primeros 6 meses de vida. En un ensayo clínico reciente, la vacunación antigripal durante el embarazo consiguió una reducción significativa de hasta el 57,5 % de todas las hospitalizaciones por cualquier infección respiratoria de vías bajas.
Además, se han observado efectos heterólogos, es decir, aquellos añadidos a los de la pretendida protección frente a la gripe, como son: menor probabilidad de prematuridad (<37 semanas, OR [odds ratio]: 0,75) y bajo peso en el nacimiento (<2500 g; OR: 0,73) y bajo peso a término (OR: 0,85), menor riesgo de infección por B. pertussis (tosferina) en mujeres no vacunadas frente a tosferina (OR: 0,4) y eficacia vacunal frente a la neumonía grave (20 %) en el niño.
Cada vez existe un mayor número de trabajos que avalan la seguridad de la vacunación antigripal en cualquier momento del embarazo. Los resultados de todos los trabajos indican que la vacunación materna no se asocia con un incremento del riesgo de malformación congénita, muerte fetal o aborto espontáneo, hechos además comprobados con la cantidad de dosis administradas a embarazadas desde hace décadas.
La mayor parte de los ingresos por gripe en niños corresponden a niños menores de 6 meses. Esta población, que es la más vulnerable, no puede recibir la vacuna antigripal. La única medida preventiva factible para este grupo es la vacunación de la madre durante el embarazo.
A pesar de los beneficios evidentes que proporciona y los bajos riesgos asociados, en España las coberturas vacunales en embarazadas frente a la gripe han sido tradicionalmente bajos. Según los datos ofrecidos por SIVAMIN, donde se muestran los datos de las coberturas vacunales, desde el año 2017 hasta el 2020 la cobertura global en España de la vacuna frente a la gripe durante el embarazo fue aumentando progresivamente. En 2021 se interrumpió este ascenso, ya que la cobertura bajó hasta el 55,2 %, y en la 2023-24 la cobertura media fue del 55,26 % oscilando entre el 82,8 % y el 29,0 % según la comunidad autónoma. En la última temporada 2024-2025 la cobertura media fue del 60,91 %, cumpliendo el objetivo, oscilando entre el 83,8 % y el 26,6 % según la comunidad autónoma. En cualquier caso las coberturas son claramente mejorables, si las comparamos con las coberturas frente a la tosferina y para ello es preciso una estrategia multidisciplinar que implique a ginecólogos, matronas, médicos de familia, pediatras, neonatólogos, enfermería, sociedades científicas y autoridades sanitarias.
Las vacunas atenuadas de virus vivos y las adyuvadas están contraindicadas, por lo que se deben emplear vacunas inactivadas. Existen datos limitados con las vacunas de desarrollo más reciente, como las de cultivos celulares.
No se ha conseguido un consenso sobre cuál es el momento óptimo para la vacunación antigripal durante el embarazo. Una revisión sistemática y metaanálisis , muestra que vacunando en el tercer trimestre de gestación o al final del segundo trimestre del embarazo, al menos, 15 días antes del parto, se producen niveles más altos de anticuerpos en la madre en el momento del parto y, por tanto, mayor transferencia de anticuerpos al feto. Por el contrario, la vacunación en momentos más precoces del embarazo protegerá más a la madre durante un periodo mayor de tiempo, pero con la posibilidad de que los anticuerpos no se mantengan hasta el momento del parto y por consiguiente que haya una menor transferencia de anticuerpos al feto. Por otra parte, no se debe perder de vista que el momento de la vacunación depende más de la presentación de la epidemia de gripe estacional que de la edad gestacional. A pesar de que los mejores niveles de protección para el feto y recién nacido se alcanzan vacunando en el tercer trimestre, no se debería retrasar la administración de la vacuna si la estación gripal ha comenzado.
Se puede administrar concomitantemente con la vacuna frente a la tosferina (Tdpa) y con la del SARS-CoV-2 en miembros distintos. También se podría administrar con la del VRS. "En el embarazo, dos vacunas en cada brazo"
8.4. Vacunación de los profesionales sanitarios
La AEP, en consonancia con organismos internacionales, el Ministerio y otras sociedades científicas, recomienda la vacunación antigripal de todos los trabajadores sanitarios y estudiantes que estén en contacto con pacientes, sobre todo lactantes e inmunodeprimidos.
En España, las coberturas para esta vacunación en el colectivo sanitario han sido tradicionalmente bajas (20-30 %), aunque en el caso concreto de los pediatras ha alcanzado hasta un 60 % en años recientes. En la Unión Europea, la mediana de las tasas de cobertura es un 25 %, pero oscila entre el 5 % de Polonia y el 55 % de Reino Unido. Sin embargo, con la llegada de la pandemia las coberturas se incrementaron notablemente (en torno al 70 %) y sería deseable que estos porcentajes se mantuviesen o incluso se mejorasen. En la temporada 2023-24 la cobertura, según datos del registro SIVAMIN (Ministerio), fue del 41,85 %, oscilando según la comunidad autónoma entre el 56,85 % y el 20,97 %. En la última de 2024-2025 la cobertura fue del 39,54 %, oscilando según la comunidad autónoma entre el 75,66 % y el 23,83 %.
Una vía para mejorar las coberturas es la solicitud de una declaración de declinación entre los profesionales sanitarios que se niegan a ser vacunados, como se ha hecho recientemente con los profesionales sanitarios el sistema público de salud del Reino Unido. El debate sobre este tema está servido, pero la evidencia demuestra que la obligatoriedad de la vacunación para acceder a determinados puestos de trabajo ha sido, hasta ahora, la única práctica que ha logrado coberturas altas entre los profesionales.
Las causas del rechazo a la vacunación antigripal entre los sanitarios son muy variadas y carecen de sustento científico: falta de tiempo, falta de seguridad de la vacuna, miedo de contraer la gripe tras la vacunación y falta de efectividad de la vacuna. Por el contrario, la actitud proclive a la vacunación se basa en un mejor conocimiento de la gripe y de las vacunas utilizadas para su prevención. Por eso, se considera fundamental la realización de campañas informativas y la implementación de estrategias específicas más efectivas en este colectivo.
En nuestras manos está fomentar la vacunación entre nuestros compañeros.
⌂
9. Administración con otras vacunas y otros productos
La vacuna frente a la gripe puede administrarse a la vez que el resto de las vacunas del calendario de vacunación. Si se ha usado la vacuna intranasal atenuada y se necesitara administrar otra vacuna de virus vivos parenteral, se puede hacer el mismo día o con cualquier intervalo de separación.
En cuanto a la coadministración con la vacuna frente al virus SARS-CoV-2 se puede administrar simultáneamente o con el intervalo de separación que se desee.
La vacuna antigripal intranasal no se debe aplicar si recibió medicamentos antivirales contra la influenza como oseltamivir o zanamivir dentro de las 48 horas anteriores, peramivir dentro de los 5 días anteriores o baloxavir dentro de los 17 días anteriores.
10. Efectos adversos
Las vacunas antigripales tienen un perfil de seguridad elevado, como así lo demuestran numerosos estudios, incluido alguno realizado en nuestro país. El balance riesgo-beneficio es netamente favorable. Dado que en España no estarán disponibles las vacunas atenuadas, solo nos referiremos en este capítulo a la seguridad de los preparados inactivados.
En las vacunas inactivadas los efectos adversos más frecuentes son las reacciónes locales, como enrojecimiento y dolor en la zona de la administración, con una frecuencia variable según diferentes trabajos, que oscila entre el 5-20 % de casos. Estos efectos generalmente son leves y no requieren atención médica.
La fiebre tras la vacunación en niños menores de 2 años se puede encontrar entre el 5,5 % y el 14 %. En algunas circunstancias se han descrito crisis febriles, siendo estas más frecuentes si se coadministra con la vacuna neumocócica conjugada. Un estudio en profundidad del tema concluye que no existe un riesgo estadísticamente significativo de incremento de crisis febriles con la administración concomitante de vacuna antigripal inactivada y la neumocócica conjugada. Por ello la Academia Americana de Pediatría y los CDC recomiendan que las vacunas antigripales sean administradas el mismo día que otras vacunas de los calendarios infantiles.
En la actualidad, se estima que el riesgo de desarrollar un síndrome de Guillain-Barré (SGB) por una infección gripal es mayor que por la vacunación. En niños no se ha encontrado que la vacunación frente a gripe suponga un riesgo para presentar SGB, si bien se necesita una mayor investigación al respecto.
Se ha identificado una asociación entre la aparición de narcolepsia posvacunal en los portadores del alelo HLA-DQB1*0602 y algún tipo específico de vacuna (H1N1pdm09 adyuvada con AS03)]. En la actualidad, ninguna de las vacunas antigripales comercializadas, autorizadas para niños o adolescentes, se asocia a un incremento del riesgo de narcolepsia.
Respecto a la seguridad de la vacuna atenuada intranasal, se han realizado muchos ensayos clínicos y estudios poscomercialización que avalan el perfil de seguridad de la vacuna atenuada intranasal, que ha sido evaluada mediante revisiones periódicas de informes realizados en base a notificaciones de eventos adversos después mas de 20 años comercializada y millones de dosis administradas. En un estudio prospectivo observacional con datos recogidos del Kaiser Permanente del norte de California con un total de 62 020 vacunados, los eventos observados más frecuentemente fueron las infecciones del tracto respiratorio inferior y las sibilancias. Con todo, no aumentó la incidencia de hospitalizaciones respecto a la población de referencia. Los efectos adversos más frecuentes se asocian con la presencia de congestión nasal y rinitis tras su administración, efectos estos que son transitorios. La vacuna atenuada intranasal tiene como advertencias y precauciones de empleo el padecimiento de asma grave o sibilancias activas; en algunos trabajos recientes se ha empleado la vacuna en niños con asma sin presentarse efectos adversos.
En cuanto a la vacunación de la embarazada, existe un gran número de trabajos que avalan la seguridad de la vacunación antigripal en cualquier momento del embarazo. Su uso desde hace décadas muestra que no se asocia con un incremento del riesgo de malformación congénita, muerte fetal o aborto espontáneo.
11. Contraindicaciones y precauciones
11.1. Contraindicaciones
Una de las contraindicaciones para no recibir la vacuna de la gripe es por edad, y así, las vacunas inactivadas parenterales están contraindicadas en menores de 6 meses, y la atenuada intranasal en menores de 24 meses. Tabla 26.6.
Se considera también una contraindicación absoluta cuando se ha presentado una reacción anafiláctica o alérgica grave a la vacuna antigripal previa o a alguno de sus componentes, excepto el huevo, ya que actualmente el antecedente de reacción alérgica grave al huevo no contraindica la vacunación antigripal. Esta circunstancia, que es muy poco frecuente, acontece en 1,35 por millón de dosis (IC 95 %: 0,65 a 2,47).
En cuanto a la vacuna intranasal atenuada, además de las contraindicaciones mencionadas anteriormente, se recomienda que no se administre a:
• Inmunocomprometidos, a excepción de niños con infección por VIH estable que reciben terapia antirretroviral y con una función inmunitaria adecuada
• Convivientes con personas con inmunosupresión grave
• Niños de 2 a 17 años que reciben aspirina o terapia que contiene aspirina, debido a la asociación del síndrome de Reye
• Embarazadas, por ausencia de datos de seguridad
11.2. Precauciones
Como sucede con otras vacunas, se recomienda posponer la vacunación cuando exista alguna enfermedad febril o cualquier proceso agudo moderado o grave. No es necesario retrasarla ante procesos leves.
Se recomienda no vacunar a los niños sanos que desarrollaron un síndrome de Guillain-Barré dentro de las 6 semanas posteriores a una vacunación antigripal. Sin embargo, se debe valorar en aquellos con enfermedades de base, ya que en estos niños los beneficios sobrepasan al hipotético riesgo.
Del mismo modo, el desarrollo de una púrpura trombocitopénica inmune en los 7 días siguientes a haber recibido la vacuna antigripal inactivada podría considerarse una precaución para la administración de futuras dosis, por el riesgo de recurrencia.
En cuanto a la vacuna intranasal debe usarse con precaución en niños con asma moderada o grave, aunque los CDC no la recomiendan en niños de 2 a 4 años que tienen asma o que han tenido antecedentes de sibilancias en los últimos 12 meses. Asimismo, se debe evitar el contacto estrecho con personas gravemente inmunodeprimidas (por ej., receptores de transplantes de médula ósea que requieren aislamiento) durante 1 semana tras la vacunación.
La vacuna atenuada intranasal está contraindicada en inmunodeprimidos, pero puede emplearse en sus contactos de 2 a 17 años, siempre que el paciente inmunocomprometido no lo sea por haber recibido un trasplante de progenitores hematopoyéticos (TPH) en los 2 meses previos, padezca enfermedad injerto contra huésped o bien sufra una inmunodeficiencia combinada grave (IDCG). En estos casos, si un contacto recibe la vacuna atenuada, deberá evitar el contacto con estos pacientes en los 7 días posteriores a la recepción de la vacuna.
Tabla 26.6. Contraindicaciones generales de la vacunación antigripal.
|
12. Quimioprofilaxis de la gripe en niños
12.1. Agentes antivirales utilizados en la quimioprofilaxis de la gripe
Los antivirales no pueden sustituir a la vacuna, salvo en niños en quienes la vacunación esté contraindicada. Existen 4 fármacos. Tres son inhibidores de la neuraminidasa como Oseltamivir (oral), Zanamivir (inhalado) y Peramivir (intravenoso) y el otro es un inhibidor selectivo de la endonucleasa cap-dependiente, el Baloxavir marboxil. No se hace mención de los adamantanos, amantadina y rimantadina, ya que se ha comunicado un nivel elevado de resistencias frente a los virus A que circulan normalmente, por ello, mientras no cambien estos patrones de resistencia, estas medicaciones no están recomendadas. Los únicos antivirales autorizados para la profilaxis de la gripe en el niño en España son oseltamivir y zanamivir.
Desde septiembre de 2009, más del 99 % de las cepas circulantes de virus de la gripe han sido sensibles a los inhibidores de la neuraminidasa.
Inhibidores de la neuraminidasa
El oseltamivir, el zanamivir y el peramivir son inhibidores de la neuraminidasa, que impiden la liberación de viriones de la célula huésped. Son activos contra los virus influenza tipo A (incluida la cepa H1N1pandémica del 2009-2010) y el virus de influenza B. Oseltamivir y zanamivir están disponibles en España. El peramivir aunque está autorizado por la EMA desde 2018 no está disponible en España (si en Japón, Corea, Reino Unido y EE. UU.), su uso es por vía intravenosa y su indicación es a partir de los 2 años (6 meses en EE.UU.).
El oseltamivir o el zanamivir son los agentes antivirales recomendados para la prevención de la gripe. Durante la temporada 2013-2014, el 98,2 % de los virus H1N1 2009 eran susceptibles al oseltamivir mientras que el 100 % de los virus H1N1 2009 analizados eran susceptibles al zanamivir. El oseltamivir y zanamivir utilizados en quimioprofilaxis disminuyen significativamente la enfermedad gripal en los hogares y hospitales de los contactos de pacientes con gripe confirmada por laboratorio. La quimioprofilaxis reduce, pero no elimina, el riesgo de gripe, y potencialmente los pacientes pueden transmitir el virus, aunque clínicamente la enfermedad sea prevenida. Igualmente persiste la susceptibilidad a enfermar de gripe una vez que se suspende el medicamento antiviral.
El oseltamivir (Tamiflu, Ebilfumin) es de primera elección y está actualmente indicado para el tratamiento de la gripe en adultos y niños, incluidos los recién nacidos a término (es decir, desde el nacimiento), cuando el virus gripal está circulando en la comunidad, y para la profilaxis posexposición en personas de 1 año o más, aunque se admite el uso por debajo de un año en caso de posexposición en brotes intensos. En Estados Unidos está autorizado tanto para tratamiento, desde el periodo neonatal, pero para la prevención se exige una edad mínima de 3 meses por los limitados datos de seguridad y eficacia en este grupo de edad (tabla 26.7). Se administra por vía oral. Está disponible en cápsulas o como un polvo para suspensión líquida.
Las dosis y la duración en la quimioprofilaxis de la gripe varían según el peso (tabla 26.8):
- 30 mg una vez al día para niños que pesan 15 kg o menos
- 45 mg una vez al día para niños que pesan más de 15 kg y hasta 23 kg
- 60 mg una vez al día para niños que pesan más de 23 kg y hasta 40 kg
- 75 mg una vez al día para niños que pesan más de 40 kg
El oseltamivir es en general bien tolerado, con pocos efectos adversos sobre todo gastrointestinales (dolor abdominal, náuseas, vómitos).
El zanamivir (Relenza) está aprobado para la profilaxis de la gripe en niños a partir de 5 años. Para el tratamiento se requiere una edad de 7 años. Es un polvo seco administrado por inhalación oral; las dosis se muestran en la tabla 26.8. Este polvo para inhalación no debe ser reconstituido en cualquier formulación líquida y no se recomienda para su uso en nebulizadores o ventiladores mecánicos. No se recomienda para los pacientes con antecedentes de sibilancias o enfermedad respiratoria crónica subyacente por presentar un mayor riesgo de desarrollar broncoespasmo y ocasionalmente pueden tener alguna disminución en su función respiratoria después de la administración del fármaco.
Es generalmente bien tolerado y los eventos adversos más comúnmente comunicados incluyen diarrea, náuseas, signos y síntomas nasales, bronquitis, tos, dolor de cabeza y mareos.
En la vigilancia posautorización se han identificado efectos adversos raros, pero graves, en pacientes con gripe que están tomando inhibidores de la neuraminidasa. Entre estos se incluyen efectos neuropsiquiátricos (delirio, alucinaciones, confusión, comportamiento anormal, convulsiones y encefalitis), muerte y reacciones cutáneas graves (incluyendo necrolisis epidérmica tóxica, síndrome de Stevens-Johnson y eritema multiforme).
Peranivir (Alpivab) también es un inhibidor de la neuraminidasa y está indicado para el tratamiento de la gripe no complicada en adultos y niños a partir de 2 años de edad; se debe adminmistrar en una sola dosis intravenosa en las 48 horas siguientes del inicio de los síntomas gripales. En Estados uUnidos la FDA lo autoriza a partir de los 6 meses.
Tabla 26.7. Dosis recomendadas de oseltamivir para la profilaxis de la gripe en niños menores de 1 año de edad.
| Edad | Dosis recomendada para la profilaxis durante 10 días |
|---|---|
| <3 meses | No recomendado salvo en situaciones críticas. Datos limitados en este grupo de edad |
| 3-11 meses | 3 mg/kg/dosis, una vez al día |
Las dosis recomendadas en esta tabla no están indicadas en los niños prematuros, los cuales pueden tener una eliminación más lenta de oseltamivir debido a una inmadurez de la función renal, pudiendo conducir a altas concentraciones séricas del medicamento en los recién nacidos prematuros de menos de un año de edad.
Tabla 26.8. Dosificación de los inhibidores de la neuraminidasa para la prevención de la gripe en niños y adolescentes.
| Agente antiviral Presentaciones |
Dosis recomendadas para la profilaxis | ||||
|---|---|---|---|---|---|
|
Oseltamivir 30 mg cápsulas |
1 a 12 años | ≥13 años | |||
| ≤15 kg | >15 a 23 kg | >23 a 40 kg | >40 kg | 75 mg una vez al día | |
| 30 mg una vez al día | 45 mg una vez al día | 60 mg una vez al día | 75 mg una vez al día | ||
|
Zanamivir 5 mg por inhalación |
Niños ≥5 años y adultos | ||||
| 2 inhalaciones (10 mg total por dosis), una vez al día | |||||
Si la presentación comercial de la suspensión oral de oseltamivir no estuviera disponible, las cápsulas de oseltamivir se pueden abrir y mezclar con líquidos azucarados.
Inhibidor selectivo de la endonucleasa cap-dependiente
El baloxavir marboxil (ácido 5-hidroxi-4-piridona-3-carboxi- lo) (Xofluza) es un fármaco antiviral con especial eficacia sobre los virus gripales que actúa inhibiendo la endonucleasa ácida de la polimerasa, una enzima esencial para la replicación viral. Es el primer representante de los denominados inhibidores de la proteína básica 2 (PB2) gripal. Ha mostrado eficacia frente a los virus gripales A y B y la mayoría de cepas de origen animal (gripe aviar). La edad mínima es de 12 años. No está indicado para la profilaxis.
12.2. Indicaciones de la quimioprofilaxis
Quimioprofilaxis preexposición
Debe reservarse para los niños que están en alto riesgo de presentar complicaciones relacionadas con la gripe y que no pueden ser protegidos de otra manera durante la época de circulación del virus gripal. El uso indiscriminado de la quimioprofilaxis puede promover la resistencia a los medicamentos antivirales y reducir la disponibilidad de estos para el tratamiento de las personas que están gravemente enfermas o con alto riesgo de complicaciones por la gripe.
Ante la existencia de un brote de gripe estacional en la comunidad, los potenciales grupos de destinatarios para la quimioprofilaxis preexposición pueden incluir los siguientes:
- Niños con alto riesgo de gripe grave o complicada en los que está contraindicada la vacuna frente a la gripe.
- Niños con alto riesgo de gripe grave o complicada durante las dos semanas siguientes a la vacunación de la gripe.
- Los familiares y profesionales de la salud no vacunados y que sea probable que tengan contacto estrecho y prolongado con niños no vacunados menores de 24 meses o pertenecientes a grupos de alto riesgo de gripe grave o complicada.
- El personal y los niños no vacunados en un entorno institucional cerrado (para controlar la aparición de brotes).
- Los niños de alto riesgo que pueden no responder adecuadamente a la vacuna contra la gripe, incluyendo los inmunocomprometidos (utilizando la quimioprofilaxis como un complemento a la vacunación).
- Los niños de alto riesgo y sus familiares cuando circulan cepas de virus de la gripe que no se corresponden con las cepas que lleva la vacuna de la gripe estacional de esa temporada.
La duración de la profilaxis pre-exposición depende de la indicación. Para las personas que reciben quimioprofilaxis mientras se espera el desarrollo de una respuesta inmune a la vacuna, la duración es generalmente de dos semanas. En las otras situaciones, esta quimioprofilaxis debe administrarse todos los días durante la duración de la potencial exposición a una persona con gripe. Pautas de duración de 28 días para el zanamivir y de 42 días para oseltamivir han sido bien toleradas, pero no hay datos publicados del uso de pautas con una duración superior a las 6 semanas.
Profilaxis posexposición
La profilaxis posexposición puede ser indicada en los niños que han tenido contacto estrecho con un caso confirmado o sospechoso de gripe durante el periodo de infectividad (es decir, un día antes del inicio de los síntomas y hasta 24 horas después de la desaparición de la fiebre) pertenecientes a grupos de alto riesgo de complicaciones de la gripe. Esta profilaxis está indicada sólo antes de las 48 horas de la exposición más reciente, no estando indicada en el caso de haber transcurrido más de 48 horas desde el último contacto o cuando se produjo el contacto fuera del periodo de infecciosidad de la persona enferma. El tratamiento precoz de las personas expuestas es una alternativa a la profilaxis posexposición. La duración de esta quimioprofilaxis es de aproximadamente siete días después de la última exposición conocida. Para el control de brotes en centros cerrados de larga estancia y hospitales, la quimioprofilaxis debe administrarse durante un mínimo de dos semanas y hasta una semana después de que se identificó el último caso conocido.
13. Bibliografía
- Aldhaeefi M, et al. Update and narrative review of avian influenza (H5N1) infection in adult patients. Pharmacotherapy. 2024;44:870-9.
- Alguacil-Ramos AM, et al. Seguridad de las vacunas antigripales en grupos de riesgo: análisis de las sospechas de reacciones adversas notificadas en Comunidad Valenciana entre 2005 y 2011. Rev Esp Quimioter. 2015;28:193-9.
- Alvarez Aldeán J, et al. Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones del Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría (CAV-AEP) para la temporada 2024−2025. An Pediatr (Engl Ed). 2024;100:438-47.
- Alvarez Aldeán J, et al. Vacunación antigripal en la infancia y la adolescencia. Consenso AEV, CAV-AEP y SEIP. An Pediatr (Engl Ed). 2025;103:503965.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. An Pediatr (Barc). 2026;104:504051.
- Ambrose CS, et al. The efficacy of intranasal live attenuated influenza vaccine in children 2 through 17 years of age: a meta analysis of 8 randomized controlled studies. Vaccine. 2012;30:886-92.
- American Academy of Pediatrics. Influenza. In: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2024-2027 Report of the Committee on Infectious Diseases. 33rd ed. Itasca, IL: American Academy of Pediatrics; 2024:456-72.
- American Academy of Pediatrics News. Hospital admissions for flu in children ages 5-17 up 145% since Jan. 4, AAP analysis shows Free. February 13, 2025 [Fuente: CDC. NHSN Hospital Respiratory Data (HRD) Dashboard ].
- American Academy of Pediatrics. Committee on Infectious Diseases. Recommendations for Prevention and Control of Influenza in Children, 2025-2026: Policy Statement. Pediatrics. 2025 Jul 28. doi: 10.1542/peds.2025-073620. Online ahead of print.
- Arístegui Fernández J, et al., en representación del grupo de estudio HOSPIGR. Hospitalizaciones infantiles asociadas a infección por virus influenza en seis ciudades de España (2014-2016). An Pediatr (Barc). 2019;90:86-93.
- Arrazola P, et al. Cobertura vacunal antigripal de los trabajadores de un hospital general, 2004-2011. Vacunas. 2012;13:138-44.
- Australian Respiratory Surveillance Report. Report 30 June to 13 July 2025.
- Australian Society of Clinical Immunology and Allergy (ASCIA). Egg Allergy and Influenza vaccination. Information for patiens, consumers and carers. Australia, 2020.
- Azziz-Baumgartner E, et al. Realizing the Potential of Maternal Influenza Vaccination. JAMA. 2021;325:2257-9.
- Barbieri E, et al. Cost-Effectiveness of Influenza Vaccination in Healthy Children: A 10-Year Population-Based Study. Vaccines (Basel). 2024;12(10):1113.
- Bénet T, et al; AFP Study Group. Incidence of Asymptomatic and Symptomatic Influenza Among Healthcare Workers: A Multicenter Prospective Cohort Study. Clin Infect Dis. 2021;72:e311-8.
- Cáceres R. Panorama actual del medicamento. 2024;48(470):127-30.
- Canadian Immunization Guide. Summary of NACI statement of April 30, 2025: Statement on seasonal influenza vaccine for 2025–2026. April 30, 2025.
- Centers for Disease Control and Prevention. ACIP Evidence to Recommendations (EtR) Framework: Safety of Influenza Vaccines for Persons with Egg Allergy. Last Reviewed: September 5, 2024.
- Centers for Disease Control and Prevention. Flu Vaccines and People with Egg Allergies.
- Centers for Disease Control and Prevention. Fluview. Influenza pediatric associated mortality.
- Centers for Disease Control and Prevention. H5 Bird Flu Current Situation.
- Centers for Disease Control and Prevention. Influenza (Flu) ACIP Recommendations Sumary. Aug 28, 2025
- Centers for Disease Control and Prevention. NHSN Hospital Respiratory Data (HRD) Dashboard.
- Centers for Disease Control and Prevention. Respiratory illnesses. Vaccination trends. March 21, 2025.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Vigilancia de la enfermedad respiratoria. Semana 02/2026 (del 5 de enero al 11 de enero de 2026). Enero de 2026.
- Chung JR, et al. Live attenuated and inactivated influenza vaccine effectiveness. Pediatrics. 2019;143:e20182094.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026. [Internet]. Madrid: AEP; 2026.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Encuesta 2012-2013: ¿Los pediatras nos vacunamos de la gripe?.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas antigripales.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ago/2025.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. Manual de Inmunizaciones en línea de la AEP. [Internet]. Madrid: AEP; may/2025.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones 2025-2026. AEP [Internet]. Septiembre 2025.
- Consejo Interterritorial del Sistema Nacional de Salud. Recomendaciones de vacunación frente a la gripe en la temporada 2025-26. Comisión de Salud Pública 3 julio 2025.
- De Gioia ER, et al. The Role of Needle Fear in Pediatric Flu Vaccine Hesitancy: A Cross-Sectional Study in Bologna Metropolitan Area. Vaccines. 2022;10:1388.
- Demicheli V, et al. Vaccines for preventing influenza in healthy adults. Cochrane Database Syst Rev. 2018;2:CD001269.
- Des Roches A, et al. Safe vaccination of patients with egg allergy by using live attenuated influenza vaccine. J Allergy Clin Immunol Pract. 2015;3:138-9.
- Dhanasekaran V, et al. Human seasonal influenza under COVID-19 and the potential consequences of influenza lineage elimination. Nat Commun. 2022;13:1721.
- Díaz-García RS, et al. Vaccination against influenza: Coverage and adherence in children under 15 years with high-risk medical conditions in the Community of Madrid. An Pediatr (Engl Ed). 2023;98:3-11.
- DRIVE-WP7-IVE Report. D7.9 Brand-specific influenza vaccine effectiveness in Europe Season 2021/22.
- Duffy J, et al. Vaccine Safety Datalink. Febrile seizure risk after vaccination in children 6 to 23 months. Pediatrics. 2016;138(1):pii: e20160320.
- Echeverría Zudaire L, et al. Documento de consenso sobre la actitud ante un niño con una reacción alérgica tras la vacunación o alergia a componentes vacunales (SEICAP, CAV-AEP). An Pediatr (Barc). 2015;83:63.e1-10.
- Elsaid M, et al. Immune thrombocytopenic purpura after influenza vaccine administration; a systematic review and meta-analysis. Trop Dis Travel Med Vaccines. 2023;9:22
- European Centre for Disease Prevention and Control (ECDC). Public health guidance: Seasonal influenza vaccination of children and pregnant women. 4 Oct 2012
- European Centre for Disease Prevention and Control (ECDC). Seasonal influenza vaccines.
- European Centre for Disease Prevention and Control (ECDC).Influenza virus characterization. September 2025.
- European Centre for Disease Prevention and Control (ECDC). Vaccine Scheduler. Influenza: recommended vaccinations.
- European Medicines Agency (EMA). EU reccomendations for 2025-2026 seasonal flu vaccine composition. 01/04/2025.
- European Medicines Agency (EMA). Vaccines for pandemic influenza.
- Fazal A, et al. Reports of Encephalopathy Among Children with Influenza-Associated Mortality - United States, 2010-11 Through 2024-25 Influenza Seasons. MMWR Morb Mortal Wkly Rep. 2025;74:91-5.
- Finish Institute For Health and Welfare. Influenza epidemic continues, vaccine protection is fairly good. Publication date 19.2.2024.
- Flannery B, et al. Influenza vaccine effectiveness against pediatric deaths: 2010-2014. Pediatrics. 2017;139.pii:e20164244.
- Fluview. CDC. Influenza pediatric associated mortality. [Internet] [consultado 20/may/2025].
- Fowlkes AL, et al. Interim Effectiveness Estimates of 2023 Southern Hemisphere Influenza Vaccines in Preventing Influenza-Associated Hospitalizations — REVELAC–i Network, March–July 2023. MMWR Morb Mortal Wkly Rep. 2023;72:1010-5.
- Frutos AM, et al; CDC Influenza Vaccine Effectiveness Collaborators. Interim Estimates of 2024-2025 Seasonal Influenza Vaccine Effectiveness - Four Vaccine Effectiveness Networks, United States, October 2024-February 2025. MMWR Morb Mortal Wkly Rep. 2025;74:83-90.
- Gallagher N, et al. Impact of live attenuated influenza vaccination programme for healthy children in Northern Ireland: A comparison of seven influenza seasons, 2010/11–2016/17, Vaccine. 2018;36:521-6.
- García A, et al. Documento de actualización y reflexión sobre vacunación antigripal en España. 11 junio 2018.
- González R, et al. Influenza vaccination coverage in children with risk conditions in Catalonia. Enferm Infecc Microbiol Clin. 2015;33:22-6.
- González-Rubio F, et al. Influenza vaccination: an ally to mitigate influenza-associated risks during the coronavirus pandemics. Clin Infect Dis. 2020 Aug 11:ciaa1190. doi: 10.1093/cid/ciaa1190. Online ahead of print.
- Greenhawt M, et al. Administration of influenza vaccines to egg allergic recipients: A practice parameter update 2017. Ann Allergy Asthma Immunol. 2018;120:49.
- Gripómetro. Cobertura de vacunación antigripal en España.
- Grohskopf LA, et al. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2025-26 Influenza Season. MMWR Morb Mortal Wkly Rep. 2025;74:500-7.
- Hamiel U, et al. Recurrent immune thrombocytopenia after influenza vaccination: A case report. Pediatrics. 2016;138(6). pii:e20160124.
- Heikkinen T, et al. Vaccination of healthy children against seasonal influenza. A European perspective. Pediatr Infect Dis J. 2013;32:881-8.
- Hu X, et al. Genomic characterization of highly pathogenic avian influenza A H5N1 virus newly emerged in dairy cattle. Emerg Microbes Infect. 2024;13:2380421.
- Hunagund S, et al. Effects of Vaccination Against Influenza, Pertussis, and COVID-19 on Human Milk Antibodies: Current Evidence and Implications for Health Equity. Front Immunol. 2022;13:910383.
- Ison MG, et al. The Emerging Threat of H5N1 to Human Health. N Engl J Med. 2025;392:916-8.
- Jain VK, et al. Time to change dosing of inactivated quadrivalent influenza vaccine in young children: evidence from a Phase III, randomized, controlled trial. J Pediatric Infect Dis Soc. 2017;6:9-19.
- Jantarabenjakul W, et al. Neurological complications associated with influenza in hospitalized children. Influenza Other Respir Viruses. 2023;17:e13075.
- Jefferson T, et al. Vaccines for preventing influenza in healthy children. Cochrane Database Syst Rev. 2018;2:CD004879.
- Kalligeros M, et al. Influenza vaccine effectiveness against influenza-associated hospitalization in children: A systematic review and meta-analysis. Vaccine. 2020;38:2893-903.
- Kharbanda EO, et al. Vaccine Safety Datalink. First trimester influenza vaccination and risks for major structural birth defects in offspring. J Pediatr. 2017;187:234-239.e4.
- Levison LS, et al. Guillain-Barré syndrome following influenza vaccination: A 15-year nationwide population-based case-control study. Eur J Neurol. 2022;29):3389-94.
- Maddux AB, et al; PALISI Pediatric Intensive Care Influenza Network Investigators. Association of Asthma With Treatments and Outcomes in Children With Critical Influenza. J Allergy Clin Immunol Pract. 2023;11:836-43.e3.
- Marien AG, et al. Parental acceptance of an intranasal vaccine: Example of influenza vaccine. Arch Pediatr. 2019;26:71-4.
- Maritsi D, et al. Influenza vaccine uptake in juvenile idiopathic arthritis: a multi-centre cross-sectional study. Eur J Pediatr. 2024;183:2937-44.
- Mattila JM, et al. Burden of influenza during the first year of life. Influenza Other Respi Viruses. 2021;15:506-12
- Maurel M, et al; European IVE group. Interim 2023/24 influenza A vaccine effectiveness: VEBIS European primary care and hospital multicentre studies, September 2023 to January 2024. Euro Surveill. 2024;29:2400089.
- Ministerio de Sanidad. Calendario común de vacunación a lo largo de toda la vida. Calendario del año 2026. Enero 2026.
- Ministerio de Sanidad. Evaluación Rápida de Riesgo. Situación Mundial de la Gripe Aviar. 5.ª actualización de 10 de diciembre 2024.
- Ministerio de Sanidad. Portal Estadístico. SIVAMIN.
- Ministerio de Sanidad. Vacunación frente a gripe en la temporada 2025-2026. Preguntas y respuestas sobre vacunación frente a gripe. 23 de septiembre de 2025.
- Ministerio de Sanidad- Recomendaciones de vacunación frente a la gripe en población infantil de 6 a 59 meses. Ponencia de Programa y Registro de Vacunaciones 2022. Octubre de 2022.
- Ministerio de Sanidad. Gobierno de España. Ponencia de Programa y Registro de Vacunaciones. Recomendaciones de vacunación frente a gripe en la temporada 2025-2026 en España Aprobado por la Comisión de Salud Pública el 3 de julio de 2025.
- Ministerio de Sanidad. Vacunación en grupos de riesgo de todas las edades y en determinadas situaciones. Julio 2018.
- Moraga Llop F, et al. Ni estando en el calendario: reflexiones sobre el fracaso de la cobertura de vacunación antigripal en Pediatría. Pediatr Integral 2024;XXVIII:484-5.
- Nohynek H, et al. Effectiveness of the live attenuated and the inactivated influenza vaccine in two-year-olds - a nationwide cohort study Finland, influenza season 2015/16. Euro Surveill. 2016;21:pii=30346.
- NSW Government. Australian Technical Advisory Group on immunization (ATAGI). 2025 seasonal influenza vaccination information for immunisation providers.
- Nunes MC, et al. Influenza vaccination during pregnancy for prevention of influenza confirmed illness in the infants: a systematic review and meta-analysis. Hum Vaccin Immunother. 2018;14:758-66.
- Olson S, et al. Vaccine Effectiveness Against Life-Threatening Influenza Illness in US Children. Clin Infect Dis. 2022 75:230-8.
- Orrico-Sánchez A, et al. Efficacy and effectiveness of influenza vaccination in healthy children. A review of current evidence. Enferm Infecc Microbiol Clin (Engl Ed). 2023;41:396-406.
- Palma-García A, et al. Effectiveness of Influenza Vaccination in Children Aged 6 to 59 Months during the Inaugural 2022-2023 Season in Andalusia, Spain. J Pediatr. 2025:282:114558.
- Pebody R, et al. Live attenuated influenza vaccine (LAIV): recent effectiveness results from the USA and implications for LAIV programmes elsewhere. Arch Dis Child. 2018;103:101-5.
- Pebody RG, et al. End of season influenza vaccine effectiveness in primary care in adults and children in the United Kingdom in 2018/19. Vaccine. 2020;38:489-97.
- Pérez-Gimeno G, et al; SiVIRA group; Members of the SiVIRA sentinel surveillance study group. Effectiveness of influenza vaccines in children aged 6 to 59 months: a test-negative case-control study at primary care and hospital level, Spain 2023/24. Euro Surveill. 2024;29:2400618.
- Pérez Martín JJ, et al. Influenza Vaccination in Children Younger than 5 Years in the Region of Murcia (Spain), a Comparative Analysis among Vaccinating and Non-Vaccinating Parents: Data from the FLUTETRA Study. Vaccines (Basel). 2024;12:192.
- Public Health England (PHE). Annual flu programme.
- Public Health England (PHE). Influenza. The Green Book, Chapter 19. March 2023. Updated 29 May 2025.
- Public Health England (PHE). National flu immunisation programme 2024 to 2025 letter. June 2024.
- Sahni LC, et al. Maternal Vaccine Effectiveness Against Influenza-Associated Hospitalizations and Emergency Department Visits in Infants. JAMA Pediatr. 2024;178:176-84.
- Sakala IG, et al. Influenza immunization during pregnancy: Benefits for mother and infant. Hum Vaccin Immunother. 2016;12:3065-71.
- Sanz Fadrique R, et al. Guillain-Barré syndrome and influenza vaccines: current evidence. Rev Esp Quimioter. 2019;32:288-95.
- Sanz-Muñoz I, et al. Importancia de los Centros Nacionales de Gripe en la vigilancia de virus aviares de alta patogenicidad. El momento para One-Health es ahora. Rev Esp Quimioter. 2024;37:121-6.
- Scott J, et al. Updated Evidence for Covid-19, RSV, and Influenza Vaccines for 2025-2026. N Engl J Med. 2025;393:2221-42.
- Shang M, et al. Influenza-Associated Pediatric Deaths in the United States, 2010–2016. Pediatrics. 2018;141:e20172918.
- Sinnathamy MA, et al. Uptake and impact of vaccinating primary school children against influenza: Experiences in the fourth season of the live attenuated influenza vaccination programme, England, 2016/2017. Influenza Other Respir Viruses. 2022;16:113-24.
- Statens Serum Institut. Denmark. Influenza - surveillance.
- Stein AN, et al. Relative Vaccine Effectiveness of Cell- vs Egg-Based Quadrivalent Influenza Vaccine Against Test-Confirmed Influenza Over 3 Seasons Between 2017 and 2020 in the United States. Open Forum Infect Dis. 2024;11:ofae175.
- Stein AN, et al. Superior Effectiveness and Estimated Public Health Impact of Cell- Versus Egg-Based Influenza Vaccines in Children and Adults During the US 2023-2024 Season. Infect Dis Ther. 2025;14:2693-718.
- Stuurman AL, et al; DRIVE Study Contributors. Brand-specific estimates of influenza vaccine effectiveness for the 2021-2022 season in Europe: results from the DRIVE multi-stakeholder study platform. Front Public Health. 2023;11:1195409.
- Takeda S, et al. Influenza vaccination during pregnancy and its usefulness to mothers and their young infants. J Infect Chemother. 2015;21:238-46.
- Thompson MG, et al; PREVENT Workgroup. Influenza vaccine effectiveness in preventing influenza-associated hospitalizations during pregnancy: a multi-country retrospective test negative design study, 2010-2016. Clin Infect Dis. 2019;68:1444–53
- Thorrington D, et al. Cost-effectiveness analysis of quadrivalent seasonal influenza vaccines in England. BMC Med. 2017;15:166.
- Trombetta CM, et al. Influenza Viruses and Vaccines: The Role of Vaccine Effectiveness Studies for Evaluation of the Benefits of Influenza Vaccines. Vaccines (Basel). 2022;10:714.
- UK Health Security Agency. Guidance on use of antiviral agents for the treatment and prophylaxis of seasonal influenza. Version 11, November 2021.
- UK Health Security Agency. Seasonal influenza vaccine uptake in GP patients: monthly data, 2024 to 2025. 28 nov 2024. Last updated 27 march 2025.
- UK Health Security Agency. Surveillance of influenza and other seasonal respiratory viruses in the UK, winter 2023 to 2024. Updated 20 January 2025.
- Vesikari T, et al. Immunogenicity and safety of a quadrivalent inactivated influenza vaccine in pregnant women: a randomized, observer-blind trial. Hum Vaccin Immunother. 2020;16:623-9.
- Villani L, et al. Seasonal influenza in children: Costs for the health system and society in Europe Influenza Other Respir Viruses. 2022;16:820-31.
- Wagner AL, et al. Single-Dose Vaccination Among Infants and Toddlers Provides Modest Protection Against Influenza Illness, Which Wanes After 5 Months. J Infect Dis. 2022;227:87-91.
- Wang X, et al. Global burden of respiratory infections associated with seasonal influenza in children under 5 years in 2018: a systematic review and modelling study. Lancet Glob Health. 2020;8:e497-510.
- White EB, et al. High Influenza Incidence and Disease Severity Among Children and Adolescents Aged <18 Years - United States, 2022-23 Season. MMWR Morb Mortal Wkly Rep. 2023;72:1108-14.
- Williams KV, et al. Increasing child vaccination coverage can reduce influenza cases across age groups: An agent-based modeling study. J Infect. 2025;90:106443.
- World Health Organization (WHO). Clinical practice guidelines for influenza. 12 septembrer 2024
- World Health Organization (WHO). Recommended composition of influenza virus vaccines for use in the 2025–2026 northern hemisphere influenza season. 28 feb 2025
- World Health Organization (WHO). Recommendations announced for influenza vaccine composition for the 2026 southern hemisphere influenza season. 26 September 2025.
- World Health Organization (WHO). Vaccines against influenza WHO position paper–November 2012. Wkly Epidemiol Rec. 2012;87:461-76.
- World Health Organization (WHO). Vaccines against influenza: WHO position paper – May 2022
- Wong KK, et al. Influenza-associated pediatric deaths in the United States, 2004-2012. Pediatrics. 2013;132:796-804.
- Yang M, et al. Characteristics and outcome of influenza-associate encephalopathy/encephalitis among children in China. Clinics (Sao Paulo). 2024;79:100475.
- Zhang C, et al. Interplay between viral shedding, age, and symptoms on individual infectiousness of influenza cases in households. J Infect Dis. 2025;231:462-70.
- Zornoza Moreno M, et al. Parents and teachers' perspectives on a school-located influenza vaccination program: A pilot study in the Region of Murcia, Spain. Hum Vaccin Immunother. 2024;20:2328406.
14. Enlaces de Interés
- American Academy of Pediatrics. Healthy children. Flu
- Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine Preventable Diseases (The Pink Book), 14th edition: Chapter 12. Influenza
- Centers for Disease Control and Prevention. Influenza (Flu)
- CDC Influenza (Flu) Information for Heath professionals
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Gripe
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de las vacunas antigripales comercializadas en España
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna de la gripe
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticia "Encuentro con la ciencia. Gripe: escalando en las coberturas de vacunación con nuevas recomendaciones"
- Comité Asesor de Vacunas e Inmunizaciones de la AEP.. Noticia "Puesta al día: recomendaciones de vacunación antigripal 2025-2026 por el CAV-AEP"
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la gripe
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la gripe
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación frente a la gripe estacional en la infancia y la adolescencia. Recomendaciones 2025-2026. AEP [Internet]
- European Centre for Disease Control and Prevention. Seasonal Influenza
- Instituto de Salud Carlos III. Informes de Vigilancia de la Gripe en España. Sistema de Vigilancia de la Gripe en España
- SiVIRA. Vigilancia centinela de Infección Respiratoria Aguda: gripe, COVID-19 y VRS
- The Australian Immunisation Handbook. Influenza (flu)
- WHO Influenza updates
15. Historial de actualizaciones
| 23 de diciembre de 2016 | Actualización de todos los apartados con las recomendaciones de la campaña 2016-2017. Nuevas citas bibliográficas y enlaces de interés |
| 13 de octubre de 2017 | Actualización de todos los apartados con las recomendaciones de la campaña 2017-2018. Nuevas citas bibliográficas y enlaces de interés |
| 2 de noviembre de 2018 | Actualización de todos los apartados con las recomendaciones de la campaña 2018-2019. Nuevas citas bibliográficas y enlaces de interés |
| 13 de noviembre de 2019 | Actualización de todos los apartados con las recomendaciones de la campaña 2019-2020. Nuevas citas bibliográficas y enlaces de interés |
| 6 de octubre de 2020 | Actualización de todos los apartados con las recomendaciones de la campaña 2020-2021. Nuevas citas bibliográficas y enlaces de interés |
| 1 de marzo de 2021 | Actualización de la composición de la vacuna para la campaña 2021-2022. Nueva cita bibliográfica y nuevo enlace de interés |
| 24 de septiembre de 2021 | Actualización de todos los apartados con las recomendaciones de la campaña 2021-2022. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2022 | Actualización del apartado "Epidemiología". Nuevas citas bibliográficas y enlaces de interés |
| 19 de octubre de 2022 | Actualización de todos los apartados con las recomendaciones de la temporada 2022-2023. Nuevas citas bibliográficas y enlaces de interés |
| 23 de noviembre de 2022 | Añadidas recomendaciones de los CDC sobre vacuna intranasal en los apartados "Administración con otras vacunas y otros productos" y "Contraindicaciones y precauciones" |
| 1 de enero de 2023 | Nuevas citas bibliográficas y enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 16 de marzo de 2023 | Actualización de todos los apartados con las recomendaciones de la temporada 2023-2024. Nuevas citas bibliográficas y enlaces de interés |
| 30 de junio de 2023 | Actualización del apartado "Efectividad de la vacunación antigripal". Nueva cita bibliográfica |
| 18 de septiembre de 2023 | Actualización de los apartados "Efectividad de la vacunación antigripal", "Indicaciones y esquemas de vacunación" y tabla 26.3, con una dosis en niños sanos si es la primera vez. Nuevas citas bibliográficas |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlaces de interés |
| 25 de marzo de 2024 | Actualización de la composición de la vacuna para la campaña 2024-2025. Nuevas citas bibliográficas |
|
3 de julio de 2024 |
Actualización de todos los apartados con las recomendaciones de la temporada 2024-2025 de la AEP. Nuevas citas bibliográficas y enlaces de interés |
| 7 de octubre de 2024 | Actualización de las recomendaciones del Ministerio para la temporada 2024-2025 |
| 1 de enero de 2025 | Nuevas citas bibliográficas y enlaces de interés |
| 20 de mayo de 2025 | Actualización de todos los apartados con las recomendaciones de la AEP de la temporada 2025-2026. Nuevas citas bibliográficas y enlaces de interés |
| 25 de septiembre de 2025 | Actualización de todos los apartados con las recomendaciones de la AEP de la temporada 2025-2026. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2026 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
-oOo-




