Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
36. Rubeola
Capítulo 36 - Rubeola
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de vacunas, composición y presentación (SRP y SRPV)
- Inmunogenicidad, eficacia y efectividad
- Vías de administración
- Indicaciones y esquemas de vacunación
- Administración con otras vacunas y otros productos
- Efectos adversos
- Precauciones y contraindicaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tabla y figura incluidas en el capítulo:
Tabla 36.1. Vacunas comercializadas en España
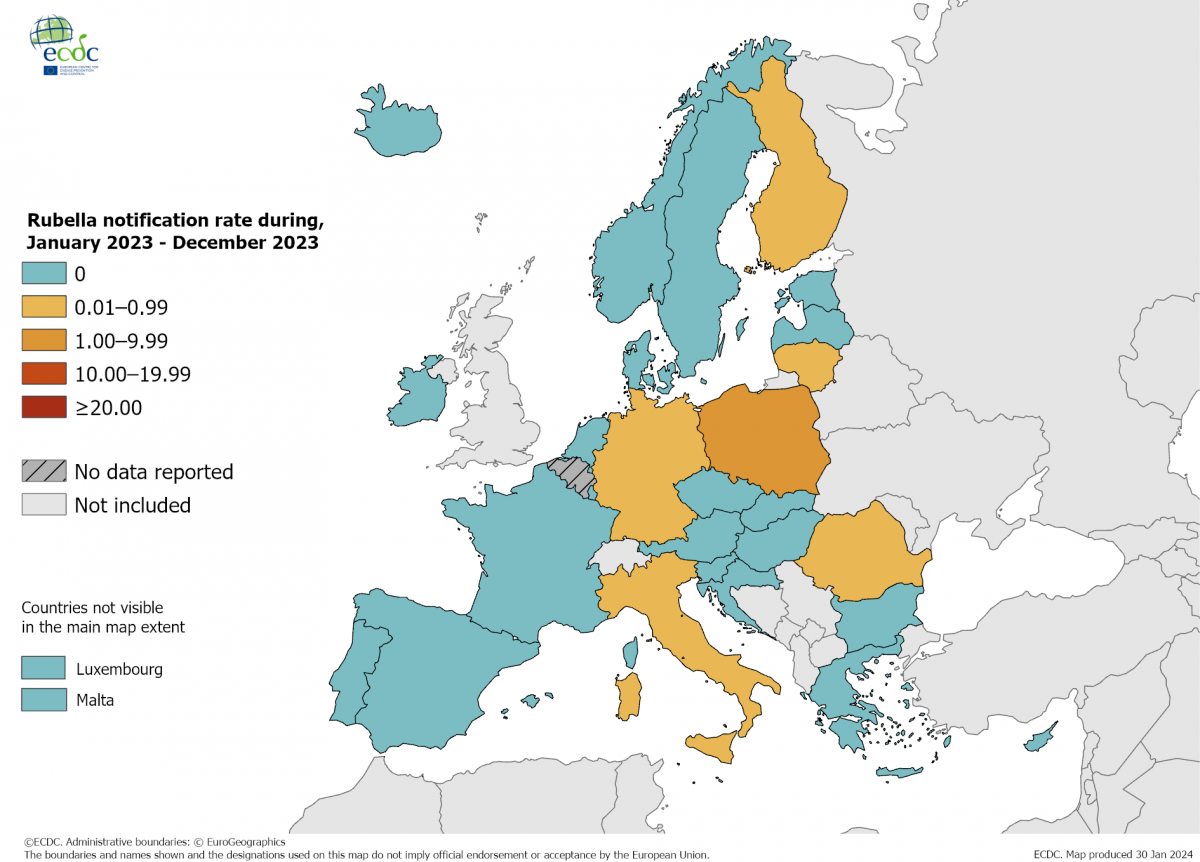
Figura 36.1. Tasa de notificación de rubeola por millón de habitantes por país, 1 de enero 2023-31 de diciembre 2023, países de la UE/AEE
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Rubeola. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2025. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-36
1. Puntos clave
- El virus de la rubeola es un Togavirus del género Rubivirus que produce una enfermedad exantemática en las personas susceptibles. Si se padece durante un embarazo puede dar lugar a anomalías en el desarrollo del embrión, el síndrome de la rubeola congénita.
- El periodo de incubación varía de 12 a 23 días. Es una enfermedad solo moderadamente contagiosa, abarcando el periodo de contagio desde 7 días antes de su inicio hasta 5-7 días después.
- La vacuna frente a la rubeola es de microorganismos atenuados y se prepara actualmente con la cepa Wistar RA27/3 cultivada en células diploides humanas. Forma parte de la vacuna combinada triple vírica (SRP) y tetravírica (SRPV).
- No hay vacuna de la rubeola monocomponente. En España solo existe vacuna de la rubeola combinada con las de sarampión y parotiditis, denominada vacuna triple vírica (SRP), y combinada además de con estas, con la de la varicela, en forma de tetravírica (SRPV).
- Se deben aplicar 2 dosis de SRP o de SRPV con un intervalo mínimo de un mes a partir de los 12 meses de edad. Si se aplica entre 6 y 11 meses de edad por un brote epidémico o un viaje internacional no se contabiliza, y a partir de los 12 meses deberán administrarse 2 nuevas dosis de la vacuna.
- Está incluida en el calendario de vacunación sistemático del CAV-AEP. La primera dosis a los 12 meses en la vacuna triple vírica (SRP) y la segunda a los 3-4 años de edad, que puede aplicarse en forma de tetravírica.
- Está contraindicada en pacientes con inmunodepresión grave.
- Puede administrarse a niños alérgicos al huevo.
2. Introducción
El virus de la rubeola es un Togavirus del género Rubivirus, muy relacionado con los arbovirus del grupo A. Es un virus ARN, relativamente poco estable inactivado por los lípidos, la tripsina, la formalina, la luz ultravioleta, el pH alto, el calor y la amantadina.
De acuerdo a los protocolos de las Enfermedades de Declaración Obligatoria de la Red Nacional de Vigilancia Epidemiológica, los criterios de definición clínica de caso de rubeola son:
- Enfermedad caracterizada por los siguientes hallazgos clínicos:
- Comienzo agudo de exantema generalizado maculopapular.
- Fiebre igual o mayor de 37,5 °C.
- Artralgia/artritis o linfadenopatía o conjuntivitis.
Para el síndrome de la rubeola congénita, los criterios son:
- Enfermedad del recién nacido como consecuencia de una infección de rubeola intraútero y que se caracteriza por los siguientes signos y síntomas:
- Cataratas/glaucoma congénito, enfermedad cardiaca congénita, pérdida de audición, retinopatía pigmentaria.
- Síntomas asociados pueden ser: púrpura, esplenomegalia, ictericia, microcefalia, retraso mental, meningoencefalitis, osteopatía.
Los criterios diagnósticos de laboratorio para la rubeola incluyen el aislamiento del virus o un aumento significativo en el nivel de anticuerpos tipo IgM frente a rubeola y para la rubeola congénita, el aislamiento del virus o la demostración de anticuerpos IgM específicos o un nivel de anticuerpos tipo IgG en el niño que se mantiene por encima y más allá de lo esperado después de los 6 meses, como consecuencia del traspaso pasivo de anticuerpos de la madre al feto.
3. Epidemiología de la enfermedad
El reservorio es el ser humano. El modo de transmisión es por vía aérea o por contacto directo con personas infectadas. Puede transmitirse a través de casos subclínicos. Los niños con el síndrome de rubeola congénita pueden expulsar una gran cantidad de virus por sus secreciones durante varios meses, pudiendo transmitir la infección a sus contactos.
El periodo de incubación varía de 12 a 23 días, desde la exposición al comienzo de la fiebre. Es solo moderadamente contagiosa, abarcando el periodo de contagio desde 7 días antes de su inicio hasta 5-7 días después.
Según la información suministrada por el Plan Nacional de Eliminación del Sarampión, de la Rubeola y del Síndrome de la Rubeola Congénita del Centro Nacional de Epidemiología, desde el año 2013 los casos son esporádicos, ha desaparecido el patrón estacional. En el 2014 se confirmaron 5 casos, en 2015 cuatro casos (tasa de 0,09/100 000), en 2016 dos casos (0,04/100 000), en dos adultos de más de 30 años sin vacunar, 1 caso en 2017 (0,02/100 000) importado en una mujer de 20 años sin vacunar, y 12 casos en 2018 (0,03/100 000), todos en el contexto de un brote en la provincia de Zaragoza, fundamentalmente en entorno laboral, que se prolonga hasta 2019. De ellos, 11 casos habían nacido fuera de España aunque no constaban viajes en periodo de incubación reciente a su país; 11 no estaban vacunados y 1 llevada solo una dosis de vacuna. En 2019 hubo 3 casos confirmados (tasa 0,01/100 000) relacionados con el brote de Zaragoza, un niño de 16 meses y dos adultos de 39 y 43 años, todos sin vacunar, mientras que desde 2020 y hasta la actualidad no ha habido más casos notificados. El último caso de rubeola congénita fue en 2014. Entre 1997 y 2014, de los 19 casos congénitos notificados en los que se conocía el país de nacimiento de la madre, solo tres madres habían nacido en España. Por otro lado, de acuerdo al segundo estudio de seroprevalencia en España, se ha observado que la inmunidad de la población frente al virus de la rubeola es superior al 95 % en todos los grupos de edad.
Los casos confirmados de rubeola descienden también en la mayoría de los países de la Unión Europea (figura 36.1), aunque persisten ondas epidémicas en algunos de ellos, sobre todo Polonia, que concentra el 50 % de los casos comunicados al TESSy (The European Surveillance System). Entre marzo de 2019 y febrero de 2020 se declararon en los países de los ECDC 376 casos (0,2 casos/millón), siendo los países de mayor incidencia Polonia, Alemania e Italia. Recientemente se han publicado los casos en Europa entre enero y diciembre de 2023 con tan solo 17 casos notificados y confirmados, destacando Polonia (9) y Alemania (5).
Figura 36.1. Tasa de notificación de rubeola por millón de habitantes por país, 1 de enero 2023-31 de diciembre 2023, países de la UE/AEE.
Fuente: ECDC 2024.
4. Tipos de vacunas, composición y presentación (SRP Y SRPV)
Según datos de la OMS, la vacuna contra la rubeola se introdujo en 174 estados miembros a finales de 2022, y la cobertura mundial se estimó en un 68 %. No obstante, 20 países aún no han introducido la vacunación frente a la rubeola, por lo que en 2023 la OMS ha actualizado sus recomendaciones de vacunación con el objetivo de interrumpir la circulación del virus y evitar la infección de las gestantes.
Por el contrario, todos los países de Europa se inmunizan contra la rubeola con la vacuna SRP. La cepa más utilizada es Wistar RA 27/3, que tiene una tasa de seroconversión del 99 % (IC95 %::98-99) con una sola dosis administrada entre los 9-18 meses de edad, alcanzando casi el 100 % ((IC95 %: 99-100%) con la segunda dosis, e induce anticuerpos IgA secretores; una cualidad que hace que la vacunación sea similar a la infección natural y previene la reinfección por virus salvajes. No obstante, es probable que todavía se produzcan pequeños brotes debidos a casos índice importados. En cualquier caso, el número de casos notificados ha disminuido en un 97·% después de la introducción de las campañas de vacunación.
La vacuna frente a la rubeola se introdujo en España en 1979, indicada para las niñas de 11 años, con la finalidad de prevenir el síndrome de la rubeola congénita. Posteriormente, en 1981, se introdujo la vacuna triple vírica (SRP) recomendada para los niños y niñas de 15 meses para protegerlos contra la rubeola, sarampión y parotiditis. A partir de 1988, se comenzó a aplicar una segunda dosis de SRP a la población de 11 años de edad. Esta dosis sustituía a la vacuna antirrubeólica monocomponente que se administraba desde 1979 solo a las niñas. Más tarde, en 1999, y después de analizar los resultados de la Encuesta Seroepidemiológica Nacional, el Consejo Interterritorial del Sistema Nacional de Salud tomó el acuerdo de adelantar la administración de la segunda dosis de SRP a una horquilla de edad que oscilara entre los 3 y los 6 años, manteniendo la de los 11 hasta que la cohorte de niños que la recibieron entre los 3 y los 6 años, cumplieran esa edad. Actualmente, esta 2.ª dosis se recomienda a los 3-4 años.
Vacuna triple vírica y tetravírica
En España las coberturas de vacunación frente al sarampión, rubeola y parotiditis (SRP) desde 2008 se mantienen por encima del 95 % para la 1.ª dosis y ligeramente por debajo del 95 % para la segunda dosis; en 2022, la cobertura con la primera dosis fue del 97,2 % (89-100 %, según las CC. AA.) y para la segunda del 93,9 % (88,05-97,95 %). Aun así, la tendencia descendente tras la consolidación de la vacunación se vio interrumpida a partir de 2010, por la irrupción de brotes de la enfermedad en distintas CC. AA.
Las vacunas de la rubeola están compuestas por una cepa atenuada de este virus, combinada con otros componentes en forma de triple vírica (sarampión, rubeola y parotiditis) o bien tetravírica (con varicela añadida), esta última ya comercializada en nuestro país (tabla 36.1). Actualmente no están disponibles en España vacunas monocomponentes frente a ninguno de los integrantes de la triple vírica.
En España hay autorizadas dos vacunas tetravíricas (aunque Priorix-Tetra no está disponible actualmente en España) que confieren protección contra sarampión, rubeola, parotiditis y varicela: SRPV. Aunque el uso de la vacuna tetravírica está admitido desde los 12 meses de edad, dada la mayor frecuencia de convulsiones febriles cuando se administra por debajo de los 2 años, la ACIP recomienda administrar los dos preparados por separado (SRP y varicela) hasta dicha edad. De haber disponibilidad, la segunda dosis se podría aplicar en forma de tetravírica.
Las vacunas de la rubeola disponibles han sido producidas en cultivos de células diploides humanas (fibroblastos): WI-38 (M-M-R-VaxPro y ProQuad) o MRC-5 (Priorix y Priorix-Tetra). Estos cultivos celulares tuvieron su origen lejano en los descubrimientos de L. Hayflick en 1962 y J. P. Jacobs en 1967, al lograr reproducir células humanas derivadas de muestras de tejido pulmonar fetal obtenidas entonces. Contienen células producidas en el laboratorio, no son células fetales, y su uso ha salvado los debates éticos y morales, habida cuenta de que se consigue con ello un efecto beneficioso notable (una vacuna que evita muertes fetales y abortos espontáneos, así como las anomalías congénitas) y no se dispone de alternativas para su producción.
Tabla 36.1. Vacunas comercializadas en España que incluyen el componente de la rubeola.
| Nombre (Laboratorio) |
Composición | Presentación (dosis) |
Conservación |
| M-M-R VaxPro (MSD) |
• Cepa Enders Edmonston (sarampión)1: no menos de 1000 CCID502 • Cepa Wistar RA 27/3 (rubeola)5: no menos de 1000 CCID502 • Cepa Jeryl-Lynn (parotiditis)1: no menos de 12 500 CCID502 • Gelatina, neomicina, L-glutamato monosódico, medio 199, trazas de albúmina humana recombinante, sacarosa, sorbitol, fosfato de sodio, fosfato de potasio, rojo fenol, bicarbonato sódico, ácido clorhídrico e hidróxido de sodio |
Liofilizada (0,5 ml) 1 vial 10 viales |
+2 a +8 °C Preservar de la luz No congelar |
| Priorix (GSK) |
• Cepa Schwarz (sarampión)1: no menos de 1000 CCID502 • Cepa Wistar RA 27/3 (rubeola)3: no menos de 1000·CCID502 • Cepa RIT4385, derivada de la Jeryl-Lynn (parotiditis)1: no menos de 5012 CCID502 • Aminoácidos, lactosa, manitol, neomicina y sorbitol |
Liofilizada (0,5 ml) 1 vial 10 viales |
+2 a +8 °C Preservar de la luz No congelar |
|
Priorix-Tetra No comercializada |
• Cepa Schwarz (sarampión)1: no menos de 1000 CCID502 • Cepa Wistar RA 27/3 (rubeola)3: no menos de 1000·CCID502 • Cepa RIT4385, derivada de la Jeryl-Lynn (parotiditis)1: no menos de 25·119 CCID502 • Cepa Oka (varicela): no menos de 1995 UFP4 • Trazas de neomicina, aminoácidos, lactosa, manitol, sorbitol y medio 199 |
Polvo en un vial. 0,5 ml de disolvente en una jeringa precargada. Envases de 1, 10, 20 o 50 |
+2 a +8 °C Preservar de la luz No congelar |
| ProQuad (MSD) |
• Cepa Enders Edmonston (sarampión)1: no menos de 3,0 log10 CCID502 • Cepa Wistar RA 27/3 (rubeola)5: no menos de 3,0 log10 CCID502 • Cepa Jeryl-Lynn (parotiditis)1: no menos de 4,3 log10 CCID502 • Cepa Oka/Merck (varicela): no menos de 3,99 log10 UFP4 • Sacarosa, gelatina hidrolizada, cloruro sódico, sorbitol, glutamato monosódico, fosfato sódico, bicarbonato sódico, fosfato potásico, cloruro potásico, neomicina, rojo fenol, ácido clorhídrico, hidróxido sódico, urea y trazas de albúmina humana recombinante |
Liofilizada (0,5 ml) 1 vial 10 viales |
+2 a +8 °C Preservar de la luz No congelar |
(1) Producido en células de embrión de pollo.
(2) CCID50: dosis que infecta al 50 % de los cultivos celulares.
(3) Producido en células diploides humanas (MRC-5).
(4) Unidades formadoras de placa.
(5) Producidos en fibroblastos pulmonares diploides humanos (WI-38).
En color rojo las vacunas que ya no están comercializadas en España.
Presentación y reconstitución
Se presentan liofilizadas en vial. La composición se puede ver en la tabla 36.1.
Priorix
La vacuna se debe reconstituir añadiendo el contenido entero del envase que contiene el diluyente al vial que contiene el polvo liofilizado. Después de añadir el diluyente al polvo liofilizado, se ha de agitar bien hasta que el polvo se disuelva completamente en el diluyente. Debido a una variación menor de su pH, la vacuna reconstituida puede variar el color de naranja claro a rojo claro sin que indique deterioro en la potencia de la vacuna.
Se debe desechar al cabo de 8 horas tras la reconstitución si no ha sido utilizada, aunque se conserve entre +2 °C y +8 °C.
M-M-RVaxPro
Para la reconstitución, utilizar el disolvente suministrado, que es un líquido incoloro transparente. Antes de mezclarlo con el disolvente, el polvo es una masa cristalina compacta de color amarillo pálido. Cuando está completamente reconstituida, la vacuna es un líquido amarillo claro. Se debe extraer el volumen completo de disolvente en la jeringa que se va a utilizar para la reconstitución e inyección. Inyectar el contenido completo de la jeringa en el vial que contiene el polvo. Agitar suavemente para mezclar por completo. Extraer en la misma jeringa todo el contenido del vial de vacuna reconstituida e inyectar el volumen total.
Se debe desechar al cabo de 8 horas tras la reconstitución si no ha sido utilizada, aunque se conserve entre +2 °C y +8 °C.
ProQuad
Existen dos presentaciones y es de prescripción médica con receta:
ProQuad con disolvente para reconstitución suministrado en un vial:
Extraer el contenido completo de disolvente del vial en una jeringa. Inyectar el contenido completo de la jeringa en el vial que contiene el polvo. Agitar suavemente para mezclar completamente. Extraer en la misma jeringa todo el contenido de vacuna reconstituida del vial e inyectar el volumen total.
La vacuna reconstituida se debe inspeccionar visualmente para detectar cualquier partícula extraña o variación del aspecto físico, antes de la administración. En el caso de que se observen cualquiera de los anteriores, desechar la vacuna.
Se recomienda que la vacuna sea administrada inmediatamente después de la reconstitución, para minimizar la pérdida de potencia. Deseche la vacuna reconstituida si no es utilizada en 30 minutos.
ProQuad con disolvente para reconstitución, suministrado en una jeringa precargada:
Inyectar el contenido completo de disolvente de la jeringa en el vial que contiene el polvo. Agitar suavemente para mezclar completamente. Extraer en la misma jeringa todo el contenido de vacuna reconstituida del vial e inyectar el volumen total. La vacuna reconstituida se debe inspeccionar visualmente para detectar cualquier partícula extraña o variación del aspecto físico, antes de la administración. En el caso de que se observen cualquiera de los anteriores, desechar la vacuna.
Se recomienda que la vacuna sea administrada inmediatamente después de la reconstitución, para minimizar la pérdida de potencia. Deseche la vacuna reconstituida si no es utilizada en 30 minutos.
Priorix-Tetra
Era de uso hospitalario, pero ya no está comercializada. Se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el polvo. Se ha de agitar bien la mezcla hasta que el polvo está totalmente disuelto. El color de la vacuna reconstituida puede variar del naranja claro al rosa fucsia debido a pequeñas variaciones del pH. Una vez reconstituida debe administrarse rápidamente o mantenerse en la nevera (entre +2 ºC y +8 ºC) un máximo de 24 horas.
5. Inmunogenicidad, eficacia y efectividad
Los ensayos clínicos han demostrado que la inmunogenicidad de ambas vacunas es muy elevada. En los sujetos previamente seronegativos se detectaron anticuerpos, en un 99,3 % de ellos, tras la vacunación.
De todas formas la serología es válida para interpretar la enfermedad, no así las vacunas que necesitan de técnicas especiales.
6. Vías de administración
Se administran por vía subcutánea, aunque también se pueden administrar por vía intramuscular. Los lugares de inyección recomendados son la región anterolateral externa del muslo en niños pequeños, y la región deltoidea en niños mayores, adolescentes y adultos. En pacientes con trombocitopenia o con cualquier alteración de la coagulación esta vacuna se aplicará por vía subcutánea.
7. Indicaciones y esquemas de vacunación
La vacuna SRP está indicada para la inmunización simultánea frente al sarampión, rubeola y parotiditis a partir de los 12 meses de edad. La segunda dosis se debe administrar, al menos, 4 semanas después de la primera.
Cuando por motivos epidemiológicos se tenga que vacunar a menores de 12 meses, se puede administrar la vacuna SRP entre los 6 y los 10 meses de vida, pero será necesario aplicar posteriormente 2 dosis de vacuna a partir de los 12 meses de edad, con un intervalo mínimo de 4 semanas.
El Comité Asesor de Vacunas de la AEP considera válida una primera dosis de vacuna triple vírica administrada erróneamente o por otros motivos a lactantes durante las 4 semanas precedentes a los 12 meses, cuando le correspondería por calendario. Estudios propios y de países de nuestro entorno con una epidemiología comparable, han certificado la menor concentración y más rápida evanescencia de los anticuerpos maternos específicos en los hijos de mujeres vacunadas - casi en su totalidad en nuestro medio -, que en los de madres que padecieron las enfermedades naturales, comportando una precoz declinación de su potencial interferencia con la respuesta vacunal y validando la eficacia protectora de la vacuna a los 11 meses de vida, lo que hace innecesaria su repetición para asegurar la vacunación. Se puede consultar la recomendación completa en los Documentos del CAV-AEP.
Se mantiene la recomendación de administrar por separado (SRP y V) en la primera dosis de la pauta en lactantes menores de 2 años por el incremento de riesgo de convulsiones febriles. Si a un niño se le administra inadvertidamente la vacuna tetravírica (SRPV) como la primera dosis de la vacuna que contiene SRP, no es necesario repetir esa dosis que contiene SRP, a menos que se administre a los 11 meses de edad.
La segunda dosis de triple vírica tiene como fundamento esencial, actuar sobre los fallos vacunales primarios, lograr una adecuada inmunidad de grupo y captar a los menores que por cualquier circunstancia no se pudieron poner la primera cuando les correspondía. La segunda dosis se administra entre los 3 y los 4 años según las CC. AA. La Asociación Española de Pediatría recomienda en su calendario de vacunaciones que la primera dosis de esta vacuna se administre a los 12 meses y la segunda a los 2 años. La segunda dosis podría administrarse en forma de tetravírica y actualmente, Aragón, Baleares, Canarias, Castilla y León, Castilla la Mancha, Galicia, Madrid, Murcia, La Rioja y la comunidad valenciana ya aplican la 2.ª dosis de los calendarios con esta vacuna tetravírica. País Vasco se ha incorporado en febrero de 2024 y Cataluña en marzo de 2024.
Sin embargo, a la vista de que en algunas comunidades autónomas la cobertura de la segunda dosis de SRP continua en cifras muy lejanas del deseado umbral del 95 % y los estragos que podría causar el sarampión con 1,5 millones de susceptibles en España (según la encuesta de seroprevalencia de 2020), sería deseable que la tendencia futura fuera hacia la administración de la segunda dosis en el segundo año de vida, como vienen realizando nuestros países vecinos: Alemania (11-14 meses primera dosis, 15-23 segunda), Austria (10-13 meses primera dosis, segunda a partir de 14 meses) y Suiza (9 y 12 meses, respectivamente).
8. Administración con otras vacunas y otros productos
La SRP y la SRPV, tanto una como otra, se puede administrar simultáneamente con el resto de las vacunas habituales, aunque con distintas jeringuillas y en lugares separados.
La administración simultánea de las vacunas triple vírica (SRP) y antiamarílica condiciona, sobre todo en menores de 2 años, una reducción en la magnitud de la respuesta humoral frente a la fiebre amarilla, rubeola y parotiditis, lo que se evita separándola por un intervalo mínimo de 4 semanas. La OMS, sin embargo, encarece su aplicación al mismo tiempo cuando la perentoriedad de su indicación no permita respetar este intervalo ideal, dado que la respuesta que induce frente a estos antígenos es suficientemente robusta. Sin embargo, alerta sobre la posibilidad de que genere una inmunogenicidad menos duradera y facilite fallos secundarios de la inmunización. Por ello, si se procede a su administración simultánea, debería considerarse la aplicación de una dosis adicional de las vacunas SR, SRP o SRPV a partir de las 4 semanas siguientes, para asegurar su efectividad en el contexto de su indicación sistemática, así como una revacunación frente a la fiebre amarilla a los 10 años en caso de persistencia del riesgo de exposición a la enfermedad, como indica el Joint Committee on Vaccination and Immunisation del Reino Unido. Las mismas consideraciones pueden extenderse a vacunaciones practicadas con la vírica bicomponente (SR) o la tetracomponente (SRPV).
Entre la administración de vacunas vivas parenterales monocomponentes y la antiamarílica, no es preciso guardar ninguna separación temporal predeterminada, pudiéndose aplicar concomitantemente o con cualquier intervalo de tiempo. Igualmente ocurre con la administración de la vacuna antigripal intranasal y otras vacunas vivas parenterales u orales que se pueden administrar el mismo día o con el intervalo de separación que se desee. Como ya se comentó, conviene en cambio respetar el preceptivo intervalo de 4 semanas entre la de SRP (o SR, o SRPV) y la antiamarílica; sin embargo, cuando se necesite una protección rápida o para no perder la oportunidad de su recepción, se acepta y recomienda su administración simultánea o con cualquier intervalo menor, puesto que no impide la inducción de suficientes niveles de anticuerpos protectores específicos.
Posibles interferencias con otros fármacos o productos biológicos
- La administración reciente de inmunoglobulinas o hemoderivados puede interferir con la respuesta serológica a la vacuna durante un tiempo variable que depende del producto y la dosis administrada (ver el capítulo 2 y el 45). Si el niño es vacunado durante ese periodo, se le debe revacunar una vez transcurrido el intervalo adecuado, a menos que se compruebe que hubo una adecuada seroconversión.
- La vacuna frente al sarampión, componente de la SRP. puede ocasionar una falta de respuesta transitoria a la tuberculina y dificultar el diagnóstico durante 4-6 semanas. Es posible que incida del mismo modo sobre los resultados de los test diagnósticos in vitro de la tuberculosis (IGRA: Interferon-gamma Release Assays). Por consiguiente, en caso de tener que practicar estas pruebas, deberán hacerse el mismo día de la vacunación o al cabo de 4-6 semanas como mínimo.
9. Efectos adversos
VACUNA TRIPLE VÍRICA
Los efectos adversos detectados tras la administración de la vacuna triple vírica son los siguientes:
- Reacciones locales (dolor, eritema, tumefacción, adenopatía): infrecuentes.
- Fiebre, que puede ser superior a 39,5 °C, al cabo de 5-12 días de la vacunación en el 5-15 % de niños vacunados; dura uno o dos días (máximo cinco) y puede aparecer asociado un exantema morbiliforme y/o una tumefacción parotídea (enfermedades atenuadas).
- Encefalitis o encefalopatía en menos de 1 por cada millón de dosis, atribuible al componente antisarampión. Dado que la incidencia tras la vacunación frente al sarampión es inferior a la incidencia global de encefalitis de causa desconocida, probablemente la mayoría de casos de alteración neurológica grave comunicadas simplemente son coincidentes en el tiempo con la inmunización, pero no son causadas por ésta. Asimismo, probablemente no hay ningún riesgo de panencefalitis esclerosante subaguda.
- Trombocitopenia transitoria.
- Reacciones alérgicas a alguno de los componentes de la vacuna. Son muy infrecuentes y aunque generalmente se han relacionado con antígenos del huevo, suelen deberse a alguna de las otras sustancias presentes en la vacuna (antibióticos, gelatina usada como estabilizador; en España la contienen solo MMRVaxPro y ProQuad).
- Convulsiones, habitualmente de tipo febril simple, en pocos casos.
- Enfermedad producida por el virus vacunal del sarampión en pacientes inmunodeprimidos, potencialmente grave e incluso mortal.
- La aparición de meningitis aséptica se relaciona con la vacunación con la cepa Urabe de la parotiditis y es excepcional tras la vacunación con las cepas Jeryl-Lynn y RIT 4385.
VACUNA TETRAVÍRICA
Tras la administración de la vacuna tetravírica se pueden observar, además de los efectos adversos de la vacuna triple vírica, los siguientes:
Herpes zóster. En un ensayo clínico se comunicaron 2 casos de herpes zóster en 2108 individuos sanos de edades comprendidas entre 12 y 23 meses que fueron vacunados con 1 dosis de ProQuad y controlados durante un año. Ambos casos fueron leves y no se comunicaron secuelas. Los datos de seguimiento activo en niños vacunados con la vacuna de varicela de virus vivos (Oka/Merck) y controlados durante 14 años tras la vacunación no demostraron incremento en la frecuencia de herpes zóster en comparación con los niños con varicela previa de tipo salvaje, durante la época anterior a la vacunación. Estos datos de seguimiento sugieren en realidad que los niños vacunados frente a varicela tienen un menor riesgo de herpes zóster. Sin embargo, en la actualidad se desconoce el efecto a largo plazo de la vacunación frente a varicela en la incidencia de zóster. Por el momento no se dispone de datos a largo plazo relacionados con las vacunas tetravíricas.
Transmisión del virus vacunal. Basándose en notificaciones aisladas de casos durante el seguimiento poscomercialización de la vacuna de la varicela Oka/Merck, existe la rara posibilidad de que el virus de la vacuna de varicela pueda transmitirse, cuando se entra en contacto con personas vacunadas con vacuna tetravírica que hayan desarrollado una erupción de tipo varicelosa.
Crisis febriles. Se han notificado crisis febriles en niños que recibieron vacuna tetravírica: En un estudio observacional poscomercialización de ProQuad, realizado en niños de 12 a 23 meses de edad, se reveló un incremento de aproximadamente dos veces en el riesgo de crisis febriles en el periodo de tiempo entre los días 5 y 12 después de una primera dosis de ProQuad, en comparación con la administración concomitante de la vacuna SRP y la vacuna de varicela. Estos datos sugieren un caso adicional de crisis febril por cada 2300 niños vacunados con ProQuad, comparado con la administración por separado de la vacuna SRP y la de la varicela.
En cuanto a la vacuna tetravírica Priorix-Tetra, en un análisis retrospectivo en niños entre 9 y 30 meses tras la primera dosis de vacunación con Priorix-Tetra frente a vacuna SRP o vacuna SRP y antivaricela, se observó un caso adicional de convulsiones por cada 5882 niños, comparados con los grupos control (riesgo atribuible de 1,7 a 3,64 por cada 10 000 niños). Estos datos fueron confirmados por un estudio observacional poscomercialización patrocinado por los Centros para el Control y la Prevención de las Enfermedades de Estados Unidos (CDC).
Por este motivo, el Comité Asesor de Inmunizaciones (ACIP) de los CDC recomienda que la primera dosis de vacunación se realice preferiblemente administrando los preparados por separado de triple vírica y varicela monocomponente, y para la segunda dosis proponen el uso de la vacuna combinada tetravírica.
10. Precauciones y contraindicaciones
Enfermedad febril aguda: debe demorarse la vacunación hasta la resolución del proceso agudo. Las infecciones de vías respiratorias altas sin fiebre o con febrícula no constituyen contraindicaciones a la vacunación.
Embarazo: las vacunas de virus vivos atenuados, sobre todo la de la rubeola, comportan el riesgo teórico, no confirmado en la práctica, de provocar malformaciones fetales si se administran durante el embarazo, por lo que no deben administrarse la SRP ni la SRPV a mujeres embarazadas. Por el mismo motivo, las mujeres en edad fértil deben evitar un embarazo hasta 1 mes tras su recepción (lo que ya viene reflejado en las fichas técnicas).
Alergias: los niños con alergia al huevo de naturaleza no anafiláctica no tienen ningún riesgo especial de desarrollar manifestaciones de hipersensibilidad, y la mayoría de niños con antecedentes de anafilaxia al huevo no presentan efectos adversos a la vacuna por lo que esta debe ser administrada en los centros de atención primaria. La mayor parte de episodios de anafilaxia consecuentes a las vacunas SRP y SRPV son debidos a la gelatina hidrolizada que contienen (solo ProQuad y M-M-RVaxPro, en España) y no a las proteínas del huevo. No es necesario efectuar test cutáneos previos, los cuales, por otra parte, no predicen qué niños desarrollarían una reacción de hipersensibilidad inmediata.
Las personas con antecedentes de anafilaxia a una dosis previa de vacuna SRP o a la neomicina (administrada de forma tópica o sistémica) o a la gelatina no deben recibir la vacuna como es norma general para todas las vacunas.
Alteraciones inmunitarias: la vacuna SRP está contraindicada en personas con inmunodeficiencias congénitas o adquiridas significativas. Los niños con inmunosupresión farmacológica, en general, pueden recibirla a partir de los 3 meses de haber finalizado la terapia y de hallarse en remisión el proceso que la motivó. En los pacientes tratados con dosis altas de corticoesteroides durante 2 o más semanas, pero que no tienen un compromiso inmunitario de base, el intervalo mínimo recomendado es de 1-3 meses. Los niños con infección por el VIH pueden y deben recibir la vacuna, tanto si están asintomáticos como si tienen síntomas, a menos que tengan inmunodeficiencia grave. Los pacientes con cifras de linfocitos T CD4 superiores al 15 % no presentan complicaciones al recibir las vacunas triple vírica o tetravírica y pueden recibirlas, aunque las respuestas inmunes a la misma pueden ser deficientes, por lo que conviene administrar las 2 dosis lo antes posible (por ejemplo, a los 12 meses y a los 13-15 meses).
Trombocitopenia: se recomienda no revacunar a los niños que desarrollan un episodio de púrpura trombocitopénica en las 6-8 semanas siguientes a la primera dosis de vacunas que contengan la del sarampión, a no ser que, una vez comprobada la no seroconversión, se considere que el beneficio de la vacunación supera al riesgo de que desarrolle de nuevo una trombocitopenia. Los pacientes con antecedentes de trombocitopenia no relacionada con la vacuna tienen un ligero aumento de posibilidades de padecer una trombocitopenia tras la vacuna, pero las ventajas de la inmunización superan a los riesgos. El riesgo de trombocitopenia tras la 2.ª dosis es inferior al que comporta la 1.ª y nunca se han comunicado casos de muerte por esta causa asociados a la vacunación con SRP en niños sanos.
Intolerancia congénita a la fructosa: contraindica la vacuna SRP y la SRPV por el contenido en sorbitol de las presentaciones comercializadas.
11. Bibliografía
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2025. An Pediatr (Barc). 2025;102:503713.
- American Academy of Pediatrics. Rubella. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 644-58.
- Bitzegeio J, et al. Estimating age-specific vaccine effectiveness using data from a large measles outbreak in Berlin, Germany, 2014/15: evidence for waning immunity. Euro Surveill. 2019;24:1800529.
- Brinkman ID, et al. Early Measles Vaccination During an Outbreak in the Netherlands: Short-Term and Long-Term Decreases in Antibody Responses Among Children Vaccinated Before 12 Months of Age. J Infect Dis. 2019;220:594-602.
- Centre for Infectious Disease Control, The Netherland, septiembre de 2019. Systematic literature review and meta-analyses of the immunogenicity, duration of protection, effectiveness/efficacy and safety of rubella vaccination.
- Centers for Disease Control and Prevention (CDC). What CDC Is Doing About Global Measles & Rubella.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Resultados de la vigilancia de la rubéola.
- Cilleruelo MJ, et al. Duration of immunity to measles, rubella and mumps during the first year of life. Vaccine. 2019;37:4164-71.
- City of Vienna. Public Health Services. Routine immunisation schedule for babies and toddlers / pre-school children.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2025. [Internet]. Madrid: AEP; 2025.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Noticia: Objetivo: recuperar las vacunaciones perdidas por la pandemia de COVID-19.
- European Centre for Disease Prevention and Control. Surveillance and disease data for rubella. En: European Centre for Disease Prevention and Control (ECDC) [en línea].
- European Centre for Disease Prevention and Control. Number of rubella cases by country, January 2023-December 2023.
- European Centre for Disease Prevention and Control. Number of rubella cases, January 2024.
- García Rojas AJ. Rubeola. En: Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Vacunas en Pediatría. Manual de la AEP 2012, 5.ª ed. Madrid: Exlibris ediciones SL; 2012. p. 453-60.
- Generalitat de Catalunya. Departament de Sanitat i Seguritat Social. Programa d’eliminació de la rubeola postnatal i congénita a Catalunya per a l’any 2005. Boletín Epidemiológico de Cataluña 2002; XXIII (extraordinario 3.er trimestre): 147-8.
- JCVI. Revised recommendations for administering more than 1 live vaccine.
- JCVI. Yellow fever: the green book, chapter 35.
- Kanakoudi-Tsakalidou F, et al. Humoral Immunity against Measles in Mother-Infant Pairs during the First Year of Life in Greece: A Cross-Sectional Study. Vaccines (Basel). 2021;9:143.
- Kauffmann F, et al. Measles, mumps, rubella prevention: how can we do better? Expert Rev Vaccines. 2021;20:811-26.
- Ma SJ, et al. Risk of febrile seizure after measles-mumps-rubella-varicella vaccine: A systematic review and meta-analysis. Vaccine. 2015;33:3636-49.
- Ministerio de Sanidad. Coberturas de vacunación triple vírica. Comunidades autónomas. Año 2023.
- Nascimento Silva J, et al. Mutual interferente on the immune response to yellow fever and combined vaccine against measles, mumps and rubella. Vaccine 2011;29:6327-34.
- Nic Lochlainn LM, et al. Effect of measles vaccination in infants younger than 9 months on the immune response to subsequent measles vaccine doses: a systematic review and meta-analysis. Lancet Infect Dis. 2019;19:1246-54.
- O'Connor P, et al. Progress Toward Rubella Elimination - World Health Organization European Region, 2005-2019. MMWR Morb Mortal Wkly Rep. 2021;70:833-39. Erratum in: MMWR Morb Mortal Wkly Rep. 2021;70:934.
- O'Leary ST, et al. Update From the Advisory Committee on Immunization Practices. J Pediatric Infect Dis Soc. 2017;6:311-6.
- Orenstein WA, et al. Measles and Rubella Global Strategic Plan 2012-2020 midterm review report: Background and summary. Vaccine. 2018;36 Suppl 1:A35-42.
- Recommendations of the Standing Committee on Vaccination (STIKO), 2024.
- Reef S, et al. Rubella vaccine. En: Plotkin SA, Orenstein WA, Offit PA (eds.). Vaccines 6.ª ed. EE. UU. Elsevier Saunders 2012:p.687-716.
- Xu J, et al. Effect of early measles vaccination on long-term protection: A systematic review. Vaccine. 2021;39:2929-37.
- World Health Organization. Eliminating measles and rubella in the WHO European Region; Integrated guidance for surveillance, outbreak response and verification of elimination. Copenhagen: WHO Regional Office for Europe; 2024.
- World Health Organization. Measles and rubella strategic framework 2021–2030. Geneva: World Health Organization; 2020.
- World Health Organization. Immunization coverage. July 18, 2023.
- World Health Organization. Meeting of the Strategic Advisory Group of Experts on Immunization, October 2018 – Conclusions and recommendations. Measles and rubella. Wkly Epidemiol Rec. 2018;93:671-3.
- World Health Organization. Rubella vaccines: WHO position paper - July 2020. Wkly Epidemiol Rec. 2020;95:306-24.
- World Health Organization. Vaccination schedule for Switzerland.
12. Enlaces de Interés
- American Academy of Pediatrics. Healthy children. German Measles (Rubella)
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2025
- CDC. Rubella.(German Measles, Three-Day Measles)
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Rubeola
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas. Triple y tetravírica
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas... una a una. Vacuna de la rubeola
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la rubeola
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la rubeola
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada
- European Centre for Disease Prevention and Control (ECDC). Rubella (German measles)
- Measles and Rubella Initiative
- WHO. Rubella
13. Historial de actualizaciones
| 2 de abril de 2018 | Actualización de los apartados epidemiología de la enfermedad; tipos de vacunas, composición y presentación (SRP y SRPV); indicaciones y esquemas de vacunación y efectos adversos. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2019 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2020 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2021 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de diciembre de 2021 | Validez de la dosis de SRP administrada a los 11 meses de edad en el apartado "Indicaciones y esquemas de vacunación" |
| 31 de marzo de 2022 | Actualización de los apartados "Epidemiología", "Tipos de vacunas, composición y presentación (SRP y SRPV)" e "Indicaciones y esquemas de vacunación". Nuevas citas bibliográficas y enlaces de interés |
| 4 de mayo de 2022 | Validez de la dosis de SRP administrada a los 11 meses de edad en ciertas circunstancias en el apartado "Indicaciones y esquemas de vacunación" |
| 1 de enero de 2023 | Nuevas citas bibliográficas y enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlaces de interés |
| 4 de marzo de 2024 | Revisión de todos los apartados del capítulo. Nuevas citas bibliográficas |
| 1 de enero de 2025 | Recomendación de disminución de la edad de aplicación de la segunda dosis de SRP a los 2 años de edad. Nuevas citas bibliográficas y enlaces de interés |
-oOo-