Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
28. Hepatitis A
Capítulo 28 - Hepatitis A
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de vacunas, composición y presentación
- Inmunogenicidad, eficacia y efectividad
- Vías de administración
- Indicaciones y esquemas de vacunación
- Situaciones especiales
- Administración con otras vacunas y otros productos
- Efectos adversos
- Precauciones y contraindicaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figura incluidas en el capítulo:
Tabla 28.1. Características de las vacunas frente a la hepatitis A
Tabla 28.2. Situaciones especiales a que puede dar lugar el desabastecimiento de esta vacuna, si se produce
Figura 28.1. Distribución de los brotes confirmados de hepatitis A por mes, desde junio 2016 hasta agosto 2018, en los países europeos (ECDC-UE/EEA
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Hepatitis A. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; jul/2025. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-28
1. Puntos clave
- De modo distinto a lo que ocurre en los niños mayores y en los adultos, en niños menores de 6 años, más del 70 % de las infecciones por el virus de la hepatitis A (VHA) son asintomáticas, el 20 % pueden tener una enfermedad leve y anictérica y solo un 10 % pueden tener una forma que cursa con ictericia. Por el contrario, en los niños mayores de 6 años y en adultos las formas ictéricas representan el 70 % de los casos.
- En países de índice de desarrollo humano alto y en los que se vacuna frente a la hepatitis A de forma sistemática la infección por el VHA cada vez se produce a edades más avanzadas, lo cual implica que la gravedad de los casos sea mayor.
- Hasta la llegada de la pandemia por el virus SARS-CoV-2, en España la incidencia de hepatitis A notificada había aumentado en los últimos años, aunque más en adultos y, sobre todo, en varones que tienen relaciones sexuales con otros varones, en personas que usan drogas de abuso y en las que tienen falta de vivienda. En los últimos meses el número de los casos notificados ha sido sustancialmente mayor.
- La vacunación universal de la población infantil es la mejor estrategia para el control de la hepatitis A en una comunidad.
- La epidemiología de la infección y la enfermedad en comunidades y países con programas de vacunación universal indican que la vacunación proporciona protección indirecta a los no vacunados (protección de grupo).
- Los niños no vacunados que pertenezcan a algún grupo de riesgo (viajeros a países endémicos, inmigrantes y sus hijos que van de vacaciones al país de origen (VFR, Visiting Friends and Relatives), niños que presentan trastornos de la coagulación, hepatopatía crónica, administración indefinida de fármacos potencialmente hepatotóxicos o que van a someterse a un trasplante hepático) deben ser vacunados.
- La vacunación es la estrategia de elección para la profilaxis posexposición en niños no vacunados. Debe administrarse antes de que hayan transcurrido 14 días desde la exposición.
2. Introducción
El virus de la hepatitis A (VHA) es un ARN virus sin envoltura. Pertenece a la familia Picornaviridae, que incluye a los enterovirus y rinovirus humanos, y se engloba dentro del género Hepatovirus. La hepatitis A (HA) es una enfermedad de distribución mundial, cuya incidencia es mayor en áreas geográficas con malas condiciones higiénico-sanitarias. El virus se replica en los hepatocitos, se libera en la secreción biliar y se encuentra en altas concentraciones en las heces. El VHA como tal no tiene un efecto citopático, debiéndose las lesiones de los hepatocitos probablemente a la respuesta inmunitaria mediada por células.
Generalmente, el curso de la enfermedad es autolimitado, pudiendo manifestarse con síntomas digestivos como fiebre, malestar general, vómitos e ictericia. Por lo general, cura de forma espontánea y sin complicaciones, dando lugar a una inmunidad duradera. Aunque de forma infrecuente, pueden aparecer complicaciones extrahepáticas inmunomediadas (renales, hematológicas, cutáneas o neurológicas). La HA no cronifica, pero entre el 10 y el 20 % de los pacientes pueden presentar una colestasis persistente y/o una hepatitis recidivante tras la infección inicial, que suele resolverse entre 2 y 6 meses, pero a la que hay que considerar infecciosa y con capacidad de transmisión. En raras ocasiones (0,015-0,5 %) puede dar lugar a una hepatitis fulminante (fallo hepático agudo).
La transmisión del VHA es fecal-oral, por lo que el lavado cuidadoso de manos constituye la principal medida preventiva, más allá de la vacunación. Existen otros modos de transmisión menos frecuentes, como a través de transfusiones de sangre o hemoderivados, uso compartido de jeringuillas o determinadas prácticas sexuales.
Después de la transmisión fecal-oral, el virus se excreta en la bilis y su concentración es más alta en las heces, especialmente durante las 2 semanas que preceden al inicio de la ictericia. Esto se correlaciona con el período de máxima infectividad. Se puede suponer que los niños y los adultos no son infecciosos una semana después de la aparición de la ictericia.
Las vacunas actualmente autorizadas son preparados de VHA inactivados con formaldehído y la edad mínima autorizada para su administración es a partir de los 12 meses de edad, aunque puede estar justificada su administración a partir de los 6 meses en determinadas circunstancias (ver el apartado 7).
En mayo de 2016, la Asamblea Mundial de la Salud aprobó la primera estrategia mundial del sector de la salud contra las hepatitis víricas, 2016-2021, en la que se destaca el papel fundamental de la cobertura sanitaria universal y cuyas metas están alineadas con las de los Objetivos de Desarrollo Sostenible. El objetivo último de la estrategia es eliminar las hepatitis víricas como problema de salud pública. Con ese fin, fija como metas mundiales para 2030 reducir las nuevas infecciones por virus de la hepatitis en un 90 % y la mortalidad por las enfermedades que causan en un 65 %, y define las medidas que han de adoptar los países y la Secretaría de la OMS para alcanzar estas metas.
3. Epidemiología de la enfermedad
El ser humano es el único huésped natural del virus. El período de incubación medio es de 28 días (rango entre 15 y 50 días, dependiendo del inóculo) y la vía de transmisión fundamental es la fecal-oral mediante el contacto directo con personas que excretan el virus o a través del consumo de alimentos o agua contaminados. También puede transmitirse a través de las relaciones sexuales que impliquen contacto oro-anal. En raras ocasiones, el VHA se ha transmitido por transfusión de sangre o productos sanguíneos de donantes durante la fase virémica de su infección. Desde 2002, las pruebas de amplificación de ácido nucleico para la detección del ARN del VHA se han aplicado a la detección del plasma fuente utilizado para la fabricación de productos derivados del plasma, reduciendo drásticamente el riesgo de transmisión por estos productos. El periodo de contagio se extiende desde 2 semanas antes del inicio de las manifestaciones clínicas (periodo donde la excreción viral en heces es mayor) hasta una semana después de la aparición de la ictericia, aunque los niños eliminan el virus durante más tiempo que los adultos, pudiendo llegar hasta las 10 semanas desde el inicio de los síntomas. En condiciones favorables, el VHA puede sobrevivir en el medio ambiente durante meses.
Se presenta tanto en forma esporádica como epidémica. Se estima que en el mundo se producen, anualmente, alrededor de 1,5 millones de casos de hepatitis A. Existen grandes diferencias geográficas en el nivel de endemicidad de la hepatitis A que varía según las condiciones sanitarias, el desarrollo socioeconómico y la disponibilidad y aplicación de vacunas. A efectos prácticos, el mundo se puede dividir en zonas con endemicidad muy baja, baja, intermedia y alta, aunque la endemicidad puede variar de una región a otra dentro de un país. Los países del norte de Europa se pueden considerar de endemia muy baja, produciéndose la mayoría de los casos en grupos de riesgo definidos, como los viajeros que vuelven de zonas endémicas, los consumidores de drogas por vía inyectada y los hombres que tienen sexo con hombres (HSH). En las zonas de baja endemicidad (Europa occidental, América del Norte y Australia), la hepatitis A se manifiesta habitualmente en forma de casos aislados en los grupos de alto riesgo o de brotes que afectan a un pequeño número de personas. En los países con endemicidad intermedia (Europa oriental) la mayor parte de los casos se observan hacia el final de la infancia y el comienzo de la edad adulta, en estas zonas la hepatitis A representa una carga importante desde el punto de vista médico y económico. En las zonas de alta endemicidad (algunas zonas de África, Asia, América Central y Sudamérica) la mayor parte de los habitantes contraen la infección de manera asintomática durante la infancia y son raros los casos clínicos de hepatitis A. En general, todos los países con bajo índice de desarrollo humano muestran una endemicidad alta o moderada de hepatitis A.
- Consultar planisferio con los países o áreas de riesgo moderado o alto de hepatitis A en el mundo, 2014 (CDC).
- Consultar mapa de Europa con la distribución de las tasas crudas de notificación de hepatitis A en los países de la Unión Europea (ECDC).
Epidemiológicamente, España pertenece a un área de baja seroprevalencia de infección por el virus de la hepatitis A (VHA) (<50·% de población inmune a los 30 años). En los últimos años ha habido una escasa circulación del virus y por esto el riesgo de contraer la infección ha sido habitualmente bajo, a pesar de la elevada proporción de individuos susceptibles. Esta situación ha sido aún más evidente durante la pandemia de la covid. La enfermedad ocurre principalmente en adolescentes y adultos pertenecientes a los grupos con alto riesgo de hepatitis A. El cambio epidemiológico más importante observado es el desplazamiento de la infección por el VHA hacia esas edades, en las que es más frecuente la enfermedad sintomática, con aparición de ictericia hasta en un 70 % de los casos. También se producen brotes ocasionales causados por la ingestión de alimentos contaminados, así como brotes familiares y en colectividades cerradas a partir de portadores asintomáticos (guarderías).
Sin embargo, en diciembre de 2024 el Centro de Coordinación de Alertas y Emergencias Sanitarias, dependiente del Ministerio de Sanidad publicó el informe denominado “Aumento de casos de Hepatitis A en España, 2024” en el que se pone de manifiesto un importante aumento de los casos notificados durante ese año, con una tendencia creciente, siendo también recogido en el correspondiente boletín semanal del ECDC. Dicho incremento, sugiere el informe, pudiera ser debido a distintos colectivos de HSH debido a las bajas tasas de cobertura vacunal en ellos.
En un estudio publicado sobre factores de riesgo de padecer hepatitis A en Cataluña, tras la introducción del programa piloto de vacunación universal a los 12 años, en 1998, mostró una mayor tasa en varones que en mujeres, con la mayor diferencia en el grupo de edad de 20 a 34 años (tasa de 8,8 frente a 2,8). El mayor factor de riesgo fue viajar a un país endémico y el contacto sexual entre varones.
Aun cuando desde mediados del año 2016 se apreció un incremento en el número de casos en varios países de Europa, (figura 28.1), siendo España uno de los países más afectados, llegando a tener más de 4500 casos declarados en 2017, el ECDC tiene registrados 2294 casos en España en 2018, cifra todavía alta comparada con los años previos al brote de 2017, cuando la situación además se agravó, debido al desabastecimiento temporal de las vacunas frente al VHA. El ECDC en su último informe publicado en 2024 sobre los casos de 2022 constata una subida importante a 4548 casos, (2020 - 189 y 2021 - 153). Los países con mayor tasa de casos son Hungría, Croacia, Rumanía y Bulgaria con el grupo de edad más afectado de 5 a 14 años. España en este informe declara 304 casos en 2022 con una tasa por 100 000 habitantes de 0,6. El último informe anual sobre enfermedades de declaración obligatoria (EDO) publicado en enero de 2025 por el Centro Nacional de Epidemiología, constata que se declararon en 2022, 287 casos, en 2023, 382 y en 2024, 1002, suponiendo un notable incremento.
Figura 28.1 Distribución de los brotes confirmados de hepatitis A por mes, desde junio 2016 a agosto 2018, en los países europeos (ECDC-UE/EEA).
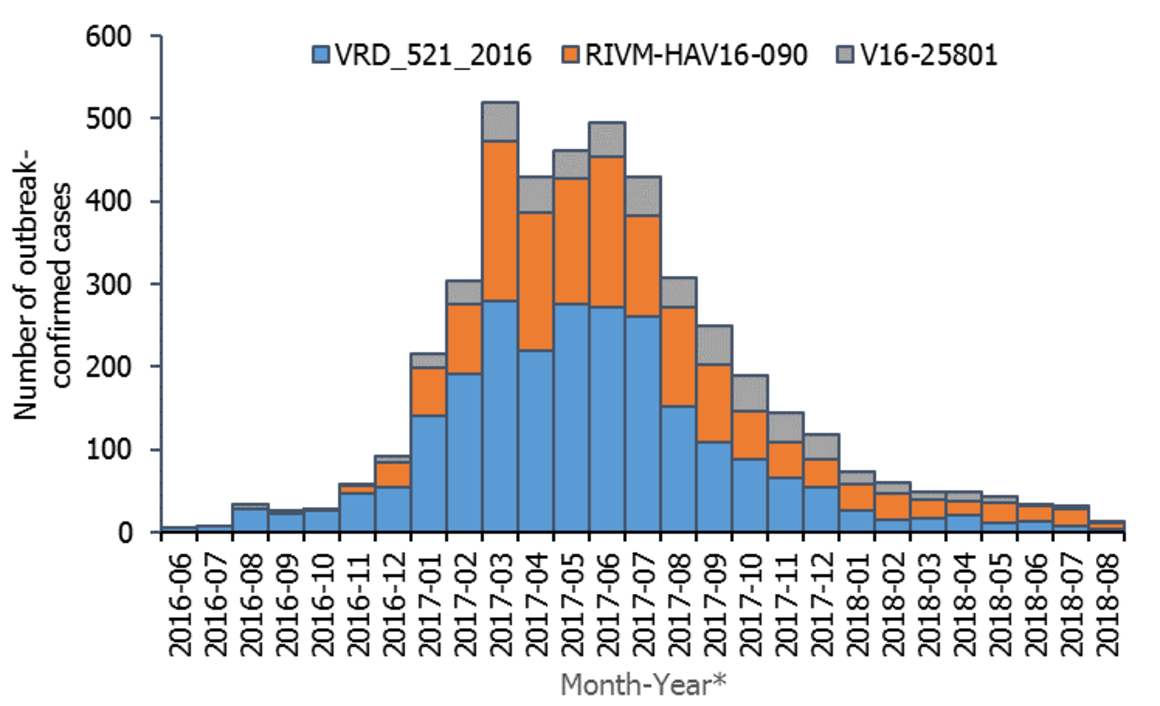
Países incluidos: Alemania, Austria, Bélgica, Croacia, Dinamarca, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Holanda, Irlanda, Italia, Letonia, Luxemburgo, Malta, Noruega, Portugal, Reino Unido, República Checa y Suecia.
Cepas de hepatitis A en colores. Tomado de: ECDC. Epidemiological update: Hepatitis A outbreak in the EU/EEA mostly affecting men who have sex with men. 2018
En Estados Unidos, los casos de hepatitis A aumentaron un 294 % durante el período 2016–2018 en comparación con 2013–2015, sobre todo a expensas de casos en brotes asociados a alimentos contaminados, personas sin hogar, adictos a drogas vía parenteral y hombres que tienen sexo con hombres. Desde 2016 y hasta abril de 2023 en EE. UU. se han declarado 44 926 casos, con un 61 % de hospitalizaciones y 424 muertos en 37 estados. Desde 2018 el comité de inmunizaciones de Estados Unidos (ACIP) recomienda especialmente la vacunación de las personas sin hogar frente a la hepatitis A.
4. Tipos de vacunas, composición y presentación
Las medidas de prevención generales consisten en una buena higiene personal, lavarse las manos, ingerir agua potable y un saneamiento adecuado. La prevención específica de la infección por el virus de la hepatitis A incluye el uso de las vacuna frente al mismo y el uso de inmunoglobulinas (capítulo 45).
Las Inmunoglobulinas son preparaciones purificadas de gammaglobulinas que derivan de grandes conjuntos de plasma humano y se utilizan para la profilaxis previa a la exposición potencial cuando no se dispone de tiempo suficiente para que la vacunación sea eficaz (la vacunación preexposición debe estar completada antes de las 2 semanas de la posible exposición) y para la profilaxis posterior a la exposición (siempre debe administrarse dentro de los 14 días posteriores a la exposición) junto con la vacunación y en lugar de la vacuna en aquellos niños menores de 1 año (entre 6 meses y 1 año se puede utilizar la vacuna aunque la dosis no sea válida para la pauta de 2 dosis) que vayan a viajar a un área endémica.
Todas las vacunas frente al virus de la hepatitis A se producen a partir de virus procedentes de cultivos in vitro de células diploides humanas, purificados mediante sistemas de ultrafiltración y cromatografía, e inactivados con formaldehído (tabla 28.1).
Tabla 28.1. Características de las vacunas frente a la hepatitis A.
|
|
HAVRIX |
VAQTA |
TWINRIX adultos |
TWINRIX pediátrico |
|---|---|---|---|---|
|
Laboratorio fabricante |
GlaxoSmithKline |
MSD |
GlaxoSmithKline |
GlaxoSmithKline |
|
Adyuvante |
Hidróxido aluminio |
Sulfato hidroxifosfato de aluminio amorfo |
Hidróxido de aluminio |
Hidróxido de aluminio |
|
Dosis de antígeno VHA |
HAVRIX 1440 |
VAQTA 50 |
TWINRIX adultos |
- |
|
Dosis de antígeno VHA |
HAVRIX 720 |
VAQTA 25 |
- |
TWINRIX pediátrico |
|
Dosis µg de HBsAg2 |
- |
- |
20 |
10 |
|
Presentación y reconstitución |
Suspensión inyectable en jeringa precargada |
Suspensión inyectable en jeringa precargada |
Suspensión inyectable en jeringa precargada |
Suspensión inyectable en jeringa precargada |
|
Volumen por dosis (ml) |
HAVRIX 1440 |
VAQTA 50 |
1 ml |
0,5 ml |
|
Pauta de vacunación |
0, 6-12 meses |
0, 6-18 meses |
0, 1, 6 meses |
0, 1, 6 meses |
1 Unidades medidas de acuerdo al método interno del fabricante.
2 HBsAg: antígeno de superficie del virus de la hepatitis B.
Conservación y transporte
Las vacunas frente al virus de la hepatitis A se deben conservar y transportar a temperaturas entre +2·ºC y +8·ºC, y mantenerse protegidas de la luz. La congelación inactiva a las vacunas.
Intercambiabilidad
Datos limitados indican que las vacunas monocomponentes de diferentes fabricantes son intercambiables. La terminación de la serie con el mismo producto es preferible, siempre que sea posible. Sin embargo, si el producto utilizado originalmente no está disponible o no se conoce, la vacunación con cualquiera de los productos es aceptable.
5. Inmunogenicidad, eficacia y efectividad
Son vacunas muy inmunógenas. Más del 95 % de los adultos desarrollarán anticuerpos protectores dentro de las 4 semanas de una dosis única de cualquiera de las vacunas, y casi el 100 % seroconvertirá después de recibir dos dosis. Entre los niños y adolescentes, más del 97 % serán seropositivos al mes de la primera dosis. En ensayos clínicos, todos los receptores tenían niveles protectores de anticuerpos después de dos dosis, títulos semejantes a los obtenidos tras la infección natural. Aunque poco después de la segunda dosis las concentraciones de anticuerpos declinan rápidamente, se estima que concentraciones superiores a 20 mUI/ml persistirán un mínimo de 20-25 años, lo que asegura una larga duración de la protección conferida por la vacuna.
Eficacia
En los ensayos clínicos aleatorizados realizados, la eficacia protectora ha oscilado entre el 94 y el 100·%.
Efectividad e impacto
Los estudios realizados para evaluar la efectividad de la vacunación coinciden en mostrar valores muy elevados, próximos al 100 %. En Cataluña, en el año 1998, se decidió poner en marcha un programa piloto de vacunación antihepatitis A en los preadolescentes de 12 años. La evaluación efectuada 7 años después del comienzo del programa mostró una efectividad del 99 % (IC 95 %: 93,11-99,9) en la prevención de la enfermedad clínica en las cohortes vacunadas, en comparación con las cohortes no vacunadas.
El impacto de la vacunación frente a la hepatitis A en los EE. UU. ha sido muy positivo. En las poblaciones nativas de Alaska, la incidencia de la enfermedad se ha reducido en un 97 % y en el Butte County de California, la vacunación redujo la incidencia de la enfermedad en un 94 % entre 1995 y 2000. En 1999 se recomendó la vacunación universal de los niños en aquellos estados que tuvieran elevadas tasas de incidencia de la hepatitis A. Los estados que adoptaron la vacunación universal tuvieron una reducción en la incidencia de la enfermedad entre 1990-1997 y 2003 del 88 %, porcentaje bastante más elevado que el 55 % observado en los estados que no adoptaron la vacunación. Actualmente, en EE. UU. se recomienda la vacunación universal frente a la hepatitis A en todos los estados.
En la región italiana de Puglia se han obtenido igualmente muy buenos resultados con la vacunación universal y en Israel, donde se administra la vacuna de manera universal en el segundo año de vida, además de haberse observado una disminución importante en las tasas de incidencia de todos los grupos de edad, han desaparecido los brotes en guarderías y centros escolares.
En Sudamérica varios países, como Argentina, la tienen introducida en el calendario infantil sistemático con una sola dosis y con buenos resultados.
6. Vías de administración
La vía de administración es intramuscular profunda en el deltoides. En niños entre 1 y 2 años la vacuna debe administrarse en la región anterolateral externa del muslo. No debe administrarse por vía endovenosa.
Está contraindicada en el glúteo según la ficha técnica. No se recomienda la vía subcutánea, ni la intradérmica ya que la respuesta inmunitaria puede ser menor, aunque si de manera inadvertida se administra por via subcutánea, se considerará dosis válida. En pacientes con trastornos de la coagulación se administrará por vía intramuscular siguiendo las recomendaciones del capítulo 17, pero en cualquier caso si se administrase subcutáneamente puede considerarse dosis válida, como ya se ha comentado, según recomiendan los CDC.
7. Indicaciones y esquemas de vacunación
La primovacunación consiste en una única dosis. Debe administrarse una dosis de recuerdo 6 meses después, al menos, para prolongar la inmunidad durante largo tiempo.
Si se utiliza la vacuna combinada de hepatitis A+B, hay que administrar 3 dosis (0, 1 y 6 meses). También puede realizarse una pauta rápida de 4 dosis (0, 7, 21-30 días y 12 meses), especialmente indicada en personas con riesgo de infección en fechas próximas (en la ficha técnica solo autorizada para la presentación de adultos). El “período de gracia” no se admite para los intervalos únicos fijados entre dosis para la pauta acelerada de la combinada frente a las hepatitis A y B (Twinrix: 0, 7, 21-30 días): las administradas a intervalos inferiores a los asignados en sus series no deben considerarse válidas y deberán repetirse a las edades apropiadas.
Aunque la ficha técnica de Havrix establece 5 años como intervalo máximo recomendado para administrar la 2.ª dosis, debemos aplicar el criterio de “dosis puesta, dosis que cuenta” y la 2.ª dosis se aplicará, para completar la pauta, en cualquier momento pasados 6 meses, aunque hayan transcurrido más de 5 años.
Si la primera y la segunda dosis de la vacuna HepA de antígeno único se administraron con menos de 6 meses de diferencia, la segunda dosis no es válida y debe repetirse 6 meses después de la segunda dosis no válida. Sin embargo, si esta dosis repetida (la tercera dosis) se administra en cualquier momento ≥6 meses después de la primera dosis, la serie puede considerarse completa.
Intervalo mínimo o edad: las dosis de vacunas administradas ≤4 días antes del intervalo mínimo o edad se consideran válidas, salvo para Twinrix.
Tabla 28.2. Situaciones especiales a que puede dar lugar el desabastecimiento de esta vacuna, si se produce.
| Si hay bajo riesgo de hepatitis A, se puede esperar a que haya vacunas adecuadas a la edad |
| Si hay alto riesgo de hepatitis A, pero ya se ha recibido una dosis adecuada a la edad, se puede esperar para la segunda dosis a la vacuna adecuada porque una sola dosis es muy eficaz |
| Si hay alto riesgo de hepatitis A y no ha recibido ninguna dosis de esta vacuna o ha recibido dosis inadecuadas se podría utilizar una de estas opciones: |
| ADULTOS |
| No está recomendado dar dos dosis infantiles en un adulto no inmunizado (CDC), salvo por necesidad de inmunización (alto riesgo de enfermedad) y desabastecimiento de las dosis de adulto |
| Si por error se administra una dosis infantil y se advierte en el momento, se puede aplicar una segunda dosis infantil en la misma consulta y en miembro distinto, y contabilizar como válidas ambas como si fuera una dosis de adulto. Si el error se descubre posteriormente, se daría por no válida la dosis infantil y habría que administrar una nueva dosis de adulto en cualquier momento y posteriormente una segunda dosis de adulto pasados 6 meses de esta administrada |
| NIÑOS |
| No está recomendado dar media dosis de adulto, salvo por necesidad de inmunización (alto riesgo de enfermedad) y desabastecimiento. Si se hubiera administrado esta media dosis, no podemos olvidar desechar la otra mitad y se podría dar por válida. Para la segunda dosis se puede esperar a la vacuna adecuada, porque una sola dosis es muy eficaz |
| Si se aplica una dosis de adulto por error en un niño, se puede dar por válida, pero en la segunda dosis, a los 6 meses de la de adulto, se utilizará la dosis infantil |
No están indicados cribados serológicos prevacunales. En España, según el criterio de edad, podría estar indicado el cribado en personas en riesgo de infección mayores de 40 años. En los menores de 40 años sería más eficiente la vacunación directa, sin cribado serológico previo.
Dada la elevada inmunogenicidad de la vacuna, no se recomienda rutinariamente el examen de anticuerpos posvacunación, aunque podría considerarse en pacientes con inmunodeficiencias y así el ACIP recomendó en junio de 2019 la medición de anticuerpos, al menos, un mes después de la vacunación frente a la hepatitis A, en inmunodeprimidos, como personas con VIH, receptores de trasplante de progenitores hematopoyéticos o los que reciben quimioterapia. Se puede considerar la posibilidad de revacunar a estas personas si no tuvieron una respuesta inmune adecuada (IgG ≥10 mUI/ml) después de la serie de vacunación primaria frente al VHA. En estos casos, las pruebas serológicas posteriores a la revacunación con dos dosis deben realizarse, al menos, 1 mes después de segunda dosis. Si la respuesta a la revacunación aún no es adecuada (es decir, es <10 mUI/ml), no se recomienda la vacunación adicional. Sin embargo, se debe aconsejar a la persona sobre los métodos para prevenir la infección por VHA, incluida la necesidad de inmunoglobulina polivalente después de una exposición. Si la vacuna produce seroconversión, existen datos limitados sobre la necesidad de repetir las pruebas o sobre la frecuencia de las dosis de refuerzo o la revacunación.
Actualmente, en nuestro país, en todas las CC. AA., excepto Cataluña, Ceuta y Melilla, la estrategia de vacunación frente a la hepatitis A se basa en la vacunación selectiva de grupos con riesgo incrementado, siguiendo las recomendaciones del grupo de trabajo de la Ponencia y Registro de Vacunaciones del Ministerio de Sanidad.
En caso de desabastecimiento de suministro a nivel mundial de la vacuna frente al VHA (como sucedió en 2017, tanto en la presentación de adultos como en la infantil), la vacunación preexposición se limita temporalmente a los grupos de riesgo incluidos en el documento antes citado (tabla 28.2).
La vacunación preexposición está indicada en:
- Personas que viajan a zonas de alta o intermedia endemicidad de hepatitis A, especialmente si han nacido con posterioridad a 1966 y si se desplazan a zonas rurales o con condiciones higiénico-sanitarias deficientes.
- Niños inmigrantes (VFR) que visitan sus países de origen que tienen una endemicidad intermedia o alta y contactos estrechos de niños adoptados de estas áreas.
- Personas con enfermedad hepática crónica, incluidas, entre otras, personas con infección por el virus de la hepatitis B o C, cirrosis, enfermedad del hígado graso, enfermedad hepática alcohólica, déficit de alfa 1 antitripsina, hepatitis autoinmune o niveles de alanina aminotransferasa (ALT) o aspartato aminotransferasa (AST) persistentemente mayores que el doble del límite superior de lo normal. Estas personas, a pesar de no tener un mayor riesgo de infección por VHA, sí lo tienen de sufrir una hepatitis A fulminante si adquieren el virus.
- Personas que han recibido o están a la espera de recibir un trasplante hepático.
- Receptores de hemoderivados, como los hemofílicos. El 3 de julio de 2020 el ACIP (Advisory Committee on Immunization Practices) dejó de recomendar la vacunación frente al VHA en estas personas, ya que desde 2002, las pruebas de amplificación de ácido nucleico para la detección del ARN del VHA se han aplicado a la detección del plasma fuente utilizado para la fabricación de productos derivados del plasma, reduciendo drásticamente el riesgo de transmisión de VHA en estos productos.
- Contactos domiciliarios y cuidadores de pacientes con infección por VHA.
- Personas a partir de los 12 meses de edad con infección por el virus de la inmunodeficiencia humana (VIH).
- Personas que presentan estilos de vida que suponen un mayor riesgo de infección: por ejemplo, hombres que practican sexo con hombres o profesionales sexuales o bien usuarios de drogas por vía parenteral.
- Personas con un mayor riesgo ocupacional: manipuladores de alimentos, personal que trabaja en guarderías infantiles y personal sanitario y residentes de instituciones asistenciales.
- Personas con síndrome de Down (SD) y sus cuidadores. Si bien el SD no comporta un riesgo incrementado de infección por el virus de la hepatitis A, se recomienda la vacunación por las deficiencias que presentan en su sistema inmunitario, la frecuente asistencia a centros de atención especializada, y su predisposición a padecer formas crónicas del VHB, circunstancia esta que multiplicaría el riesgo de una enfermedad grave del VHA en caso de coinfección.
- Personas que tendrán un contacto personal cercano con un niño procedente de adopción internacional, ya que la mayoría de estos niños provienen de países donde la hepatitis A es de endemicidad alta o intermedia.
- Estados Unidos ha incluido también en las indicaciones de profilaxis preexposición a las personas sin hogar, embarazadas en riesgo de infección (viajeras internacionales, drogadicción, contacto con personal cercano a un adoptado internacional o personas sin hogar) o de hepatitis A grave (hepatopatía crónica, VIH), personal ingresado o que trabaja en instituciones penitenciarias, y a cualquier persona que solicite la vacunación.
- En 2006 el ACIP recomendó la vacunación rutinaria de todos los niños de 12 a 23 meses. El 3 de julio de 2020, se reafirma en la recomendación de 2019 que consistía en la vacunación de todos los niños y adolescentes de 2 a 18 años que no hubieran recibido previamente la vacuna.
Se incluye la recomendación de vacunar al personal de guarderías infantiles (educadores, personal de limpieza y cocina, etc.), debido a la existencia de casos asintomáticos en los niños que acuden a las mismas y a la facilidad de transmisión y contagio que presentan estos niños que no controlan esfínteres; sin embargo, el uso de la vacuna no debería limitarse solo a estos trabajadores, sino que podría ampliarse a los niños, para su propia protección y la de sus familiares y contactos domésticos.
En España, el papel de las guarderías en la difusión del virus de la hepatitis A está subestimado. Las guarderías que atienden a niños con pañales tienen más probabilidad de experimentar brotes de esta enfermedad. Por esta razón, los niños mayores de 12 meses que acuden a guardería deberían recibir la vacuna contra la hepatitis A. Idealmente, la vacunación se realizará antes del acceso a las guarderías. Los niños que acudan a edades más tempranas no podrán ser vacunados hasta que cumplan los 12 meses, edad mínima recomendada para la administración de la vacuna.
La pauta de vacunación en ambos tipos de profilaxis (pre y posexposición, esta última comentada más adelante) consiste en 2 dosis, a partir de los 12 meses de edad, con un intervalo de, al menos, 6 meses entre ellas. Para los viajeros se recomienda que la 1.ª dosis se administre, al menos, 2 semanas antes del viaje a la zona endémica, pero si no se podido hacer, se puede administrar en cualquier momento antes de la salida.
En febrero de 2018, el ACIP de los Estados Unidos recomendó el uso de la vacuna contra la hepatitis A, en lugar de inmunoglobulina (Ig) inespecífica, en lactantes de 6-11 meses de edad cuando viajan a zonas de riesgo. Ello es debido a la posible interferencia de las Ig cuando se recomienda para la protección contra la infección por VHA con la administración simultánea de la vacuna triple vírica, que también se aconseja para estos lactantes antes del viaje internacional. El uso de la vacuna contra la hepatitis A, en lugar de Ig, elimina este problema y, al igual que sucede con la vacuna triple vírica, estos niños deben recibir las dosis apropiadas de las vacunas después de cumplir los 12 meses de edad, es decir, la vacuna administrada entre los 6 y 11 meses de edad no se considera una dosis válida y, por tanto, no cuenta para la serie vacunal recomendada frente al VHA..
En cuanto a la duración de la protección, diversos trabajos publicados han mostrado la persistencia de anticuerpos protectores durante un periodo de 15 a 17 años, tras la administración de 2 dosis de vacuna frente a la hepatitis A. Algunos autores consideran posible un esquema vacunal de una sola dosis y así se está haciendo en algunos países sudamericanos.
Según datos de la OMS, 33 países incluyen en su calendario sistemático infantil la vacunación frente a la hepatitis A, mientras que en 41 se hace únicamente en los grupos de riesgo y en 14 en ambos.
En algunos países, como Australia, Canadá, España, Italia o Rusia se vacuna solo en alguna región determinada, en otros antes de entrar en las escuelas infantiles (Austria, México), mientras que en otros se vacuna a cualquier persona incluida en grupos de riesgo (Australia, Bahamas, Bélgica, Chipre, Eslovenia, España, Finlandia, Iraq, San Marino y Nueva Zelanda).
En junio de 2019, el ACIP recomendó que todos los niños y adolescentes de 2 a 18 años que no hayan recibido previamente la vacuna contra la hepatitis A se vacunen de manera rutinaria a cualquier edad y se vuelve a reafirmar en julio de 2020.
En España, como se ha comentado previamente, Cataluña, Ceuta y Melilla incorporaron hace años la vacunación universal a sus calendarios de vacunación pediátricos. Ceuta y Melilla incluyeron en el año 2000 la vacunación universal frente a la hepatitis A en niños en el segundo año de vida, administrando la primera dosis a los 15 meses y la segunda dosis a los 2 años de edad. Cataluña instauró en 1998 un programa piloto de vacunación universal frente a la hepatitis A en los adolescentes de 11-12 años, aplicándola en las escuelas en forma de vacuna combinada frente a las hepatitis A y B. Con esta medida, la efectividad frente a la hepatitis A ha sido muy importante, con una reducción del 97 % en la incidencia de casos en las cohortes vacunadas y con disminuciones importantes en las no vacunadas, probablemente como consecuencia de la protección de grupo. A partir de 2015, la vacunación universal frente a la hepatitis A, en Cataluña, pasó de ser un pilotaje a convertirse en sistemática y se realiza desde entonces administrando 2 dosis, una a los 15 meses y otra a los 6 años de edad. Los niños a los que se administra la primera dosis a los 6 años recibirán la segunda a los 11-12 años en la escuela, y hasta que las cohortes susceptibles estén vacunadas, se continuará vacunando a los 11-12 años, con dos dosis, en el ámbito escolar.
De la misma manera que ocurrió con la estrategia selectiva de la vacunación frente a la hepatitis B, la vacunación frente a la hepatitis A de la población de mayor riesgo tendrá muy poco impacto en la incidencia de la enfermedad, ya que solo se puede prevenir un pequeño porcentaje del total de casos. Únicamente la vacunación universal puede reducir de forma significativa la enfermedad. Además, al no existir un reservorio no humano, ni infecciones crónicas por el virus de la hepatitis A, la vacunación universal tiene el potencial de conseguir la eliminación de la enfermedad en una comunidad o país.
En resumen, el CAV-AEP mantiene actualmente la recomendación de vacunar frente a la hepatitis A a las personas con un riesgo incrementado de infección, a la vez que considera que, idealmente, la vacunación universal de todos los niños podría ser la estrategia óptima para la eventual eliminación y control de esta enfermedad.
8. Situaciones especiales
Vacunación posexposición y control de brotes
Se recomienda utilizar la vacuna como profilaxis posexposición (apartado 3 del capítulo 9 del Manual) en las siguientes circunstancias:
- Niños sanos de 12 meses de edad o más, si se administra antes de 14 días tras la exposición. Si bien se ha demostrado que una dosis es suficiente para prevenir la enfermedad, es recomendable administrar una segunda dosis 6 meses después, al menos. En inmunodeprimidos y pacientes con hepatopatía crónica debe administrarse además inmunoglobulina (Ig) polivalente. Si no está indicada la vacuna se administrará solamente Ig.
- Niños no vacunados y personal de guarderías cuando ocurre algún caso de hepatitis A entre los niños o entre el personal.
- Niños no vacunados y personal de guarderías cuando se detectan casos en 2 o más familias de los niños que acuden al centro.
- Miembros (<40 años) de las familias que llevan los hijos a una misma guardería o centro de preescolar, cuando se detectan casos en 3 o más familias.
- Contactos (<40 años) de los casos que aparecen en una escuela o en un centro sanitario, cuando la investigación epidemiológica demuestra que ha habido transmisión en la escuela o en el centro sanitario.
- En adultos >40 años, no existe mucha experiencia con la vacuna, y en profilaxis posexposición se recomienda mejor el empleo de la Ig, en vez de la vacuna, aunque no supone una contraindicación sino una precaución y, de hecho, el Ministerio, en personas de esta edad inmunodeprimidos o hepatópatas crónicos, recomienda la vacuna y la Ig conjuntamente.
En la exposición a fuente común (manipulador de alimentos) se recomienda la vacunación en los siguientes casos:
- Manipuladores de alimentos susceptibles del mismo establecimiento del caso índice.
- Personas susceptibles que hayan sido consumidores de alimentos manipulados por el caso índice, si la investigación epidemiológica indica riesgo de transmisión en un ámbito cerrado (escuela, hospital, cuartel, etc.).
La vacunación de los susceptibles también está indicada para el control de brotes comunitarios. La administración de la primera dosis de la vacuna debe hacerse lo antes posible y alcanzar coberturas del 70 % o más para controlar el brote.
La profilaxis posexposición no se recomienda en las siguientes circunstancias:
- Contactos escolares o laborales de un único caso. Solamente se hará en los contactos personales en caso de un brote en la escuela o en una clase.
- Personal sanitario expuesto a un paciente con hepatitis A: el cumplimiento riguroso de la higiene de manos antes y después del contacto con el paciente y la aplicación de las precauciones de aislamiento son las medidas de prevención más eficaces en esta situación.
La profilaxis posexposición con inmunoglobulina polivalente en los niños menores de 6 meses; dosis: 0,02 ml/kg y 0,06 ml/kg, para estancias en países endémicos inferiores a 3 meses y de 3 a 5 meses, respectivamente; para estancias más prolongadas debe repetirse la administración de 0,06 ml/kg cada 5 meses. En EE. UU. tienen una nueva inmunoglobulina polivalente GamaSTAN y la recomiendan para viajes de hasta 1 mes de duración, 1 dosis de IG a 0,1 ml/kg; para viajes de hasta 2 meses, 1 dosis de IG a 0,2 ml/kg, y para viajes de ≥2 meses, se debe repetir una dosis de 0,2 ml/kg de IG cada 2 meses durante el viaje o hasta que el bebé pueda recibir la vacuna HepA (es decir, a la edad ≥6 meses). En los niños mayores de 6 meses es preferible la vacuna en el calendario del viajero, “incluso en el aeropuerto”, ya que es eficaz a partir de los 15 días de su administración. Si la vacuna se aplica entre 6 y 11 meses de edad, como se ha comentado con anterioridad, habría que volver a repetirla a partir de los 12 meses de edad.
Revacunación
La duración exacta de la protección es desconocida. Se ha demostrado que los anticuerpos anti VHA persisten en niveles protectores durante, al menos, 20 años tras la administración de la vacuna y los modelos matemáticos de cinética de anticuerpos realizados indican que persisten anticuerpos durante 40 años o más. Dado que se ha demostrado que existe memoria inmunológica, aun cuando se produjera descenso de anticuerpos, la protección en caso de exposición al virus continuaría, de forma similar a lo que ocurre con la hepatitis B.
Respuesta serológica IgM tras vacunación
La serología frente a la hepatitis A solo debe hacerse en el contexto de una probable enfermedad por ese virus, y no para comprobar la respuesta inmunológica a la vacunación. Más del 95 % de los vacunados con una dosis presentan aumento de IgG, y prácticamente el 100 % tras dos dosis. Sin embargo, puede haber confusión a la hora de interpretar un resultado serológico con IgM (+) frente al virus de la hepatitis A tras la vacunación reciente frente a ese virus o la posibilidad de que se trate de una infección natural. Hay que tener en cuenta que hasta en un 8-20 % de adultos vacunados muestran un resultado de VHA IgM (+) a las 2-3 semanas de la vacunación, pudiendo persistir estos anticuerpos durante 1 mes (ACIP, CDC). Solo por serología, no se puede distinguir entre elevación por infección natural o por vacunación, por lo que se deben tener en cuenta también el contexto clínico y el epidemiológico para cumplir los criterios de caso.
9. Administración con otras vacunas y otros productos
La administración concomitante de otras vacunas en lugares distintos y con otras jeringas no se considera que pueda interferir con la respuesta a la vacuna antihepatitis A.
Posibles interferencias con otros productos biológicos.
Se puede administrar simultáneamente la vacuna y las inmunoglobulinas inespecíficas (Ig) siempre que se haga en lugares anatómicos distintos y con jeringas distintas. Por ello, las personas inmunodeprimidas y las personas con enfermedades hepáticas crónicas, que han de viajar a áreas endémicas durante las 2 semanas siguientes, deberían recibir una dosis de vacuna a la vez que la Ig y posteriormente deben completar la pauta de vacunación.
10. Efectos adversos
Es una vacuna muy segura. Los efectos adversos suelen ser leves y autolimitados, y habitualmente son efectos de tipo local: dolor o enrojecimiento en el lugar de la inyección. Los efectos sistémicos se registran en menos del 10 % de los vacunados, y pueden consistir en cefaleas, fiebre, cansancio y trastornos gastrointestinales leves. La anafilaxia tras la administración de la vacuna es excepcional.
11. Precauciones y contraindicaciones
Las contraindicaciones de las vacunas frente a la hepatitis A son las habituales de las vacunas inactivadas: reacción anafiláctica a una dosis previa, hipersensibilidad grave a algún componente de las vacunas disponibles, rango de edad fuera de lo establecido o presentar una enfermedad aguda grave en el momento de su administración.
La seguridad de la vacuna durante el embarazo no se ha estudiado en ensayos clínicos. Un estudio multicéntrico con bases de datos de seguridad de vacunas de los CDC y vigilancia basada en la población encontró que la administración de la vacuna contra la HepA durante el embarazo no se asoció con un mayor riesgo de efectos adversos. Sin embargo, se encontró una asociación entre la vacunación materna contra la hepatitis A y los recién nacidos pequeños para la edad gestacional. Los investigadores creen que esta asociación probablemente se debió a factores de confusión no medidos, pero podría justificar una consideración adicional. En definitiva, puesto que se trata de una vacuna preparada con un virus inactivado, aparentemente no existe riesgo de daño fetal, por lo que cuando esté indicada, el embarazo no debería ser motivo de contraindicación. Tampoco existe contraindicación para administrarla en mujeres durante la lactancia.
La vacuna no está contraindicada en pacientes con enfermedades crónicas o inmunosupresión. Aunque puede ser menos eficaz en personas inmunodeprimidas, proporciona cierta protección, por lo que debe administrarse si existe indicación.
12. Bibliografía
- Advisory Committee on Immunization Practices (ACIP). Fiore AE, et al. Prevention of hepatitis A through active or passive immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006;55(RR-7):1-23.
- Aldea Novoa M, et al. Programas de vacunación universal contra la hepatitis A en el mundo. Vacunas. 2012;13:150-62.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2025. An Pediatr (Barc). 2025;102:503713.
- American Academy of Pediatrics. Hepatitis A. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 373-81.
- Andani A, et al. One or two doses of hepatitis A vaccine in universal vaccination programs in children in 2020: A systematic review. Vaccine. 2022;40:196-205.
- Arístegui Fernández J, et al. Hepatitis A. En: Vacunas. Algo más que el calendario vacunal. Cuestiones y respuestas. Hidalgo Vicario MI, Montón Álvarez JL, editores. Undergraf SL, Madrid, 2017, pp 147- 64.
- Cao G, et al. The global trends and regional differences in incidence and mortality of hepatitis A from 1990 to 2019 and implications for its prevention. Hepatol Int. 2021;15:1068-82.
- Castrillejo D, et al. Hepatitis A. Una reflexión, desde la ciudad autónoma de Melilla, tras la introducción de la vacuna. Newsletter Hepatitis A: Epidemiología. 2011;1:15-19.
- Centers for Disease Control and Prevention. Clinical Screening and Diagnosis for Hepatitis A. 2024.
- Centers for Disease Control and Prevention. Hepatitis A. Yellow Book 2026. Chapter 4.
- Centers for Disease Control and Prevention. Hepatitis A Outbreak Linked to Person-to-Person Contact. April 2024.
- Centers for Disease Control and Prevention. Nelson NP, et al. Prevention of Hepatitis A Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices, 2020. MMWR Recomm Rep. 2020;69:1-38.
- Centro Nacional de Epidemiología. Boletín Epidemiológico Semanal. Informe de Vigilancia Epidemiológica en España. Semana 4 2025.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2025. [Internet]. Madrid: AEP; 2025.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; jun/2025. [consultado el dd/mmm/aaaa].
- Domínguez A, et al. Impact and effectiveness of a mass hepatitis A vaccination programme of preadolescents seven years after introduction. Vaccine. 2008;26:1737-41.
- Domínguez García A, et al. Hepatitis A. En: Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Vacunas en Pediatría. Manual de la AEP 2012, 5.ª ed. Madrid: Exlibris ediciones SL; 2012. p. 359-70.
- European Centre for Disease Prevention and Control. Atlas Hepatitis A.
- European Centre for Disease Prevention and Control. Hepatitis A - Annual Epidemiological Report.
- European Centre for Disease Prevention and Control. Communicable disease threats report. Week 50, 7-13 December 2024.
- European Centre for Disease Prevention and Control. Epidemiological update: Hepatitis A outbreak in the EU/EEA mostly affecting men who have sex with men. 12 september 2018.
- European Centre for Disease Prevention and Control. Epidemiological update: Spread of hepatitis A virus strains of genotype IB in several EU countries and the United Kingdom. 29 september 2022
- Espul C, et al.Five-year follow-up of immune response after one or two doses of inactivated hepatitis A vaccine given at 1 year of age in the Mendoza Province of Argentina. J Viral Hepat. 2015;22:453-8.
- Foster MA, et al. Increase in Hepatitis A Virus Infections - United States, 2013-2018. MMWR Morb Mortal Wkly Rep. 2019;68:413-5.
- Freeman E, et al. Field effectiveness of hepatitis A vaccine and uptake of post exposure prophylaxis following a change to the Australian guidelines. Vaccine. 2014;32:5509-13.
- Godoy P, et al. Trends and risk factors of hepatitis A in Catalonia after the introduction of a hepatitis A+B vaccination programme. J Viral Hepat. 2018;25:1001-7.
- Medscape. Hepatitis A: Background, Pathophysiology, Etiology. Gilroy RK. Update Sept 2020.
- Ministerio de Sanidad. Centro de Coordinación de Alertas y Emergencias Sanitarias. Aumento de casos de Hepatitis A en España, 2024. 20 de diciembre de 2024.
- Moro PL, et al. Reports to the Vaccine Adverse Event Reporting System after hepatitis A and hepatitis AB vaccines in pregnant women. Am J Obstet Gynecol. 2014;210:561.e1-6.
- Naciones Unidas. Agenda 2030 para el Desarrollo Sostenible.
- Nelson NP, et al. Update: Recommendations of the Advisory Committee on Immunization Practices for use of hepatitis A vaccine for postexposure prophylaxis and for preexposure prophylaxis for international travel. MMWR Morb Mortal Wkly Rep 2018;67:1216-20. Erratum: MMWR Morb Mortal Wkly Rep 2019;68:233.
- Nelson NP, et al. Hepatitis A vaccination for post-exposure pro-phylaxis in persons aged 40 years and older. Vaccine. 2014;32:2939.
- UK Health Security Agency. The Green Book. Immunisation against infectious diseases. Hepatitis A. Chapter 17. Updated Jan 2024.
- O’Leary ST, et al. Update from the Advisory Committee on Immunization Practices. J Pediatric Infect Dis Soc. 2019;8:379-83.
- O’Leary ST, et al. Update from the Advisory Committee on Immunization Practices. J Pediatric Infect Dis Soc. 2019;8:495-500.
- Ott JJ, et al. Long-term protective effects of hepatitis A vaccines. A systematic review. Vaccine. 2012;31:3-11.
- Ott JJ, et al. Single-dose administration of inactivated hepatitis A vaccination in the context of hepatitis A vaccine recommendations. Internat J Infect Dis. 2013;17:e939–44.
- Plumb ID, et al. Persistence of antibody to Hepatitis A virus 20 years after receipt of Hepatitis A vaccine in Alaska. J Viral Hepat. 2017;24:608-12.
- Pedersini R, et al. HAV & HBV vaccination among travellers participating in the National Health and Wellness Survey in five European countries. Travel Med Infect Dis. 2016;14:221-32.
- Ponencia de Programa y Registro de Vacunaciones. Recomendaciones de vacunación frente a hepatitis A en grupos de riesgo. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional. 2017.
- Raczniak GA, et al. Duration of protection against hepatitis A for the current two-dose vaccine compared to a three-dose vaccine schedule in children. Vaccine. 2013;31:2152-5.
- Ramaswamy M, et al. Hepatitis A vaccine immunogenicity 25 years after vaccination in Alaska. J Med Virol. 2021;93:3991-4.
- Shah N, et al. Review of long term immunogenicity and tolerability of live hepatitis A vaccine. Hum Vaccin Immunother. 2020;16:2816-21.
- Shin EC, et al. Natural history, clinical manifestations, and pathogenesis of hepatitis A. Cold Spring Harb Perspect Med. 2018 4;8:pii:a031708.
- Theeten H, et al. Long-term antibody persistence after vaccination with a 2-dose Havrix™ (inactivated hepatitis A vaccine): 20 years of observed data, and long-term model-based predictions. Vaccine. 2015;33:5723-7.
- van Herck K, et al. Seventeen-year antibody persistence in adults primed with two doses of an inactivated hepatitis A vaccine. Human Vaccines Immunotherap. 2012;8:323-7.
- van Herck K, et al. Antibody persistence and immune memory in healthy adults following vaccination with a two-dose inactivated hepatitis A vaccine: long-term follow-up at 15 years. J Med Virol. 2011;83:1885-91.
- Vizzotti C, et al. Impact of the single-dose immunization strategy against hepatitis A in Argentina. Pediatr Infect Dis J. 2014;33:84-8.
- WHO. Estrategia mundial del sector de la salud contra las hepatitis vÍricas 2016-2021: hacia el fin de las hepatitis vÍricas. 2016.
- WHO. The Global Prevalence of Hepatits A Virus Infection and Susceptibility: A Sistematic Review. 2009.
- WHO. WHO position paper on hepatitis A vaccines-October 2022. Weekly Epidemiol Rec. 2022;97:493-512.
13. Enlaces de Interés
- American Academy of Pediatrics. Immunization. Hepatitis A
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2025
- Centers for Disease Control and Prevention. Hepatitis A vaccination
- Centers for Disease Control and Prevention. Hepatitis A. Pink Book 2021. Chapter 9
- Centers for Disease Control and Prevention. Hepatitis A. Yellow Book 2026. Chapter 4
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: hepatitis A
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente a la hepatitis A
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas... una a una. Vacuna de la hepatitis A
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la hepatitis A
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la hepatitis A
- European Centre for Disease Control and Prevention. Hepatitis A
- Ministerio de Sanidad. Información para el viajero: hepatitis A
- New Zealand. Inmunisation Handbook 2025. Hepatitis A
- Public Health England. Immunisation against infectious disease. The Green Book. Hepatitis A
- Red Book, 32th Edition 2021-2024 Report of the Committee on Infectious Diseases, 32th Edition. Hepatitis A
- Red Nacional de Vigilancia Epidemiológica. Instituto de Salud Carlos III. Protocolo de vigilancia de la hepatitis A
- The Australian Immunisation HandBook. Hepatitis A
- WHO. Hepatitis A
14. Historial de actualizaciones
| 6 de julio de 2018 | Actualización de los apartados introducción; epidemiología de la enfermedad; indicaciones y esquemas de vacunación y situaciones especiales. Nuevas citas bibliográficas y enlaces de interés |
| 14 de julio de 2020 | Actualización de los apartados introducción; epidemiología de la enfermedad; vías de administración; indicaciones y esquemas de vacunación y precauciones y contraindicaciones. Nuevas citas bibliográficas |
| 22 de marzo de 2022 | Actualización de los apartados puntos clave; introducción y tipos de vacunas, composición y presentación. Nuevas citas bibliográficas |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 11 de abril de 2023 | Actualización de todos los apartados. Nuevas citas bibliográficas |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlace de interés |
| 19 de noviembre de 2024 | Creación de un nuevo subapartado "Respuesta serológica IgM tras vacunación" |
| 1 de enero de 2025 | Nuevas citas bibliográficas y enlace de interés |
| 18 de julio de 2025 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
-oOo-



