Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
40. Tuberculosis. BCG
Capítulo 40 - Tuberculosis. BCG
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de vacunas, composición y presentación
- Inmunogenicidad, eficacia y efectividad
- Vías de administración
- Indicaciones y esquemas de vacunación
- Administración con otras vacunas y otros productos
- Efectos adversos
- Precauciones y contraindicaciones
- Nuevas vacunas en investigación
- Observaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tabla y figuras indluidas en el capítulo:
Tabla 40.1. Eficacia estimada de la BCG frente a la tuberculosis en la edad pediátrica
Figura 40.1. Número de casos de TB en 2023 en países con, al menos, 100 000 casos
Figura 40.2. Tuberculosis en el mundo. Tasas de incidencia global por 100 000 habitantes, 2023
Figura 40.3. Tuberculosis en el mundo. Distribución de casos por género y edad, 2023
Figura 40.4. Tuberculosis en Europa. Tasas de incidencia por 100 000 habitantes, 2023
Figura 40.5. Tasas de notificación de tuberculosis en España según la comunidad autónoma, 2023
Figura 40.6. Vía y dosis de la vacuna BCG
Figura 40.7. Política de vacunación con BCG en los diferentes países, 2025
Figura 40.8. Vacunas frente a la tuberculosis en investigación, 2025
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Tuberculosis. BCG. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ago/2025. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-40
1. Puntos clave
- La tuberculosis (TB) es la infección más prevalente en el mundo y una de las 10 principales causas de muerte a nivel global. Su incidencia es difícil de conocer con precisión debido a que la mayoría de los casos ocurren en países con bajo índice de desarrollo humano, pero se considera que 1 de cada 4 habitantes del planeta está infectado por Mycobacterium tuberculosis y que un 10 % de los infectados desarrollará la enfermedad a lo largo de la vida.
- La OMS estima que los esfuerzos globales para combatir la TB han salvado 79 millones de vidas desde el año 2000. Los objetivos para 2035 del Programa “Estrategia Fin a la Tuberculosis” de la OMS y la ONU persiguen una reducción del 95 % en el número de muertes causadas por tuberculosis y una reducción del 90 % en la tasa de incidencia de la enfermedad, en relación a los niveles de 2015. Para este año 2025, los objetivos son reducciones del 75 % y 50 %, respectivamente.
- En España, atendiendo a los casos declarados a través del sistema EDO, las tasas de TB respiratoria en los últimos 20 años se sitúan entre 10 y 25 casos por 100 000 habitantes al año.
- Los niños son especialmente vulnerables a desarrollar enfermedad activa y a presentar formas graves y extrapulmonares de la enfermedad.
- En las dos últimas décadas, en nuestro país, al igual que en los países de nuestro entorno, ha disminuido el número de casos pediátricos, pero la migración y el aumento de viajes internacionales han dado lugar a importantes cambios epidemiológicos y a la aparición de cepas resistentes y multirresistentes, que hacen del manejo de esta enfermedad un problema de salud pública prioritario.
- La prevención de la enfermedad se basa en la acción sobre los determinantes sociales, la detección y el tratamiento de la infección tuberculosa latente y la vacunación.
- La actuación más importante en el control de la tuberculosis es el diagnóstico precoz junto al tratamiento correcto de los casos bacilíferos, así como el estudio de contactos y, por extensión, el de los brotes que aparezcan en comunidades cerradas. El objetivo de todos los programas es identificar y tratar las fuentes de infección, administrando un tratamiento antituberculoso completo que de acuerdo con los estándares internacionales suele ser de 6 meses, aunque puede acortarse a 4 meses en casos seleccionados o puede prolongarse según el tipo de TB, el estado inmunitario del enfermo y el patrón de resistencia del bacilo.
- La única vacuna disponible es la BCG, elaborada con un bacilo atenuado de Mycobacterium bovis. En España solo está disponible en el País Vasco la vacuna BCG, de AJ Vaccines, que proviene de la cepa original del bacilo de Calmette-Guérin, cepa danesa 1331. Es de uso intradérmico, liofilizada a una concentración de 1 mg/ml (equivalente a 2-8 millones de bacilos viables). Única presentación de 1 ml. Está contraindicada en inmunodeprimidos y embarazadas. Se administra exclusivamente por vía intradérmica en la cara externa superior del brazo (en la región superior de la inserción distal del músculo deltoides) y en la cara externa del muslo (a la altura del trocánter mayor).
- La BCG es la vacuna en uso más antigua, ha sido utilizada ampliamente en el mundo desde 1930, actualmente se incluye en los calendarios de más de 100 países en los que se estima que se administra a unos 100 millones de niños recién nacidos cada año.
- La vacuna BCG, no es efectiva en la prevención de las formas pulmonares de la enfermedad, pero ha demostrado una adecuada efectividad en la prevención de meningitis y enfermedad tuberculosa diseminada en lactantes y niños pequeños, por lo que se incluye en el calendario de vacunación de países con alta endemia.
- En países con baja tasa de incidencia de TB como España, esta vacuna no se incluye en el calendario sistemático, siendo la Comunidad Autónoma del País Vasco la última en retirarla en enero de 2013. Actualmente, en nuestro medio, está recomendada en los niños que pertenecen a grupos de riesgo de presentar infección tuberculosa, pero solo está disponible en el País Vasco.
- Existen numerosas líneas de investigación para conseguir vacunas más efectivas frente a la TB.
2. Introducción
La TB es una de las principales causas de morbi-mortalidad de origen infeccioso en el mundo. Su control, es uno de los objetivos de desarrollo sostenible que Naciones Unidas ha propuesto para 2035 con un plan que, con respecto a las tasas notificadas en 2015, persigue reducir un 90 % el número de casos nuevos de TB y en un 95 % el número de muertes. Para conseguirlo es necesario el acceso global a las herramientas de diagnóstico, a los nuevos tratamientos menos tóxicos y más eficaces, así como disponer de nuevas vacunas más efectivas y seguras para prevenir la TB pulmonar.
Objetivos de la ONU para 2027 respecto a la tuberculosis:
- Cobertura de pruebas rápidas de tuberculosis:
- Objetivo 100 % para los nuevos diagnósticos. Estado en 2023: 48 %
- Cobertura de tratamiento de tuberculosis:
- Objetivo: 90 %. Estado en 2023: 75 %
- Cobertura del tratamiento preventivo de la tuberculosis:
- Objetivo del 90 % entre poblaciones de alto riesgo. Estado en 2023: 21 % entre los contactos domésticos de personas diagnosticadas de TB, 56 % entre las personas con VIH
- Disponibilidad de una nueva vacuna contra la tuberculosis segura y eficaz:
- Objetivo, dentro de cinco años. Estado en 2023: seis vacunas en ensayos de Fase III
La TB es una enfermedad infecciosa causada por micobacterias, el agente etiológico más frecuente es el Mycobacterium tuberculosis, bacilo aeróbico, ácido alcohol resistente, descubierto por Koch en 1882, incluido en el complejo Mycobacterium tuberculosis complex junto a M. bovis, M. africanum, M. microti y M. canetii, especies de menor relevancia clínica con las que comparte >95 % de homología en su DNA. Otras micobacterias (atípicas) son patógenos oportunistas ambientales que pueden producir un cuadro clínico similar en pacientes inmunodeprimidos, especialmente con infección por el VIH.
La enfermedad tuberculosa puede afectar a cualquier órgano, siendo la forma pulmonar la más frecuente. La mayoría de los casos en pediatría son de localización torácica (parenquimatosa o ganglionar), representando las formas extrapulmonares (renal, osteoarticular, meníngea, abdominal, etc.) el 15 % del total. En los niños, la enfermedad tuberculosa pulmonar se presenta en la mayoría de las ocasiones de forma oligosintomática.
3. Epidemiología de la enfermedad
La TB es una enfermedad de transmisión aérea a partir de bacilos existentes en las gotitas suspendidas en el aire que emiten los enfermos con TB pulmonar o laríngea al toser o estornudar. El periodo de transmisibilidad es variable, se mantiene mientras persistan bacilos viables en el esputo del enfermo y el riesgo de infección tras la exposición, aumenta si la convivencia supera las 4 horas al día en espacio cerrado, siendo mayor en los niños más pequeños debido a lo estrecho del contacto con los convivientes. Se estima que aproximadamente el 23 % de la población mundial (1700 millones de personas) tiene una infección tuberculosa latente (ITBL) y que el 10 % de las personas con ITBL eventualmente desarrollará la enfermedad TB.
El periodo de incubación, desde la infección hasta la positivización tuberculínica, es de 2 a 10 semanas y, sin embargo, el tiempo entre la infección y el desarrollo de la enfermedad puede ser de meses o años. El riesgo de progresión a enfermedad es mayor en niños y en inmunodeprimidos. Se estima que, entre los infectados menores de 1 año, el 50 % desarrollará enfermedad activa, el porcentaje desciende al 25 % entre los niños de 1 a 2 años y al 10 % a partir de los 5 años. Además, los niños de corta edad presentan con más frecuencia formas diseminadas graves, incluyendo la TB miliar y la TB meníngea.
A pesar de que los niños son más vulnerables y progresan con más frecuencia a enfermedad que el adulto, la TB infantil ha sido durante décadas una epidemia oculta debido a su dificultad diagnóstica, su menor incidencia en relación al adulto y a la escasa capacidad infectiva del niño.
Con el desarrollo del tratamiento, las mejoras en el saneamiento, de las condiciones de vida y de la vigilancia epidemiológica, la incidencia y la mortalidad han disminuido significativamente. Sin embargo, desde la década de 1990, la epidemia mundial ha empeorado debido a factores como la aparición de cepas de TB resistentes a fármacos, el uso de agentes inmunosupresores, la drogadicción, la pobreza y los movimientos de población, convirtiendo a la tuberculosis en una de las principales enfermedades infecciosas reemergentes y en un grave problema de salud mundial. Globalmente es la decimotercera causa de muerte y aunque está presente en todos los países y grupos de edad, al ser una enfermedad curable y prevenible, la mayor morbimortalidad se concentra en los países con bajo índice de desarrollo humano.
A nivel mundial, el número anual de muertes por TB disminuyó entre 2005 y 2019, pero esta tendencia revirtió en 2020 y 2021. Los aumentos estimados en la incidencia de tuberculosis entre 2021 y 2023 son consecuencia de las interrupciones en el diagnóstico y el tratamiento durante la pandemia de COVID-19, cuando el número notificado de personas recién diagnosticadas con tuberculosis disminuyó de 7,1 millones en 2019 a 5,8 millones en 2020 y 6,4 millones en 2021. Se supone que esta reducción se debe a un aumento en el número de personas con tuberculosis no diagnosticadas ni tratadas, así como, a una reducción en la transmisión durante los períodos de confinamiento y a cierto nivel de subregistro.
En el Informe Global de la Tuberculosis 2024, se considera que en 2023 existen, al menos, 2,6 millones de casos no diagnosticados y/o no registrados y se notifica un aumento del número de personas que enfermaron de tuberculosis (10,8 millones/134 casos por 100·000 habitantes) de los cuales 1,8 millones desarrollaron la enfermedad, con 1,25 millones de muertes, mostrando como la TB ha vuelto a ser la enfermedad infecciosa que más muertes origina en el mundo y como, el impacto más inmediato del aumento de personas con tuberculosis no diagnosticadas ni tratadas durante la pandemia, se traduce en un aumento de la mortalidad por tuberculosis en los años posteriores. Sin embargo, aunque acabar con la epidemia mundial de TB sigue siendo un objetivo lejano, existen motivos para ser optimistas, como el hecho de que el aumento global de casos referido ha comenzado a ralentizarse y a estabilizarse en 2024.
La mayoría de los casos de tuberculosis en 2023 se produjeron en las regiones de la OMS del Sudeste Asiático (45 %), África (24 %) y el Pacífico Occidental (17 %), con proporciones menores en el Mediterráneo Oriental (8,6 %), las Américas (3,2 %) y Europa (2,1%); ocho países presentaron más de dos tercios de los casos, India (26 %), Indonesia (10 %), China (6,8 %), Filipinas (6,8 %), Pakistán (6,3 %), Nigeria (4,6 %), Bangladesh (3,5 %) y la República Democrática del Congo (3,1 %) (figura 40.1).
Figura 40.1. Número de casos de TB en 2023 en países con, al menos, 100 000 casos.
Fuente: Global tuberculosis report. OMS 2024
Los países se clasifican como endémicos, cuando la incidencia es >100 casos/100 000 habitantes/año y no endémicos, cuando la incidencia es <20 casos/100 000 habitantes año (figura 40.2).
Figura 40.2. Tuberculosis en el mundo. Tasas de incidencia global por 100 000 habitantes, 2023.
Fuente: Global tuberculosis report. OMS 2024
La mayor carga se concentra en hombres adultos (≥15 años), con una estimación de 6,0 millones de casos en 2023, equivalente al 55·% del total; en comparación, con 3,6 millones de casos de mujeres adultas (≥15 años), equivalente al 33 % del total, y 1,25 millones de casos entre niños (0–14 años), equivalente al 12 % del total estimado. Las notificaciones de casos de personas con diagnóstico reciente de tuberculosis en 2023 representaron el 75 % del total, pero la incidencia varía según la edad y el sexo, 76 % en hombres adultos, 80 % en mujeres adultas y 55 % en niños de 0 a 14 años (figura 40.3).
Figura 40.3. Tuberculosis en el mundo. Distribución de casos por género y edad, 2023.
Fuente: Global tuberculosis report. OMS 2024
Para conseguir un control efectivo de la TB es necesario encontrar herramientas de diagnóstico más rápidas y fiables que las actuales, y disponer nuevos fármacos efectivos que permitan acortar la terapia.
Se considera que actualmente 50 millones de personas ya están infectadas de forma latente con cepas de M. tuberculosis multirresistentes (MDR) o extremadamente resistentes a fármacos (XDR); se estima que unas 400 000 personas desarrollaron TB multirresistente o resistente a rifampicina (MDR/RR) en 2023 y que solo dos de cada cinco personas con tuberculosis resistente tuvieron acceso al tratamiento, creando un reservorio para futuros casos de TB activa de difícil manejo. Las tasas de éxito del tratamiento de la tuberculosis sensible a los medicamentos se mantuvieron en 2023 en el 88 % y para TB-MDR/RR en el 68 %. En la población menor de 15 años, la tasa de curación con tratamiento alcanzó el 90 %. En este contexto desarrollar vacunas eficaces es fundamental para el control de la enfermedad.
En la Región Europea de la OMS en 2023 se registró un aumento de casos, estimándose que 225 000 personas enfermaron de tuberculosis, lo que equivale a 24 casos por cada 100 000 habitantes, reflejando un ligero aumento en comparación con 2022. Los casos de TB en niños y adolescentes en la UE/EEE, aumentaron un 26 %, lo que marca el tercer año consecutivo de crecimiento; los niños menores de 15 años representan actualmente el 4,3 % de todos los casos, con un aumento de las notificaciones de 1341 en 2022 a 1689 en 2023, lo que representa un preocupante aumento del 10 % en la TB pediátrica 2023. Este aumento continuo de casos de TB infantil indica una transmisión continua dentro de las comunidades (figura 40.4).
Figura 40.4. Tuberculosis en Europa. Tasas de incidencia por 100 000 habitantes, 2023.
Fuente: ECDC. Tuberculosis surveillance and monitoring in Europe 2025 (Datos de 2023).
En España en 2023, se notificaron un total de 4208 casos de TB (tasa de 8,8 por 100 000 habitantes), 263 casos importados (6,3 del total). El número de casos fue superior en hombres (2575 casos, 65,3 %) y la localización principal fue la pulmonar (n=2721, 69 %). La ratio nacidos en España/nacidos en otro país mostró un descenso progresivo entre 2015 y 2023 (de 2,2 a 1,1, respectivamente). Se notificaron 210 casos en menores de 15 años (92 en menores de 5 años y 118 en el grupo de 5 a 14 años). El 69 % de los casos presentaron localización pulmonar (n=2721), un 26,2 % otras localizaciones (n=1035) y un 0,7 % localización meníngea (n=27). Se realizó estudio de resistencias en 2137 casos, detectándose 52 casos con resistencias a rifampicina y 36 casos con MDR y ningún caso extremadamente resistente (XDR); 11 de los casos eran nacidos en España. En el 78,6 % de los casos el resultado del tratamiento fue satisfactorio.
Las CC. AA. que presentaron tasas por encima del tercer cuartil en 2023 (superior a10,3) fueron: Ceuta (28,9), Melilla (14,0), Cataluña (12,3), Galicia (11,2) y País Vasco (10,9). En la figura 40.5, se representa la distribución por comunidades autónomas.
Figura 40.5. Tasas de notificación de tuberculosis en España según la comunidad autónoma, 2023.
Fuente: RENAVE. Vigilancia de la tuberculosis.Año 2023.
En consonancia con la estrategia “Fin a la TB”, España en 2019 elaboró un plan para la prevención y control de la TB que plantea como objetivo general detener la transmisión de la TB a través del acceso universal a la prevención, el diagnóstico y el tratamiento. Entre las medidas epidemiológicas para el control de la enfermedad tuberculosa, es fundamental identificar y tratar las fuentes de infección para impedir la transmisión, además del diagnóstico, del aislamiento y del tratamiento precoz, realizando una buena una encuesta epidemiológica que permita hacer los estudios de contactos pertinentes.
Los niños menores de 5 años representan un grupo demográfico importante para conocer la epidemiología de la enfermedad TB, los niños se consideran “casos centinela” de una transmisión reciente desde un adulto bacilífero y, por lo tanto, siempre que se diagnostica una TB en un niño, hay que buscar el caso índice entre los adultos de su entorno.
En la edad pediátrica está indicado realizar estudio para detección de infección TB latente en todo niño con contacto con un caso bacilífero y en los niños inmigrantes procedentes de áreas de alta prevalencia (incidencia ≥40 casos por 100 000 habitantes), para clasificarlos como expuestos, infectados o enfermos y realizar el tratamiento preciso.
- Expuesto: niño asintomático con contacto estrecho con un paciente bacilífero y con prueba de tuberculina (PT) negativa (<·5·mm) y test Interferon-Gamma-Release-Assay (IGRA), negativo. Teniendo en cuenta que el intervalo de positivización de las pruebas es de 2 a 10 semanas. 8-10 semanas tras el estudio inicial está indicado repetir la PT y confirmar si existe viraje (>6·mm respecto a la PT previa).
- Infectado: niño asintomático con PT positiva o que presenta viraje y/o IGRA positivo, en el que se descarta enfermedad, al presentar radiografía de tórax normal. Esta situación se denomina infección tuberculosa latente (ITBL).
- Enfermo: niño con clínica compatible y hallazgos radiológicos, analíticos, anatomopatológicos y/o microbiológicos sugestivos. La PT y/o IGRA suelen ser positivos, aunque en las formas iniciales o diseminadas pueden ser negativos.
En niños convivientes con una persona bacilífera, con estudio inicial negativo, está indicada la quimioprofilaxis primaria, si el niño es <5 años, en cualquier edad si existe inmunodepresión y en recién nacidos hijos de madres bacilíferas, hasta la confirmación de una 2.ª PT negativa.
El tratamiento de la ITBL, para evitar el desarrollo de la enfermedad, se realiza con isoniacida durante 6-9 meses. Si el caso índice está ocasionado por una cepa resistente o multirresistente se indicará la pauta en función de la sensibilidad de la cepa.
4. Tipos de vacunas, composición y presentación
La única vacuna disponible es la vacuna BCG elaborada por Albert Calmette y Camile Guérin, de cuyas iniciales toma el nombre (BCG = bacilo de Calmette-Guérin), es una vacuna viva atenuada derivada del bacilo Mycobacterium bovis, agente etiológico de la tuberculosis en bóvidos, que se desarrolló tras años de cultivos secuenciales en el laboratorio (230 veces seguidas durante 13 años). La BCG, se introdujo por primera vez en 1921, se eligió la vía oral al considerarse el tracto gastrointestinal la vía natural de infección tuberculosa en lactantes y niños alimentados con leche no pasteurizada mostrando su eficacia al disminuir la mortalidad infantil.
Desde 1974, la vacunación intradérmica con BCG al nacimiento ha sido incluida en el Programa Ampliado de Inmunización (EPI) de la OMS, resultando en más de 4000 millones de vacunas administradas en todo el mundo, con aproximadamente 200 millones de vacunas administradas cada año, pero se debate sobre su efectividad entre los niños mayores y los adultos. Una revisión sistemática y metanálisis llevados a cabo con el objetivo de investigar el impacto específico de la edad de la vacunación infantil con BCG en el desarrollo y la mortalidad por tuberculosis (pulmonar y extrapulmonar), encontró que la vacunación al nacer brinda una protección significativa contra la enfermedad y es eficaz para prevenir las formas graves en niños menores de 5 años, pero es ineficaz en adolescentes y adultos. Hallazgos que concuerdan con un meta-análisis publicado en Lancet en 2024 analizando 26 estudios de cohorte de 68 552 individuos, con vacunación con BCG al nacer, que fueron evaluados, al menos, durante 6 meses después de la exposición doméstica o cercana a una persona con tuberculosis, y concluyen afirmando que la vacunación BCG tuvo una efectividad del 37 % contra todas las formas de tuberculosis en niños menores de 5 años y del 42 % contra la enfermedad pulmonar en niños menores de 3 años, pero no ofreció protección a adolescentes o adultos después de la exposición cercana.
La BCG comercial no es un producto único, existen diferentes formulaciones en términos de cepa, composición (la concentración de bacterias vivas en los viales de la vacuna puede oscilar entre 50 000 y tres millones por dosis) y/o dosificación. Actualmente, en los programas de inmunización de todo el mundo se utilizan seis cepas de BCG: BCG Pasteur1173 P2, BCG Danish1331, BCG·Glaxo107, BCG Tokyo172-1, BCG Rusia-I y BCG Brasil. El análisis genómico de las subcepas de BCG vacunales muestra la falta de más de cien genes, entre los que se incluyen los de la región denominada RD1 que contiene los factores de virulencia ESAT6 y CFP10, dos de las proteínas que inducen mayor respuesta inmune, además constatan la existencia de múltiples diferencias de atenuación entre las distintas cepas vacunales, hallazgos que algunos autores correlacionan con las diferencias observadas en la eficacia de los distintos preparados de BCG para prevenir la enfermedad TB.
El único preparado disponible en España es la vacuna BCG de AJ Vaccines, actualmente con graves problemas de suministro, que en la práctica significa que no se encuentra y solo está disponible para grupos de riesgo en el País Vasco. Contiene bacilos derivados de una cepa que proviene de la cepa original del bacilo de Calmette-Guérin. Es de uso intradérmico, liofilizada a una concentración de 1 mg/ml (equivalente a 2-8 millones de bacilos viables). Cada 1 ml de vacuna reconstituida contiene 0,75 mg de Mycobacterium bovis (BCG), cepa danesa 1331, viva atenuada, con 2-8 x106 UFC. Entre los excipientes presenta: Glutamato de sodio, sulfato de magnesio heptahidrato, hidrogenofosfato de potasio, ácido cítrico monohidrato, L-asparagina monohidrato, citrato de hierro y amonio, glicerol 85 %, y agua. La pauta de vacunación incluye una sola dosis.
Aunque actualmente se están realizando estudios en los que se evalúa la eficacia de la revacunación en adolescentes y adultos para revertir o reducir la reactivación de la ITBL, algunos trabajos previos sugieren que la revacunación no mejora la eficacia de la BCG.
Presentación y reconstitución
Existe una sola presentación de un 1 ml (vacuna reconstituida), correspondiente a 10 dosis para adultos y niños mayores de 1 año (0,1 ml) o a 20 dosis para niños menores de 1 año (0,05 ml). Para la reconstitución, se debe utilizar únicamente el disolvente suministrado con la vacuna BCG. Conservar en nevera (entre +2 °C y +8 °C) con los viales dentro del embalaje para protegerlos de la luz.
5. Inmunogenicidad, eficacia y efectividad
No hay ninguna vacuna tan ampliamente utilizada ni tan polémica como la BCG.
Se sabe que la inmunidad celular es importante para el control de la tuberculosis, pero no existe un marcador inmunológico que se pueda correlacionar con protección frente a la enfermedad. La respuesta inmune a la inmunización primaria con BCG ha sido evaluada en diferentes estudios que demuestran que hay una inducción de células T polifuncionales CD4+ y CD8+, interferón (IFN-γ) +, interleucina (IL) -2+ y factor de necrosis tumoral (TNF-α) tras la vacunación, pero no ha sido posible demostrar una correlación de protección. Las personas vacunadas desarrollan una respuesta inmunitaria entre 8 y 14 semanas después de la vacunación, que se pone de manifiesto con la positivización de la PT.
La eficacia y la efectividad de la vacunación con BCG contra la TB varía considerablemente según los estudios y las poblaciones. La mayoría de los trabajos han demostrado que las vacunas de BCG producen un grado más alto de protección contra las formas graves de TB, que contra las formas moderadas de la enfermedad. La BCG proporciona una protección global del 50 % frente a la enfermedad tuberculosa, en especial, previene la meningitis tuberculosa y las formas diseminadas durante la edad infantil, siendo menos eficaz en la prevención de las formas pulmonares, confiriendo una protección variable y en su mayoría deficiente contra la TBC pulmonar en adolescentes y adultos (tabla 40.1). La eficacia de la vacunación neonatal de BCG disminuye con la edad, la mayoría de las evidencias sugieren que la eficacia persiste tras 10 años, con una cierta efectividad residual de hasta 20-25 años, habiéndose descrito hasta de 80 años.
Tabla 40.1. Eficacia estimada de la BCG frente a la tuberculosis en la edad pediátrica.
| Clasificación de los casos | Eficacia % | IC 95 % (*) |
| Casos de TB (ensayo clínico) | 74,2 | (61,6-82,6) |
| Casos de TB (caso-control) | 52,4 | (37,9-63,6) |
| Muertes | 64,8 | (11,8-86,0) |
| Casos confirmados por laboratorio | 82,6 | (58,2-92,8) |
| Meningitis TB | 64,4 | (30,0-82,0) |
| TB diseminada | 78,0 | (58,1-88,3) |
(*) Intervalo de confianza del 95 %
Fuente: elaboración propia a partir de diversos trabajos
La vacunación con BCG es altamente coste-efectiva contra la tuberculosis grave en niños y está especialmente indicada en los países con alta incidencia de tuberculosis. Por otra parte, los estudios epidemiológicos realizados en países africanos, donde se administra BCG a recién nacidos, describen efectos heterólogos, no específicos y no esperados de esta vacuna, reduciendo la mortalidad neonatal e infantil, hallazgos que se corroboran en los estudios realizados en países donde la mortalidad infantil es muy baja, como España, que también describen los efectos beneficiosos inespecíficos de la vacunación con BCG al nacimiento, disminuyendo la hospitalización por infecciones respiratorias y sepsis.
La reducción de la mortalidad global parece deberse a que la vacuna BCG entrena y estimula la respuesta inmune, induciendo resistencia inespecífica frente a otros patógenos a través de su capacidad para reprogramar funcional y epigenéticamente a células inmunes innatas, como monocitos, macrófagos y células NK. La creciente evidencia respecto a la existencia de memoria inmunológica en la inmunidad innata, y de que la exposición a antígenos genera un “entrenamiento” de las células implicadas, preparándolas para posteriores exposiciones, ha despertado un notable interés y ha dado lugar al desarrollo de diferentes proyectos de investigación para conocer si la BCG puede proteger frente a otras infecciones a través de esta "inmunidad entrenada".
Otros usos de la vacuna BCG
En 1990, la Food and Drug Administration (FDA) aprobó el usó del BCG para el tratamiento inmunoterápico del cáncer superficial de vejiga.
La utilidad de la BCG no se agota con la TB:
- Es eficaz en la prevención de la lepra (Mycobacterium leprae) y la úlcera de Buruli (Mycobacterium ulcerans)
- Efectos inespecíficos sobre la mortalidad infantil y general por una variedad de microorganismos. Junto con otras vacunas atenuadas (sarampión, polio, viruela, etc.), especialmente la BCG ha demostrado tener efectos heterólogos, más allá de la protección frente a la TBC, probablemente mediante la estimulación de la “inmunidad entrenada”
6. Vías de administración
La BCG se administra estrictamente por vía intradérmica, habitualmente en la cara externa superior del brazo (en la región superior de la inserción proximal del músculo deltoides) o en la cara externa del muslo (a la altura del trocánter mayor). El brazo debe encontrarse en un ángulo de 45° con el cuerpo. Es costumbre administrar la vacuna en el brazo izquierdo de manera sistemática.
La dosis es de 0,1 ml en niños mayores de 1 año de edad y la mitad (0,05 ml) en los menores de 1 año. El lugar donde va a aplicarse la inyección debe estar limpio y seco. Si se utiliza un antiséptico (por ejemplo, alcohol) para limpiar la piel, hay que dejar que se evapore completamente antes de la inyección. La vacuna BCG debe administrase con una jeringa de 1 ml graduada en centésimas de ml (1/100 ml) equipada con una aguja de bisel corto de calibre 25-26 G. No deben utilizarse para la administración de esta vacuna inyectores a presión ni dispositivos de punción múltiple.
Figura 40.6. Vía y dosis de la vacuna BCG
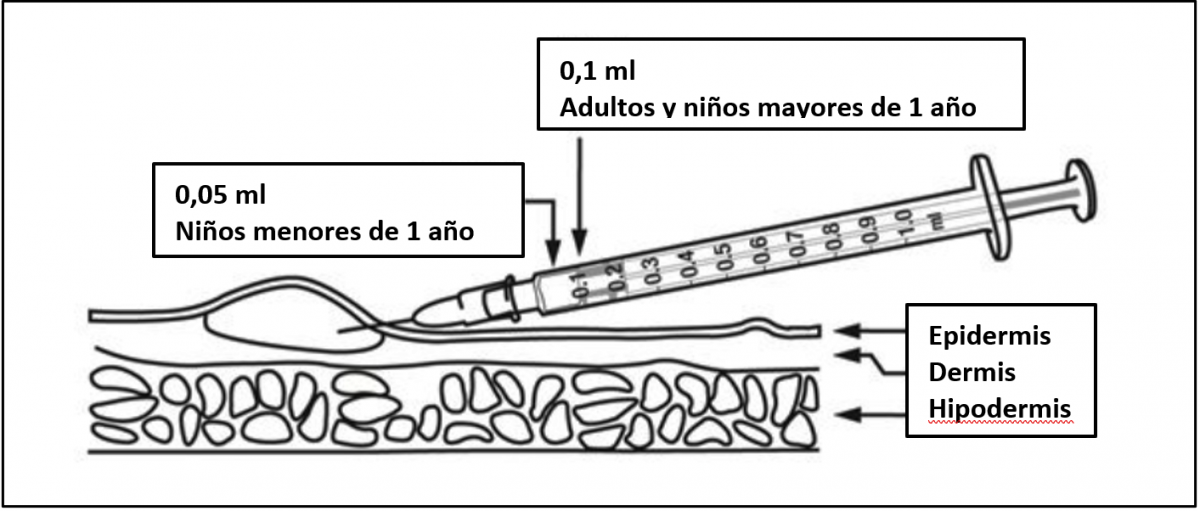
Fuente: esquema modificado de la ficha técnica
La BCG debe ser administrada por personal entrenado en la técnica intradérmica (figura 40.5). Debe estirarse la piel entre el dedo índice y pulgar. La aguja debe estar casi paralela a la superficie de la piel e insertarse lentamente (con el bisel hacia arriba), aproximadamente 2 mm en la capa superficial de la dermis. La aguja debe ser visible a través de la epidermis durante la inserción. La inyección debe realizarse lentamente. Si la administración es correcta, aparecerá una pápula en el punto de inyección. Se recomienda no cubrir el punto de inyección para facilitar la cicatrización.
7. Indicaciones y esquemas de vacunación
La vacunación BCG se recomienda como parte de los programas nacionales de inmunización infantil de acuerdo con la epidemiología de la tuberculosis del país. En España, la conferencia de consenso realizada en el año 1991, teniendo en consideración el bajo riesgo de infección por M. tuberculosis en nuestro país, la variable efectividad de la vacuna frente a TB pulmonar y la existencia de un buen sistema de notificación y de control de brotes, recomendó abandonar la vacunación sistemática y reservarla para los grupos de riesgo. En la actualidad, ninguna comunidad autónoma la mantiene en el calendario, siendo el País Vasco la última en retirarla en enero de 2013, aunque en 2023 ha adquirido dosis para vacunar a grupos de riesgo.
La International Union Against Tuberculosis and Lung Disease (IUATLD) recomienda a los países pasar de una política de vacunación sistemática con BCG a la selectiva de grupos de alto riesgo cuando se constatan la existencia de:
- Un sistema de notificación eficaz y la tasa media anual de notificación de tuberculosis pulmonar bacilífera es <5 por 100 000
- La tasa media anual de notificación de meningitis tuberculosa en <5 años es <1 por 10 millones de habitantes en los últimos 5 años
- El riesgo anual de infección tuberculosa es <0,1 %
En nuestro medio se debe considerar la vacunación con BCG en:
- Recién nacidos en zonas o grupos de riesgo con riesgo anual de infección >0,1
- Niños PT/IGRA negativos con exposición a pacientes bacilíferos con mal cumplimiento o rechazo del tratamiento o en los que el tratamiento no consigue la negativización del esputo (bacilíferos irreductibles) o con tuberculosis causada por cepas MDR o XDR
- Neonatos hijos de madre con TB pulmonar o con exposición domiciliaria: vacunación si está asintomático y no hay evidencia de infección TB
- Niños menores de 5 años, PT negativos, que se desplacen a residir en países de alta endemia tuberculosa (>40 casos por 100.000 habitantes), que vuelvan a su país de origen para permanecer más de 3 meses o que previsiblemente vayan a viajar al país de manera repetida durante la infancia. La vacunación deberá administrarse dos meses antes del viaje, en especial si se viaja a países donde los programas de control y el acceso a un tratamiento adecuado no es posible y donde la prevalencia de TB multirresistente es alta
Salvo en niños menores de 6 meses sin historia de contacto previo, se debe realizar una prueba para el despistaje de infección tuberculosa (Tuberculina/IGRA) previa a la vacunación porque no está indicada en personas infectadas,
La OMS actualizó en febrero de 2018, su posicionamiento y las recomendaciones de uso de la vacuna BCG ampliando su ámbito, incluyendo también a la prevención de otras infecciones por micobacterias no tuberculosas, como la lepra (M. leprae) y la úlcera de Buruli (M. ulcerans).
Según el informe de la OMS de 2020, la BCG se usa de forma sistemática en los recién nacidos de 153 países y en 25 países se recomienda en grupos de riesgo, lo que supone la administración de más de 200 millones de dosis cada año (figura 40.6). En 2019 entre los países que recomiendan BCG universal 115 informaron una cobertura de BCG superior al 80 % y 87 comunicaron una cobertura superior al 90 %. En 2024 la cobertura global es del 88 %.
Figura 40.7. Política de vacunación con BCG en los diferentes países, 2025.
Fuente: The BCG World Atlas. 3rd edition. 2020.
La recomendación de suspender la vacunación sistemática con BCG en un país determinado se realiza si existe un sistema de notificación de casos de tuberculosis eficaz, la tasa de notificación anual de tuberculosis pulmonar con baciloscopia es inferior al 5 por 100 000, el riesgo anual de infección tuberculosa es <0,1 %, y la tasa anual de notificación de meningitis tuberculosa es <1 por cada 10 millones de habitantes en los 5 años previos.
8. Administración con otras vacunas y otros productos
La asociación de la BCG con otras vacunas no aumenta la reactogenicidad y se desarrolla una inmunidad comparable a la que se obtiene con su aplicación aislada, siempre y cuando el lugar de aplicación sea diferente al de las otras vacunas, cosa fácil por otra parte, dado lo diferente de la técnica de aplicación de la BCG (vía intradérmica) en relación al resto de las vacunas. Puede ser administrada al mismo tiempo que las vacunas atenuadas, incluyendo vacunas combinadas contra sarampión, rubeola, paperas y varicela. Si no es así, deben separarse por, al menos, 4 semanas de intervalo. las vacunas orales e intranasales no tiene que separarse por 4 semanas, si no se administran el mismo día.
No hay ningún problema con las vacunas inactivadas, que se pueden administrar en cualquier momento, antes, durante o después de esta vacuna.
Debido al riesgo de linfadenitis regional, se recomienda no usar el mismo brazo en el que se ha aplicado la BCG para la administración de otras vacunas durante un periodo de 3 meses. No se debe administrar la vacuna a pacientes que hayan sido tratados con antibióticos en los últimos 30 días.
No es necesario mantener ningún intervalo entre la administración de inmunoglobulinas o hemoderivados y la vacunación BCG.
Los anticuerpos monoclonales pueden comprometer la efectividad y seguridad de las vacunas vivas atenuadas, por lo que están contraindicadas hasta que hayan transcurrido, al menos, 3 meses (6 meses tras un tratamiento con adalimumab, certolizumab pegol, infliximab o rituximab; 12 con ustekinumab para la BCG) de su supresión. La precaución incluye a los hijos de madres tratadas con estos inmunomoduladores.
9. Efectos adversos
En general, esta vacunación no suele causar fiebre o malestar. Es una vacuna muy segura y bien tolerada, pero muy reactógena en el lugar de la inyección. Algunas semanas después de la vacunación (2-6 semanas) se desarrolla casi seimpre una pequeña pápula que va aumentando de tamaño y puede ulcerarse unas semanas más tarde, y además presentar engrosamiento de los nódulos linfáticos, cervicales o axilares (adenopatía satélite). La pápula persiste durante 2-3 meses y deja una cicatriz permanente. Esta reacción no requiere tratamiento. Esta lesión cura espontáneamente con formación de una pequeña costra.
La reactogenicidad de la vacuna BCG depende en gran medida de la cepa vacunal que se utilice y de la técnica de administración empleada. Con una cepa y una técnica adecuadas, además de una correcta selección de susceptibles, la seguridad está ampliamente demostrada después de más de cuatro mil millones de dosis administradas en el mundo desde 1921.
La complicación de carácter leve/moderado más frecuente es la presencia de una adenopatía regional ipsilateral, con o sin supuración (adenitis supurativa en el 4 % de recién nacidos y 0,3 % en niños mayores). Las reacciones locales en el punto de inoculación de mayor importancia, como úlceras y abscesos, son fundamentalmente causadas por una técnica no adecuada en cuanto a condiciones asépticas o, más frecuentemente, debido a la inyección no estrictamente intradérmica (subcutánea o intramuscular) o por la vacunación de individuos previamente infectados.
Se han descrito las siguientes reacciones locales con la siguiente frecuencia: absceso (menos del 0,01 %), dolor (menos del 95·%), eritema (menos del 95 %), linfadenopatía (1-2 %; más frecuente en <2 años), necrosis/ulceración (ulceración con drenaje: 75 %), nódulo/pápula (más del 95 %, a 10-14 días posvacunación), pústulas (95 %; posible costra pasadas las 6 semanas), queloide (2-4 %; más si hay escarificación), tumefacción (menos del 95 %).
En cuanto a las reacciones sistémicas, se han comunicado con la siguiente frecuencia: anorexia (<5 %), artralgias/mialgias (<5·%), erupción cutánea, fatiga/astenia (<5 %), fiebre (<1 %), infección vacunal. Riesgo de infección diseminada (“BCGosis”) varía entre 1,56-4,29 casos/millón en niños sin factores de riesgo hasta el 1 % en niños con infección por VIH o inmunodeficiencia primaria en los que se describen casos de TB diseminada con áreas de compromiso más allá del sitio de vacunación (miliar, osteoarticular, cutánea diseminada, etc) ocasionadas por la cepa vacunal de Micobacterium bovis incluso años después de la vacunación. El M.bovis BCG es susceptible a los fármacos antituberculosos de primera línea, excepto a pirazinamida.
10. Precauciones y contraindicaciones
Contraindicaciones de la vacuna BCG
La vacuna BCG no debe administrarse en los siguientes casos:
-
Inmunodeficiencias congénitas
-
Inmunodeficiencias adquiridas, como en los casos en los que la respuesta inmune esté disminuida por la acción de ciertos medicamentos (corticoesteroides, agentes alquilantes, antimetabolitos, fármacos biológicos) o por radioterapia o por procesos oncológicos (ej.: linfoma, leucemia, enfermedad de Hodgkin u otros tumores del sistema retículo-endotelial)
-
Lactantes expuestos intraútero o a través de la lactancia materna a tratamientos inmunosupresores, por ejemplo, anticuerpos monoclonales inmunosupresores (ej: anti-TNFα como Infliximab, adalimumab o anti CD20 como el rituximab)
-
Tuberculosis activa o previa o infección tuberculosa latente. Aunque estudios recientes han demostrado que BCG es segura en personas con infección tuberculosa latente.
-
Recién nacidos hijos de mujer VIH positiva hasta descartar la transmisión vertical. Los niños con infección por el VIH que reciben la vacuna BCG, al nacimiento cuando están asintomáticos y sin diagnóstico, tienen riesgo de desarrollar enfermedad local o diseminada. Este riesgo se ha estimado entre 400 y 1300 casos por 100 000 dosis de BCG. Por esta razón, esta vacuna está contraindicada en los pacientes con infección por el VIH en los países de baja prevalencia de tuberculosis, como España. En muchos de los países donde coexisten tasas muy altas de infección por el VIH y de tuberculosis, la situación se complica porque no disponen de la posibilidad de descartar la infección por el VIH en los hijos de madres infectadas antes de la aplicación rutinaria de la BCG.
La OMS ha establecido para estos países las siguientes recomendaciones:
- Los niños nacidos de madres en las que se desconoce su estado con respecto a la infección por el VIH deberían recibir la BCG al nacimiento ya que los beneficios exceden los riesgos potenciales
- Los recién nacidos de madres con infección por el VIH, en los que se desconoce si están o no infectados, y que están totalmente asintomáticos, deberían recibir la BCG al nacimiento, analizando cuidadosamente los factores epidemiológicos locales, ya que los beneficios habitualmente exceden al riesgo
- Los recién nacidos infectados por el VIH no deberían recibir la BCG
- Los recién nacidos hijos de madres infectadas por el VIH, en los que se desconocen si están o no infectados, pero que tienen síntomas compatibles con infección por el VIH no deberían ser inmunizados ya que los riesgos de la vacunación exceden a los beneficios
- Aunque el embarazo no constituye una contraindicación estricta, se debe valorar individualmente el riesgo de infección, especialmente en el primer trimestre. Si es posible debe posponerse la vacunación hasta después del parto o administrar 1 mes antes del embarazo
- En el recién nacido pretérmino con peso <2500 g. tradicionalmente la BCG ha estado contraindicada debido a que la respuesta a esta vacuna sería muy débil o no se produciría. Hay datos contradictorios sobre la respuesta de los RNP, si tienen una edad gestacional ≥32 semanas pueden ser vacunados al nacimiento y la respuesta será similar a los RNT; si son <32 semanas, la vacunación no se debe diferir si el riesgo de exposición a la infección tuberculosa es alto, pero si el riesgo es pequeño o no existe, la vacunación se debe retrasar a los 3-6 meses.
- Hipersensibilidad grave a la BCG o a cualquiera de sus componentes.
- Si no se ha realizado previamente la prueba de la tuberculina (salvo los recién nacidos) o si ésta ha dado positiva
- Pacientes quemados
- Niños con malnutrición del tipo Kwashiorkor
- Tuberculosis, o cualquier otra enfermedad infecciosa activa o durante su convalecencia
- Angiopatías o hemopatías graves
- Pacientes que están recibiendo tratamiento antituberculoso
- Tratamiento con antibióticos durante los últimos 30 días
La vacunación debe posponerse en personas con fiebre, o en caso de patologías cutáneas generalizadas. Aunque el eccema no es una contraindicación, la zona de inyección debe estar libre de lesiones.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO
Se debe realizar una prueba de la tuberculina previa a la vacunación con BCG (salvo en recién nacidos). Las personas identificadas como positivas a la prueba de la tuberculina no deben vacunarse, ya que la administración de la vacuna les podría provocar una reacción local grave. Aunque estudios recientes han demostrado que BCG es segura en personas con infección tuberculosa latente.
Aunque las reacciones anafilácticas son raras, durante la vacunación se debe contar con las medidas necesarias para su manejo y tratamiento. Siempre que sea posible, deberá observarse al paciente en cuanto a síntomas de reacción alérgica hasta 15-30 minutos después de haber recibido la vacuna.
La inyección profunda incrementa el riesgo de linfadenitis y de formación de abscesos.
En caso de sobredosis, sobre todo en niños pequeños, puede presentarse una linfadenitis supurativa benigna que se cura de forma lenta y espontánea. En casos excepcionales puede desarrollarse una infección generalizada por la vacuna BCG.
Se recomienda no usar el mismo brazo en el que se ha aplicado la vacuna BCG para la administración de otras vacunas durante un período de 3 meses.
11. Nuevas vacunas en investigación
A pesar del uso generalizado de la BCG, la TB sigue siendo la principal enfermedad transmisible de las vías respiratorias que amenaza la salud pública, y aunque desde hace un siglo la BCG ha ayudado a controlar la enfermedad, su efecto disminuye a largo plazo y no previene la tuberculosis pulmonar (la forma más frecuente de presentación y responsable de la mayoría de las infecciones y de la transmisión).
El desarrollo de nuevas vacunas contra la TB se identificó como una prioridad para la OMS en 2018, elaborando un documento con las Características Preferidas del Producto (PPC) para las nuevas vacunas cuyo objetivo es proteger contra la TB pulmonar y presentar un mejor perfil de seguridad y eficacia que la BCG contra todas las formas de tuberculosis, incluso en lactantes e inmunodeprimidos, y lograr una protección que dure, al menos, 10 años. Los modelos sugieren que, para 2050, una vacuna infantil con estas características podría evitar hasta 18 millones de casos de tuberculosis y 2,6 millones de muertes y sería rentable en casi todos los países con alta carga de tuberculosis.
Comparando con otras enfermedades, el desarrollo de vacunas contra la TB es aún más desafiante debido a la complejidad de la enfermedad, su patogénesis, la ausencia de una hipótesis confirmada sobre los mecanismos de protección inmunomediados y los plazos relativamente prolongados necesarios para la evaluación de los parámetros de eficacia clínica. Un desafío clave en el desarrollo de la vacuna contra la tuberculosis es la falta de correlatos inmunitarios de protección aceptados o validados. Esto tiene un impacto en el cribado preclínico de candidatos potenciales y en la optimización de la formulación de la vacuna, ya que se deben realizar experimentos de protección largos y costosos utilizando modelos animales que aún no han sido validados para predecir la eficacia clínica. La falta de un correlato inmune establecido también obstaculiza el desarrollo de un ensayo calificado y apropiado para medir la potencia que aceleraría y armonizaría la caracterización del producto y el control de calidad.
Las últimas dos décadas de investigación, los avances en la comprensión científica del sistema genético, la proteómica y los mecanismos inmunológicos contra el MTB han acelerado el desarrollo de nuevas vacunas candidatas contra la TB en desarrollo clínico, incluidas vacunas inactivadas, vacunas vivas atenuadas, vacunas de subunidades, vacunas de vectores virales, vacunas de ADN, y las vacunas emergentes de ARNm, así como las vacunas basadas en partículas similares a virus (VLP), que actualmente se encuentran en etapas preclínicas o ensayos clínicos.
Actualmente hay 15 vacunas candidatas en ensayos clínicos: cuatro en Fase I, cinco en Fase II y seis en Fase III (figura 40.8).
El mecanismo de acción de estas vacunas puede clasificarse en 3 grandes categorías estratégicas:
- Prevención preexposición, dirigidas a recién nacidos y lactantes, antes de la primera exposición
- Prevención posexposición, dirigidas a adolescentes y adultos. Tienen como finalidad proteger a los contactos expuestos, algunos de los cuales pueden identificarse como conversores recientes mediante pruebas de diagnóstico de ITL, ayudando a evitar la evolución a enfermedad. Varias vacunas en desarrollo están diseñadas para mejorar la protección proporcionada por la BCG, en particular, en adultos que ya han recibido la vacunación inicial. De estas, la vacuna M72/AS01E ha emergido como una candidata líder, demostrando una eficacia del 50 % en la prevención de la enfermedad tuberculosa en individuos con infección tuberculosa durante los ensayos de fase 3 realizados en Sudáfrica a partir de marzo de 2024
- Vacunas terapéuticas de micobacterias inactivadas que han sido diseñadas buscando disminuir los tiempos de tratamiento en las personas infectadas con tuberculosis latente, o bien reducir la probabilidad de recurrencia después de la finalización del tratamiento
En cuanto a los tipos de vacunas en investigación se dispone de:
- Vacunas de subunidades. Utilizan antígenos seleccionados por la respuesta en personas enfermas o antígenos de fusión recombinantes de M. tuberculosis, ya sea vehiculada por vector viral o administrada con adyuvante, cuyo objetivo es potenciar la inmunidad a BCG:
- Vacunas que utilizan virus como vehículo: Ad5Ag85A emplea adenovirus, TB/FLU-04L virus de la gripe, ChAdOx185A, adenovirus de simio y MVA85A un poxvirus
- Vacunas de proteínas recombinantes que se formulan con adyuvantes: M72/AS01E, H4:IC31, H56:IC31, AEC/BC02 y la vacuna ID93 + GLA-SE
- Vacunas atenuadas. Estas vacunas se preparan eliminando algunos de los genes de virulencia en el MTB, que pierde su patogenicidad, expresa significativamente múltiples antígenos, activa diferentes tipos de células T y mejora la inmunogenicidad. Pueden utilizarse como vacunas preventivas y como sustituto de la vacuna BCG del recién nacido. En comparación con otras vacunas, sus ventajas son que puede activar respuestas inmunitarias complejas y diversas, tiene una gama más amplia de epítopos antigénicos, induce respuestas inmunitarias similares a las de una infección natural y, por tanto, produce protección a largo plazo. Sin embargo, las vacunas atenuadas también tienen algunos inconvenientes, como riesgos potenciales de recuperar la virulencia y complicaciones del complejo inmunológico:
- Mycobacterium tuberculosis atenuada: MTBVAC
- BCG (Gates MRI-TBV01-201para revacunación
- Vacunas recombinantes. La recombinación y modificación de la BCG existente es una de las direcciones de investigación para las vacunas contra la tuberculosis. Mediante la inserción de genes diana exógenos en la bacteria para usarlos como portadores para construir se han desarrollado varios tipos de rBCG y se han evaluado sus efectos protectores y respuestas inmunes humorales y celulares en modelos animales y humanos:
- BCG recombinante, sobre-expresando Ag85B
- BCG recombinante: introduciendo una región (RD1) del M. tuberculosis ausente en la BCG
- BCG recombinante VPM1002: introduce un gen de L. monocytogenes
- Vacunas inactivadas. Las vacunas inactivadas utilizan formas lisadas completas o fragmentadas de MTB para inducir una respuesta inmune contra una variedad de antígenos de MTB. Estas vacunas inducen respuestas inmunes humorales y mediadas por células Th1, defendiendo contra infecciones extracelulares de MTB y han mostrado buenos efectos inmunoterapéuticos en el control de la tuberculosis. Entre las desventajas se destaca que confieren un período de inmunización corto que hace necesario utilizar dosis múltiples y entre las ventajas destaca su estabilidad, seguridad y fácil producción:
- Mycobacteria no tuberculosa inactivada por calor: DAR-90
- Mycobacteria no tuberculosa: VACCAE
- Vacuna inactivada poliantigénica de fragmentos liposomales de M. tuberculosis inactivado: RUTI.
Más información en la figura 40.8.
Figura 40.8. Vacunas frente a la tuberculosis en investigación, 2025.
Fuente: TuBeruclosis Vaccine Initiative (TBVI). April 2025
Entre las vacunas en fase 3 de ensayos clínicos, la mejor posicionada actualmente es MTBVAC, la vacuna española desarrollada por la Universidad de Zaragoza y la biofarmacéutica Biofabri. MTBVAC tiene potencial para sustituir a la centenaria BCG y ofrecer una protección más completa tanto en recién nacidos como en adultos.
Vacunas destinadas a recién nacidos y niños, destacan 4 productos:
Un producto en fase preclínica:
- CG-ZMP1 (Universidad de Zürich), una vacuna BCG recombinante cuyo objetivo principal es del de sustituir de forma segura la BCG en los recién nacidos (expuestos al VIH). Se realizaron estudios de prueba de concepto sobre inmunogenicidad, seguridad y eficacia protectora en animales.
Dos productos candidatos en la fase 3 de desarrollo: son MTBVAC y VPM1002:
- VPM1002 (SSI, Max Planck. Alemania), en fase 3 de desarrollo (NCT04351685) está basada en la cepa de M. bovis de la BCG modificada genéticamente (introducción de listeriolisina -un gen de Listeria monocytogenes- y eliminación simultánea del gen de la ureasa C) para buscar un mejor reconocimiento por el sistema inmunológico mejorando significativamente la producción de células T CD4 + y CD8·+ específicas de antígeno. En el estudio se evalúa la eficacia y seguridad, compararando a recién nacidos expuestos y no expuestos al VIH vacunados con BCG o con VPM1002. Los datos de los primeros ensayos clínicos confirmaron los datos preclínicos y demostraron que VPM1002 es al menos tan segura e inmunogénica como BCG. Actualmente se está realizando en la India un ensayo de fase III para evaluar el potencial de VPM1002 como vacuna posexposición en la prevención de la recurrencia de la tuberculosis después de una terapia farmacológica antituberculosa exitosa. En junio de 2022 finalizó el reclutamiento de casi 7000 recién nacidos sanos de ambos sexos en Sudáfrica, Tanzania, Kenia, Uganda y Gabón. El estudio evaluará la eficacia y seguridad y comparará a recién nacidos expuestos y no expuestos a VIH vacunados con BCG o con VPM1002. Aún no se han publicado resultados intermedios.
- MTBVAC (UNIZAR. España) es la primera y única vacuna atenuada basada en M. tuberculosis que ha alcanzado la fase III de investigación en humanos. El desarrollo de MTBVAC es el resultado de una colaboración público-privada que aúna más de 25 años de investigación y desarrollo (I+D) por parte de la Universidad de Zaragoza y 17 años de desarrollo industrial y clínico por Biofabri. La vacuna MTBVAC es una vacuna atenuada derivada de un aislado humano de M.tuberculosis, que pertenece al linaje (euroafricano-americano), uno de los linajes más extendidos a nivel global. La vacuna se elabora incluyendo dos mutaciones estables mediante la deleción de los genes de virulencia phoP y fadD26. MTBVAC en relación con la BCG contiene un un 50 % más de epítopos reconocidos por célulasT humanas presentes en las cepas de M.tuberculosis incluyendo los principales antígenos delecionados en todas las cepas de BCG, el reconocimiento de estos antígenos por parte del huésped, conlleva una mejor protección frente a la infección, mediante una respuesta mediada por célulasT a CFP10/ESAT6.
Los resultados de la fase Ia en adultos mostraron un perfil de seguridad robusta para MTBVAC en las tres dosis probadas hasta llegar a una dosis de 105, equivalente a la utilizada actualmente con BCG. Los estudios de inmunología mediante estimulación de la sangre de los participantes con BCG o MTBVAC mostraron una correlación dosis/respuesta de linfocitos CD4 polifuncionales y los voluntarios en los que se administró la misma dosis de MTBVAC que de BCG, el número de individuos que respondieron tras 4 semanas de la vacunación fue mayor en el grupo vacunado con MTBVAC.
Por otra parte, la prueba de Elispot para ESAT6 y CFP10, que se utiliza para diferenciar individuos vacunados con BCG e infectados por tuberculosis, fue negativa para todos los vacunados con MTBVAC a los 7 meses después de la vacunación, pero se pudo observar una tendencia de la respuesta específica contra CFP10-ESAT6 en los participantes vacunados con MTBVAC en comparación con BCG.
El plan de desarrollo clínico para MTBVAC considera como primer objetivo la vacunación en recién nacidos, dado que esta población no ha estado previamente expuesta a micobacterias ambientales ni a vacunados previamente con BCG. Es importante remarcar la importancia de la vacunación de esta población dada la alta incidencia de tuberculosis en menores de 5 años (muy similar a los adolescentes).
La vacuna MTBVAC se encuentra actualmente en la fase final de los estudios de eficacia de ensayos clínicos; fase III en bebés y fase IIb de adultos. En 2022, se inició un estudio en África subsahariana que prevé la participación de 7500 recién nacidos. En marzo de 2025, se habían vacunado 3914 bebés en el marco de este ensayo. El estudio compara la eficacia de MTBVAC con la de la BCG, se espera que concluya en 2028 y entre los objetivos se incluye demostrar una eficacia un 50 % mayor que la vacuna BCG en recién nacidos.
Una vacuna terapéutica:
-
RUTI (Archivel Farma. España) fase IIb: es una vacuna inactivada mediante calor, poliantigénica, obtenida a partir de fragmentos de la pared celular purificados y lisosomales de bacilos M. tuberculosis cultivados en condiciones de estrés para simular el entorno dentro de los granulomas, induciendo así la producción de antígenos específicos de latencia que normalmente están ocultos al sistema inmunológico. Se investiga su uso terapéutico como agente inmunomodulador con capacidad para activar una respuesta amplia del sistema inmune complementario al tratamiento antituberculostático, en particular en enfermos con resistencias a los fármacos. En los estudios de evaluación de eficacia se evidencia que reduce significativamente el daño pulmonar y la carga bacteriana y mantiene la respuesta inmunitaria celular contra ESAT-6, en comparación con el tratamiento de base. También se observó un efecto aditivo al administrarse en combinación con el tratamiento de base, aumentando la reducción del daño pulmonar (x2), la carga bacteriana pulmonar (1 log10) y la respuesta inmunitaria contra PPD, HSP16.3 y PsTS1. Estos datos demuestran por primera vez la seguridad de la inmunoterapia con antígenos de Mtb en un modelo de tuberculosis activa, lo que aumenta la eficacia del tratamiento habitual. Esto impulsa el inicio de estudios clínicos para evaluar la seguridad y la eficacia de RUTI® en pacientes con tuberculosis, con el fin de mejorar su salud, reducir su potencial contagio y acortar la duración del tratamiento
En resumen, el panorama del desarrollo de nuevas vacunas frente a la tuberculosis es moderadamente optimista, aunque no se vislumbran resultados a corto plazo y los retos pendientes son muchos y complejos.
12. Observaciones
Actualmente la intervención más importante en el control de la tuberculosis es el diagnóstico precoz junto al tratamiento correcto de los casos bacilíferos, unido al estudio de contactos y, por extensión, el de los brotes que aparezcan en comunidades cerradas. El objetivo, por tanto, de todos los programas es identificar y tratar las fuentes de infección para impedir la transmisión.
La vacunación de contactos no está indicada, salvo en niños PT negativos con exposición a pacientes bacilíferos irreductibles o con cepas resistentes (ver indicaciones).
La actual vacuna BCG es relativamente eficaz y es la vacuna más utilizada en el mundo en la actualidad, pero es insuficiente para afrontar el control mundial de la TB, por lo que el camino de la investigación se ha orientado fundamentalmente a mejorar la vacuna existente y a identificar nuevas vacunas más eficaces y seguras. Una nueva vacuna contra la tuberculosis tiene el potencial de reducir la incidencia de la tuberculosis, prevenir la progresión de la infección latente a la enfermedad activa y frenar la transmisión de cepas resistentes a los medicamentos, lo que la convierte en un componente fundamental de las estrategias mundiales de control de la tuberculosis, especialmente el objetivo Fin de la Tuberculosis de la Organización Mundial de la Salud.
13. Bibliografía
- Abubakar I, et al. Systematic review and meta-analysis of the current evidence on the duration of protection by bacillus Calmette-Guérin vaccination against tuberculosis. Health Technol Assess. 2013;17:1-372.
- Adams V, et al. Enfermedad tuberculosa en niños: epidemiología, manifestaciones clínicas y diagnóstico. UpToDate.
- American Academy of Pediatrics. Tuberculosis. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 786-814.
- Angelidou A, et al. Licensed Bacille Calmette-Guérin (BCG) formulations differ markedly in bacterial viability, RNA content and innate immune activation. Vaccine. 2020;38:2229-40.
- Arts RJW, et al. Immunometabolic pathways in BCG-induced trained immunity. Cell Rep. 2016;17:2562-71.
- Baquero-Artigao T, et al. Actualización del diagnóstico y tratamiento de la tuberculosis. An Pediatr (Engl Ed). 2023;98:460-9.
- Benn CS, et al. Revaccination with Live Attenuated Vaccines Confer Additional Beneficial Nonspecific Effects on Overall Survival: A Review. EBioMedicine. 2016;10:312-7.
- Buonsenso D, et al. Ptbnet QFT-Plus study group. Performance of QuantiFERON-TB Gold Plus assays in paediatric tuberculosis: a multicentre PTBNET study. Thorax. 2023;78:288-96.
- Caminero JA, et al . Diagnóstico y tratamiento de la tuberculosis con resistencia a fármacos. Arch Bronconeumol. 2020;56:514-21.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Informe epidemiológico sobre la situación de la tuberculosis en España. Año 2021.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Informe epidemiológico sobre la situación de la tuberculosis en España. Año 2023.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ago/2025.
- De Bree LCJ, et al. Non-specific effects of vaccines: Current evidence and potential implications. Semin Immunol. 2018;39:35-43.
- De Castro MJ, et al. Nonspecific (Heterologous) Protection of Neonatal BCG Vaccination Against Hospitalization Due to Respiratory Infection and Sepsis. Clin Infect Dis. 2015;60:1611-9.
- Donald PR, et al. Age and the epidemiology and pathogenesis of tuberculosis. Lancet. 2010;375:1852-4.
- European Centre for Disease Prevention and Control, WHO Regional Office for Europe. Tuberculosis surveillance and monitoring in Europe 2024 - 2022 data. Stockholm: 2024.
- Ernst JD. Mechanisms of M. tuberculosis Immune Evasion as Challenges to TB Vaccine Design.Cell Host Microbe. 2018;24:34-42.
- Floyd K, et al. Global tuberculosis targets and milestones set for 2016–2035: definition and rationale. Int J Tuberc Lung Dis. 2018;22:723-30.
- Hatherill M, et al. Infant BCG vaccination is beneficial, but not sufficient. Lancet Glob Health. 2022;10:e1220-1.
- Hernanz-Lobo A, et al. Prevalence and Clinical Characteristics of Children With Nonsevere Tuberculosis in Spain. Pediatr Infect Dis J. 2023;42:837-43.
- Kaufmann SHE, et al. Vaccine Development Against Tuberculosis Over the Last 140 Years: Failure as Part of Success. Front Microbiol. 2021:12:750124.
- Lancione S, et al. Tracking changes in national BCG vaccination policies and practices using the BCG World Atlas. BMJ Glob Health. 2022;7:e007462.
- Lanciane S. The BCG World Atlas. 3.ª edición.
- Lobo N, et al. 100 years of Bacillus Calmette–Guérin immunotherapy: from cattle to COVID-19. Nat Rev Urol. 2021;18:611-22.
- Maani AA, et al. The critical role of new tuberculosis vaccines in achieving the WHO 2035 End TB target. IJID Reg. 2025;14(Suppl 2):100595.
- Martin C, et al. Update on TB Vaccine Pipeline. Apl. Sci. 2020;10:2632.
- Martín C, et al. MTBVAC, a live TB vaccine poised to initiate efficacy trials 100 years after BCG. Vaccine. 2021;39:7277-85.
- Martinez L, et al. Infant BCG vaccination and risk of pulmonary and extrapulmonary tuberculosis throughout the life course: a systematic review and individual participant data meta-analysis. Lancet Glob Health. 2022;10:1307-16.
- Ministerio de Sanidad. Plan para la prevención y control de la tuberculosis en España 2019.
- Ministerio de Sanidad. Plan para la prevención y control de la tuberculosis, 2019-2030. 2024.
- Organización Mundial de la Salud. Todos por la salud, salud para todos: argumentario a favor de la inversión 2025–2028. 2024
- Organización Panamericana de la Salud. Hoja de ruta para poner fin a la tuberculosis en niños y adolescentes. Segunda edición. Washington, D.C.: Organización Panamericana de la Salud; 2020. Licencia: CC BY-NC-SA 3.0 IGO.
- Paulo J, et al. G100 years of the Bacillus Calmette-Guérin vaccine. Vaccine. 2021;39:7220-22.
- Principi N, et al. The present and future of tuberculosis vaccinations. Tuberculosis. 2015;95:6-13.
- Roy A, et al. Effect of BCG vaccination against Mycobacterium tuberculosis infection in children: systematic review and meta-analysis. BMJ. 2014;349:g4643.
- Soler-Garcia A, et al. QFT-Plus Study Group of the Spanish Pediatric TB Research Network. Performance of QuantiFERON-TB Gold Plus assays in children and adolescents at risk of tuberculosis: a cross-sectional multicentre study. Thorax. 2022;77:1193-201.
- Tameris, M. et al. Safety, reactogenicity, and immunogenicity of MTBVAC in infants: a phase 2a randomised, double-blind, dose-defining trial in a TB endemic setting. EBioMedicine. 2025:114:105628.
- Tarancón R, et al. New live attenuated tuberculosis vaccine MTBVAC induces trained immunity and confers protection against experimental lethal pneumonia. PLoS Pathog. 2020;16:e1008404.
- The TuBerculosis Vaccine Initiative (TBVI).
- Vekemans J, et al. Tuberculosis vaccines: Rising opportunities. PLoS Med. 2019;16:e1002791.
- von Reym Fordham C. Vaccines for prevention of tuberculosis. UpToDate 2023.
- World Health Organization. BCG vaccines: WHO position paper – February 2018. Wkly Epidemiol Rec. 2018;93:73-96.
- World Health Organization. Global tuberculosis report 2024. October 2024.
- World Health Organization. WHO operational handbook on tuberculosis. Module 5: management of tuberculosis in children and adolescents.Geneva: World Health Organization; 2022. Licence: CC BY-NC-SA 3.0 IGO.
- Zhuang L, et al. Next-Generation TB Vaccines: Progress, Challenges, and Prospects. Vaccines (Basel). 2023;11:1304.
14. Enlaces de Interés
- Centers for Disease Control and Prevention (CDC). Bacille Calmette-Guérin (BCG) Vaccine for Tuberculosis
- Centers for Disease Control and Prevention (CDC). Tuberculosis. Yellow Book, 2024
- Centers for Disease Control and Prevention (CDC). Tuberculosis Vaccine
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Tuberculosis
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente a la tuberculosis
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas... una a una. Vacuna de la tuberculosis (BCG)
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Todas las noticias relacionadas con la vacuna BCG
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la tuberculosis
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias. La vacuna MTBVAC contra la tuberculosis muestra efectos heterólogos en modelos animales
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias. País Vasco reintroduce la vacunación frente a la tuberculosis con BCG en menores de 5 años con alto riesgo
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias: Postura de la OMS sobre la vacuna BCG (tuberculosis)
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias. Una vacuna promete cambiar el panorama de la tuberculosis en el mundo
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la tuberculosis/BCG
- European Centre for Disease Prevention and Control (ECDC). European Tuberculosis Surveillance Network
- Organización Mundial de la Salud (OMS). Tuberculosis
- Plan para la prevención y control de la tuberculosis en España. Indicadores de seguimiento 2023
- Public Health England. Tuberculosis (TB): diagnosis, screening, management and data
- Stop TB Partnership
- The BCG World Atlas
- The Australian Immunization Handbook. 10th Edition. Tuberculosis
- Tuberculosis profile: Spain
- TuBerculosis Vaccine Initiative (TBVI)
- World Health Organization. Diagnosis and notification of rifampicin-resstant TB (MDR/ RR-TB)
- World Health Organization. Global Programme on Tuberculosis & Lung Health
- World Health Organization. Global Tuberculosis Report 2024
- World Health Organization. Tuberculosis
⌂
15. Historial de actualizaciones
| 30 de agosto de 2018 | Actualización de los apartados epidemiología de la enfermedad; tipos de vacunas, composición y presentación; inmunogenicidad, eficacia y efectividad; indicaciones y esquemas de vacunación y efectos adversos. Nuevas citas bibliográficas. Nuevos enlaces de interés |
| 20 de enero de 2021 | Actualización de todos los apartados. Actualización de todas las figuras. Nuevas citas bibliográficas. Nuevos enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 24 de octubre de 2023 | Actualización de todos los apartados, excepto "Efectos adversos". Actualización de todas las figuras. Nuevas citas bibliográficas. Nuevos enlaces de interés |
| 8 de agosto de 2025 | Actualización de todos los apartados, excepto "Efectos adversos". Actualización de todas las figuras. Nuevas citas bibliográficas. Nuevos enlaces de interés |
-oOo-










