Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
43. Virus respiratorio sincitial
Capítulo 43 - Virus respiratorio sincitial
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de inmunización, composición y presentación
- Inmunogenicidad, eficacia y efectividad
5.1. Inmunogenicidad
5.2. Eficacia y efectividad
5.2.1. Palivizumab
5.2.2. Nirsevimab
5.2.2.1 Impacto del uso de nirsevimab
5.2.3. RSVPreF
7.1. Recomendaciones de uso en España de nirsevimab (Ponencia de Vacunas y Comisión de Salud Pública)
7.2. Recomendación en España acerca de RSVPreF (Ponencia de Vacunas y Comisión de Salud Pública)
7.3. Estrategias de inmunización frente al VRS en otros países
7.4. Recomendaciones de sociedades científicas sobre el uso de nirsevimab
- Efectos adversos
- Precauciones y contraindicaciones
- Interacciones con otros medicamentos
- Otras estrategias de inmunoprevención
11.1. Inmunización directa a recién nacidos y lactantes pequeños
11.2. Inmunización directa a lactantes mayores y niños pequeños
11.3. Inmunización directa para personas mayores de 60 años
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figuras incluidas en el capítulo:
Tabla 43.1. Eficacia de nirsevimab en los estudios clínicos preautorización
Figura 43.1. Estructura del virus respiratorio sincitial
Figura 43.2. Formación de los sincitios
Figura 43.3. Configuración de las formas pre-F y pos-F
Figura 43.4. Sitios antigénicos y capacidad de generar anticuerpos neutralizantes de las formas pre-F y pos-F
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Virus respiratorio sincitial. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-43
1. Puntos clave
- A pesar de la gran carga de enfermedad asociada al virus respiratorio sincitial (VRS), y después de más de 60 años de investigación, no existe todavía una vacuna autorizada. Sin embargo, contamos con dos anticuerpos monoclonales como medida de prevención mediante inmunización pasiva.
- Palivizumab, aprobado en 1998, está autorizado para su uso en pretérminos ≤35 semanas de gestación, y en niños menores de 2 años de edad con displasia broncopulmonar o con cardiopatía congénita hemodinámicamente significativa.
- Nirsevimab, aprobado por la EMA el 4 de noviembre de 2022, está autorizado para todos los recién nacidos y lactantes, tanto sanos como de riesgo, durante su primera temporada del VRS.
- Nirsevimab ha demostrado seguridad y eficacia en los estudios publicados, tanto en la prevención de infecciones del tracto respiratorio inferior atendidas medicamente como las que requieren hospitalización.
- La vida media prolongada de nirsevimab hace que, con una sola inyección intramuscular al inicio de la temporada, se cubra toda la estación del VRS. Además, puede ser coadministrado con cualquier vacuna pediátrica.
- Tras la campaña de inmunización con nirsevimab llevada a cabo en España en la temporada 2023-2024, los datos de efectividad e impacto demuestran una reducción del 75 % en los ingresos por enfermedad debida al VRS en menores de 12 meses, habiéndose evitado unas 10 000 hospitalizaciones.
- Está autorizada y disponible una vacuna (RSVPreF) indicada para la protección pasiva frente a la enfermedad del tracto respiratorio inferior causada por el VRS en los lactantes desde el nacimiento hasta los 6 meses de edad tras la inmunización materna durante el embarazo.
2. Introducción
El virus respiratorio sincitial (VRS) pertenece al género Orthopneumovirus, familia Pneumoviridae. Tiene dos grupos antigénicos principales de cepas, A y B, y múltiples genotipos dentro de los dos grupos.
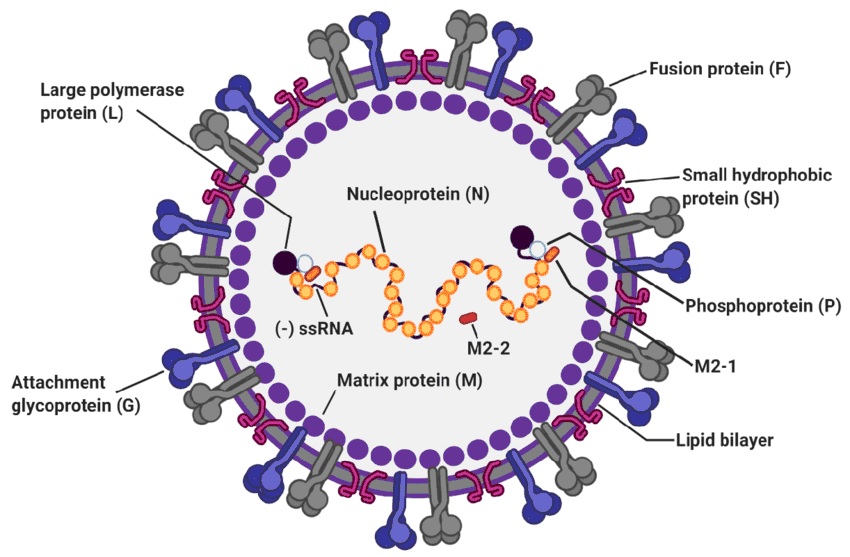
Para entender el mecanismo de actuación y la diana del virus frente a la que actúan los anticuerpos monoclonales y las futuras vacunas, conviene tener algunos conocimientos sobre la estructura viral (figura 43.1), que consta de genoma viral (ARN de cadena sencilla, con 10 genes que codifican 11 proteínas, 8 de ellas estructurales), nucleocápside y una envoltura lipídica donde se anclan 3 proteínas de membrana:
- Glucoproteína G, responsable de la adhesión a las células ciliadas de las vías respiratorias y las células planas de los alveolos pulmonares (neumocitos tipo 1). La variabilidad antigénica entre los grupos A y B está determinada por las diferencias en esta glicoproteína
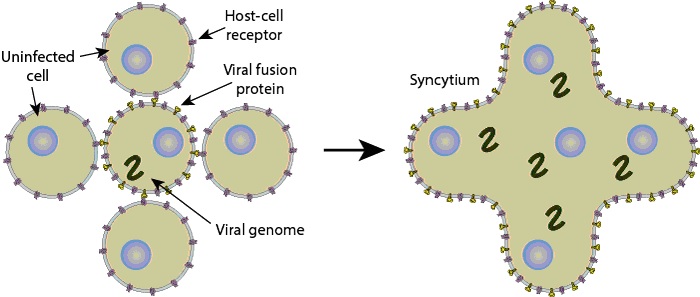
- Glucoproteína F, responsable de la fusión de las membranas virales y celulares, induciendo la destrucción de las membranas celulares, produciendo los característicos sincitios, que son grandes masas protoplasmáticas que contienen los numerosos núcleos celulares que pertenecían a las células intactas (figura 43.2)
- Proteína SH, cuya función es poco conocida actualmente
Figura 43.1. Estructura del virus respiratorio sincitial.
Tomada de Jung HI, et al. Viruses. 2020;12:102.
Figura 43.2. Formación de los sincitios.
Tomada de ViralZone
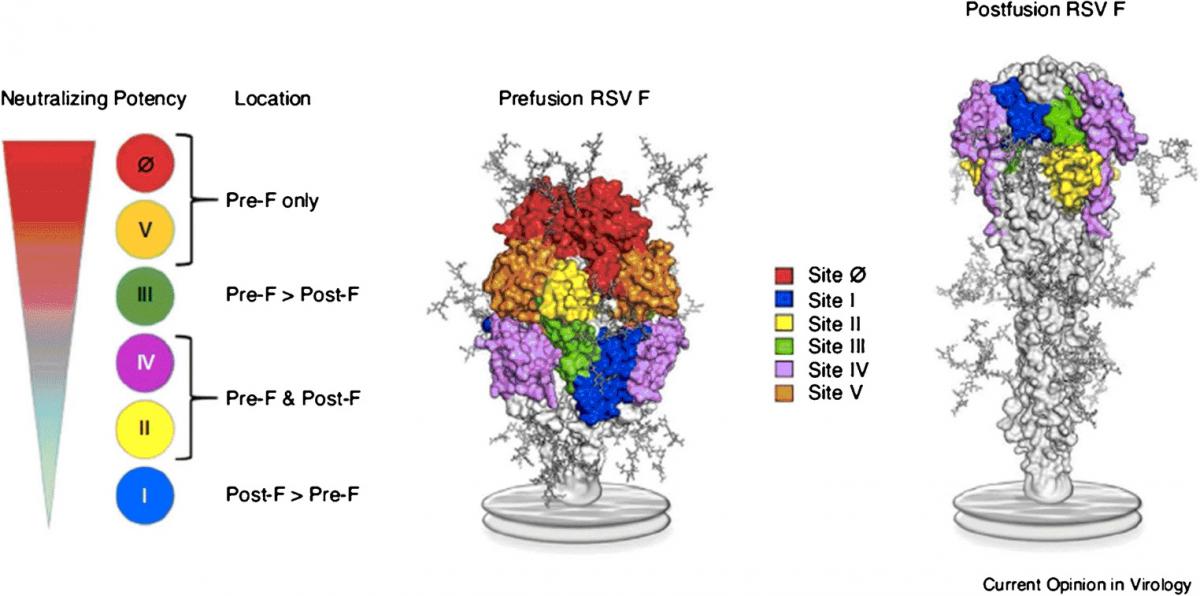
Las únicas proteínas que inducen anticuerpos neutralizantes son la glucoproteína F y la glucoproteína G, si bien la F es la diana preferida para el desarrollo de vacunas, anticuerpos monoclonales y antivirales, ya que juega un papel esencial en la entrada viral a la célula huésped, está altamente conservada dentro y entre los subtipos A y B del VRS, y debido a sus 6 sitios antigénicos provocan la producción de altas concentraciones de anticuerpos neutralizantes (≥90 % de estos se dirigen contra esta proteína).
La glucoproteína F, a su vez, se puede presentar adoptando dos conformaciones espaciales diferentes en el mismo virus (figura 43.3):
- Prefusión (pre-F): cuando predomina esta forma, el virus adopta una forma filamentosa, convirtiéndole en altamente infectivo. De los 5 principales sitios de neutralización (Ø, II, III, IV y V) presentes en la superficie pre-F, Ø y V son los más sensibles al reconocimiento por parte de inmunoglobulinas al ser los que están más expuestos. Los anticuerpos que se unen a la proteína en esta conformación resultan ser los más potentes, tanto en términos de neutralización, como de avidez (figura 43.4).
- Posfusión (pos-F): forma predominante en la configuración esférica del VRS, sin exposición de los sitios antigénicos superiores Ø y V que son objetivo de anticuerpos neutralizantes, lo cual ayuda al virus a evadir al sistema inmune. Una vez plegada, no puede volver a la configuración pre-F (figura 43.4).
Figura 43.3. Configuración de las formas pre-F y pos-F.
Tomada de Ruckwardt TJ, et al. Immunity. 2019;51:429-42.
Figura 43.4. Sitios antigénicos y capacidad de generar anticuerpos neutralizantes de las formas pre-F y pos-F.
Tomada de Graham BS. Curr Opin Virol. 2017;23:107-12.
3. Epidemiología de la enfermedad
El VRS es el principal agente productor de infección respiratoria a nivel mundial, de distribución universal y con carácter estacional, con una incidencia máxima en el hemisferio norte entre noviembre y febrero. Las infecciones por VRS del subgrupo A tienen una mayor incidencia y una mayor transmisibilidad que las del grupo B, aunque ambos son detectables durante la misma temporada epidémica.
En menores de 5 años, una revisión sistemática estimó que, globalmente, el VRS originó en 2019 unos 33 millones de infecciones respiratorias del tracto inferior (IRTI) (tasa de incidencia mundial estimada de 94,6 por 1000 lactantes al año), 3,6 millones de hospitalizaciones (tasa de 15,9 ingresos por 1000 lactantes al año), unas 26 300 muertes intrahospitalarias y unos 101 000 fallecimientos totales atribuibles al VRS (el 2,2 % de muertes en el mundo en este grupo de edad son debidas al VRS, es decir, uno de cada 50 fallecimientos). Tanto las hospitalizaciones como las muertes fueron más frecuentes en los menores de 6 meses de edad: 6,6 millones de IRTI, con 1,4 millones de ingresos hospitalarios (60 % fueron de menores de 3 meses), 13 300 muertes intrahospitalarias y unas 45 700 muertes (el 0,7 % de muertes en el mundo hasta los 28 días de vida son atribuibles al VRS; entre los 28 días y los 6 meses de edad, el 3,6 %, es decir, uno de cada 28 fallecimientos). Por cada muerte intrahospitalaria por IRTI asociada al VRS, se estima que en la comunidad ocurren aproximadamente tres muertes más atribuibles al VRS. Más del 95 % de los episodios de IRTI y más del 97 % de las muertes atribuibles al VRS en todas las franjas de edad ocurrieron en países con menor índice de desarrollo humano (Li Y, 2022).
En otra revisión sistemática y metanálisis sobre la carga global de enfermedad en prematuros, se estima que el VRS en 2019 produjo en este grupo unos 1 650 000 episodios de IRTI, 533 000 hospitalizaciones y unos 26 750 fallecimientos, de los que unos 3050 fueron intrahospitalarios. La tasa de incidencia de IRTI-VRS y de hospitalización fueron significativamente más altas que para los nacidos a término. En el segundo año de vida, los prematuros y los que fueron a término tuvieron una tasa de incidencia de IRTI similar, pero aun así la tasa de hospitalización en los que fueron prematuros fue significativamente mayor (RR 2,26). Los prematuros tardíos tuvieron tasas de incidencia de IRTI-VRS similares a las de los menores de 1 año, pero la tasa de hospitalización fue más alta en los primeros 6 meses (RR 1,93) que los nacidos a término. En general, los prematuros representaron el 25 % de las hospitalizaciones por IRTI-VRS. La tasa de letalidad intrahospitalaria en prematuros fue similar a la de todos los lactantes. Los factores asociados con infecciones graves fueron: cardiopatías congénitas, traqueostomía, displasia broncopulmonar, enfermedad pulmonar crónica o síndrome de Down, con OR entre 1,40 y 4,23 (Wang X, 2024).
El Centro Europeo para la Prevención y el Control de Enfermedades (ECDC) publicó el 12 de diciembre de 2022 un documento de evaluación de riesgos, advirtiendo de la alta probabilidad de que se observara un incremento significativo en la presión asistencial sobre los sistemas de salud de la UE/EEE en las siguientes semanas y meses, debido al aumento en las hospitalizaciones pediátricas por VRS desde finales de octubre de 2022, a partir de la semana 47, siendo la incidencia mayor y de aparición más temprana que en el período previo a la pandemia, coincidiendo además con la circulación simultánea de otros patógenos respiratorios como el virus de la gripe y el SARS-CoV-2.
Afecta al 60 % de los niños menores de 1 año y casi al 100 % de los menores de 2 años, en ocasiones más de una vez en cada temporada. Constituye una de las principales causas de consulta en atención primaria y urgencias pediátricas, además de la principal causa de hospitalización en los periodos de máxima incidencia. Prácticamente el 70 % de las hospitalizaciones por bronquiolitis se deben al VRS. Según un reciente estudio, en Europa ingresan uno de cada 56 menores de 2 años que fueron recién nacidos a término debido a infección por VRS. Supone la 2.ª causa de mortalidad de causa infecciosa a nivel global en niños de 1 a 12 meses, solo por detrás del paludismo. Además, cada vez se describe más su impacto en la población adulta, especialmente en mayores de 65 años, donde el VRS es responsable de aproximadamente 1,5 millones de episodios de infección respiratoria de vías bajas.
En un estudio retrospectivo realizado en España donde se analiza la carga de enfermedad durante un período de 9 años (2004-2012), las hospitalizaciones anuales por bronquiolitis por VRS en menores de 1 año oscilaron entre 6390 y 8637. Más del 98·% de ellas ocurrieron en lactantes sin factores de riesgo (fundamentalmente menores de 3 meses); sin embargo, la presencia de alguno de los siguientes antecedentes: prematuridad, enfermedad pulmonar crónica, síndrome Down, cardiopatía congénita o enfermedad neuromuscular, se asoció con una mayor mortalidad intrahospitalaria, estimada en 90 casos por cada 100 000. En otro trabajo español recientemente publicado (estudio BARI), en el que se analizaron datos longitudinales de septiembre de 2017 a junio de 2018 de 51 292 niños <5 años de dos comunidades autónomas españolas, el coste sanitario directo medio por caso de bronquiolitis atendido médicamente fue de 1753 euros en el primer año de vida, 896 euros en el segundo, y 683 euros entre los 2 y los 5 años. La mayor parte de los costes se correspondieron con los derivados de la hospitalización. En los casos específicos de VRS, el coste sanitario directo medio por caso atendido médicamente fue mayor, debido sobre todo a la hospitalización: 3362 euros en el primer año de vida, 3252 euros en el segundo y 3514 euros entre los 2 y los 5 años.
4. Tipos de inmunización, composición y presentación
Actualmente están aprobados 2 anticuerpos monoclonales para la prevención pasiva de la enfermedad por VRS: palivizumab (Synagys, 1998) y nirsevimab (Beyfortus, aprobado por la Comisión Europea el 31 de octubre de 2022, y por la FDA el 17 de julio de 2023).
- Palivizumab es un anticuerpo monoclonal IgG1 humanizado producido por tecnología de ADN recombinante en células huésped de mielomas de ratón, que contiene un 95 % de secuencia genética idéntica a la humana, y el 5 % restante de origen murino. Actúa uniéndose a la proteína F del VRS, inhibiendo la fusión celular. Tiene una vida media de 20 días. Se presenta en viales de 0,5 ml (50 mg) y 1 ml (100 mg).
- Nirsevimab es un anticuerpo monoclonal humano de inmunoglobulina G1 kappa (IgG1κ) producido en células de ovario de hámster chino mediante tecnología de ADN recombinante, modificada con una sustitución triple de aminoácidos (YTE) en la región Fc para extender la semivida en suero, que está entre 85 y 117 días. Actúa uniéndose al sitio antigénico Ø de la proteína pre-F bloqueando la fusión celular. Se presenta en jeringa precargada de 0,5 ml (50 mg) y 1 ml (100 mg).
También está aprobada una vacuna de subunidades de proteína F prefusión recombinante bivalente, RSVPreF (Abrysvo), para la protección pasiva frente a la IRTI por VRS en los lactantes desde el nacimiento hasta los 6 meses de edad tras la inmunización materna durante el embarazo. Está compuesta por un antígeno de la proteína F prefusión del subgrupo A y otro del subgrupo B, producidos en células de ovario de hámster chino mediante tecnología de ADN recombinante. Se presenta en caja con un vial de polvo, una jeringa precargada con el disolvente, y un adaptador del vial a la jeringa.
5. Inmunogenicidad, eficacia y efectividad
5.1. Inmunogenicidad
Los niveles séricos alcanzados por ambos anticuerpos monoclonales son similares, pero la capacidad neutralizante de nirsevimab es, al menos, 50 veces mayor que palivizumab. En un análisis conjunto de los datos del ensayo en fase IIb (análisis explotratorio post-hoc -no preespecificado- tras completar el estudio) y del ensayo MELODY (fase III, análisis exploratorio preespecificado, en pretérminos >29 semanas de gestación, pretérminos tardíos y a término, sanos), se observó que los receptores de nirsevimab tenían niveles de anticuerpos neutralizantes 140 veces más altos que los basales en el día 31 y se mantuvieron 50 veces más altos en el día 151 y 7 veces más altos en el día 361. Estos niveles son significativamente más altos que los que se generan tras pasar la infección natural, o los transmitidos por la madre durante la gestación, que además declinan rápidamente (Wilkins D, 2023). Los niveles en lactantes con alto riesgo (con enfermedad pulmonar crónica, cardiopatía congénita y/o pretérminos de menos de 29 semanas de gestación) en su primera temporada de VRS son similares en el día 151 a los obtenidos en el estudio MELODY (Domachowske J) y también fueron estudiados en el ensayo de seguridad MEDLEY comparándolos con los obtenidos en los ensayos IIb y III, demostrando niveles de anticuerpos similares a los encontrados en los datos agrupados, y por encima del objetivo farmacocinético de más del 80 % del área debajo de la curva, tanto a nivel global (94 %) como en cada uno de los subgrupos: enfermedad pulmonar crónica (94 %), cardiopatía congénita (80 %) y extremadamente prematuros (94 %). Sobre la base de esos datos farmacocinéticos, se extrapoló que la eficacia de nirsevimab es similar en los lactantes de alto riesgo respecto a los sanos incluidos en los estudios (Simoes EAF 2023).
En el ensayo MEDLEY también se compararon los niveles y duración de anticuerpos producidos por palivizumab y nirsevimab, en una temporada (pretérminos 29 a 35 semanas de gestación, con seguimiento hasta el día 361) o dos temporadas (pacientes con enfermedad pulmonar o cardiopatía congénita, con segumiento en cada temporada hasta el día 361). En la primera temporada, la aleatorización fue 2:1 (nirsevimab:palivizumab), mientras que en la temporada 2, los que habían recibido palivizumab se aleatorizaron 1:1 para recibir palivizumab o nirsevimab; a los que en la temporada 1 se les administró nirsevimab, en la segunda recibieron otra dosis de este anticuerpo monoclonal. Los resultados muestran que en la temporada 1, los niveles de Ac en los receptores de nirsevimab fueron más altos en las muestras del día 31 y disminuyeron gradualmente, pero se mantuvieron 17 veces por encima del valor inicial en el día 361; en los receptores de palivizumab, los niveles de Ac aumentaron gradualmente con dosis mensuales hasta el día 151. Los niveles de ambos Ac siguieron patrones similares en la temporada 2. Como conclusiones del estudio, nirsevimab obtuvo niveles aproximadamente 10 veces mayores que palivizumab en ambas temporadas, siendo además más sostenidos tras 1 año de la dosis en comparación con palivizumab (Wilkins D 2024).
Respecto a RSVPreF, en el estudio fase IIb (SAVVY), diseñado para analizar la seguridad e inmunogenicidad en embarazadas sanas de 18 a 49 años, se muestra que la vacuna genera una respuesta inmune en la embarazadas y una transmisión de anticuerpos eficiente, con una persistencia de estos en el lactante hasta los 6 meses de vida (Simoes EAF, 2022).
5.2. Eficacia y efectividad
5.2.1. Palivizumab
El estudio IMpact-RSV, único ensayo clínico aleatorizado y controlado con palivizumab, en prematuros ≤35 semanas de gestación o con displasia broncopulmonar (DBP), señaló una reducción del riesgo relativo (RR) de hospitalización por VRS del 55 % (4,8 % en el grupo de palivizumab frente al 10,6 % en el grupo de placebo; p<0,001), y una reducción del riego absoluto (RA) del 5,8 %, es decir, que con cada 17 tratamientos se previene una hospitalización (NNT=17). Los prematuros sin DBP tuvieron una reducción del RR del 78 % en la hospitalización (1,8 % vs 8,1 %; p<0,01), y del RA del 6,3 % (NNT=16). En los prematuros con DBP, la reducción del RR fue del 39 % (7,9 % vs 12,8 %), mientras que la del RA fue del 4,9 % (NNT=20). Sin embargo, la gravedad de la enfermedad por VRS en niños hospitalizados, en términos de días de estancia en UCI y días de ventilación mecánica, no se modificó en los tratados con palivizumab, como tampoco la mortalidad..
La biblioteca Cochrane publicó en 2021 una revisión sistemática sobre el uso de palivizumab para la prevención de la infección grave por VRS en niños. Se incluyeron cinco estudios clínicos aleatorizados con un total de 3343 participantes, la mayoría en entorno ambulatorio en niños con un alto riesgo de infección por VRS debido a comorbilidades como la displasia broncopulmonar y la cardiopatía congénita, aunque un estudio también incluyó a lactantes hospitalizados, en los que se compara palivizumab, placebo o ninguna intervención. Los principales resultados fueron: palivizumab reduce la hospitalización debida a VRS en un 56 % (RR 0,44; IC95 %: 0,30 a 0,64), pero tiene poca repercusión en la mortalidad en comparación con placebo o ninguna intervención a los dos años de seguimiento (RR 0,69; IC95 %: 0,42 a 1,15), poca o ninguna diferencia en los eventos adversos en comparación con placebo o ninguna intervención a los 150 días de seguimiento (RR 1,09; IC95 %: 0,85 a 1,39), y solo una ligera reducción (22 %) en la hospitalización debido a enfermedades de las vías respiratorias en comparación con placebo o ninguna intervención a los dos años de seguimiento (RR 0,78; IC95 %: 0,62 a 0,97). Palivizumab reduce la tasa de infección por VRS en un 67 % a los dos años de seguimiento (RR 0,33; IC95 %: 0,20 a 0,55), y la tasa diaria de sibilancias un 61 % en comparación con placebo o ninguna intervención al año de seguimiento (RR 0,39; IC95%: 0,35 a 0,44). Sin embargo, hay una diferencia escasa o nula en los días de uso de oxígeno, la duración de la estancia en la unidad de cuidados intensivos o los días de ventilación mecánica.
5.2.2. Nirsevimab
Nirsevimab ha demostrado eficacia y seguridad en los ensayos clínicos realizados. Los primeros datos publicados fueron del estudio fase IIb (Griffin MP, 2020) (tabla 43.1) realizado en pretérminos sanos entre 29 y 34 semanas de gestación, desde noviembre de 2016 hasta noviembre de 2017. A un total de 1453 lactantes se les asignó aleatoriamente recibir nirsevimab (969) o placebo (484) al comienzo de la temporada de VRS. La incidencia de infección respiratoria del tracto inferior (IRTI) debida al VRS atendida médicamente en los 150 días posteriores a su administración fue menor en el grupo que recibió nirsevimab (2,6 % [25 lactantes]) que en el de placebo (9,5·% [46 lactantes]), con una eficacia del 70,1 % (intervalo de confianza (IC95 %, 52,3 a 81,2) (p<0,001), así como la incidencia de hospitalización: 0,8 % (8 lactantes) en el grupo que recibió nirsevimab frente al 4,1 % (20 lactantes) en el grupo de placebo, con una eficacia calculada del 78,4 % (IC95 %: 51,9 a 90,3) (p<0,001). Estas diferencias fueron consistentes en todas las ubicaciones geográficas y subtipos A o B del VRS. Los eventos adversos fueron similares en los dos grupos, sin reacciones de hipersensibilidad notables.
En la tabla 43.1 se muestra un resumen de los datos publicados de estos estudios.
Tabla 43.1. Eficacia de nirsevimab en los estudios clínicos preautorización.
| Fase estudio (publicación de resultados) |
Población incluida en ensayo | Eficacia frente a enfermedad por VRS en los 150 días tras inmunización | ||
| Atendida médicamente | Hospitalización | Enfermedad grave | ||
| IIb (Griffin MP, 2020) |
RNPT sanos 29-34 sg | 70,1 % (IC95 %: 52,3 a 81,2) |
78,4 % (IC95 %: 51,9 a 90,3) |
— |
| III MELODY (1·cohorte) (Hammitt Ll, 2022) |
RNPT sanos 35-37 sg RN a término sanos |
74,5 % (IC95 %: 49,6 a 87,1) |
62,1 % (IC95 %: -8,6 a 86,9) |
— |
| IIb + III (1 cohorte) (Simoes EAF, 2023) |
RNPT sanos 29-37 sg RN a término sanos |
79,5 % (IC95 %: 65,9 a 87,7) |
77,3 % (IC95 %: 50,3 a 89,7) |
86,0 % (IC95 %: 62,5 a 94,8) |
| III MELODY (2·cohortes) (Muller WJ, 2023) |
RNPT sanos 35-37 sg RN a término sanos |
76,4 % (IC95 %: 62,3 a 85,2) |
76,8 % IC95 %: 49,4 a 99,4) |
78,6 % (IC95 %: 48,8 a 91,0) |
Tabla de elaboración propia a partir de los estudios publicados (referencias disponibles en el apartado de bibliografía). El grupo control recibió placebo.
Los primeros datos publicados fueron del estudio fase IIb (Griffin MP, 2020). A un total de 1453 lactantes se les asignó aleatoriamente recibir nirsevimab (969) o placebo (484) al comienzo de la temporada del VRS. La incidencia de infección respiratoria del tracto inferior (IRTI) debida al VRS atendida médicamente en los 150 días posteriores a su administración fue menor en el grupo que recibió nirsevimab (2,6 % [25 lactantes]) que en el de placebo (9,5 % [46 lactantes]), con una eficacia del 70,1 % (p<0,001), así como la incidencia de hospitalización: 0,8 % (8 lactantes) en el grupo que recibió nirsevimab frente al 4,1 % (20 lactantes) en el grupo de placebo, con una eficacia calculada del 78,4 % (p<0,001). Estas diferencias fueron consistentes en todas las ubicaciones geográficas y subtipos A o B del VRS. Los eventos adversos fueron similares en los dos grupos, sin reacciones de hipersensibilidad notables. El NNI calculado con estos datos para evitar un caso de IRTI por VRS atendida médicamente fue de 14, y de 30 para la hospitalización.
Tras el estudio de fase IIb de nirsevimab, en el que todos los lactantes recibieron una dosis fija de 50 mg, los análisis farmacocinéticos y de exposición-respuesta al fármaco indicaron que esta dosis no era la óptima en lactantes que pesaban 5 kg o más. Este hallazgo condujo al desarrollo del régimen de dosificación según el peso de 50 mg para lactantes de <5 kg y de 100 mg para lactantes de ≥5 kg, que posteriormente se utilizó para el estudio de fase III MELODY.
En el ensayo MELODY, realizado durante 2019 y 2020 en 1490 pretérminos tardíos (entre 35 y 37 semanas de gestación) y recién nacidos a términos sanos, de los que 994 recibieron nirsevimab y 496 placebo, se observó una eficacia en la prevención de IRTI por VRS que requirió atención médica del 74,5 %, y del 62,1 % para prevenir el ingreso hospitalario en los 150 días posteriores a la administración de nirsevimab, con un excelente perfil de seguridad. No se obtuvo significación estadística en este segundo objetivo (prevención de hospitalizaciones) por la baja incidencia de ingresos por VRS durante la pandemia por SARS-CoV-2, lo que motivó que se suspendiera el reclutamiento (Hammitt Ll, 2022). El NNI calculado con estos datos para evitar un caso de IRTI por VRS atendida médicamente fue de 26, y de 100 para la hospitalización.
Los datos combinados de los estudios fase IIb (pretérminos entre 29 y 34 semanas de gestación) y la primera cohorte del MELODY (pretérminos ≥35 semanas de gestación y a término) fueron publicados en 2023 (Simoes EAF). Este análisis estaba preespecificado en el protocolo desde el inicio del desarrollo clínico. Se incluyeron los datos de 2350 lactantes (todos los de MELODY, y los participantes en el fase IIb que recibieron 50 mg pesando menos de 5 kg, emparejados 2:1 con participantes que recibieron placebo, excluyéndose los que recibieron esa dosis pero pesaban ≥5 kg, ya que los análisis farmacocinéticos y de exposición-respuesta tras el ensayo indicaron que esta dosis no era la óptima en esos lactantes); del total, 1564 recibieron nirsevimab y 786 placebo. Los resultados de eficacia se muestran en la tabla 43.1. El NNI calculado con estos datos para evitar un caso de IRTI por VRS fue de 19 para IRTI atendida médicamente, de 48 para la hospitalización y de 50 para enfermedad grave. El NNI calculado para evitar un caso de IRTI por cualquier causa atendida médicamente fue de 15, y de 35 para la hospitalización. Sobre la base de datos farmacocinéticos, un grado de eficacia similar fue extrapolado a lactantes nacidos extremadamente prematuros, con enfermedad pulmonar crónica o enfermedad cardíaca congénita.
Tras aprobar la FDA el reinicio del reclutamiento en 2021, se reanudó el estudio MELODY, incluyéndose otros 1522 sujetos (segunda cohorte), que se sumaron a los 1490 de la primera cohorte, para un total de 3012, de los que 2009 recibieron nirsevimab y 1003 placebo. La eficacia en la prevención de infecciones que requirieron atención médica fue del 76,4 %, del 76,8 % para prevenir el ingreso hospitalario, y del 78,6 % para prevenir ingresos en UCI (Muller WJ). El NNI calculado con estos datos para evitar un caso de IRTI por VRS fue de 23 para IRTI atendida médicamente, de 62 para hospitalización y de 71 para enfermedad grave.
En octubre de 2022 se presentaron al ACIP los datos combinados sumando los estudios Fase IIb y MELODY ALL (Felter C, 2022): eficacia en la prevención de infecciones que requirieron atención médica del 79,0 % (IC95 %: 68,5 a 86,1), del 80,6 % (IC95 %: 62,3 a 90,1) para prevenir el ingreso hospitalario y del 86,2 % (IC95 %: 68,1 a 94,0) para prevenir ingresos en UCI. Estos datos, ofrecidos por la compañía fabricante, no han sido publicados.
En la reunión del ACIP del 23 de febrero de 2023, el resultado de eficacia para prevenir ingresos en UCI se modificó al 90,0 %, aunque con un intervalo de confianza más amplio (IC95 %: 16,4 a 98,8). El grupo de trabajo concluyó con una recomendación favorable al uso de nirsevimab para todos los recién nacidos y lactantes menores de 8 meses en su primera temporada del VRS (Jones J, 2023). El NNI calculado con estos datos para evitar un caso de IRTI por VRS es de 20 para IRTI atendida médicamente, de 47 para la hospitalización y de 52 para enfermedad grave.
Los resultados de los análisis primarios del estudio fase IIIb HARMONIE (Hospitalized RSV Monoclonal Antibody Prevention) llevado a cabo en 235 centros de Francia, Alemania y Reino Unido durante la temporada de VRS 2022-2023, en condiciones similares a las que se usaría nirsevimab en la práctica real, fueron publicados a finales de 2023 (Drysdale). El objetivo primario fue determinar la eficacia y la seguridad de una dosis de nirsevimab (<5 kg 50 mg; ≥5 kg 100 mg), en comparación con ninguna intervención (cuidados estándar), para la prevención de hospitalizaciones por IRTI relacionadas con el VRS en lactantes menores de 12 meses que no fueron elegibles para recibir palivizumab. Se incluyeron 8058 lactantes de hasta 12 meses de edad (4037 recibieron nirsevimab y 4021 cuidados estándar) que fueron a término o prematuros ≥29 semanas de gestación, mostrando los siguientes resultados principales de eficacia durante el seguimiento (3 meses de media) tras su administración: 83,21 % (IC95 %: 67,77 a 92,04; p <0,001) para hospitalizaciones debidas al VRS (11 casos en grupo de nirsevimab, 60 en el otro grupo); 75,71 % (IC95 %: 32,75 a 92,91, p=0,004) frente a hospitalizaciones de casos graves debidos al VRS (5 casos en grupo de nirsevimab, 19 en el otro grupo), y 58,04 % (IC95 %: 39,69 a 71,19) para hospitalizaciones por IRTI debida a cualquier causa (45 casos [1,1 %] en el grupo de nirsevimab y 98 [2,4 %] en el grupo de cuidados estándar). Con estos datos, el NNI calculado es de 82 para evitar una hospitalización y de 285 para evitar una hospitalización con cuadro grave. El perfil de seguridad ha sido favorable y consistente con los datos ya presentados en los diferentes estudios pivotales. Los resultados finales del estudio han sido remitidos para publicación, pendientes de revisión (Munro APS 2025), y muestran una eficacia a los 180 días para hospitalización por IRTI-VRS del 82,7 % (IC95 %: 67,8 a 91,5; p<0,0001), siendo del 75.3 % (IC95 %: 38.1 a 91.8; p=0.0013) para los cuadros graves, y del 41,9 % (IC95 %: 23,1 a 56,3; p<0,0001) para IRTI por cualquier causa.
En un análisis exploratorio post-hoc del estudio MELODY se examinó la incidencia de IRTI por VRS y otros patógenos respiratorios hasta el día 511. Se detectaron infecciones VRS y no VRS en 193/852 (22,7 %) de los participantes que recibieron nirsevimab y 551/852 (64,7 %) de los que recibieron placebo. Las tasas de infección por VRS fueron menores con nirsevimab en comparación con placebo, incluidas las coinfecciones por VRS-rinovirus/enterovirus. Las tasas de otras infecciones virales fueron similares entre los brazos del estudio. Aproximadamente el 70 % de las infecciones únicas por VRS y las coinfecciones por VRS se consideraron leves, mientras que el 26,2 % de las infecciones únicas por VRS y el 24,5 % de las coinfecciones por VRS requirieron hospitalización. Como conclusión, los autores manifiestan que nirsevimab protegió contra infecciones únicas y coinfecciones por VRS, sin evidencia de sustitución del VRS por otros virus respiratorios (Arbetter E, 2024).
5.2.2.1. Impacto del uso de nirsevimab
La efectividad e impacto del uso de nirsevimab en vida real en la temporada 2023-2024 ha sido confirmado en muchas publicaciones, entre las que destacan:
- En España, donde se administraron más de 277 000 dosis con una cobertura una media del 92 % en los nacidos durante la temporada y del 88 % en los nacidos antes de comenzar la misma, un estudio del Ministerio de Sanidad junto a las CC. AA., basado en un modelo sobre datos del sistema de vigilancia centinela de infecciones respiratorias agudas (SIVIRA) para estimar el impacto de la administración de nirsevimab a los niños nacidos a partir del 1 de abril de 2023 frente a hospitalizaciones por VRS entre las semanas 40 de 2023 y 8 de 2024, en comparación con lo que se hubiera esperado con referencia al mismo período en la temporada 2022/23, estimó una reducción del 71-75 % en los ingresos por enfermedad debida al VRS en menores de 12 meses, habiéndose evitado teóricamente entre 7510 y 10 213 hospitalizaciones (Mazagatos C, 2024)
- En un estudio poblacional de casos y controles a nivel nacional, la efectividad por protocolo para prevenir la hospitalización por VRS en nacidos en temporada fue del 83,1 % (IC95 %: 78,5 a 86,8), y del 80,3 % (IC95 %: 75,3 a 84,4) para nacidos antes de temporada, mientras que la efectividad por intención de tratar fue del 78,0 % (IC95 %: 72,7 a 82,3) y 71,0 % (IC95 %: 64,6 a 76,2), respectivamente. La efectividad fue similar en ambos grupos para ingreso en UCI, necesidad de ventilación mecánica, o según el subgrupo de VRS. La efectividad por protocolo fue menor en los niños varones (sólo en nacidos en temporada; 79,2 %), los nacidos prematuros (65,8 % en nacidos en temporada, 61,5% en grupo de recuperación) o con bajo peso al nacer (65,8 % y 66,9 %, respectivamente), o nacidos de embarazos múltiples (72,8 % y 52,8 % respectivamente) (Nuñez O, 2025)
- En Galicia, la efectividad global fue del 82,0 % (IC95 %: 65,6 a 90,2), siendo del 86,9 % (69,1 a 94,2) contra las IRTI-VRS graves que requirieron soporte de oxígeno, y del 69,2 % (55,9 a 78,0) contra las hospitalizaciones por IRTI por todas las causas y del 66,2% (56,0–73,7) frente a las hospitalizaciones por todas las causas. No se pudo estimar la eficacia de nirsevimab frente a otros criterios de valoración de IRTI-VRS graves debido a que hubo muy pocos eventos. Las hospitalizaciones por IRTI relacionadas con el VRS se redujeron en un 89,8 % (rango intercuantílico IQR 87,5 a 90,3), y el número necesario de inmunizaciones para evitar una hospitalización por IRTI-VRS fue de 25 (IQR 24 a 32) (Ares-Gómez S, 2024)
- El análisis final del estudio Nirse-Gal de la temporada 2023-2024, muestra que en Galicia el 92,0 % de los lactantes elegibles recibieron nirsevimab (88,5 % de los nacidos antes de temporada, 95,3 % de los nacidos en temporada). En cuanto a la efectividad, en el análisis por intención de tratar, fue del 70,7 % (IC95 %: 42,4 a 85,1) y del 80,3 % (IC95 %: 54,6 a 91,5) frente a necesidad de oxígeno, mientras que, en el análisis por sensibilidad la efectividad frente a hospitalización fue del 81,6 % (IC95 %: 65,1 a 90,3) y frente a necesidad de oxigenoterapia del 86,5·% (IC95 %: 69,1 to 94,1). La eficacia contra la hospitalización por bronquiolitis o bronquitis por todas las causas fue del 46,0 % (IC95%: 6,8 a 68,7) y contra hospitalización por IRTI por todas las causas fue del 35,2 % (IC95 %: -3,8 a 59,6). Se observaron tasas acumuladas significativamente más bajas de hospitalizaciones por IRTI-VRS para la cohorte de recuperación, la cohorte estacional y para ambas cohortes combinadas que las de las temporadas anteriores (p<0,0001 para todas las comparaciones). El número necesario a inmunizar con nirsevimab para evitar una hospitalización por IRTI-VRS se calculó en 30 lactantes de la cohorte general, o 16 lactantes de la cohorte estacional (Mallah N, 2024).
- En un estudio donde se ha estimado la efectividad de nirsevimab frente a hospitalizaciones debidas al VRS en lactantes menores de 9 meses en tres comunidades autónomas españolas, se muestra que, con el método del cribado, la efectividad fue del 86,9 % en la Región de Murcia, del 69,3 % en la Comunidad Valenciana y del 97,0 % en Valladolid. En el análisis combinado de los datos de las tres regiones, la efectividad fue del 84,4 % (IC95 %: 76,8 a 90,0). Con el método de test-negativo, los datos agrupados de Comunidad Valenciana y Región de Murcia muestran una efectividad del 70,2 % (IC95 %: 38,3 a 88,5). Los resultados muestran que la inmunización con nirsevimab fue, al menos, un 70 % efectiva para prevenir las hospitalizaciones en ese grupo. Sin embargo, no mostró protección frente a las hospitalizaciones por IRTI no relacionadas con el VRS (López-Lacort M, 2024)
- En Cataluña, niservimab redujo en un 87,6 % los ingresos hospitalarios debidos al VRS, y un 90,1 % los ingresos en UCI. También hubo disminuciones en el número de bronquiolitis atendidas en atención primaria (48,1 %), infecciones por VRS (68,9 %), neumonía viral (60,7 %) y visitas a urgencias hospitalarias por bronquiolitis (55,4 %) (Coma M, 2024). También en Cataluña, con datos pendientes de revisión por pares, tras el uso de nirsevimab, el riesgo de IRTI-VRS en lactantes de 0 a 11 meses con respecto a los >35 meses se ha reducido en un 75,6 % (IC95 %: 73,4 a 77,5) con respecto a la temporada pasada, y el riesgo de bronquiolitis por todas las causas en niños de 12 a 35 meses. en un 61,9 % (60,9 a 62,9) con respecto al período prepandémico y en un 39,8 % (IC95 %: 39,3 a 40,2) respecto a la epidemia de la temporada 2022/2023, a pesar de una alta transmisión comunitaria del VRS, especialmente entre niños de ≥12 meses (Perramon-Malavez A, 2024)
- En Navarra, donde se ofreció nirsevimab al nacer a todos los niños nacidos entre octubre y diciembre de 2023, se realizó un estudio de cohorte poblacional en Navarra. El riesgo de hospitalización por VRS fue del 8,5 % entre los lactantes no inmunizados con nirsevimab frente al 0,7 % en inmunizados. La eficacia estimada fue del 88,7 % (IC95 %: 69,6 a 95,8). La inmunización al nacer de los lactantes evitó una hospitalización por cada 15,3 lactantes inmunizados. Los autores concluyen que si se inmunizara a los nacidos entre septiembre y enero se podría prevenir el 77,5 % de las hospitalizaciones por VRS (Ezpeleta G, 2024)
- En la Comunidad de Madrid, la eficacia ajustada frente a hospitalización fue del 93,6 % a los 30 días de la administración de nirsevimab y del 87,6 % a los 150 días, mientras que para ingreso en UCI fue del 94,4 % a los 30 días y del 92,1 % a los 90 días (Barbas JF, 2024). En un estudio prospectivo entre lactantes <1 año hospitalizados por IRTI en uno de los hospitales La Paz y Severo Ochoa de Madrid, se comparó la tasa de ingresos por virus respiratorios en la temporada 2022-23 con la de la temporada 2023-24 (donde su usó nirsevimab). En esta última, se observó una reducción de las hospitalizaciones de un 62,5 %, y un 74,5 % en los ingresos en UCI. Los lactantes ingresados en esa temporada eran mayores (p = 0,001) y tuvieron estancias hospitalarias más cortas (p < 0,001) que los de la temporada 2022-23: la probabilidad de hospitalización superior a 5 días disminuyó un 64,6 % en los menores de 3 meses y un 47,7 % en los menores de 6 meses. El uso de oxígeno de alto flujo fue menos frecuente entre los pacientes con VRS que recibieron nirsevimab (p = 0,002). Los ingresos por VRS, metapneumovirus humano y adenovirus disminuyeron un 78, 36,6 y 69,5 %, respectivamente (García-García ML, 2025).
- Un estudio retrospectivo realizado en 15 servicios de urgencias pediátricos españoles de 9 regiones diferentes entre las temporadas epidémicas de 2018 y 2024 (noviembre-enero) comparó las temporadas 2018-2023 con la temporada 2023-2024 con respecto al número de IRTI y bronquiolitis aguda, ingresos hospitalarios relacionados con bronquiolitis aguda y admisiones a UCIP. En la temporada 2023-2024, en comparación con las tasas promedio de las temporadas epidémicas anteriores se produjo una disminución del 57,7 % en los episodios de IRTI (IC95 %: 56,5 a 58,8; p <0,001), una disminución del 59,2 % en los episodios de bronquiolitis aguda (IC95 %: 57,9 a 60,4; p <0,001), una reducción del 63,1 % en los ingresos hospitalarios relacionados con bronquiolitis aguda (IC95 %: 60,9 a 65,2; p< 0,001) y una reducción del 63,1 % en las admisiones a UCIP (IC95 %: 58,1 a 67,9; p< 0,001). Los hospitales de las regiones que no inmunizaron a todos los menores que tenían menos de 6 meses al inicio de temporada, mostraron peores resultados (Andina D, 2024). La mayoría de los ingresos por bronquiolitis se produjeron en niños sanos mayores de 6 meses que no formaban parte de la población diana de la inmunización, lactantes elegibles que no fueron inmunizados y lactantes inmunizados con bronquiolitis no relacionada con el VRS. Entre los lactantes con bronquiolitis por VRS, no se observaron diferencias significativas en las tasas de ingreso en la UCIP ni en la duración de la estancia entre los vacunados y los no vacunados (Andina D, 2025).
- Un estudio observacional, retrospectivo y multicéntrico, analizó los datos recogidos en el Registro de Bronquiolitis de la SEUP (25 hospitales de 11 CC. AA.) y comparó un período de 26 días (entre el 1 y el 26 de diciembre) en las temporadas 2022 y 2023: el número de casos de bronquiolitis atendidos en urgencias disminuyó un 41,6 % (IC95 %: 34,9 a 48,2) y el de ingresos por bronquiolitis un 55,4 % (IC95 %: 46,6 a 64), mientras que los ingresos por VRS disminuyeron un 60,3 % (IC95 %: 51,9 a 68,7). Los ingresos en UCIP disminuyeron un 81,3% (IC95 %: 57,9 a 100%). Hubo una reducción del 60,9 % (IC95 %: 26,5 a 95,3) en la necesidad de oxigenoterapia de alto flujo entre los pacientes con bronquiolitis (Vázquez-López P, 2025).
- En el primer estudio publicado realizado en 2 comunidades autónomas (Comunidad Valenciana y Región de Murcia) únicamente en el ámbito de la pediatría de atención primaria se reclutaron a todos los bebés con IRTI, realizando una PCR para VRS. Se empleó un enfoque de diseño de prueba negativa para estimar la eficacia de nirsevimab. En el estudio participaron 160 lactantes, de los que 141 (88 %) había recibido nirsevimab. 128 pertenecían al grupo de inmunizados nacidos antes del inicio de la temporada (grupo de recuperación), de los que el 88 % recibió nirsevimab. En total, se detectaron 44 PCR positivas a VRS (27,5 %). Dentro del grupo de recuperación, 37 (28,9 %) dieron positivo para el VRS. La efectividad global fue del 75,8 % (IC95 %: 40,4 a 92,7) y del 80,2 % (IC95 %: 44,3 a 95,4) en los lactantes pertenecientes al grupo de recuperación (López-Lacort M, Pediatrics 2025)
- En Luxemburgo, un estudio publicado con datos hasta mitad de diciembre de 2023, se estima en un 69 % la disminución de las hospitalizaciones por VRS en menores de 6 meses (232 en 2022 versus 72 en 2023) con una cobertura del 84 % (1277 dosis/1524 nacimientos). La duración del ingreso hospitalario también se redujo significativamente (media de 5,6 días en 2022 frente a 3,4 días en 2023) (Ernst C, 2024)
- En EE. UU. se ha estimado que la efectividad de nirsevimab fue del 90 % (IC95 %: 75 a 96) frente a la hospitalización asociada al VRS en lactantes menores de 8 meses en su primera temporada de VRS. La mediana del tiempo desde la recepción de nirsevimab hasta la aparición de los síntomas fue de 45 días (IQR: 19 a 76) (Moline HL, MMWR, 2024). En un estudio de casos y controles con test negativo en menores de 5 años durante la temporada del VRS 2023-2024 en 7 centros pediátricos, la efectividad de nirsevimab fue del 89 % (IC95 %: 79 a 94) contra las IRTI-VRS atendidas médicamente y del 93 % (IC95 %: 82 a 97) frente a hospitalización asociada al VRS. Entre 229 muestras secuenciadas, no hubo diferencias en las mutaciones del sitio de unión de nirsevimab según el estado de recepción de nirsevimab (Moline HL, JAMA, 2024). En un análisis se compararon las tasas de hospitalización en niños <5 años en las temporadas 2024-25 y 2018-20 utilizando datos de la Red de Vigilancia de Hospitalizaciones Asociadas al VRS (RSV-NET) y la Red de Vigilancia de Nuevas Vacunas (NVSN); entre los de 0 a 7 meses (elegibles para la protección con vacunación materna o nirsevimab), las tasas de hospitalización asociadas al VRS en 2024-25 fueron más bajas en comparación con las tasas agrupadas en 2018-20, con reducciones relativas estimadas del 43 % (IC95 %: 40 a 46) (RSV-NET) y del 28 % (IC95 %: 18 a 36) (NVSN). La mayor reducción se observó en lactantes de 0 a 2 meses de edad (RSV-NET: 52 %, IC95 %: 49 a 56); NVSN: 45 %, IC95 %: 32 a 57 %) durante los períodos de máxima hospitalización (diciembre-febrero) (Patton ME, 2025). En un estudio de casos y controles con test negativo realizado en un departamento de emergencias de EE. UU., la EV estimada de nirsevimab fue del 68,4 % contra IRTI-VRS, del 80,5 % contra hospitalización por VRS y del 84,6 % contra la enfermedad grave por VRS. La efectividad estimada contra la infección por VRS disminuyó del 79,3 % a las 2 semanas después de la inmunización al 54,8 % a las 14 semanas después de la inmunización (Xu H, 2025). En un estudio retrospectivo del Kaiser Permanente Northern California (KPNC), la efectividad de nirsevimab fue del 87,2 % (IC95 %: 81,7 a 91,1 %) contra IRTI-VRS y del 98,0 % (IC95 %: 85,1 a 99,7) contra la hospitalización por IRTI-VRS. Los lactantes con IRTI-VRS inmunizados con nirsevimab tuvieron menos visitas médicas (diferencia de medias ajustada: -0,86; p = 0,001) y menor probabilidad de hospitalización (OR: 0,11; IC95 %:: 0,01 a 0,85) que los lactantes no inmunizados (Hsiao A, 2025)
- En Francia, en un estudio de casos y controles emparejado, multicéntrico y prospectivo para evaluar la eficacia del tratamiento con nirsevimab frente a la hospitalización por bronquiolitis asociada al VRS en menores de 12 meses realizado con datos entre el 15 de octubre y el 10 de diciembre de 2023, la eficacia ajustada frente a hospitalización fue del 83,0 % (IC95 %: 73,4 a 89,2), frente a ingreso en UCI del 69,6 % (42,9 a 83,8), y contra la IRTI-VRS que requirió soporte ventilatorio del 67,2 % (38,6 a 82,5) (Assad Z, 2024). En un estudio poblacional en el que se utilizó el Sistema Nacional de Datos de Salud sobre hospitalizaciones por VRS entre el 15 de septiembre de 2023 al 31 de enero de 2024 en lactantes elegibles para haber recibido nirsevimab, la EV frente a IRTI-VRS fue del 65 % (IC95 %: 61 a 69) para las hospitalizaciones, del 74 % (IC95%: 56 a 85) para ingresos en UCIP, del 66 % (IC95 %: 51 a 76) para requerir soporte ventilatorio y del 67 % (IC95 %: 57 a 75) para requerir oxigenoterapia (Jabagi MJ, 2025).
- Chile fue el primer país de Latinoamérica en administrar nirsevimab como parte de la campaña de invierno que comenzó el 1 de abril de 2024. Se ofreció la inmunización a los nacidos en temporada (1 abril al 30 de septiembre de 2024) y recaptación a los nacidos entre el 1 de octubre de 2023 y el 30 de marzo de 2024. La cobertura para esos grupos fue del 98,1 % y 90,3 %, respectivamente. Al finalizar la campaña se decidió ampliar la inmunización a los nacidos entre el 1 y el 31 de octubre de 2024. Mientras que en población elegible no inmunizada las hospitalizaciones por IRTI-VRS representaron el 82 % de las ocurridas en 2022, en inmunizados fueron solo el 9 % respecto a las de 2022. Respecto a ingresos en UCIP, en no inmunizados representaron el 74 % de las acontecidas en 2019, mientras que en inmunizados fueron el 13 % con respecto a 2019, el 10% de las de 2022, y el 5% de las de 2023. Los días de estancia media en hospitalizados fue de 3,62 días en inmunizados y de 4,61 días en no inmunizados (p=0.0002) (Ministerio de Salud de Chile, 2024). Los datos del estudio NIRSE-CL, que incluyó 154 173 lactantes con una cobertura del 94 %, muestran que la efectividad combinada fue del 76,4 % frente a hospitalización por IRTI-VRS, del 84,9 % frente a ingreso en UCI por VRS, del 66,5 % frente a hospitalización por IRTI de cualquier causa, y del 47,9 % frente a las hospitalizaciones por todas las causas. Se estimó una reducción del 77,5 % en hospitalizaciones por IRTI-VRS y se evitaron 30 casos por cada 1000 lactantes inmunizados, con un número necesario a inmunizar para prevenir un ingreso por IRTI-VRS de 35. No se registraron muertes por VRS en lactantes inmunizados durante 2024, frente a 13 muertes en 2023 (Torres JP, 2025)
- En una revisión sistemática y metaanálisis se identificaron y analizaron 1238 registros, de los cuales 32 eran estudios de cohortes y de casos y controles de cinco países (Francia, Italia, Luxemburgo, España y EE.·UU.) que se incluyeron en la revisión sistemática y 27 en el metaanálisis. Nirsevimab se asoció con una menor probabilidad de hospitalización relacionada con el VRS (odds ratio [OR]: 0,17; IC95 %: 0,12 a 0,23), una menor probabilidad de ingreso en la UCI (OR 0,19; IC95 %: 0,12 a 0,29) y una menor probabilidad de incidencia de IRTI (OR 0,25; IC95 %: 0,19 a 0,33) en lactantes de 0 a 12 meses. Sin embargo, la duración de la estancia hospitalaria no difirió entre los grupos de nirsevimab y control (diferencia de media ponderada: 0,01; IC95 %: -0,63 a 0,65) (Sumsuzzman DM 2025).
5.2.3. RSVPreF
En abril de 2023 fueron publicados los resultados de un ECA doble ciego en fase 3 (estudio MATISSE) en embarazadas de 49 años o menos años, que entre las 24 y 36 semanas de gestación recibieron una inyección intramuscular única de 120 μg de proteína F de prefusión de RSV bivalente (RSVpreF) o placebo. El estudio fue realizado durante la pandemia covid, y se excluyeron embarazos de alto riesgo (riesgo de parto prematuro, embarazo múltiple o hijo anterior con una anomalía congénita clínicamente significativa). El seguimiento a sus hijos se realizó entre 12 y 24 meses tras el nacimiento. Los criterios de valoración principales de la eficacia fueron: IRTI atendida médicamente e IRTI grave asociada al VRS en lactantes dentro de los 90, 120, 150 y 180 días después del nacimiento. Se consideró que un límite inferior del intervalo de confianza (IC) superior al 20 % cumplía el criterio de éxito de la eficacia de la vacuna. La eficacia vacunal (EV) para infección respiratoria del tracto inferior (IRTI) atendida médicamente en el lactante fue del 57,1 % en los primeros 90 días de vida, siendo 14,7 el límite inferior del IC, por lo que no se cumplió el criterio primario de eficacia y del 51,3 % hasta los 180 días, siendo el NNI (número necesario de embarazadas a inmunizar para evitar un caso en sus hijos) calculado con los datos aportados en el estudio es de 111 y 55, respectivamente. Para IRTI grave, la EV fue del 81,8 % en los primeros 90 días y del 69,4 % hasta los 180 días, siendo el NNI calculado de 142 y 77, respectivamente. La vacunación materna con RSVpreF no evitó en sus hijos la enfermedad de las vías respiratorias inferiores atendida médicamente por cualquier causa (no solo por VRS) dentro de los 90 días (eficacia 7,0 %; IC99,17 %: −22,3 a 29,3) o 180 días (eficacia 2.5 %; IC99,17 %: –17,9 a 19,4) posteriores al nacimiento (Kampmann B, 2023). En el análisis final del estudio, la EV frente a IRTI grave fue del 82,4 % (IC95 %: 57,5 a 93,9) en los primeros 90 días de vida, y del 70,0 % (IC95 %: 50,6 a 82,5) en los 180 días posteriores al nacimiento. En cuanto a IRTI atendida medicamente, la EV fue del 57,6 & (IC95 %: 31,3 a 74,6) y del 49,2 % (IC95 %): 31,4 a 62,8) en los 90 y 180 primeros días de vida, respectivamente. Los resultados finales de seguridad en embarazadas, recién nacidos y lactantes fueron consistentes con el análisis primario sin que se identificaran nuevos problemas de seguridad (Simões EAF, 2025).
En Argentina, en 2024, se realizó una campaña entre el 1 de marzo y el 31 de agosto para la vacunación de las gestantes entre las 32 y 36 semanas de gestación. Con datos del Ministerio de Salud, la cobertura en esta primera temporada ha sido del 61,9 %, y se estima que se han producido unos 50 000 casos menos de bronquiolitis que en 2023 (Juarez MV). Los datos de hospitalización por IRTI-VRS entre el 1 de abril y el 30 de septiembre de 2024 en lactantes menores de 6 meses ofrecidos por el estudio BERNI (estudio de 3 temporadas, multicéntrico, retrospectivo, de casos y controles con test negativo) en 12 hospitales han mostrado que la EV frente a hospitalización fue del 78,6 % (IC95%: 62,1 a 87,9) desde el nacimiento hasta los 3 meses de edad y del 71,3% (IC95 %: 53,3 a 82,3) desde el nacimiento hasta los 6 meses de edad. La efectividad contra la IRTI-VRS grave fue del 76,9 % (IC95 %: 45,0 a 90,3) desde el nacimiento hasta los 6 meses de edad. Se produjeron tres muertes hospitalarias asociadas al VRS, todas entre lactantes cuyas madres no recibieron RSVpreF durante el embarazo (Pérez Marc G, 2025). Con datos del Ministerio de Salud de Argentina, en nota de prensa de fecha 2 de enero de 2025, la reducción de hospitalizaciones asociadas a VSR en menores de 6 meses fue del 62,1 % y del 69,9 % para ingresos en UCI. Para la campaña 2025, el Ministerio ha decidido que esta dure 6 meses, por tratarse de la estrategia más costoefectiva.
Un estudio realizado en Reino Unido prospectivo, multicéntrico y con test negativos para analizar la efectividad de la vacunación materna con RSVpreF contra la hospitalización por IRTI-VRS en lactantes, entre el inicio de la campaña (12 de agosto en Escocia, 1 de septiembre de 2024 en Inglaterra) y el 20 de enero de 2025. La EV ajustada fue del 72,4 % (IC95 %: 47,8 a 85,4) para los lactantes cuyas madres fueron vacunadas más de 14 días antes del parto, y del 57,7 % (IC95 %: 28,2 a 75,1) para los lactantes cuyas madres fueron vacunadas en cualquier momento antes del parto (Williams TC, 2025).
6. Vías de administración
Palivizumab, nirsevimab y RSVPreF se administran por vía intramuscular.
7. Indicaciones y esquemas de inmunización
Palivizumab, según ficha técnica, está indicado para la prevención en niños con alto riesgo de enfermedad grave por VRS: pretérminos ≤35 semanas de gestación que tengan menos de 6 meses de edad al inicio de la estación de riesgo de infección por VRS, niños menores de 2 años de edad que hayan requerido tratamiento para la displasia broncopulmonar durante los últimos 6 meses, y niños menores de 2 años de edad con cardiopatía congénita hemodinámicamente significativa. Respecto a los prematuros, la Sociedad Española de Neonatología la recomienda si la edad gestacional es ≤28+6 días y edad ≤9 meses al inicio de la estación VRS, o si la edad gestacional es 29+0 a 31+6 días y ≤6 meses al inicio de la estación VRS, o si la edad gestacional es 32+0 a 34+6 días que reúnan los 2 criterios mayores: edad menor de 10 semanas al inicio de la estación VRS (nacidos a partir del 6 de agosto inclusive) y con, al menos, un hermano que acude al colegio o guardería. La pauta es de 15mg/kg intramuscular en intervalos mensuales durante toda la estación VRS de noviembre a marzo (máximo 5 dosis).
Nirsevimab fue aprobado por la Comisión Europea el 31 de octubre de 2022 y por la Agencia Reguladora de Medicamentos y Productos para el Cuidado de la Salud del Reino Unido (MHRA, 7 de noviembre de 2022), en ambos casos para su uso en neonatos y lactantes durante su primera temporada del VRS. También ha sido aprobado por el Departamento Federal de Salud de Canadá (Health Canada, 19 de abril de 2023) y por la FDA (17 de julio de 2023), con la misma indicación que en Europa, y, además, en niños de hasta 24 meses de edad de riesgo para enfermedad grave en su segunda temporada de VRS, que puede incluir, entre otros, niños con enfermedad pulmonar crónica del prematuro, cardiopatía congénita hemodinámicamente significativa, estados inmunocomprometidos, síndrome de Down, fibrosis quística, enfermedad neuromuscular o anomalías congénitas de las vías respiratorias. En Argentina, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) autorizó nirsevimab el 30 de noviembre de 2023. Se administra mediante una única inyección intramuscular antes del inicio de la temporada en lactantes o en el momento del nacimiento en el caso de los nacidos durante la temporada de VRS, siendo la dosis recomendada de 50 mg para niños que pesen menos de 5 kg y de 100 mg para niños que pesen 5 kg o más. Para los niños de riesgo en su segunda temporada de VRS, la dosis recomendada es de 200 mg (dos dosis de 100 mg, coadministradas) si pesa ≥10 kg, y una única dosis de 100 mg si pesa menos de 10 kg. Los CDC recomiendan una dosis de nirsevimab para todos los recién nacidos durante la temporada del VRS, así como a todos los menores de 8 meses al inicio de la temporada; para los niños entre 8 y 19 meses pertenecientes a un grupo de riesgo, recomiendan una dosis en su segunda temporada.
Abrysvo, según ficha técnica, está indicada para la protección pasiva frente a la enfermedad del tracto respiratorio inferior causada por el virus respiratorio sincitial (VRS) en los lactantes desde el nacimiento hasta los 6 meses de edad tras la inmunización materna durante el embarazo; también está aprobada para la inmunización activa de personas de 60 años de edad. La pauta consta de una dosis única intramuscular. En cuanto a la indicación en gestantes, fue aprobada por la FDA el 21 de agosto de 2023 para su uso entre la 32 y la 36 semana de gestación, y autorizada por la Comisión Europea el 24 de agosto para su uso entre las 24 y las 36 semanas de gestación. También ha sido aprobada en Argentina en septiembre 2023 y Canadá el 21 de diciembre de 2023, en ambos casos para la administración entre las 32 y 36 semanas de gestación. En Reino Unido se aprobó en noviembre 2023 para su uso entre las 28 y 36 semanas de gestación. En España, fue efectiva la comercialización de Abrysvo el 1 de diciembre de 2023, aunque no estuvo disponible en oficinas de farmacia para la temporada 2023-2024, sí estándolo en la 2024-2025 para venta bajo prescripción médica, pero no financiada, no habiendo sido elegida como estrategia para esta temporada 2024-2025 por la Comisión de Salud Pública del Ministerio de Sanidad. De momento, solo Argentina y Reino Unido ha recomendado la revacunación con RSVPreF en cada embarazo, a pesar de no disponer de datos de inmunogenicidad y seguridad al respecto.
7.1. Recomendaciones de uso en España de nirsevimab (Ponencia de Vacunas y Comisión de Salud Pública)
Tras el documento de la Ponencia de Vacunas de julio de 2023 con las recomendaciones de utilización de nirsevimab para la temporada 2023-2024, en marzo de 2024 se publicaron las de la temporada 2024-2025, siendo estas actualizadas el 18 de julio y el 9 de septiembre, donde se recogen las siguientes recomendaciones de uso de nirsevimab:
1.- Prematuros con una edad gestacional <35 semanas, incluyendo los menores de 29 semanas de gestación: administración de una dosis antes de cumplir 12 meses de edad (50 mg si pesan <5 kg, 100 mg si pesan ≥5 kg). Si recibieron una dosis en la temporada 2023-2024 podrán recibir una nueva dosis al inicio de la temporada 2024-2025 si todavía no han cumplido 12 meses de edad: 100 mg si pesan menos de 10 kg, 200 mg (2 dosis de 100 mg) si pesan ≥10 kg.
2.- Población infantil con las siguientes condiciones de alto riesgo de enfermedad grave por VRS:
(a) pacientes con cardiopatías congénitas con afectación hemodinámica significativa cianosantes o no cianosantes
(b) pacientes con displasia broncopulmonar
(c) cirugía cardíaca con bypass cardiopulmonar.
(d) pacientes con otras patologías de base que suponen un gran riesgo para padecer bronquiolitis grave por VRS, como son aquellos con inmunodepresión grave (enfermedades oncohematológicas; inmunodeficiencias primarias sobre todo combinadas y agammaglobulinemia congénita; tratamiento con inmunosupresores de forma continuada), errores congénitos del metabolismo, enfermedades neuromusculares, pulmonares graves, síndromes genéticos con problemas respiratorios relevantes, síndrome de Down, fibrosis quística y aquellos en cuidados paliativos
En estos pacientes con condiciones de riesgo, se administrará nirsevimab antes de cada temporada del VRS antes de cumplir los 24 meses de edad en el momento de recibir la inmunización. La dosis en la segunda temporada será de 200 mg en dos inyecciones intramusculares (2 x 100 mg), administradas en el mismo acto vacunal si pesa ≥10 kg, y una única dosis de 100 mg si pesa menos de 10 kg. Si no han recibido una dosis previa en la temporada 2023-2024, pero tienen una edad entre 12 y 23 meses, recibirán también una dosis de 100 o 200 mg en función del peso.
En lactantes sometidos a cirugía cardíaca con bypass cardiopulmonar, se puede administrar una dosis adicional lo antes posible una vez que el lactante esté estable después de la cirugía para asegurar niveles séricos adecuados de nirsevimab. En los primeros 90 días tras recibir la primera dosis de nirsevimab, la dosis adicional debe ser de 50 mg o 100 mg según el peso corporal (200 mg si pesan ≥10 kg). Si han transcurrido más de 90 días después de la primera dosis, la dosis adicional podría ser una dosis única de 50 mg independientemente del peso corporal durante la primera temporada del VRS o de 100 mg durante la segunda temporada del VRS para cubrir el resto de la temporada de VRS.
3.- Menores de 6 meses al inicio o durante la temporada del VRS
Se recomienda para la temporada 2024-2025, la administración de nirsevimab a los menores de 6 meses nacidos entre el 1 abril de 2024 y el 31 de marzo de 2025. Dosis: 50 mg si peso <5 kg, 100 mg si peso ≥10 kg. La campaña comenzará en octubre de 2024, pudiéndose adelantar si se estima oportuno. En octubre se inmunizará también a los nacidos entre el 1 de abril y el 30 de septiembre de 2024.
4.- Otras recomendaciones:
Se deberá intentar inmunizar a la mayoría de la población diana nacida fuera de la temporada del VRS al principio de la temporada de VRS. No obstante, haber cumplido 6 meses no será criterio de exclusión siempre que se trate de población diana por su fecha de nacimiento (entre el 1 de abril de 2024 y el 31 de marzo de 2025). Asimismo, los nacidos durante la temporada (octubre - marzo) deberán recibir nirsevimab de manera muy precoz (preferiblemente en las primeras 24-48 horas tras el nacimiento) debido a la mayor gravedad de la enfermedad del VRS en los primeros días de vida. Si no es posible, se deberá administrar a la mayor brevedad.
El documento también advierte que hay que tener en cuenta que la vacuna frente al VRS para embarazadas está disponible en las oficinas de farmacia para adquisición por prescripción privada, y que en la temporada 2024-2025 se recomienda la inmunización de la población diana independientemente del antecedente de vacunación materna durante el embarazo.
El 21 de noviembre de 2024, la CSP aprobó el documento de la Ponencia “Recomendaciones de inmunización pasiva para prevención de enfermedad grave por VRS en la población infantil”, donde se recomienda la inmunización pasiva con anticuerpo monoclonal antes del comienzo y durante cada temporada estacional de VRS a los siguientes grupos de población, por orden de prioridad, como ya se había hecho en el documento del 9 de septiembre:
- Prematuros de <35 semanas, antes de cumplir 12 meses de edad cronológica
- Población con alto riesgo de enfermedad grave por VRS
- Menores de 6 meses: todos los nacidos entre el 1 de abril del año de comienzo de la temporada y el 31 de marzo del año de fin de temporada
Se recomienda la inmunización de la población diana independientemente del antecedente de vacunación materna durante el embarazo
En el documento se advierte que estas recomendaciones se revisarán a medida que vaya surgiendo nueva evidencia sobre la implantación de diferentes estrategias de prevención de la enfermedad grave por VRS. Asimismo, se espera la autorización de nuevas vacunas y de nuevos anticuerpos monoclonales en los próximos meses o años. Asimismo, se valorarán los resultados de la evaluación económica con datos de nuestro país actualmente en marcha.
7.2. Recomendación en España acerca de RSVPreF (Ponencia de Vacunas y Comisión de Salud Pública)
En el documento antes mencionado, se manifiesta que la estrategia de vacunación en embarazadas protegería a los recién nacidos desde el nacimiento y evitaría la posible reticencia a un pinchazo adicional en el recién nacido, aunque presenta incertidumbres sobre su impacto en otros programas de vacunación y posibles interferencias con otras vacunas, como la menor respuesta inmune frente a tosferina (Tdpa), aunque se desconoce la relevancia clínica de estos hallazgos. No existen datos sólidos que avalen que la infección por VRS pueda ser potencialmente grave para la mujer embarazada y no están claros los beneficios de la vacunación para la propia embarazada, aunque sí puede serlo en caso de condiciones subyacentes. La estrategia mixta busca maximizar la cobertura y protección, pero conlleva mayores costes y complejidad logística. La vacuna frente al VRS para embarazadas está disponible en España en las oficinas de farmacia, sujeta a prescripción médica. Para la temporada 2024/2025, se recomienda la inmunización de la población diana con nirsevimab independientemente del antecedente de vacunación materna durante el embarazo.
También se manifiesta que un cambio de estrategia implica dificultades para comunicar dicha decisión tanto a los gestores de la sanidad como al personal sanitario y a la población en general.
En un anexo se señala que, aunque no se recomienda la vacunación en embarazadas, si esta se realizara por prescripción médica deberá registrarse en el sistema de información/registro de vacunaciones de las CC. AA. En menores cuyas madres han recibido la vacuna frente al VRS, la administración está documentada y los progenitores rechazan la inmunización del recién nacido por vacunación materna, se deberían tener en cuenta los siguientes aspectos para considerar la administración de anticuerpo monoclonal:
- Cuando hayan transcurrido menos de 15 días entre la administración de la vacuna y el parto
- Madre con inmunodepresión o patologías asociadas a una transferencia reducida de anticuerpos, como en el caso de infección por VIH
- Presencia de condiciones de alto riesgo en recién nacido o lactante (ver condiciones en los subapartados del documento B.1 y B.2 del apartado 9. Recomendaciones)
- Lactantes de madres vacunadas que podrían haber perdido anticuerpos maternos, como en el caso de cirugía cardiopulmonar con bypass o con oxigenación por membrana extracorpórea
Valorar la administración en los nacidos si la administración de la vacuna se ha producido, al menos, 14 días antes del parto y teniendo en cuenta el mes de nacimiento, la duración de anticuerpos séricos, y el momento del año en el que comienza a circular el virus.
7.3. Estrategias de inmunización frente al VRS en otros países
A fecha de noviembre de 2024, las estrategias elegidas por otros países para la prevención mediante inmunización pasiva frente al VRS para la protección de la población infantil con vacunación en embarazadas (RSVPreF) y/o anticuerpo monoclonal (Nirsevimab) en recién nacidos y lactantes, son (tomadas del documento de la Ponencia/Comisión de Salud Pública de 21 de noviembre):
- En Francia, donde en la temporada 2023/2024 se utilizó nirsevimab, la Alta Autoridad Sanitaria recomienda ambas estrategias, siendo la decisión individual de la embarazada o los futuros padres una vez informados de las dos opciones. No recomiendan las dos estrategias de forma conjunta (vacunar a la embarazada e inmunizar a su hijo recién nacido). En cuanto a RSVPreF; recomiendan que, por precaución, se administre entre la 32-36 semanas de gestación, entre septiembre y enero. Si la embarazada no se hubiera vacunado, o en caso de prematuros o cuando existe un intervalo entre vacuna y nacimiento inferior a 14 días, recomiendan la administración de anticuerpos monoclonales. En mujeres inmunodeprimidas también recomienda el uso de estos últimos
- En Luxemburgo, donde también se utilizó nirsevimab en la temporada 2023/2024, también se recomienda para futuras temporada la vacunación estacional en embarazadas en las 32-36 SG, siendo ambas estrategias alternativas (no conjuntas), sin mostrar preferencia por ninguna
- En Países Bajos, el Health Council ha elegido el anticuerpo monoclonal en menores de un año al inicio de su primera temporada de VRS, basándose en que hay más certidumbre acerca de la seguridad de los anticuerpos, que con ella se puede llegar a un mayor número de niños, y en la protección del prematuro
- En Canadá, el National Advisory Committee on Immunization (NACI) recomienda nirsevimab en los menores de 8 meses que entren en la temporada de circulación del virus, debido a su mayor eficacia y por una posible mayor duración de la protección. El Comité recomienda que la embarazada, una vez informada por su proveedor de cuidados sanitarios, considere como una decisión individual la inmunización con RSVPreF antes o durante la temporada de VRS
- En Reino Unido, el JCVI emitió en junio de 2023 un posicionamiento recomendando ambas estrategias, sin establecer una preferencia por ninguna de las dos opciones, aunque finalmente el programa nacional que se ha implementado a partir del 1 de septiembre de 2024 es el de la vacunación en embarazadas a partir de las 28 semanas de gestación, en cada embarazo y a lo largo de todo el año. Asimismo, a los menores de alto riesgo se les ofrecerá también la inmunización con nirsevimab a partir octubre independientemente de si la madre se ha vacunado
- En Alemania, el STIKO recomienda la administración de nirsevimab a todos los recién nacidos durante la temporada de VRS (de octubre a marzo) y menores de 6 meses al inicio de la temporada de VRS (los nacidos entre abril y septiembre) en su primera temporada de exposición a VRS, con inicio en otoño de 2024
- En Finlandia, se recomienda nirsevimab a los nacidos en temporada y captación a los menores de 3 meses
- En Irlanda, se recomienda nirsevimab a los nacidos en temporada y captación a los menores de 6 meses
- En Austria se recomiendan ambas estrategias: RSVPreF entre las 24-36 SG, preferentemente entre septiembre y marzo, y nirsevimab en recién nacidos y captación en menores de 6 meses, siendo estrategias alternativas, no recomendando su administración conjunta. Ninguna de las estrategias está financiada
- En Bélgica, se recomiendan ambas estrategias de modo estacional (vacunación en embarazadas entre 28-36 SG o nirservimab en todos los lactantes menores de un año al inicio de su primera temporada de VRS). Estas estrategias son alternativas, no recomendando la combinación de ambas y lo deja a criterio del progenitor/profesional sanitario. Por ahora, solo se financia la administración de nirsevimab
- En Australia se recomienda la vacunación en embarazadas entre las 28-36 SG, a lo largo del año. Norsevimab se recomienda solo en los nacidos cuyas madres no se han vacunado o nacieron menos de 2 semanas tras la vacunación materna, en menores con alto riesgo de enfermedad grave por VRS independiente del estado de vacunación materna y en la 2.ª temporada de VRS de este grupo de población. Actualmente, no está todavía financiada
- En EE. UU. en la temporada 2023/2024 se han utilizado ambas estrategias, vacunación con RSVPREF (entre las 32-36 SG) y Nirsevimab a <8 meses, aunque con bajas coberturas en ambos casos. Para la temporada 2024/2025 se siguen recomendando ambas
- Chile inició la inmunización con nirsevimab a finales de marzo de 2024 para los nacidos a partir de esa fecha, y para los nacidos fuera de temporada (nacidos a partir del 1 de octubre de 2023)
- Argentina, realizó una campaña entre el 1 de marzo y el 31 de agosto de 2024 para la vacunación de gestantes entre las 32 y 36 semanas de gestación con RSVPreF. Con datos de la Comisión Nacional de Inmunizaciones (CoNaIn) y del Ministerio de Salud, la cobertura en esta primera temporada ha sido del 62,9 %. El Grupo de Trabajo VRS del Ministerio de Sanidad argentino recomienda la revacunación en cada embarazo
- En Uruguay, RSVPreF se ofrece entre la 32+0 y la 36+6 sg a las gestantes mayores de 18 años, en una campaña desde el 13 de enero hasta el 31 de agosto de 2025. Además, Uruguay se une a Argentina para el estudio BERNI
- En Paraguay, con una estrategia de uso de nirsevimab (inicio en marzo 2025) en los nacidos entre enero y julio, en <12 meses con factores de riesgo y <24 meses con cardiopatías hemodinámicamente significativas, a fecha de 7 de mayo la cobertura fue del 90 %
7.4. Recomendaciones de sociedades científicas sobre el uso de nirsevimab
La Asociación Española de Pediatría fue la primera sociedad científica a nivel mundial en recomendar la inclusión de la inmunización sistemática con nirsevimab para todos los menores de seis meses y su administración anual a niños menores de dos años con enfermedades subyacentes que aumentan el riesgo de infección grave por VRS, al incluirla en su Calendario de Inmunizaciones 2023, publicado el 1 de enero.
El 26 de enero de 2023, la Sociedad Francesa de Neumología y Alergología pediátricas recomendó la prevención sistemática con nirsevimab de la bronquiolitis por VRS en todos los niños menores de un año a partir de la próxima temporada epidémica.
El 17 de febrero de 2023 la Sociedad Italiana de Neonatología, junto a la Board del Calendario Vaccinale per la Vita, formada por la Sociedad Italiana de Higiene, la Sociedad Italiana de Pediatría, la Federación Italiana de Pediatras y la Federación Italiana de Médicos Generales, publicaron un documento donde se proponían como apoyo para la evaluación de nirsevimab a la Autoridad de Salud Pública y solicitaban su inclusión en el Calendario de Inmunización Nacional.
El 24 de febrero de 2023, las sociedades científicas de pediatría francesas (Sociedad Francesa de Pediatría, Grupo de Patología Infecciosa Pediátrica, Asociación Francesa de Pediatría Ambulatoria y el Consejo Nacional de Profesionales de Pediatría) recomendaron la administración sistemática de una dosis de nirsevimab a todos los lactantes menores de 6 meses durante todo el período epidémico (septiembre-octubre a febrero-marzo). Para los niños con riesgo alto (prematuros, fibrosis quística y otras afecciones broncopulmonares crónicas, cardiopatías congénitas, drepanocitosis, inmunodeficiencias primarias o adquiridas, enfermedades neurológicas o musculares graves, trisomía 21, etc.), la prevención mediante nirsevimab debe extenderse hasta la edad de 1 año.
El 24 de mayo de 2023, la Sociedad Española de Neonatología (SENeo) recomendó el uso de nirsevimab en todos los recién nacidos y lactantes de menos de 6 meses al inicio de la estación VRS, así como mantenerla en una segunda estación en aquellos lactantes con displasia broncopulmonar o situaciones especiales de riesgo de desarrollar una enfermedad grave por VRS, aun siendo mayores de 6 meses.
En octubre de 2023 se publicaron en la revista Anales de Pediatría un artículo especial con el posicionamiento de la Sociedad Española de Infectología Pediátrica (SEIP) y una carta científica de la SENeo, con sus recomendaciones, así como una editorial del CAV-AEP comentando las mismas.
8. Efectos adversos
Las reacciones adversas más frecuentes (≥1/10) descritas en la ficha técnica de palivizumab son fiebre, eritema leve y transitorio, e hinchazón en el lugar de la inyección. Después de la comercialización se han descrito muy raramente casos de apnea o anafilaxia.
La reacción adversa más frecuente con nirsevimab es la erupción leve a moderada (0,7 %) que se produce en los 14 días posteriores a la dosis. Además, fiebre en el 0,6 % y reacción en el lugar de la inyección en el 0,4 %, ambos dentro de los 7 días posteriores a la dosis.
En mujeres embarazadas de 24-36 semanas de gestación las reacciones adversas notificadas con mayor frecuencia tras la administración de RSVPreF fueron dolor en el lugar de vacunación (41 %), cefalea (31 %) y mialgia (27 %). La mayoría de las reacciones locales y sistémicas fueron de intensidad leve a moderada y remitieron en los 2-3 días posteriores a la aparición. RSVPref no produce malformaciones ni toxicidad fetal/neonatal. Los principales resultados relacionados con el parto evaluados en el grupo de RSVPreF en comparación con placebo incluyeron parto prematuro (6 vs 5 %), bajo peso al nacer (5 vs 4 %) y anomalías congénitas (5 vs 6 %). Los resultados preliminares de la primera temporada de vacunación materna contra el VRS en EE. UU. con datos del Vaccine Safety Datalink (VSD) presentados al ACIP en octubre de 2024, determinaron que la vacunación materna con RSVPreF en la 32-36 semanas de gestación no estaba asociada con un mayor riesgo de parto prematuro o de nacidos pequeños para la edad gestacional (peso al nacimiento p<10 para edad gestacional y sexo) (DeSilva M, 2024). No se detectaron señales de toxicidad en lactantes de hasta 24 meses de edad. La incidencia de acontecimientos adversos notificados hasta 1 mes después del nacimiento en lactantes fue similar en el grupo de RSVPreF y en el grupo de placebo (37 vs 35 %). En enero de 2025 se publicaron los datos definitivos del ensayo MATISSE (Madhi SA, 2025): el porcentaje de pretérminos fue del 5,7 % en el brazo RSVPreF y del 4,7 % en el brazo placebo (riesgo relativo [RR] 1,20, IC95 %: 0,98 a 1,46), siendo la mayoría prematuros tardíos. Los porcentajes de recién nacidos con bajo peso para edad gestacional fueron comparables entre ambos grupos (6,9 vs 6,4 %). Cuando se estratificó por índice de desarrollo humano (IDH), el porcentaje de prematuridad en ambos grupos fue del 5,0 % en países con alto IDH, mientras que en países con IDH medio-alto fue del 7,5 vs 4,2 %, en los de IDH medio-bajo del 2,6 vs 5,1 %, y en los de bajo IDH del 3,1 vs 2,1 %, con un global en países de IDH no alto del 7,0 vs 4,0 %. El 58,2 % de los prematuros tuvo un peso al nacer >2500 g. Las tasas de peso al nacer extremadamente bajas (1000 g o menos) y muy bajas (1000–1500 g) fueron comparables entre ambos grupos (0,5 % vs 1,2 % y 1,5 vs 2,9 %, respectivamente). Se produjeron veintidós muertes durante el periodo de seguimiento (24 meses), 8 en el grupo de RSVPreF y 14 en el de placebo. Los investigadores no encontraron relación entre la vacunación de las gestantes con RSVPreF y las causas de las muerte.
El 7 de enero de 2025, la FDA modificó las fichas técnicas de Abrysvo (RSVPreF, Pfizer) y de Arexvy (RSVPreF3 OA, GSK) para incluir el síndrome de Guillain-Barré (SGB como un efecto adverso raro tras la vacunación, basado en los resultados de un estudio observacional poscomercialización en personas de 65 años y más, que sugieren un mayor riesgo de síndrome de Guillain-Barré (SGB) durante los 42 días posteriores a la vacunación, con un exceso de casos estimados de 9 por millón de dosis en el caso de Abrysvo, y de 7 por millón de dosis de Arexvy (mientras que los casos esperados son de 11 por millón de en personas de 75 a 79 años sin vacunación), aunque de momento no se puede establecer una relación causal. La condición es mucho menos común en las personas más jóvenes y, hasta ahora, no hay evidencia de que la vacuna contra el VRS aumente el riesgo de SGB en embarazadas. Según la FDA, los beneficios de recibir una de las vacunas, en términos de hospitalizaciones y muertes evitables, superan el riesgo potencial de SGB en adultos de 75 años de edad o más y en adultos de entre 60-74 años de edad con mayor riesgo de enfermedad grave por VRS. En Europa, el SGB aparece en la ficha técnica de Abrysvo como raro (pueden afectar hasta 1 de cada 1 000 personas), en personas de 60 años o más, no apareciendo como efecto adverso en gestantes. Hasta el momento no aparece reflejado en la ficha de Arexvy. . En un estudio se estimó un exceso de 5,2 casos (Arexvy) a 18,2 casos (Abrysvo) de SGB por millón de dosis de vacunas administradas (Fry SE, 2025).
Las personas que tienen antecedentes de SGB pueden vacunarse según lo recomendado para su edad. Existe evidencia que sugiere que haber tenido un diagnóstico previo de SGB no predispone a una persona a sufrir más episodios de SGB cuando se inmuniza con otras vacunas. Aunque actualmente no hay ninguna indicación para la revacunación, se debe aconsejar a quienes sean diagnosticados con SGB dentro de las seis semanas posteriores a una dosis de la vacuna contra el VRS que consulten a un médico antes de aceptar una futura oferta de revacunación, como medida de precaución (Green Book, 2025).
9. Precauciones y contraindicaciones
Una infección aguda moderada o grave, o una enfermedad febril pueden justificar el retraso en la administración de palivizumab o nirsevimab. Una enfermedad febril leve, como por ejemplo una infección leve del tracto respiratorio superior, normalmente no es motivo para retrasar su administración. Al igual que con otras inyecciones intramusculares, se deben administrar con precaución en lactantes con trombocitopenia o cualquier trastorno de la coagulación.
Palivizumab y nirsevimab están contraindicados en pacientes con hipersensibilidad grave conocida al principio activo o a cualquier componente de la formulación, así como a otros anticuerpos monoclonales humanizados.
Se debe posponer la vacunación con RSVPreF en gestantes con enfermedad febril aguda. Sin embargo, la presencia de una infección leve, como un catarro, no debe dar lugar al aplazamiento de la vacunación. Se debe administrar con precaución a personas con trombocitopenia o cualquier trastorno de la coagulación. RSVPreF está contraindicada en pacientes con hipersensibilidad grave a los principios activos o a alguno de los excipientes.
10. Interacciones con otros medicamentos
Si bien no se han realizado estudios específicos que investiguen la coadministración de estos anticuerpos monoclonales con las vacunas, ya que estos no son requeridos por las autoridades reguladoras, el mecanismo de acción sobre sitios antigénicos virales altamente específicos, no plantea ninguna preocupación con respecto a la coadministración con vacunas. Palivizumab se ha usado durante más de 2 décadas, no interfiriendo con la respuesta inmunitaria a las vacunas vivas o inactivadas autorizadas. Por tanto, no se espera que una inmunización pasiva específica del VRS interfiera en la respuesta inmune activa de las vacunas, pudiendo coadministrarse con cualquier vacuna en sitios anatómicos diferentes.
Con respecto a la posible interacción con medicamentos, no se han realizado estudios de interacciones. Los anticuerpos monoclonales no suelen tener un potencial significativo de interacción, ya que no afectan directamente a las enzimas del citocromo P450 y no son sustratos de transportadores hepáticos o renales. Los efectos indirectos en las enzimas del citocromo P450 son poco probables ya que la diana de nirsevimab es un virus exógeno.
RSVPreF se puede administrar de forma concomitante con la vacuna frente a la gripe estacional. Según la ficha técnica, se recomienda un intervalo mínimo de dos semanas entre la administración de RSVPreF y la administración de Tdpa, ya que no se ha estudiado en embarazadas. Sin embargo, la FDA y los CDC admiten la coadministración.
11. Otras estrategias de inmunoprevención
A pesar de la carga de enfermedad asociada con el VRS, y después de 60 años de investigación activa, no existe todavía una vacuna autorizada. El desarrollo de una vacuna contra el VRS se ha visto obstaculizado por los efectos que se produjeron en la década de 1960 cuando una vacuna inactivada con formalina condujo a una mayor gravedad de la enfermedad en los niños vacunados cuando en la temporada siguiente se infectaban por VRS.
En general, las infecciones primarias son más graves; sin embargo, las reinfecciones son comunes a lo largo de la vida, ya que la inmunidad que se produce tras la infección natural no es completa ni duradera. La vacuna ideal debería poder prevenir enfermedades graves y limitar la transmisión, induciendo una respuesta inmunitaria más duradera y mejorada que la infección natural, y que estimulara tanto la inmunidad sistémica como la mucosa.
El objetivo es la prevención en los grupos de edad donde se concentra la mayor carga de enfermedad: lactantes y niños pequeños, y personas mayores de 60 años. Para la prevención en lactantes, la estrategia que parece puede ofrecer mejores resultados, además de la inmunoprofilaxis pasiva mediante anticuerpos monoclonales, es la protección indirecta mediante la vacunación de la embarazada; para niños pequeños y adultos mayores, se busca la protección directa mediante la vacunación en esos grupos. Los ensayos más avanzados son los de vacunas basadas en la proteína Pre-F para embarazadas y personas mayores (en este último grupo, ya se han aprobado algunas de ellas), así como otro anticuerpo monoclonal para menores de un año, el clesrovimab.
11.1. Inmunización directa a recién nacidos y lactantes pequeños
Clesrovimab es un anticuerpo monoclonal recombinante humano IgG1 kappa que actúa específicamente sobre el sitio antigénico IV, presente tanto en la forma pre-F como pos-F del VRS. Este sitio está altamente conservado (99,8 %), con datos de más de 15 000 secuenciaciones tanto de VRS A como B, por lo que hay una baja probabilidad de mutaciones y escapes mutantes. Su vida media, gracias a la tecnología YTE (la misma que nirsevimab) está en torno a 44 días y su capacidad neutralizante es similar a la de nirsevimab. Además, tiene una amplia distribución y concentración en tejido mucoso nasal, estando en estudio su posible capacidad neutralizante del VRS en vías altas. La dosis de clesrovimab es independiente del peso del receptor: 105 mg IM.
Los resultados de 2 ensayos clínicos aleatorizados, uno en fase 2b/3 finalizado, y los provisionales del ensayo fase 3, fueron presentados en la ID Week 2024, la reunión anual conjunta de varias sociedades científicas de EE.·UU. relacionadas con la infectología (16-19 de octubre en Los Ángeles, California) y al ACIP el 23 de octubre de 2024 (Sinha A, 2024).
El ensayo fase 2b/3 doble ciego inscribió a 3614 participantes de 22 países de 5 continentes que fueron asignados aleatoriamente 2:1 para recibir mg o placebo: pretérminos sanos de 29-34 semanas de gestación (631), y pretérminos tardíos (35-37 semanas) y nacidos a término sanos (2983) en su primera temporada de VRS. El objetivo fue evaluar la seguridad y eficacia de clesrovimab hasta el año de edad. Los resultados muestran que la incidencia de eventos adversos fue comparable entre los grupos de clesrovimab y placebo; no se consideró ninguna muerte (7 en el grupo de clesrovimab, 3 en el grupo de placebo) relacionada con la intervención del estudio; no se identificó ningún patrón con respecto a la causa o el momento de la muerte. Se han atribuido a comorbilidades subyacentes. En cuanto a eficacia, se cumplieron con todos los criterios de valoración preespecificados para IRTI-VRS hasta el día 150 posdosis:
- El criterio principal de valoración, la reducción de la incidencia de IRTI-VRS atendida médicamente con ≥1 indicador de IRTI o gravedad (sibilancias, tiraje/retracción de la pared torácica, estertores/crepitantes, hipoxemia, taquipnea o deshidratación) en comparación con placebo fue del 60,4 % (IC95 %: 44,1 a 71,9; p < 0,001)
- Clesrovimab redujo las hospitalizaciones por clínica respiratoria debidas al VRS (criterio de valoración secundario) en un 84,2 % (IC95 %: 66,6 a 92,6; p < 0,001)
- En cuanto a criterios de valoración terciarios, redujo la incidencia de IRTI-VRS un 52,0 % (IC95 %: 39,5 a 61,9), la hospitalización con clínica respiratoria de vías bajas debida al VRS un 90,9 % (IC 95%: 76,2 a 96,5) y la incidencia de IRTI-VRS grave atendida médicamente en un 91,7 % (IC95 %: 62,9 a 98,1)
- Además, en un análisis post hoc, la eficacia frente a IRTI-VRS atendida médicamente con ≥2 indicadores de IRTI o gravedad fue del 88,0 % (IC del 95 %: 76,1 a 94,0)
A los 180 días, la eficacia para los todos los criterios de valoración establecidos y los del análisis post hoc fue muy similar a las de los 150 días.
La eficacia a los 150 días para IRTI por cualquier causa atendida médicamente fue del 13,1 % (IC95 %: -0,6 a 24,8) y para hospitalización IRTI por cualquier causa del 49,0 % (IC95 %: 26,7 a 64,5).
El ensayo fase 3, multicéntrico, aleatorizado, parcialmente ciego, en pacientes de riesgo de infección grave por VRS, con palivizumab como control, con fecha prevista de finalización en abril de 2026, ha reclutado a 896 participantes de 27 países de 6 continentes en su primera temporada de VRS, con antecedente de prematuridad ≤35 semanas de edad gestacional (50 menores de 29 semanas, 495 de 29 o más semanas), enfermedad pulmonar crónica (250) o cardiopatía congénita hemodinámicamente significativa (101). Fueron asignados aleatoriamente 1:1 para recibir clesrovimab (105 mg IM el día 1 y placebo el día 28) o palivizumab mensual. El criterio de valoración principal es la seguridad y la tolerabilidad de clesrovimab frente a palivizumab en la primera temporada. Los participantes elegibles en su segunda temporada de VRS recibirán clesrovimab (210 mg IM). Los resultados preliminares para su primera temporada muestran:
- El perfil de seguridad de clesrovimab en lactantes con mayor riesgo de enfermedad grave por VRS es generalmente comparable al de palivizumab y coherente con el perfil de seguridad en lactantes sanos
- No se consideró ninguna muerte (8 en el grupo de clesrovimab, 4 en el grupo de palivizumab) relacionada con la intervención del estudio; no se identificó ningún patrón con respecto a la causa o el momento de la muerte. Se han atribuido a comorbilidades subyacentes
- Las tasas de incidencia de IRTI-VRS atendida médicamente con ≥1 indicador de IRTI o gravedad y las hospitalizaciones asociadas al VRS (criterios de valoración secundarios) fueron comparables entre clesrovimab (3,6 % y 1,3 %, respectivamente) y palivizumab (3,0 % y 1,5 %, respectivamente) hasta el día 150
- La farmacocinética (medida por la concentración de anticuerpos detectados) en estos participantes es similar a los del estudio fase 2b/3 (sanos), por lo que se extrapola que la eficacia es similar, y no es necesario modificar la dosis en estos pacientes
11.2. Inmunización directa a lactantes mayores y niños pequeños
Para niños a partir de los 6-12 meses de edad, el ensayo más avanzado es un ensayo fase 3 con vacuna atenuada intranasal (VAD00004, Sanofi) iniciado en febrero 2024 en Argentina, EE. UU. y Honduras. El objetivo es reclutar a 6300 niños de 6 a 21 meses, que recibirán 2 dosis de vacuna (con 8 semanas de intervalo) o placebo, con un seguimiento hasta 24 meses. Está prevista la finalización del estudio en junio de 2026. Hay otros ensayos en fase 2, con vacunas vivas atenuadas intranasales para niños entre 6 y 24 meses (Meissa Vaccines, Blue Lake), así como con una vacuna de ARN (ARNm-1345) intramuscular en niños entre 2 y 17 años (la misma vacuna de Moderna aprobada para adultos mayores de 60 años). El 12 de diciembre de 2024 la FDA anunció la suspensión del reclutamiento de los estudios fase 1 con vacunas ARNm-1345 y ARNm-1365 (VRS/metapneumovirus), ambas de Moderna, en niños de 5 a 24 meses hasta que se estudien las señales de alerta en cuanto a su seguridad en lactantes de 5 a 8 meses de edad después de que se informaran cinco casos de IRTI-VRS de grave a muy grave en bebés que recibieron un dosis de 15 μg de ARNm-1345 (3 casos) o una dosis de 15 μg de ARNm-1365 (2 casos), en comparación con 1 caso en el grupo de placebo. Cinco de los 6 bebés requirieron hospitalización y 1 necesitó ventilación mecánica. Moderna suspendió el reclutamiento el 17 de julio y lo notificó a la FDA el 19 de julio. El ensayo también encontró que la respuesta inmune a la vacunación con ARNm-1345 fue menor en los que habían recibido anteriormente nirsevimab comparación con aquellos que no lo habían recibido, lo que sugiere una posible interacción.
11.3. Inmunización directa para personas mayores de 60 años
Hay 3 vacunas aprobadas, 2 de subunidades proteicas (Abrysvo y Arexvy) y una de ARNm (mResvia):
- Abrysvo (RSVPreF; bivalente: 60 mcg de Ag PreF del VRS A y 60 mg del VRS B; no adyuvada; Pfizer): al final de la primera temporada del VRS, la eficacia fue del 65,1 % (IC95 %: 35,9 a 82,0) para IRTI definida por dos o más síntomas, y 88,9 % (IC95 %: 56,3 a 98,7) para IRTI grave definida por tres o más síntomas. Los datos más recientes ofrecidos por la compañía muestran que la protección disminuyó levemente alrededor de los 18 meses después de la vacunación, aunque todavía llegaba al 48,9 % (IC95 %: 13,7 a 70,5) frente a IRTI y al 78,6 % (IC95 %: 23,2 a, 96,1) frente a IRTI grave. Al final de la segunda temporada, la EV fue del 55,7 % (IC95 %: 34,7 a 70,4) y del 77,8 % (IC95 %: 51,4 a 91,1), respectivamente (Walsh EE, 2025). Fue autorizada para su uso en personas a partir de 60 años (a la misma vez que para gestantes) por la FDA el 31 de mayo de 2023 y por la Comisión Europea el 23 de agosto de 2023. El 22 de octubre de 2024 la FDA la aprobó para personas de 18 años o más en condiciones de inmunosupresión, así como en personas de 18 a 59 con condiciones de riesgo como obesidad mórbida, diabetes mellitus, EPOC, asma moderada-grave, enfermedad cardiovascular, insuficiencia cardíaca o insuficiencia renal, basándose en los resultados del ensayo fase 3 MONeT (Munjal I, 2024) en base a criterios de no inferioridad inmunológicos respecto a personas de 60 o más años participantes en el estudio RENOIR. También se observó que una segunda dosis al mes de la primera no aumentaba la respuesta inmunogénica. El 27 de febrero de 2025 el Comité de Medicamentos de Uso humano (CHMP) de la EMA, dio su opinión positiva al cambio de ficha técnica de Abrysvo, para incluir entre las indicaciones a las personas entre 18 y 59 años. El 12 de marzo de 2025 Abrysvo fue precalificada por la OMS. El 7 de enero de 2025 la FDA modificó las fichas técnicas de Abrysvo y Arexvy para incluir que los resultados de un estudio observacional poscomercialización sugieren un mayor riesgo de síndrome de Guillain-Barré durante los 42 días posteriores a la vacunación. El 12 de agosto de 2024, se inició en Escocia la vacunación de las personas de 75 a 79 años con Abrysvo, y el 1 de septiembre en Inglaterra. En una evaluación temprana del impacto del programa en las hospitalizaciones relacionadas con el VRS en esa población, en Escocia, con una cobertura del 68,6 % (a 27 de noviembre), se observó una reducción del 62,1 % (IC95 %: 35,0 a 79,8) en las hospitalizaciones por VRS en ese grupo de edad (Hameed SS, 2025), mientras que en Inglaterra, con una cobertura del 47,4 % (a 6 de enero), los resultados mostraron una discontinuidad en las tasas de hospitalización correspondiente a una reducción del 30 % (IC95 %: 18 a 40, p<0,0001); aunque no es estudio para ver EV, a mitad de estudio, con cobertura del 41,8 % (30 noviembre), los autores la estiman en un 72 % para evitar hospitalizaciones (Mensah AA, 2025).
- Arexvy (RSVPreF3 OA; monovalente: 120 mcg Ag PreF3 de VRS A; adyuvada con AS01E; GSK). Los resultados de EV, con intervalos de confianza significativos en todos los casos, tras 3 temporadas del VRS (30,6 meses de seguimiento), presentados al ACIP el 24 de octubre de 2024 (Gerber S, 2024), y publicados en línea en mayo 2025 (Ison MG, 2025), son:
Sin tener en cuenta la estacionalidad como covariable):
- Para IRTI: EV en la primera temporada del 82,6 % (seguimiento 6,7 meses), en la segunda temporada del 56,1 % (seguimiento 6,3 meses) y en la tercera del 48,0 % (seguimiento 7 meses). La EV acumulada en las 2 primeras temporadas del 74,5 % (17,8 meses de seguimiento) y en las tres temporadas (30,6 meses de seguimiento) del 69,1 %
- Para IRTI grave: EV 94,1 % en la primera temporada, 82,7 % acumulada en las dos primeras temporadas, y 72,3 % en 3 temporadas
Teniendo en cuenta la estacionalidad del VRS como covariable:
- Para IRTI: La EV acumulada en las 2 primeras temporadas del 67,2 % (17,8 meses de seguimiento) y en las tres temporadas del 62,9 % (30,6 meses de seguimiento)
- Para IRTI grave: EV del 78,6 % acumulada para las 2 primeras temporadas (seguimiento 17,8 meses) y 72,3 % en 3 temporadas (30,6 meses de seguimiento)
- EV acumulada en las 3 temporadas en personas de 60 a 69 años del 60,3 % y del 70,6 % en las de 70 a 79 años
- EV en pacientes con, al menos, una comorbilidad de interés (enfermedad pulmonar crónica con síntomas que restringen la actividad o con medicación crónica, enfermedad cardiovascular crónica, diabetes mellitus tipo 1 y tipo 2, enfermedad renal crónica y enfermedad hepática crónica): en la primera temporada 91,4 % (seguimiento 6,7 meses), en la segunda 51,5 % (seguimiento 6,3 meses) y 57,8 % en la tercera (seguimiento 7 meses). La EV acumulada en las 3 temporadas fue del 64,7 % (30,6 meses de seguimiento)
- EV acumulada en las 3 temporadas frente al VRS A del 69,8 % y frente al VRS B del 58,6 %
El ensayo también analizó la eficacia durante dos temporadas en personas que recibieron una segunda dosis y encontró una eficacia acumulada del 67,1 %, lo que sugiere que la revacunación después de 12 meses no agrega un beneficio adicional para la población general.
Fue aprobada por la FDA el 3 de mayo de 2023, y autorizada por la Comisión Europea el 6 de junio fue 2023, el 10 de julio por la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) de Reino Unido, el 4 de agosto en Canadá, y el 25 de septiembre en Japón, en todos los casos con la misma indicación que la EMA. La FDA (7 de junio de 2024) y la Comisión Europea (26 de agosto de 2024) autorizaron la ampliación de la indicación a personas de 50 a 59 años de edad con mayor riesgo de contraer enfermedad del tracto respiratorio inferior por VRS (enfermedad pulmonar crónica con síntomas que restringen la actividad o con medicación crónica, enfermedad cardiovascular crónica, diabetes mellitus tipo 1 y tipo 2, enfermedad renal crónica y enfermedad hepática crónica); la eficacia en este grupo se infirió al cumplir criterios de no inferioridad en cuanto a inmunogenicidad comparado con los estudios pivotales en personas de 60 años o más donde se demostró la eficacia (Ferguson M, 2024). Los datos de un estudio fase 3 en 530 adultos de 50 años o más presentado en el Congreso de la Sociedad Europea de Medicina Geriátrica (Valencia, 18-20 de septiembre de 2024) respaldan la coadministración de Arexvy y Shingrix (ambas adyuvadas con AS01) con un perfil de seguridad y reactogenicidad aceptable. El 7 de enero de 2025 la FDA modificó las fichas técnicas de Abrysvo y Arexvy para incluir que los resultados de un estudio observacional poscomercialización sugieren un mayor riesgo de síndrome de Guillain-Barré durante los 42 días posteriores a la vacunación.
En un estudio de casos y controles negativos para evaluar la efectividad en los 90 días tras RSVPreF3+AS01 (Arexvy) y RSVPreF (Abrysvo) frente a la infección por VRS, la visita a urgencias o la hospitalización en adultos de 60 años o más desde octubre de 2023 hasta abril de 2024, la EV estimada fue del 75,1 % (IC95 %: 73,6 a 76,4) contra la infección respiratoria y fue similar para los de 60 a 74 años y los de 75 años o más, y frente a las visitas a urgencia u hospitalizaciones. Para los pacientes inmunodeprimidos, la EV osciló entre el 67,0 % (IC95 %: 62,6 a 70,9) para los de 60-74 años y del 73,1 % (IC95 %: 69,9 a 76,0) para los mayores de 75 años. En el subgrupo de los receptores de trasplante de células madre, la EV fue del 29,4 % (IC95 %: 3,5 a 48,4) para los de 60 a 74 años y del 44,4 % (IC95 %: 1,0 % a 68,8) para los mayores de 75 años (Fry SE, 2025).
- Una vacuna de ARNm de Moderna (mRNA-1345, monovalente VRS A, no adyuvada), mRESVIA, fue aprobada por la FDA el 31 de mayo de 2024. El Comité de Medicamentos de Uso Humano (CHMP) de la EMA recomendó su autorización el 28 de junio de 2024, siendo aprobada por la Comisión Europea el 23 de agosto de 2024. La EV, con datos de la ficha técnica de la FDA, a los 3,7 meses de seguimiento, es del 78,7 % (IC95 %: 62,8 a 87,9) para la prevención de IRTI por VRS con 2 o más síntomas, y del 80,9 % (IC9 5%: 50,1 a 92,7) para IRTI-VRS con 3 o más síntomas. A los 8,6 meses de seguimiento, fue del 62,5 % y 61,1 % respectivamente, siendo la EV distinta según edad para IRTI-VRS con 2 o más síntomas: 58,8 % para personas de 60 a 69 años, 78,0 % entre los70 y 79 años, y del -20 % a partir de los 80 años. A los 18 meses de seguimiento, la EV fue del 50 %.
Recomendaciones de Comités Asesores de Inmunizaciones
El 7 de junio de 2023, el Comité Asesor de Vacunaciones e Inmunizaciones del Reino Unido (JCVI) consideró que un programa de vacunación para los adultos de 75 o más años puede ser coste/efectivo, con una campaña que incluyera de inicio una repesca de varias cohortes, sin preferencias por ninguna de las dos vacunas RSVpreF que están disponibles. La campaña se inicia el 1 de septiembre de 2024 para personas entre 75 y 79 años.
El 21 de junio de 2023, el Comité Asesor sobre Prácticas de Inmunización (ACIP) recomendó que los adultos ≥60 años puedan recibir una dosis única de la vacuna contra el virus respiratorio sincitial (VRS), mediante la toma de decisiones clínicas compartidas. El 26 de junio de 2024, ACIP votó actualizar estas recomendaciones indicando una dosis única de vacuna frente al VRS para todos los adultos de ≥75 años y los adultos de 60 a 74 años que tienen un mayor riesgo de enfermedad.
En el documento de la Ponencia de Vacunas “Evaluación de la vacunación frente a VRS en población adulta”, aprobado por la CSP el 21 de noviembre de 2024, no se establecen recomendaciones de vacunación frente al VRS en la población adulta. Se recomienda volver a realizar una evaluación a medida que se obtenga más evidencia científica.
En ese documento se hacen algunas consideraciones, como:
- La vacunación frente al VRS en población adulta se realizaría con el objetivo de evitar hospitalizaciones y mortalidad asociada a la infección por VRS en la población más vulnerable. Hasta ahora solo se ha establecido un programa de vacunación a nivel poblacional en EE. UU. en la temporada 2023-2024. Varios países de nuestro entorno recomiendan la vacunación para la temporada 2024-2025 en población a partir de los 60 o los 75 años de edad y en personas con condiciones de riesgo, encontrándose alta heterogeneidad entre las recomendaciones
- La vacunación en adultos mayores podría influir favorablemente en la epidemiología de otras infecciones víricas y bacterianas, que suelen asociarse a la infección por VRS, pudiendo reducir el uso de antibióticos y con ello las resistencias antimicrobianas
- Respecto a las posibles estrategias, si se dirige sólo a la población con mayor riesgo de enfermedad grave puede tener una mejor aceptación por la mayor percepción de riesgo, tanto por parte del paciente como por el personal sanitario
- En la introducción de la vacunación frente al VRS en población adulta habría que tener en cuenta ciertos aspectos asistenciales y logísticos: aumento en la carga asistencial para administración de vacunas estacionales, reconstitución o descongelación según la vacuna, coadministración, etc
- El conocimiento y la percepción del riesgo de VRS, así como la necesidad, y el momento, en su caso, de revacunación, que se encuentra actualmente en estudio, pueden influir en la aceptación y la confianza en el programa de vacunación
12. Bibliografía
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. An Pediatr (Barc). 2026;104:504051.
- American Academy of Pediatrics. Respiratory Syncytial Virus. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 628-36.
- Andina Martínez D, et al. Impact of universal Respiratory Syncytial Virus prophylaxis in Spain Working Group. Nirsevimab and Acute Bronchiolitis Episodes in Pediatric Emergency Departments. Pediatrics. 2024;154:e2024066584.
- Andina Martínez D, et al; Impact of Universal Respiratory Syncytial Virus Prophylaxis in Spain Working Group. Nirsevimab and Acute Bronchiolitis Admissions in Infants Under One Year of Age. Pediatr Pulmonol. 2025;60:e71249.
- Arbetter D, et al. Lower respiratory tract infections following respiratory syncytial virus monoclonal antibody nirsevimab immunization versus placebo: Analysis from a Phase 3 randomized clinical trial (MELODY). Clin Infect Dis. 2025;81:634-44
- Ares-Gómez S, et al. NIRSE-GAL study group. Effectiveness and impact of universal prophylaxis with nirsevimab in infants against hospitalisation for respiratory syncytial virus in Galicia, Spain: initial results of a population-based longitudinal study. Lancet Infect Dis. 2024;24:817-28.
- Assad Z, et al. Nirsevimab and Hospitalization for RSV Bronchiolitis. N Engl J Med. 2024;391:144-54.
- Barbas Del Buey JF, et al. The effectiveness of nirsevimab in reducing the burden of disease due to respiratory syncytial virus (RSV) infection over time in the Madrid region (Spain): a prospective population-based cohort study. Front Public Health. 2024;12:1441786.
- Biagi C, et al. Current State and Challenges in Developing Respiratory Syncytial Virus Vaccines. Vaccines (Basel). 2020;8:672.
- Bon L, et al. The assessment of future RSV immunizations: How to protect all infants? Front Pediatr. 2022:10;98174.
- Coma E, et al. Effectiveness of Nirsevimab Immunoprophylaxis Against Respiratory Syncytial Virus-Related Outcomes in Hospital and Primary Care Settings: A Retrospective Cohort Study in Infants in Catalonia (Spain). Arch Dis Child. 2024;109:736-41.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026. [Internet]. Madrid: AEP; 2026.
- DeSilva, M. RSVpreF Vaccine, Preterm Birth, and Small for Gestational Age at Birth. Preliminary Results from The Vaccine Safety Datalink. Meeting of ACIP. Centers for Disease Control and Prevention. October 23, 2024.
- den Hartog G, et al. Decline of RSV-specific antibodies during the COVID-19 pandemic. Lancet Infect Dis. 2023;23:23-25.
- Diethelm-Varela B, et al. New Developments and Challenges in Antibody-Based Therapies for the Respiratory Syncytial Virus. Infect Drug Resist. 2023;16:2061-74.
- Domachowske J, et al. Safety of Nirsevimab for RSV in Infants with Heart or lung disease or Prematurity. N Engl J Med. 2022;386:892-4.
- Drysdale S, et al. HARMONIE Study Group. Nirsevimab for Prevention of Hospitalizations Due to RSV in Infants. N Engl J Med. 2023;389:2425-35.
- Drysdale SB, et al. Priorities for developing respiratory syncytial virus vaccines in different target populations. Sci Transl Med. 2020;12:eaax2466.
- Ernst C, et al. Impact of nirsevimab prophylaxis on paediatric respiratory syncytial virus (RSV)-related hospitalisations during the initial 2023/24 season in Luxembourg. Eurosurveillance. 2024;29:pii=2400033.
- Esposito S, et al. Coadministration of Anti-Viral Monoclonal Antibodies With Routine Pediatric Vaccines and Implications for Nirsevimab Use: A White Paper. Front. Immunol. 2021;12:708939.
- European Centre for Disease Prevention and Control. Intensified circulation of respiratory syncytial virus (RSV) and associated hospital burden in the EU/EEA – 12 December 2022. ECDC: Stockholm; 2022.
- Ezpeleta G, et al. Effectiveness of Nirsevimab Immunoprophylaxis Administered at Birth to Prevent Infant Hospitalisation for Respiratory Syncytial Virus Infection: A Population-Based Cohort Study. Vaccines. 2024;12:383.
- Felter C. Nirsevimab updated safety and efficacy. ACIP Presentation Slides. ACIP General Meeting. October 19-20, 2022.
- Ferguson M, et al. Noninferior Immunogenicity and Consistent Safety of Respiratory Syncytial Virus Prefusion F Protein Vaccine in Adults 50-59 Years Compared to ≥60 Years of Age. Clin Infect Dis. 2024;79:1074-84.
- Fleming-Dutra, K. Workgroup considerations regarding maternal RSV vaccine. ACIP General Meeting February 23, 2023.
- Fleming-Dutra KE, et al. Use of the Pfizer Respiratory Syncytial Virus Vaccine During Pregnancy for the Prevention of Respiratory Syncytial Virus–Associated Lower Respiratory Tract Disease in Infants: Recommendations of the Advisory Committee on Immunization Practices — United States, 2023. MMWR Morb Mortal Wkly Rep 2023;72:1115-22.
- Francisco L, et al. Nirsevimab para la prevención de la enfermedad por virus respiratorio sincitial en niños. Posicionamiento de la Sociedad Española de Infectología Pediátrica. An Pediatr (Barc). 2023;99:257-63.
- Fry SE, et al. Effectiveness and Safety of Respiratory Syncytial Virus Vaccine for US Adults Aged 60 Years or Older. JAMA Netw Open. 2025;8:e258322.
- García-García ML, et al. Impact of Nirsevimab on RSV and Non-RSV Severe Respiratory Infections in Hospitalized Infants. Influenza Other Respir Viruses. 2025;19:e70105.
- Garegnani L, et al. Palivizumab for preventing severe respiratory syncytial virus (RSV) infection in children. Cochrane Database Syst Rev. 2021;11:CD013757.
- Griffin MP, et al. Nirsevimab Study Group Single Dose Nirsevimab for Prevention of RSV in Preterm Infants. N Engl J Med. 2020;383:415-25.
- Hameed SS, et al. Early evidence of RSV vaccination impact on hospitalisation rates of older people in Scotland. Lancet Infect Dis. 2025;25:256-8.
- Hammit Ll, et al. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022;386:837-46.
- Hsiao A, et al. Effectiveness of Nirsevimab Against RSV and RSV-Related Events in Infants. Pediatrics. 2025;156:e2024069510.
- Iofrío de Arce A, et al. en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Nirsevimab y otras estrategias para la prevención de la infección por VRS. An Pediatr (Barc). 2023;99:221-3.
- Ison MG, et al. AReSVi-006 study group. Efficacy, safety, and immunogenicity of the AS01E-adjuvanted respiratory syncytial virus prefusion F protein vaccine (RSVPreF3 OA) in older adults over three respiratory syncytial virus seasons (AReSVi-006): a multicentre, randomised, observer-blinded, placebo-controlled, phase 3 trial. Lancet Respir Med. 2025;13:517-29.
- Jabagi MJ, et al. Nirsevimab Effectiveness at Preventing RSV-Related Hospitalization in Infants. NEJM Evid. 2025;4:EVIDoa2400275.
- Jones J. Evidence to Recommendations framework for nirsevimab. ACIP General Meeting February 23, 2023.
- Jones J. Next Steps for the ACIP Maternal & Pediatric RSV Work Group. ACIP General Meeting. October 19-20, 2022.
- Juarez MV. VRS: Impacto de las estrategias implementadas a nivel global y en Argentina. En V Jornada Virtual Actualización en Inmunizaciones 2024. [Internet].
- Kampmann B, et al. MATISSE Study Group. Bivalent Prefusion F Vaccine in Pregnancy to Prevent RSV Illness in Infants. N Engl J Med. 2023;388:1451-64.
- Karron RA. Preventing respiratory syncytial virus (RSV) disease in children. Science. 2021;372:686-7.
- Li Y, et al for the RESCEU investigators. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic analysis. Lancet. 2022;399:2047-64.
- López-Lacort M, et al. Early estimates of nirsevimab immunoprophylaxis effectiveness against hospital admission for respiratory syncytial virus lower respiratory tract infections in infants, Spain, October 2023 to January 2024. Euro Surveill. 2024;29:pii=2400046.
- López-Lacort M, et al. Nirsevimab Effectiveness Against Severe RSV Infection in the Primary Care Setting. Pediatrics. 2025:155:e2024066393.
- Madhi SA, et al. Preterm Birth Frequency and Associated Outcomes From the MATISSE (Maternal Immunization Study for Safety and Efficacy) Maternal Trial of the Bivalent Respiratory Syncytial Virus Prefusion F Protein Vaccine. Obstet Gynecol. 2025;145:147-56.
- Mallah N, et al. NIRSE-GAL study group. Full 2023-24 season results of universal prophylaxis with nirsevimab in Galicia, Spain: the NIRSE-GAL study. Lancet Infect Dis. 2025;25:e62-3.
- Mazur NI, et al. Respiratory syncytial virus prevention within reach: the vaccine and monoclonal antibody landscape. Lancet Infect Dis. 2023;23:e2-21.
- Martinón-Torres F, et al. Clinical and economic burden of respiratory syncytial virus in Spanish children: the BARI study. BMC Infect Dis. 2022;22:759-64.
- Mazagatos C, et al. SARI Sentinel Surveillance RSV Study Group. 'Correction to Estimated Impact of Nirsevimab on the Incidence of Respiratory Syncytial Virus Infections Requiring Hospital Admission in Children <1 Year, Weeks 40, 2023, to 8, 2024, Spain. Influenza Other Respir Viruses. 2024;18:e13294'. Influenza Other Respir Viruses. 2024;18:e70043.
- Mejias A, et al. Respiratory Syncytial Virus Vaccines. Are We Making Progress? Pediatr Infect Dis J. 2019;38:e266-9.
- Mejias A, et al. The journey to a respiratory syncytial virus vaccine. Ann Allergy Asthma Immunol. 2020;125:36-46.
- Mensah AA, et al. Early impact of RSV vaccination in older adults in England. Lancet. 2025;405:1139-40.
- Ministerio de Salud de Chile. Instituto Sistemas Complejos de Ingeniería (ISCI) y Facultad de Medicina de la Universidad de Chile. Estudio NirseCL. Monitoreo del impacto de Nirsevimab en Chile [Internet].
- Ministerio de Sanidad. Actualización de recomendaciones de utilización de nirsevimab para la temporada 2024-2025 en España. Ponencia de Programa y Registro de Vacunaciones. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud, marzo 2024. Actualizaciones: 18 de julio y 9 de septiembre de 2024. [Internet].
- Ministerio de Sanidad. Ponencia de Programa y Registro de Vacunaciones. Evaluación de la vacunación frente a VRS en población adulta. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Noviembre 2024. [Internet].
- Ministerio de Sanidad. Inmunización pasiva con nirsevimab (Beyfortus®) frente a virus respiratorio sincitial para la temporada 2024-2025. Preguntas y respuestas para profesionales sanitarios. 13 agosto 2024. [Internet]
- Ministerio de Sanidad. Ponencia de Programa y Registro de Vacunaciones. Recomendaciones de inmunización pasiva para prevención de enfermedad grave por VRS en la población infantil. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Noviembre 2024. [Internet].
- Moline HL, et al. Early Estimate of Nirsevimab Effectiveness for Prevention of Respiratory Syncytial Virus-Associated Hospitalization Among Infants Entering Their First Respiratory Syncytial Virus Season - New Vaccine Surveillance Network, October 2023–February 2024. MMWR Morb Mortal Wkly Rep 2024;73:209-14.
- Moline HL, et al. New Vaccine Surveillance Network Collaborators. Respiratory Syncytial Virus Disease Burden and Nirsevimab Effectiveness in Young Children From 2023-2024. JAMA Pediatr. 2025;179:179-87.
- Muller WJ, et al. MELODY Study Group. Nirsevimab for Prevention of RSV in Term and Late-Preterm Infants. N Engl J Med. 2023;388:1533-34.
- Munjal I. Safety and Efficacy of Bivalent RSV Prefusion F Vaccine in Vaccinated Mothers and their Infants. ACIP General Meeting. February 23, 2023.
- Munjal I. RSVPreF Adult. Clinical development program. Meeting of ACIP. Centers for Disease Control and Prevention. October 24, 2024.
- Munro APS, et al. HARMONIE Study Group. 180-day efficacy of nirsevimab against hospitalisation for respiratory syncytial virus lower respiratory tract infections in infants (HARMONIE): a randomised, controlled, phase 3b trial. Lancet Child Adolesc Health. 2025;9:404-12.
- Navarro JA, et al. RSV: perspectives to strengthen the need for protection in all infants. Emerg Themes Epidemiol. 2021;18:15.
- Nuñez O, et al. Effectiveness of catch-up and at-birth nirsevimab immunisation against RSV hospital admission in the first year of life: a population-based case-control study, Spain, 2023/24 season. Euro Surveill. 2025;30:2400596.
- Papi A, et al. AReSVi-006 Study Group. Respiratory Syncytial Virus Prefusion F Protein Vaccine in Older Adults. N Engl J Med. 2023;388:595-608.
- Patton ME, et al. Interim Evaluation of Respiratory Syncytial Virus Hospitalization Rates Among Infants and Young Children After Introduction of Respiratory Syncytial Virus Prevention Products — United States, October 2024–February 2025. MMWR Morb Mortal Wkly Rep 2025;74:273-81.
- Pérez Marc G, et al. Real-world effectiveness of RSVpreF vaccination during pregnancy against RSV-associated lower respiratory tract disease leading to hospitalisation in infants during the 2024 RSV season in Argentina (BERNI study): a multicentre, retrospective, test-negative, case–control study. Lancet Infect Dis. 2025;9:1044-54.
- Perramon-Malavez A, et al. Introduction of nirsevimab in Catalonia, Spain: description of bronchiolitis and the Respiratory Syncytial Virus incidence in the 2023/24 season. Eur J Pediatr. 2024;183:5181-9.
- Sánchez-Luna M, et al. Trends in respiratory syncytial virus bronchiolitis hospitalizations in children less than 1 year: 2004-2012. Curr Med Res Opin. 2016;32:693-8.
- Sánchez Luna M, et al. en representación de la Junta Directiva de la Sociedad española de Neonatología SENEO Comisión de Infecciones SENEO y Comisión de Estándares de SENEO. Recomendaciones de la Sociedad Española de Neonatología para la profilaxis frente a las infecciones graves por virus respiratorio sincitial con nirsevimab, para la estación 2023-2024. An Pediatr (Engl Ed). 2023;99:264-5.
- Sánchez Luna M, et al. en representación de la Junta Directiva de la Sociedad española de Neonatología SENEO Comisión de Infecciones SENEO y Comisión de Estándares de SENEO. Recomendaciones de la Sociedad Española de Neonatología para la profilaxis frente a las infecciones graves por virus respiratorio sincitial con nirsevimab, para la estación 2024-2025. An Pediatr (Engl Ed). 2024;101:364-6.
- Simões EAF, et al. Efficacy of nirsevimab against respiratory syncytial virus lower respiratory tract infections in preterm and term infants, and pharmacokinetic extrapolation to infants with congenital heart disease and chronic lung disease: a pooled analysis of randomised controlled trials. Lancet Child Adolesc Health. 2023;7:180-9.
- Simões E, et al. Pooled efficacy of nirsevimab against RSV lower respiratory tract infection in preterm and term infants. ESPID 2022 Congress; May 9-13. Hybrid Congress.
- Simões EAF, et al. Prefusion F Protein-Based Respiratory Syncitial Virus Inmunization in Pregnancy. N Eng J Med. 2022;386:1615-26.
- Simões EAF, et al. Efficacy, Safety, and Immunogenicity of the MATISSE (Maternal Immunization Study for Safety and Efficacy) Maternal Respiratory Syncytial Virus Prefusion F Protein Vaccine Trial. Obstet Gynecol. 2025;145:157-67.
- Sinha A. Clesrovimab (MK-1654): Pediatric Clinical Program. Meeting of ACIP. Centers for Disease Control and Prevention. October 23, 2024.
- Societá Italiana di Pediatria. Posizione del Board del Calendario Vaccinale per la Vita e della Società Italiana di Neonatologia sul possibile utilizzo di anticorpi monoclonali a lunga emivita per la prevenzione universale delle malattie da Virus Respiratorio Sinciziale.
- Société Française de Pédiatrie, Groupe de Pathologie Infectieuse Pédiatrique, Association Française de Pédiatrie Ambulatoire et Conseil National Professionnel de Pédiatrie. Stratégie de prévention des bronchiolites à VRS des nourrissons Avis des Sociétés Savantes Françaises de Pédiatrie.
- Societé Pédiatrique de Pneumologie et Allergologie. Position de la SP2A sur les stratégies de prévention de la bronchiolite.
- Sumsuzzman DM, et al. Real-world effectiveness of nirsevimab against respiratory syncytial virus disease in infants: a systematic review and meta-analysis. Lancet Child Adolesc Health. 2025;9:393-403.
- Taveras J, et al. Preventive Strategies for Respiratory Syncytial Virus Infection in Young Infants. Neoreviews. 2020;21:e535-45.
- The Joint Committee on Vaccination and Immunisation (JCVI). Respiratory syncytial virus (RSV) immunisation programme: JCVI advice, 7 June 2023. Last updated 11 September 2023.
- The Joint Committee on Vaccination and Immunisation (JCVI). Respiratory syncytial virus (RSV): maternal vaccination. Published 12 July 2024. Last updated 22 February 2025.
- The Joint Committee on Vaccination and Immunisation (JCVI). Respiratory syncytial virus (RSV): vaccination for older adults. Published 5 July 2024. Last updated 10 July 2025.
- Torres JP, et al. Effectiveness and impact of nirsevimab in Chile during the first season of a national immunisation strategy against RSV (NIRSE-CL): a retrospective observational study. Lancet Infect Dis. 2025;25:1189-98.
- Turalde-Mapili MWR, et al. The efficacy and safety of nirsevimab for the prevention of RSV infection among infants: A systematic review and meta-analysis. Front Pediatr. 2023;11:1132740.
- UK Health Security Agency. Respiratory syncytial virus: the green book, chapter 27a. Last updated 14 July 2025.
- Vazquez-Lopez P, et al. Changes in Care in Spanish Pediatric Emergency Departments After the First Immunization With Nirsevimab. Pediatr Emerg Care. 2025;41:365-71.
- Verwey C, et al. Review and Update of Active and Passive Immunization Against Respiratory Syncytial Virus. BioDrugs. 2023;37:295-309.
- Walsh EE, et al. RENOIR Clinical Trial Group. Efficacy and Safety of a Bivalent RSV Prefusion F Vaccine in Older Adults. N Engl J Med. 2023;388:1465-77.
- Walsh EE, et al. for the RENOIR Clinical Trial Group. Efficacy, Immunogenicity, and Safety of the Bivalent Respiratory Syncytial Virus (RSV) Prefusion F Vaccine in Older Adults Over 2 RSV Seasons. Clin Infect Dis. 2025 Feb 10:ciaf061. doi: 10.1093/cid/ciaf061. Online ahead of print.
- Wang X, et al. RESCEU investigators. Global disease burden of and risk factors for acute lower respiratory infections caused by respiratory syncytial virus in preterm infants and young children in 2019: a systematic review and meta-analysis of aggregated and individual participant data. Lancet. 2024;403:1241-53.
- Weil-Olivier C, et al. Immunization technologies: Time to consider new preventative solutions for respiratory syncytial virus infections. Hum Vaccin Immunother. 2023;19:2209000.
- Wildenbeest JG, et al. for the RESCEU Investigators. The burden of respiratory syncytial virus in healthy term-born infants in Europe: a prospective birth cohort study. Lancet Respir Med. 2023;11:341-53.
- Wilkins D, et al. Durability of neutralizing RSV antibodies following nirsevimab administration and elicitation of the natural immune response to RSV infection in infants. Nat Med. 2023;29:1172-9.
- Wilkins D, et al. RSV Neutralizing Antibodies Following Nirsevimab and Palivizumab Dosing. Pediatrics. 2024;154:e2024067174.
- Williams TC, et al. the PERUKI & BronchStart Collaboration. Bivalent prefusion F vaccination in pregnancy and respiratory syncytial virus hospitalisation in infants in the UK: results of a multicentre, test-negative, case-control study. Lancet Child Adolesc Health. 2025;9:655-62.
- Xu H, et al. Estimated Effectiveness of Nirsevimab Against Respiratory Syncytial Virus. JAMA Netw Open. 2025;8:e250380.
13. Enlaces de interés
- Australian Inmunisation. Handbook. Respiratory syncytial virus (RSV)
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026
- Canadian Immunization Guide. Respiratory syncytial virus (RSV) vaccines
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: virus respiratorio sincitial
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de anticuerpos y vacunas frente al virus respiratorio sincitial
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una...y un anticuerpo. Anticuerpo del virus respiratorio sincitial
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una...y un anticuerpo. Vacuna del virus respiratorio sincitial
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre el VRS
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la inmunización frente al virus respiratorio sincitial
- CDC. Respiratory Syncytial Virus Infection (RSV)
- PATH. RSV vaccine and mAb Snapshot
- The Platform Disease: RSV
- WHO. Preferred Product Characteristics for Respiratory Syncytial Virus (RSV) Vaccines
- WHO. Global Respiratory Syncytial Virus Surveillance
14. Historial de actualizaciones
| 25 de enero de 2023 | Creación del capítulo con todos sus apartados y cambio de nombre a Manual de Inmunizaciones |
| 06 de febrero de 2023 | Actualización del apartado "Inmunogenicidad, eficacia y efectividad" y nuevas citas bibliográficas |
| 20 de marzo de 2023 | Actualización de los apartados "Inmunogenicidad, eficacia y efectividad" e "Inmunoprevención en fase de investigación". Creación de las tablas 43.1 a 43.4. Nuevas citas bibliográficas |
| 10 de abril de 2023 | Actualización de los apartados "Inmunogenicidad, eficacia y efectividad" e "Inmunoprevención en fase de investigación". Creación de la tabla 43.5 y la figura 43.5. Nuevas citas bibliográficas |
| 24 de mayo de 2023 | Actualización de los apartados "Epidemiología", "Tipos de inmunización, composición y presentación", "Inmunogenicidad, eficacia y efectividad", "Indicaciones y esquemas de inmunización" e "Inmunoprevención en fase de investigación". Sustitución de la tabla 43.5 por la figura 43.6. Nuevas citas bibliográficas |
| 13 de junio de 2023 | Actualización de los apartados "Inmunogenicidad, eficacia y efectividad" e "Inmunoprevención en fase de investigación" |
| 1 de agosto de 2023 | Cambio de título del apartado 11 de Inmunoprevención en fase de investigación a Otras estrategias de inmunoprevención. Actualización de los apartados "Tipos de inmunización, composición y presentación", "Indicaciones y esquemas de inmunización" y "Otras estrategias de inmunoprevención". Nuevas citas bibliográficas |
| 4 de diciembre de 2023 | Actualización de los apartados "Indicaciones y esquemas de inmunización" y "Otras estrategias de inmunoprevención". Nuevas citas bibliográficas |
| 1 de enero de 2024 | Actualización de los apartados "Inmunogenicidad, eficacia y efectividad" y "Otras estrategias de inmunoprevención". Nuevas citas bibliográficas y enlace de interés |
| 14 de marzo de 2024 | Actualización de los apartados "Inmunogenicidad, eficacia y efectividad" y "Otras estrategias de inmunoprevención". Nuevas citas bibliográficas |
| 13 de agosto de 2024 | Actualización de todos los apartados, excepto "Introducción" y "Epidemiología de la enfermedad". Fusión de todas las tablas anteriores en la 43.1. Se eliminan las figuras 43.5 y 43.6. Nuevas citas bibliográficas y enlaces de interés |
| 26 de agosto de 2024 | Actualización del apartado "Otras estrategias de inmunoprevención" con la autorización en Europa de mRESVIA |
| 13 de noviembre de 2024 | Actualización de los apartados "Inmunogenicidad, eficacia y efectividad", "Efectos adversos" y "Otras estrategias de inmunoprevención". Nuevas citas bibliográficas |
| 2 de diciembre de 2024 | Actualización de los apartados "Indicaciones y esquemas de inmunización" y "Otras estrategias de inmunoprevención". Nuevas citas bibliográficas |
| 1 de enero de 2025 | Actualización de los apartados "Epidemiología de la enfermedad", "Inmunogenicidad, eficacia y efectividad", subapartados "Nirsevimab" y "RSVPref", "Efectos adversos" y "Otras estrategias de inmunoprevención", subapartados "Inmunización directa a lactantes mayores y niños pequeños" y "Inmunización directa para personas mayores de 60 años". Nuevas citas bibliográficas y enlaces de interés |
| 11 de febrero de 2025 | Actualización del apartado "Efectos adversos". Nueva cita bibliográfica |
| 14 de mayo de 2025 | Actualización de los apartados "Indicaciones y esquemas de vacunación" y "Efectos adversos" y los subapartados "Impacto del uso de nirsevimab", "RSVpreF", " Estrategias de inmunización frente al VRS en otros países" e "Inmunización directa para personas mayores de 60 años". Nuevas citas bibliográficas |
| 20 de agosto de 2025 | Actualización de los apartados “Impacto del uso de nirsevimab”, “Eficacia y efectividad de RSVPreF”, “Estrategias de inmunización frente al VRS en otros países”. Actualización de algunas citas bibliográficas e incorporación de otras nuevas |
| 1 de enero de 2026 | Nuevas citas bibliográficas y enlaces de interés |
-oOo-