Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
35. Rotavirus
Capítulo 35 - Rotavirus
- Puntos clave
- Introducción
- Virología
- Epidemiología de la enfermedad
- Tipos de vacunas, composición y presentación
- Inmunogenicidad, eficacia, efectividad e impacto
- Vías de administración
- Indicaciones y esquemas de vacunación
- Pautas de vacunación mixtas y aspectos legales
- Recomendaciones de vacunación
- Administración con otras vacunas y otros productos
- Efectos adversos
- Contraindicaciones y precauciones
- Seguridad y observaciones sobre la invaginación intestinal
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tabla y figuras incluidas en el capítulo
Tabla 35.1. Principales características de las dos vacunas frente al rotavirus
Figura 35.1. Descenso mantenido en la detección de rotavirus después de la introducción de la vacuna frente al rotavirus en Reino Unido 2021-2022 y 2022-2023
Figura 35.2. Incorporación de la vacuna frente al rotavirus en el calendario nacional en el mundo. Situación en diciembre de 2025
Figura 35.3. Infografía aspectos prácticos de la vacunación frente al rotavirus
Figura 35.4. Infografía con las semanas de inicio y finalización de las 2 vacunas
Figura 35.5. Vacunación en recién nacidos de madres tratadas con anticuerpos monoclonales y otros inmunosupresores
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Rotavirus. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-35
1. Puntos clave
- El rotavirus (RV) es la causa principal de diarrea infantil grave en todo el mundo e infecta prácticamente a todos los niños en los 5 primeros años de vida, sobre todo en los primeros 2 años.
- Su transmisión es por vía fecal-oral por contacto directo y a través de los fómites.
- Tiene un periodo de incubación de 1 a 3 días y es contagiosa durante el curso clínico y hasta 8 días después del inicio del cuadro. En pacientes inmunocomprometidos se puede alargar hasta los 30 días.
- La persistencia en la infancia de una alta morbilidad por rotavirus, independientemente de la mejoría en las condiciones higiénicas y sanitarias, sitúa a la vacunación como la única estrategia con posibilidad de impacto en la prevención de la enfermedad.
- El objetivo de estas vacunas ha sido reproducir la historia natural de la infección: proteger frente a la enfermedad grave en los primeros meses de vida.
- Las vacunas se han mostrado eficaces contra la gastroenteritis por rotavirus (GEA-RV) grave, existiendo cierta evidencia de su eficacia frente a cualquier causa de diarrea y para la protección de grupo.
- Los estudios poscomercialización en los países de alto índice de desarrollo humano (IDH) en los que se vacuna sistemáticamente frente al RV indican que puede ocurrir invaginación intestinal como consecuencia de esta vacunación, pero el riesgo es bajo, de aproximadamente 1 a 5 casos por 100 000 niños vacunados, incluso en las últimas revisiones no se ha apreciado este riesgo. A pesar de ello todos los estudios de riesgo beneficio han sido favorables a la administración de la vacuna.
- Debemos mantener una vigilancia activa de las reacciones adversas de las vacunas frente al rotavirus, fundamentalmente de la posibilidad de invaginación intestinal, informando a los padres de los niños que van a ser vacunados de los beneficios y riesgos de esta vacuna, y explicando claramente los signos de alarma de invaginación intestinal, para poder actuar con rapidez y evitar las complicaciones de un diagnóstico diferido.
- Existen 2 vacunas frente al rotavirus, monovalente humana (Rotarix) y pentavalente bovina-humana (RotaTeq), ambas atenuadas y de administración oral, que han demostrado ser seguras y eficaces frente a la enfermedad y que no interfieren con las vacunas del calendario vigente.
- Las vacunas están contraindicadas en caso de antecedente de invaginación intestinal o de cualquier causa que la predisponga y en la inmunodeficiencia combinada grave.
- Se recomienda la vacunación frente al rotavirus en todos los lactantes.
- La Comisión de Salud Pública del Sistema Nacional de Salud aprobó la inclusión de esta vacuna en toda España en 2024, dando de plazo para su incorporación en todas las CC. AA. antes del final de 2025. Actualmente todas lo han cumplido, aunque Andalucía lo ha hecho en enero de 2026.
2. Introducción
La gastroenteritis aguda (GEA), cuya expresión clínica es un cuadro de diarrea y vómitos, es una de las enfermedades más comunes en niños y la segunda causa de morbilidad y mortalidad en la edad infantil a escala mundial. La causa más frecuente es la infección gastrointestinal y el principal agente el rotavirus del grupo A.
La gastroenteritis por rotavirus (GEA-RV) afecta a todos los niños. Los estudios indican que a la edad de 5 años casi todos ellos han desarrollado anticuerpos contra el RV. Se asocia a una mayor gravedad que la causada por otros agentes infecciosos, con más riesgo de deshidratación y de necesidad de hospitalización, dándose principalmente entre los 6 y 24 meses de edad.
La historia natural de la enfermedad muestra una alta incidencia de infecciones repetidas en los 2 primeros años de vida, gran parte de ellas poco sintomáticas, y una disminución de la gravedad del cuadro clínico con el número de infecciones.
No existen grupos de riesgo identificables para una mayor carga de enfermedad, salvo los prematuros, que son especialmente vulnerables a esta infección, con cuadros potencialmente más graves que los lactantes a término (Ministerio Sanidad 2019).
Las mejoras higiénico-sanitarias tienen un impacto limitado en el control de la gastroenteritis aguda por RV (GEA-RV), por lo que la vacunación es la mejor manera de prevenir la enfermedad.
3. Virología
El género Rotavirus pertenece a la familia Reoviridae, que son virus icosaédricos sin envoltura y con genoma segmentado de ARN de doble hélice. En 1973, un equipo australiano dirigido por Ruth Bishop, descubrió al microscopio electrónico un nuevo virus en heces y muestras de biopsia duodenal de niños con diarrea grave, clasificándolo como un tipo de orbivirus. En 1974, Flewett denominó a estos nuevos virus como rotavirus por su aspecto de rueda (“rota” en latín), nombre que fue oficialmente reconocido por el Comité Internacional de Taxonomía de Virus cuatro años más tarde.
Los rotavirus (RV) son virus sin envuelta lipídica, con un genoma compuesto por 11 segmentos de ARN de doble cadena, que codifica codifican 6 proteínas estructurales (VP1, VP2, VP3, VP4, VP6 y VP7) y 6 no estructurales (NSP), y una cápside con tres capas proteicas: una capa interna formada VP2 donde se encuentra el genoma y las proteínas VP1 y VP3, una capa media formada por VP6 y una capa externa compuesta mayoritariamente por VP7, desde la cual se proyectan hacia el exterior de la superficie del virus 60 espículas de VP4. VP4 y VP7, tienen determinantes antigénicos que inducen la producción de anticuerpos neutralizantes, por lo que son los objetivos inmunológicos de las vacunas para generar anticuerpos protectores.
Según la proteína VP6 se definen los serogrupos (de la A hasta la J). Los serogrupos A (>90 %), B y C pueden producir infecciones en humanos, aunque habitualmente los 2 últimos infectan a animales.
El genotipado del RV se basa en el análisis de las secuencias de los genes que codifican las proteínas VP7 (G de glicoproteína) y VP4 (P de proteína sensible a proteasas) y la clasificación en genotipos se realiza por un sistema binario basado en estas dos proteínas: VP7 (número detrás de la G) y VP4 (número entre corchetes detrás de la P). Así, se han descrito más de 60 combinaciones de G y P en humanos, siendo 5 cepas (G1P[8], G2P[4], G3P[8], G4P[8] y G9P[8]) las responsables del 80-90 % de la carga mundial de la morbilidad infantil. Las proteínas G y P son los objetivos inmunológicos de las vacunas para generar los anticuerpos que protegen contra enfermedad y reinfección.
A pesar de que el sistema de genotipado binomial G/P se ha utilizado ampliamente, no permite analizar de manera completa la variabilidad genética, la dinámica evolutiva y las interacciones entre los diferentes genotipos de RV que se encuentran cocirculando en la población. Además, con las actuales técnicas de secuenciación masiva que permiten tener cada vez mayor número de secuencias de genomas completos, el sistema de clasificación binomial está siendo reemplazado por el de tipado basado en el genoma completo asignando un genotipo a cada uno de los 11 segmentos genómicos. De esta forma, se clasifican los RV en tres constelaciones genotípicas llamadas Wa-like, DS-1-like y AU-1-like9. Las constelaciones Wa- y DS-1-like son las más frecuentes en humanos. Los genotipos G1P[8], G3P[8], G4P[8], G9P[8] y G12P[8] se asocian a la constelación genotípica Wa-like, mientras que G2P[4], G8P[4] o G8P[6] se asocian generalmente a una constelación DS-1-like76.
4. Epidemiología de la enfermedad
La GEA-RV ocurre típicamente en picos durante el invierno en zonas de clima templado del mundo, mientras que en los países tropicales ocurren durante todo el año. Antes de la introducción de las vacunas frente al RV en los calendarios sistemáticos de muchos países del mundo, en los países con bajo índice de desarrollo humano (IDH) la GEA-RV en menores de 5 años causaba unos 114 millones de casos al año, de los cuales más de 20 millones eran graves, y entre 500 000 y 800 000 muertes (uno de cada 205 niños fallecía debido a la deshidratación). Estas cifras se han reducido gracias a la introducción de la vacunación en los programas de inmunización de muchos países, En 2016 la infección por RV fue responsable de más de 258 millones de episodios de diarrea en población infantil menor de 5 años (intervalo de incertidumbre (II) 95 %: 193 millones a 341 millones), con una incidencia de 0,42 casos por niño-año (II 95 %: 0,30-0,53). Todavía hoy, tras la introducción de la vacunación en los programas de inmunización de muchos países, se producen unas 200 000 muertes al año (Hartman 2023).
En el resto de países, la mortalidad por RV es muy baja, siendo sin embargo una causa importante de morbilidad y de hospitalización en niños pequeños.
En Europa, la GEA-RV provoca entre 75 000 y 150 000 hospitalizaciones y hasta 600 000 visitas médicas al año. El último informe disponible de la red EuRotaNet, que incluye a trece países europeos, incluyendo a España, fue publicado en marzo de 2025 y recoge datos desde 2006 hasta la temporada 2022-2023. En esa última temporada, G3P[8] fue el genotipo más prevalente (74 %), y en todos los países. Siete genotipos tuvieron una prevalencia >1 %: G1P[8], G8P[8], G2P[4], G9P[8], G3P[8], G12P[8] y G9P[4]. Al igual que en 2021/22, G3P[8] fue el genotipo más prevalente, detectado en el 74 % de las detecciones de cepas individuales, y fue el más prevalente en todos los países de EuroRotaNet. Se observó una importante disminución en el número absoluto y la proporción de cepas de G1P[8] y G2P[4] en países con y sin programas de vacunación. No se ha detectado un número significativo de nuevas cepas emergentes ni hay evidencia de aparición de cepas de escape por los programas de vacunación.
Además, en la temporada 2022/23 se detectaron seis cepas únicas, potencialmente zoonóticas, previamente observadas en bovinos u otros rumiantes. Su carácter zoonótico requiere confirmación mediante secuenciación genómica. No se ha registrado un aumento significativo de nuevas cepas emergentes.
En España, se han analizado los casos de RV notificados a la RENAVE durante el periodo 1995-2020 y los brotes de RV notificados durante el periodo 2002-2022. Durante el periodo 1995-2020, se notificaron un total de 69·447 casos (mínimo: 320 casos, año 2020; máximo: 4288 casos, año 2017), con una mediana de 2643 casos por año. El 91 % de los casos con información disponible eran menores de 5 años y el 56 % eran varones. Analizando el número anual de casos por grupos de edad, se observa que el mayor número de casos notificados se encuentra en la población menor de 5 años. En el periodo 1995-2005, se observó un aumento en el número de casos anuales tanto en el grupo de menores de 1 año como en el de 1-4 años. No obstante, a partir del año 2006, se observa una disminución de casos en menores de 1 año, mientras que en el grupo de 1-4 años la tendencia fue ascendente desde 2010, estabilizándose a partir del año 2015. Este aumento del número de casos en el grupo de edad de 1-4 años puede deberse a que la población no vacunada tiene menos exposición a RV y a lo largo del tiempo forman grupos de población susceptibles de infección (Ministerio de Sanidad 2024).
El RV infecta a casi todos los niños durante la infancia o la primera infancia. La transmisión se produce a través de la vía fecal-oral a través del contacto personal cercano y a través de fómites.
El período de incubación es de uno a tres días, después del cual la enfermedad puede comenzar abruptamente, con fiebre y vómitos que a menudo preceden al inicio de la diarrea. Hasta un tercio de los niños desarrollará fiebre alta. La enfermedad suele durar entre tres y ocho días.
Los niños con RV son infecciosos mientras presentan síntomas y hasta aproximadamente ocho días después de la aparición de estos. Los pacientes inmunodeprimidos pueden ser infecciosos hasta 30 días después del inicio de los síntomas. Durante la fase aguda de la enfermedad se eliminan grandes cantidades de RV en las heces y solo se requieren unos pocos viriones para causar infección en un huésped susceptible.
La infección por RV en los primeros tres meses de vida suele ser leve o asintomática. Esto posiblemente se deba a la protección pasiva de los anticuerpos adquiridos desde la madre, la lactancia materna y la estructura celular intestinal de los recién nacidos.
El cuadro de gastroenteritis por rotavirus (GEA-RV) grave con deshidratación ocurre predominantemente en bebés y niños de entre 3 meses a 2 años. En el transcurso de la vida se tienen repetidas exposiciones al RV, pero después de la vacunación o de las infecciones en la primera infancia, estas suelen ser más leves.
El espectro clínico varía desde una infección asintomática hasta una enfermedad aguda grave con diarrea y vómitos frecuentes y de gran volumen, que provocan deshidratación, alteraciones electrolíticas y sus secuelas. El espectro de enfermedades del RV es más grave que el de otras causas comunes de diarrea en los niños.
Existen evidencias de la diseminación extraintestinal del RV con la infección natural y su implicación en manifestaciones extradigestivas, como convulsiones, leucomalacia o trastornos autoinmunes, entre otros. En un interesante estudio, los autores concluyen que las infecciones por rotavirus pueden acompañarse de manifestaciones neurológicas graves, como encefalopatía o encefalitis, pero aparentemente autolimitadas en niños previamente sanos. El origen de las mismas podría ser: a) invasión directa del sistema nervioso, b) la llamada ruta nerviosa por la liberación de mediadores como la serotonina que activa el sistema nervioso entérico, y c) como parte de una respuesta inmune coordinada mediada por citoquinas y toxinas. La prevalencia de manifestaciones neurológicas se estima en el 2-5 %, mientras que la concomitancia de convulsiones febriles y afebriles con un episodio de GEA-RV entre 1,2 y 6,4 %.
5. Tipos de vacunas, composición y presentación
Las dos vacunas disponibles en Europa son (tabla 35.1):
- Monovalente humana atenuada (Rotarix, de GlaxoSmithKline Biologicals): la cepa inicial era un rotavirus humano con especificidad G1 P[8] aislado de un niño con gastroenteritis. Esta cepa fue clonada y pasada por cultivos de células Vero para su atenuación, obteniéndose la cepa vacunal RIX4414. Incluye como aditivo sacarosa.
- Pentavalente bovina-humana reordenada (RotaTeq, de MSD): utiliza la cepa de rotavirus bovino WC3. Contiene cinco cepas atenuadas, obtenidas por recombinación genética entre esta cepa y cepas de rotavirus humanos, que expresan cada una la proteína de superficie VP7 de los rotavirus humanos de los tipos G1, G2, G3 y G4 y la proteína VP4 del rotavirus humano correspondiente al genotipo P[8]. Contiene sacarosa.
Ambas vacunas se presentan en formulación oral líquida en tubo precargado, y han de conservarse entre +2 y +8·ºC, con una validez de 3 años (monovalente humana) y 2 años (pentavalente bovina-humana). En el caso de Rotarix se trata de un líquido transparente e incoloro; en el de RotaTeq el líquido es transparente amarillo pálido y puede tener un tono rosado.
Tabla 35.1. Principales características de las dos vacunas frente al rotavirus.
| Nombre comercial | Rotarix | RotaTeq |
| Laboratorio | GlaxoSmithKline Biologicals | MSD Vaccines (Europa) Merck and Co., Inc. (EE. UU.) |
| Tipo de vacuna | Monovalente humana atenuada | Pentavalente bovina-humana reordenada |
| Cepas vacunales | RIX4414 | Bovina WC3 (G6P7[5]) Reordenadas humana-bovina: G1 x WC3; G2 x WC3 G3 x WC3; G4 x WC3 P[8]x WC3 |
| Tipos incluidos | G1P[8] | G1, G2, G3, G4, P[8] |
| Dosis | Dosis = 1,5 ml No menos de: - 106 CCID50 |
Dosis = 2 ml No menos de: - 2,2 x 106 UI G1 - 2,8 x 106 UI G2 - 2,2 x 106 UI G3 - 2,0 x 106 UI G4 - 2,3 x 106 UI P1[8] |
| Presentación | Líquida con buffer (carbonato de calcio) |
Líquida con buffer (citrato y fosfato sódico) |
CCID50 = mediana de dosis infectante en cultivo de tejidos; UI = unidades infecciosas
Las vacunas frente al RV fueron autorizadas por la Agencia Europea de Medicamentos (EMA) en 2006 (RV1 en febrero y RV5 en junio). Desde 2008, el CAV-AEP recomienda la vacunación sistemática frente al RV. También en 2008, las sociedades europeas de enfermedades infecciosas y de gastroenterología pediátricas recomendaron la vacunación sistemática, a lo que se sumó la Academia Europea de Pediatría en 2020.
La Food and Drug Administation (FDA) aprobó la vacuna RV5 en febrero de 2006, y en agosto el Advisory Committee on Immunization Practices (ACIP) recomendó la vacunación sistemática de los lactantes, a lo que se sumó la Academia Americana de Pediatría (AAP) en enero de 2007. En abril de 2008 se autorizó la vacuna RV1, actualizando tanto ACIP como AAP la recomendación de vacunación con cualquiera de los dos preparados.
En 2006, la Organización Mundial de la Salud (OMS) recomendó la inclusión de la vacunación frente al RV en los programas nacionales de inmunización de aquellas regiones y países donde los datos de eficacia de la vacuna sugirieran un impacto significativo en la salud pública y dónde hubiera una infraestructura adecuada y mecanismos de financiación disponibles. Desde 2009, recomienda que se incluya en todos los programas nacionales de inmunización.
En 2010, la comercialización de RV1 primero (29 de marzo) y posteriormente de RV5 (10 de junio) fue suspendida por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) por precaución, debido al hallazgo de fragmentos de ADN de circovirus porcino. Esta suspensión duró 5 meses en el caso de RV5 (hasta el 4 noviembre) y 6 años en el de RV1 (hasta el 13 de junio de 2016), hasta que se aseguró la desaparición del virus en el proceso de fabricación, a pesar de que su presencia en las vacunas no implicó ningún problema en cuanto a la seguridad de las mismas.
6. Inmunogenicidad, eficacia y efectividad
Todavía no están claros los factores específicos de respuesta inmune que se puedan considerar como marcador de protección. Por ello, en los ensayos con las vacunas se ha empleado como medida de inmunogenicidad la elevación sérica de los títulos de anticuerpos IgA y como medida de eficacia la disminución en la incidencia de GEA-RV en el grupo vacunado respecto al grupo control.
Inmunogenicidad
- Vacuna monovalente humana: los porcentajes de seroconversión en Latinoamérica han sido de 61-65 % tras la segunda dosis. En el estudio europeo las tasas de seroconversión observadas fueron del 80-96·% y en los estudios realizados con la formulación líquida del 88-90 %.
- Vacuna pentavalente bovina-humana: las tasas de seroconversión tras la tercera dosis han sido del 95 %.
Eficacia
-
Vacuna monovalente humana: dentro del estudio de seguridad en fase III, incluyendo a 63 225 sujetos en 11 países de Latinoamérica y en Finlandia, se realizó el análisis de eficacia en un subgrupo de 20 169 niños, observándose una protección frente a la GEA-RV grave y a la hospitalización asociada de un 85 % y frente a la hospitalización por diarrea de cualquier causa del 42 %. La protección frente a los distintos tipos G fue del 92 % frente al G1, 87 % frente al G3, G4 y G9 y del 41 % frente al G2. En el estudio de eficacia realizado posteriormente en 3994 sujetos en 6 países europeos, incluida España, la protección en el segundo año fue de un 72 % frente a cualquier GEA-RV, del 86 % frente a gastroenteritis grave y del 92 % frente a la hospitalización. Respecto a la protección frente a los distintos tipos se observó una eficacia del 96 % frente a G1P[8] y del 88 % frente a los no G1P[8].
Los estudios realizados en Asia (Hong Kong, Singapur y Taiwán) en 10 708 niños, mostraron una eficacia del 96 % frente a diarrea grave. En este mismo estudio los datos de eficacia a los tres años frente a GEA grave por RV que requiriese hospitalización fue del 100 % (IC 95 %: 72,4-100). La eficacia en países de IDH bajo se estimó con el estudio realizado en Sudáfrica (3166 niños) y en Malawi (1773 niños), evidenciándose una disminución de la GEA-RV grave del 76,9 % en Sudáfrica y del 49,4 % en Malawi, con similar eficacia en ambas poblaciones frente a los tipos G1 y los no G1. El de Malawi, además, valoraba la seguridad de la vacuna en un subgrupo de lactantes infectados por VIH, sin observarse diferencias en la reactogenicidad o aparición de efectos adversos respecto al grupo control que recibió placebo. El estudio sudafricano comparaba también la eficacia de 3 dosis frente a las 2 dosis habituales, sin evidenciarse mayor beneficio con una tercera dosis. Además, valoraba la seguridad de la vacuna en un subgrupo de lactantes infectados por VIH, sin observarse diferencias en la reactogenicidad o aparición de efectos adversos respecto al grupo control que recibió placebo.
En cuanto a la eficacia de la vacuna frente al tipo G2P[4], un estudio de casos y controles realizado en Brasil, donde este tipo ha emergido como predominante, ha mostrado una eficacia vacunal frente a la GEA-RV grave asociada a este tipo del 77 % entre los 6 y los 12 meses de edad, disminuyendo esta eficacia al 15 % en mayores de 12 meses.
- Vacuna pentavalente bovina-humana: el estudio de eficacia y seguridad en fase III realizado con esta vacuna en 68 038 sujetos de 11 países, principalmente EE. UU. y Finlandia, evidenció una disminución en las visitas a la urgencia hospitalaria o en la necesidad de hospitalización por GEA-RV de los tipos G1-G4 de un 94 % en el grupo vacunado y, según el tipo G, del 95 % en el G1, 87 % en el G2, 93 % en el G3, 89 % en el G4 y 100 % en el G9. Dentro de este estudio, en el análisis de eficacia realizado en un subgrupo de 5673 sujetos, la protección frente a cualquier GEA-RV G1-G4 fue del 74 % y frente a la grave del 98 %. Durante el segundo año la protección frente cualquier GEA-RV fue del 63 % y frente a la GEA grave del 88·%. Considerando distintas zonas geográficas, la disminución en la hospitalización y asistencia a urgencias por GEA-RV hasta 2 años después de la vacunación fue del 94,7 % en Europa, del 94,9 % en EE. UU. y del 90,4·% en América Latina. Una ampliación del estudio en 20 763 niños de Finlandia ha mostrado una eficacia mantenida hasta los 3 años de edad del 94 % frente a la hospitalización por GEA-RV.
El análisis retrospectivo de los datos de eficacia y seguridad de un subgrupo de 2070 recién nacidos prematuros, incluidos en este estudio, documentó una eficacia similar al del total de vacunados, con una protección frente a la hospitalización y atención en urgencias del 100 % y frente a cualquier GEA-RV del 73 %.
Los estudios realizados en Asia (Bangladesh y Vietnam) en 2036 lactantes y en África (Kenia, Ghana y Mali) en 5468 niños, han aportado datos de eficacia del 48,3 % frente a la enfermedad grave durante los casi 2 años de seguimiento en Asia y del 39,3 % en África.
En el conjunto de los ensayos clínicos realizados con las vacunas RV1 y RV5 se demostró eficacia frente a la gastroenteritis producida por los genotipos más comunes de RV G1P[8], G2P[4], G3P[8], G4P[8] y G9P[8], y también con RV1 frente a genotipos poco comunes de RV G8P[4] y G12P[6].
En países con IDH bajo se ha observado que la eficacia es generalmente baja para ambas vacunas si se compara con la de países con IDH alto siendo esta eficacia menor tanto frente a cepas homotípicas como heterotípicas.
Efectividad e impacto
- Vacuna monovalente humana: además del estudio de casos y controles realizado en Brasil, ya citado, el desarrollado en El Salvador y el hecho en Australia durante un brote de GEA-RV asociado a G9P[8], demostraron una efectividad del 76 % y del 84,5 %, respectivamente, frente a la hospitalización por GEA-RV. En esa misma región, dos años más tarde, no se evidenció protección vacunal frente a la hospitalización por GEA-RV G2P[4] durante un brote asociado a este tipo. Gastañaduy demuestra un 30,7 % de reducción de mortalidad en México tras la introducción en 2007 de la vacuna en calendario. En la mencionada revisión sistemática reciente, la efectividad de la vacuna monovalente fue de entre el 57 % (países menos desarrollados) y 84 % (países industrializados). Los datos de efectividad de Reino Unido, a más de cinco años de la introducción de esta vacuna en el calendario sistemático en julio de 2013, son incuestionables (figura 35.1).
- Vacuna pentavalente bovina-humana: en EE. UU. tanto el estudio de cohortes a nivel nacional como el estudio retrospectivo casos-controles realizado en Texas, ofrecieron una efectividad vacunal del 100 % frente a hospitalización por GEA-RV. El estudio casos-controles realizado en Nicaragua evidenció una efectividad del 58 % frente a la GEA-RV grave. En el estudio finlandés prospectivo durante 3 años concluido en agosto de 2012, se observó una efectividad del 92·% para la prevención de hospitalización por GEA-RV en niños correctamente vacunados. En un estudio de casos y controles de EE..UU. en el que se analizaban las hospitalizaciones y visitas a urgencias tras la vacunación mostró efectividad hasta los 7 años (91 % el primer año y 69 % entre el 6.º y 7.º años de vida). Una reciente revisión sistemática de la efectividad de las vacunas frente al rotavirus recoge una efectividad de la vacuna pentavalente de entre 45 % (países con índice de desarrollo humano (IDH) bajo) y 90 % (países con IDH elevado).
Figura 35.1. Descenso mantenido en la detección de rotavirus después de la introducción de la vacuna frente al rotavirus en Reino Unido 2021-2022 y 2022-2023.
Tomado de: Public Health England monthly national norovirus and rotavirus report. 02 July 2023.
Estudios recientes
Según VIEW-hub, a fecha 31 de diciembre de 2025, (figura 35.2) 138 países han introducido la vacunación en sus programas nacionales de inmunización (133 como sistemática, 3 en determinadas regiones) y 2 países solo en grupos de riesgo, mientras que otros 8 están en vías de introducirla. Venezuela, en 2018, ha sido el único país en suspender el programa una vez instaurado. Según esta misma fuente, en Europa son 29 los países con vacunación universal frente al RV, en otros 2 (Moldavia y Rusia) está financiada en algunas regiones, y en 2 (Portugal y San Marino) solo para grupos de riesgo. En España, ya está incluida en el calendario de todas las CC. AA. salvo en Andalucía, que lo ha anunciado para enero de 2026. Los beneficios sobre la salud han sido inmensos, con un descenso importante de la morbimortalidad debida a GEA-RV en lactantes y niños pequeños, tanto en los países de bajo IDH como en los de alto IDH. Se ha publicado recientemente una revisión de la literatura sobre la efectividad de ambas vacunas siendo los resultados francamente positivos.
En países de nuestro entorno que incluyen esta vacunación en el calendario sistemático se ha observado un descenso marcado en la circulación del RV, como se comprueba en el Reino Unido tras su introducción en 2013, apreciándose una disminución importante y mantenida de la actividad del RV de hasta un 77 % en relación con las temporadas anteriores. Se ha calculado que se ha producido un ahorro de costes de 12,5 millones de libras esterlinas por temporada por la disminución de visitas ambulatorias, a urgencias e ingresos hospitalarios, tanto en niños como en adultos.
Figura 35.2. Incorporación de la vacuna frente al rotavirus en los calendarios nacionales en el mundo. 138 países. Situación en diciembre de 2025.
Fuente: The International Vaccine Access Center (IVAC) Map Rotavirus. (Acceso Dic 2025).
En Finlandia, donde la vacunación frente al RV está incluida en el calendario vacunal desde 2009, con coberturas superiores al 95·%, se ha observado un descenso muy importante en las hospitalizaciones debidas a GEA-RV (94,4 %) tras 4 años del inicio de la vacunación sistemática. Tras 10 años de seguimiento, se mantienen los resultados de EV en el tiempo en los vacunados.
En Alemania la efectividad frente a la hospitalización por RV en niños menores de 5 años ha sido del 86 %.
En un estudio realizado en Bélgica, en 2016, se comprobó una notable disminución de la infección nosocomial asociada a la enfermedad por rotavirus tras el inicio de la vacunación universal en 2006 en el que, comparando la tasa de infección nosocomial pre y posvacunal, se apreció una reducción del 85 % en la misma y una disminución promedio de 2 días en la estancia hospitalaria
Un estudio en Argentina observó una reducción significativa del 54,0 % de los casos de GEA-RV notificados y del 39,3 % en las hospitalizaciones en menores de dos años, en los 3 años posteriores a la implementación de RV1 en calendario sistemático.
Australia incorporó la vacunación frente al RV al Programa Nacional de Inmunizaciones en julio de 2007 (RV1 o RV5 según territorio, solo RV1 desde 2017). En una revisión tras 15 años de la implementación, se ha observado que la introducción en el programa se asoció con una rápida reducción de las hospitalizaciones por GEA-RV y por todas las causas en niños elegibles para la vacunación. En el contexto de una cobertura menos completa y menor oportunidad de la vacunación, la reducción fue menos sustancial e inconsistente. No hay evidencia de la aparición de serotipos no vacunales y/o de reemplazo.
Un estudio en EE. UU. publicado en 2024, evaluó durante 13 años (2009–2022) la efectividad de la vacuna contra el rotavirus en niños de 8 a 59 meses atendidos por gastroenteritis aguda. La vacuna mostró una efectividad del 78 % para prevenir visitas a urgencias u hospitalizaciones, siendo más alta frente a los casos graves (hasta 94 %). También ofreció protección frente a los genotipos más comunes. La efectividad fue mayor en menores de 3 años y disminuyó con la edad.
En nuestro país, en la Comunidad Valenciana, el impacto de la vacunación, aun con coberturas medias de entre el 40 y el 42 %, ha ocasionado un descenso de los ingresos hospitalarios por GEA-RV del 67-71 %, dependiendo de la edad, lo que supuso un ahorro de 6 millones de euros/100 000 niños en 7 años, por las estancias evitadas. Un estudio posterior refrenda la importante carga de la enfermedad en España y la efectividad de las vacunas disponibles a través de una revisión sistemática de los estudios realizados en nuestro entorno, ya que las vacunas frente al RV han mostrado en España una efectividad de entre el 83 y el 96 % y un impacto de hasta un 70 % de reducción de hospitalizaciones, dependiente de la cobertura de vacunación alcanzada, apoyando por tanto la inclusión de la vacunación en el calendario sistemático.
Un metaanálisis sobre la relación entre la vacuna frente al RV y la reducción de gastroenteritis en menores de 5 años concluye que existe evidencia sobre la alta y mantenida protección de las vacunas frente al RV y reafirma el bajo riesgo de sus efectos indeseables en menores de 2 años. Los datos agrupados sugieren que ambas vacunas confieren protección frente a la GEA-RV grave causada por las cepas G1, G2, G3, G4, G9 y P[8], no habiéndose observado diferencias significativas entre la protección frente a cepas parcial o totalmente heterotípicas en comparación con las homotípicas, hecho que es de vital relevancia en los países de bajo IDH en los que es fácil que circulen cepas de distintos genotipos simultáneamente. La revisión concluye dando apoyo a incrementar las tasas de vacunación en todo el mundo.
Aunque las vacunas contra el rotavirus inducen cierta protección cruzada entre distintos genotipos (protección heterotípica), esta no parece depender exclusivamente de los anticuerpos neutralizantes específicos contra los genotipos VP4/VP7. Esto se apoya en el hecho de que, a pesar del número limitado de genotipos circulantes a nivel global, no se observa una evolución antigénica similar a la del virus de la gripe. Además, aunque se identifican patrones cíclicos de aparición de ciertos genotipos -lo que sugiere una inmunidad específica frente a ellos-, la introducción de nuevas variantes no suele asociarse con mayor gravedad, lo que indicaría la existencia de otros mecanismos de protección aún poco conocidos.
Un análisis global de estudios realizados entre 2005 y 2023 (Amin, 2023) examinó si los cambios en la distribución de genotipos de rotavirus tras la introducción de vacunas se deben a una presión selectiva inducida por la vacuna o a fluctuaciones naturales en el tiempo. Al agrupar datos de 361 estudios, se observó una mayor prevalencia del genotipo no vacunal G2P[4] en países que introdujeron la vacuna, especialmente en los primeros años tras su implementación. Sin embargo, al analizar los datos longitudinales más detallados -como los de América- no se encontraron evidencias claras de que estos cambios se mantuvieran a largo plazo. En conclusión, el aumento de G2P[4] tras la vacunación podría ser un fenómeno temporal, sin indicios sólidos de una presión selectiva sostenida provocada por la vacuna.
De hecho, no hay evidencia con más de 15 años desde el inicio del uso de la vacuna de que los programas de vacunación frente al RV conlleven la aparición y el aumento de casos por genotipos no cubiertos por la vacuna. Los cambios en la distribución de genotipos deben ser interpretados en el contexto de las fluctuaciones naturales que también se observan en países sin programa de vacunación y que también existían antes de la introducción de las vacunas. El reemplazo de los genotipos por la vacunación no tiene una evidencia sólida.
Es fundamental establecer un sistema de vigilancia de la enfermedad por RV continuada en el tiempo, año tras año y a nivel nacional, para conocer los genotipos circulantes tanto antes como después de la introducción de la vacuna usando tanto el genotipado binomial clásico G/P como de genomas completos, que permitan detectar la emergencia de cepas que pudieran escapar de la protección de las vacunas.
Beneficios indirectos
Los beneficios que se obtienen con esta vacunación, tanto directos sobre los lactantes vacunados como indirectos en forma de protección de grupo en convivientes o en niños de otras edades no vacunados, son muy claros aun cuando estos efectos son más evidentes en los países con alto IDH, comparado con aquellos que lo tienen menor, y están parcialmente relacionados con las tasas de coberturas vacunales. Habiéndose, incluso, demostrado reducciones en las hospitalizaciones por GEA no causadas por RV en los grupos de edad vacunados y en las tasas de hospitalización por GEA-RV y no debidas a RV en los grupos de mayor edad.). La protección que confiere la vacuna podría hacerse, incluso, extensiva a los adultos, tal y como sugieren estudios recientemente publicados en Irlanda.
Por otra parte, existen evidencias de la diseminación extraintestinal del RV con la infección natural y su implicación en manifestaciones extradigestivas, como convulsiones, si bien estos hallazgos no han sido encontrados en otros estudios.
Un estudio reciente sobre los predictores del efecto indirecto de la vacunación frente al rotavirus concluyó que esta puede generar beneficios indirectos, aunque con variabilidad entre países. A los ocho años de su implementación, se observó un efecto indirecto positivo en todas las regiones de la OMS, especialmente en países con alta mortalidad infantil, buena cobertura vacunal y bajas tasas de natalidad. Sin embargo, en el 16 % de los países analizados se identificaron períodos con efecto indirecto negativo, donde la población no vacunada presentó mayor carga de enfermedad. Este fenómeno fue más común en países con alta natalidad, baja mortalidad infantil y menor cobertura vacunal.
Por otro lado, una actual revisión sistemática (Ong DS, Vaccines, 2025) incluyó 44 estudios con más de 9 millones de participantes, evaluando el impacto de la introducción nacional o regional de la vacuna en distintos grupos etarios. En niños no vacunados menores de 5 años, se observaron reducciones significativas en hospitalizaciones y consultas ambulatorias por GEA por rotavirus, así como en la positividad de rotavirus en muestras fecales. Estos efectos indirectos fueron más pronunciados en países de altos ingresos y con menor mortalidad infantil. Los datos sobre adolescentes y adultos fueron escasos, pero sugieren beneficios potenciales. Estos hallazgos resaltan la importancia de considerar los efectos indirectos al evaluar el impacto global y la costo-efectividad de los programas de inmunización contra rotavirus.
En un análisis sobre el coste/efectividad de la inclusión de la vacuna de forma sistemática en los calendarios de inmunización en un país con bajas tasas de mortalidad, como es Japón, concluye que el beneficio económico sería favorable, incluso desde el punto de vista del proveedor de servicios sanitarios, en un escenario en el que se valore pormenorizadamente el efecto protector de la vacuna en todos los ámbitos (ingresos, consultas, protección de grupo…).
En nuestro país se han evaluado los costes económicos de la enfermedad por RV por Álvarez Aldeán y cols, estimándose estos en aproximadamente 28 millones de € al año atribuibles al sistema sanitario y unos 50 millones de €/año desde la perspectiva social, con una pérdida de la productividad de sus padres o cuidadores en dos tercios de los casos.
En noviembre de 2022 ha sido publicado en nuestro país un informe realizado por la Agencia de Evaluación de Tecnologías Sanitarias, dependiente del Instituto de Salud Carlos III con los objetivos de evaluar:
- La seguridad, eficacia, efectividad y eficiencia de distintas estrategias de vacunación frente a rotavirus en menores de un año
- La eficiencia de la vacunación universal y de la vacunación a población de riesgo en comparación con la no vacunación
Y estimar el posible impacto presupuestario que podría tener la implantación de la vacunación universal frente al rotavirus en España. El estudio de elevada calidad y complejidad y de lectura recomendable para aquellos interesados en el tema extrae, entre otras, las siguientes conclusiones:
- Las dos vacunas disponibles en España frente al rotavirus presentan un buen perfil de seguridad
- Estas mismas vacunas han demostrado una eficacia elevada en la prevención de GEA-RV
- En nuestro país se observa una reducción relevante en las tasas de hospitalización por GEA-RV en los últimos años, lo cual coincide a su vez con un incremento progresivo de la cobertura de vacunación hasta niveles elevados en 2020, aunque esta vacunación se lleva a cabo, mayoritariamente por vía privada
- En comparación con el escenario de ausencia de vacunación, la vacunación universal conseguiría un impacto mucho mayor que la estrategia de vacunación a población de riesgo en cuanto a reducción de eventos clínicos
- La vacunación universal sería eficiente con Rotarix con precios entre 111,85 y 118,20 € la vacunación completa y con RotaTeq entre 108,70 y 115,50 € la vacunación completa
- Desde el punto de vista ético y social, la incorporación de la vacunación universal permitiría disminuir las actuales desigualdades en el acceso
En enero de 2024, el Grupo de Trabajo de vacunación frente al rotavirus de la Ponencia de Programa y Registro de Vacunaciones estableció que la vacunación frente al RV reduciría la incidencia de GEA en la población infantil. Desde la perspectiva social, la introducción de esta vacuna resulta eficiente con un precio de la pauta completa de RV1 igual o menor a 118,20 euros y con RV5 de 115,50 euros. En este caso, se recomienda la vacunación frente al RV en lactantes a partir de las 6 semanas de vida, pudiendo utilizar cualquiera de las dos vacunas disponibles. Aunque en lactantes con edad gestacional inferior a la que figura en las fichas técnicas (≥25 semanas en RV5 y ≥27 semanas en RV1) se deberá utilizar la vacuna permitida. Finalmente, la Comisión de Salud Pública aprobó la inclusión de esta vacuna en toda España, dando de plazo para su incorporación en todas las CC. AA. antes del final de 2025.
Un estudio realizado en la Región de Murcia analizó la cobertura de las vacunas no financiadas contra el meningococo B (MenB) y el rotavirus en lactantes menores de un año, así como los factores socioeconómicos asociados a su acceso. Los resultados mostraron que solo el 34,7 % recibió dos dosis de MenB y el 56,7 % completó la pauta de rotavirus. La nacionalidad española de los progenitores fue el factor más fuertemente asociado a una mayor probabilidad de vacunación, lo que evidencia desigualdades en el acceso a vacunas fuera del calendario oficial, influenciadas por condiciones socioeconómicas.
Otro estudio en la Comunidad Valenciana estimó la efectividad de la vacuna frente al rotavirus en un entorno sin financiación pública, analizando datos de más de 560 000 niños. Se observó que la efectividad directa era mayor en zonas con baja cobertura vacunal, mientras que en zonas con alta cobertura (≥70 %) se detectó una reducción del 17 % en casos de gastroenteritis en no vacunados, evidenciando un efecto protector indirecto. Se estimó una efectividad real del 82 % frente a los casos de gastroenteritis por rotavirus.
Duración de la protección
La duración de la protección proporcionada por las vacunas contra el RV es difícil de evaluar debido al efecto de protección de grupo que se produce después de la implementación de la vacuna en el calendario vacunal sistemático. Un gran estudio multicéntrico llevado a cabo en los EE. UU. (Payne, 2015) puso de manifiesto que las vacunas monovalente (RV1) y pentavalente (RV5) brindan una protección duradera y ampliamente heteróloga contra la infección. No se observó una diferencia estadísticamente significativa en la eficacia vacunal para los ciclos completos de RV1 y RV5 en una comparación directa de datos durante un período de tiempo de 4 años. La efectividad de la vacuna persistió hasta el séptimo año de vida para RV5 y hasta el tercer año de vida para RV1. A destacar que esas diferencias en la duración se deben a que la RV1 se autorizó en los EE. UU. aproximadamente dos años después que la RV5, lo que afectó la cobertura vacunal y a la fortaleza del estudio correspondiente para los grupos de mayor edad analizados para RV1.
En Finlandia, con datos del registro nacional de enfermedades, la incidencia de GEA-RV, que disminuyó tras la inclusión de RV5 en el programa nacional de vacunaciones, se mantuvo baja hasta los 7 años de edad.
Otros estudios de eficacia en países de alto IDH con seguimientos prolongados han demostrado niveles de protección elevados contra la enfermedad grave hasta el tercer año de vida.
Sin embargo, en los países de IDH bajo (Kenya, Malawi, Uganda, Ghana, Sudáfrica y Bangladesh) se ha observado que la eficacia de las vacunas disminuye entre un 30-40 % el primer y el segundo año de vida. Las razones de esta disminución de la inmunidad no están del todo claras, aunque no sería únicamente debido a la disminución de anticuerpos inducidos por la vacunación.
7. Vías de administración
Las dos vacunas disponibles frente al rotavirus son de administración exclusivamente oral.
8. Indicaciones y esquemas de vacunación
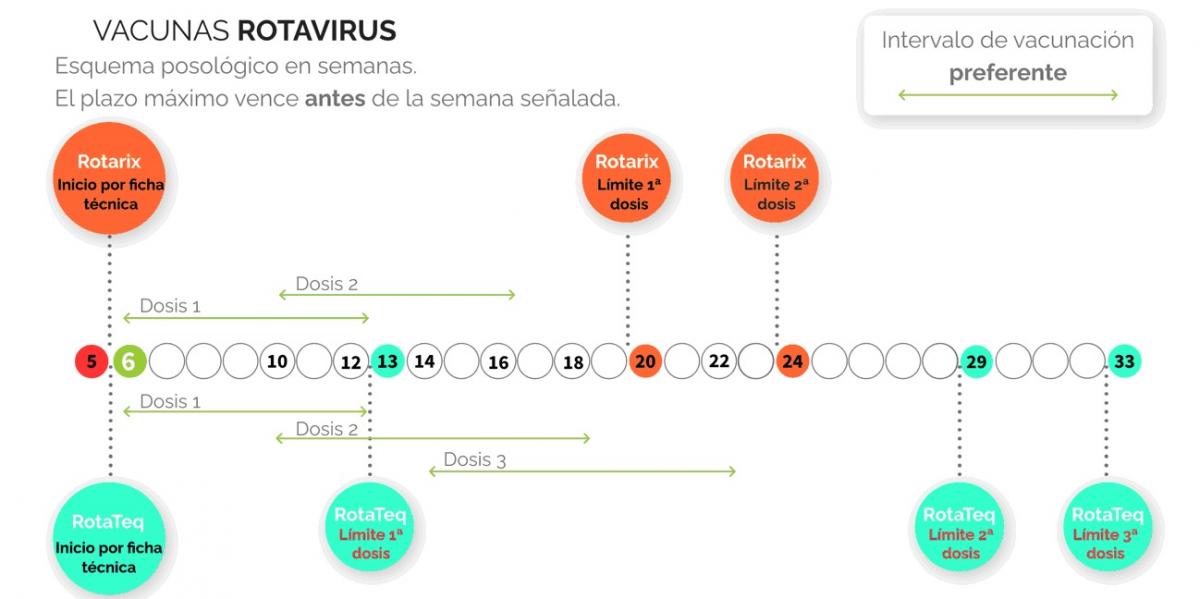
RotaTeq se administra en 3 dosis. La inmunización se puede iniciar a partir de las 6 semanas de edad y no más tarde de las 12 semanas (12 semanas y 6 días), con un intervalo mínimo entre dosis de 4 semanas. Las 3 dosis deben ser administradas antes de las 33 semanas de edad (32 semanas + 6 días).
Rotarix se administra en 2 dosis. La primera dosis debe ser administrada a partir de las 6 semanas de edad. Debe haber un intervalo de, al menos, 4 semanas entre dosis. La pauta completa de vacunación debe ser administrada preferentemente antes de las 16 semanas de edad (hasta 15 semanas + 6 días, antes de 16 semanas + 0 días), y en cualquier caso finalizada a las 24 semanas de edad (hasta 23 semanas + 6 días, antes de 24 semanas + 0 días).
Dado el posible efecto sobre la invaginación intestinal, actualmente se recomienda que la 1.ª dosis se administre lo antes posible, entre las 6 y las 8 semanas de vida.
En ninguna de las dos vacunas hay que restringir la ingesta de alimentos o líquidos en relación con su administración. En base a la evidencia de los ensayos clínicos en los países desarrollados, la lactancia materna durante el periodo de vacunación no parece que pueda interferir la inmunogenicidad de ambas vacunas. Si se observa o se sospecha firmemente que se ha tomado una dosis incompleta (por ejemplo, el niño escupe o regurgita la vacuna), puede administrarse una única dosis de reemplazo en la misma visita, pero esta circunstancia no se ha estudiado en los ensayos clínicos. Habitualmente el contacto con la mucosa oral se considera que hace que la vacuna sea efectiva y no deba repetirse. Si el problema se repite, no deben administrarse más dosis de reemplazo.
Se recomienda completar la pauta de administración con la misma vacuna. Aunque no existen datos de intercambiabilidad, recientemente se han publicado pautas mixtas que parecen seguras y con una respuesta inmune comparable. Si el lactante hubiera recibido previamente alguna dosis de vacuna frente al rotavirus y no se pudiese determinar qué preparado se ha utilizado o si se le hubieran administrado 2 dosis de diferente fabricante, se completará con una de las vacunas disponibles hasta un total de 3 dosis, antes de las 24 semanas de vida (23 semanas + 6 días) si para la dosis final se emplea Rotarix y hasta las 33 semanas de edad (32 semanas + 6 días) si es RotaTeq.
Si se administra por error la primera dosis más tarde de las 12 semanas de edad y si no se han producido problemas, el lactante podrá completar la pauta de vacunación con cualquiera de las 2 vacunas, siempre que cumpla el intervalo mínimo de separación de 4 semanas y la fecha de finalización de la vacuna (23 semanas + 6 días para la monovalente y 32 semanas + 6 días para la pentavalente). Si el lactante superara la edad última de administración comentada para cada una de las vacunas no continuará la pauta para completar el número total de dosis.
Si se ha pasado una GEA por rotavirus, la vacuna sigue estando indicada y debe completarse con las dosis necesarias para cada uno de los 2 productos, cumpliendo los intervalos mínimos entre dosis y las edades mínimas y máximas de ambos preparados.
La administración en prematuros hospitalizados se ha constatado que es segura bajo unas adecuadas condiciones higiénicas, por lo que debería ser una práctica habitual en las unidades de neonatología, pues, de lo contrario, algunos de estos niños no podrán ser vacunados tras el alta, al haber sobrepasado la edad máxima para recibir la 1.ª dosis. Así se ha recomendado en un documento de vacunación de prematuros realizado por la Sociedad Española de Neonatología y el Comité Asesor de Vacunas de la AEP, denominado ROTAPREM. Aquellos que han recibido la primera dosis en el ámbito hospitalario deben continuar la pauta de vacunación correspondiente en la atención primaria, estando la vacuna financiada en ambas situaciones al estar incluidos en los grupos de riesgo tributarios de dicha prestación. Un estudio multicéntrico realizado en Sicilia, donde se vacunó frente al RV (con RV1) cuando por edad les correspondía a los recién nacidos pretérminos (RNP) de entre 25 y 36 semanas de gestación que estaban ingresados en UCI neonatal, confirma la seguridad de la vacunación en hospital. De los 449 RNP incluidos en este estudio, solo el 1,9 % experimentó eventos adversos dentro de los 14 días posteriores a una de las dos dosis (fiebre ≥38 °C 0,2 %, dolor abdominal 0,6 % y diarrea 1,5·%), sin diferencias significativas respecto al grupo que recibió placebo.
La Comunidad Autónoma del País Vasco fue la primera en incluir la financiación de la vacunación frente al rotavirus a los recién nacidos prematuros menores de 32 semanas (31 semanas + 6 días), al ser considerados población de riesgo para la enfermedad por rotavirus y posteriormente el Ministerio de Sanidad la recomendó para toda España en estos niños en noviembre de 2019.
En las infografías siguientes se pueden apreciar los aspectos prácticos de la vacunación frente al rotavirus en los lactantes (Figura 35.3) y las semanas de inicio y finalización de las 2 vacunas (Figura 35.4).
Figura 35.3. Aspectos prácticos de la vacunación frente al rotavirus en los lactantes.
Figura 35.4. Semanas de inicio y finalización de las 2 vacunas antirrotavirus.
Vacunación parcial
Los estudios en niños parcialmente vacunados (aquellos que no han completado las pautas de dos dosis con RV1 o de tres dosis con RV5) muestran que en los países con IDH alto la protección decae entre un 69 y un 93 % y su duración no está clara.
9. Pautas de vacunación mixtas y aspectos legales
Pautas de vacunación mixtas
Se recomienda completar la pauta vacunal con el mismo preparado con el que se ha iniciado. Un artículo señala que la pauta mixta provoca una respuesta inmune comparable a las de las pautas convencionales, y que parecen seguras (Libster 2016).
En caso de haber recibido una dosis y si no se pudiera determinar el preparado o se le hubieran administrado dos dosis de diferente fabricante, se deberá completar la pauta con cualquiera de las vacunas disponibles hasta un total de 3 dosis, observando los plazos máximos de administración de cada una de ellas: antes de las 24 semanas de vida para la dosis final si se emplea Rotarix (23 semanas + 6 días) y hasta las 33 semanas de edad si es RotaTeq (32 semanas + 6 días). Un estudio mejicano (Macías-ParraM, 2024) con pautas mixtas demostró una respuesta inmune comparable y con igual seguridad
Si se administra por error la primera dosis más tarde de las 12 semanas de edad y si no se han producido problemas, el lactante podrá completar la pauta de vacunación con cualquiera de las 2 vacunas, siempre que cumpla el intervalo mínimo de separación de 4 semanas y la fecha de finalización de la vacuna (23 semanas + 6 días para la monovalente y 32 semanas + 6 días para la pentavalente). Si el lactante superara la edad última de administración comentada para cada una de las vacunas, no continuará la pauta para completar el número total de dosis.
Aspectos legales
Las vacunas frente al RV como todas las vacunas, al ser un producto biológico, deben, de forma obligatoria, prescribirse en receta médica normalizada, debiendo constar en ella el nombre comercial del preparado junto al resto de los datos de obligado cumplimiento.
La vacuna frente al RV, como todas las vacunas, debe ser administrada en centros acreditados para la vacunación y nunca por los padres en su domicilio, para garantizar así su correcta administración, proceder a su registro, mantener una observación posvacunación durante 15-30 minutos, vigilar posibles reacciones adversas inmediatas (por eso tiene que ser un entorno sanitario con capacidad de reconocimiento de cualquier tipo de reacción adversa inmediata y con competencia para actuar frente a ella) y desechar el vial utilizado de forma segura, siguiendo los protocolos establecidos.
10. Recomendaciones de vacunación
Se mantiene la recomendación de la vacunación universal frente al RV por parte de las sociedades científicas y de la OMS, especialmente en aquellos países donde la diarrea supone más del 10 % de la mortalidad en niños menores de 5 años. Desde el año 2008, el CAV-AEP viene considerando recomendable la vacunación sistemática frente al RV para todos los lactantes españoles.
La vacuna frente al RV, como todas las vacunas, debe ser administrada en centros acreditados para la vacunación y nunca por los padres en su domicilio, para garantizar así su correcta administración, proceder a su registro, mantener una observación posvacunación durante 15-30 minutos, vigilar posibles reacciones adversas inmediatas y desechar el vial utilizado de forma segura, siguiendo los protocolos establecidos.
En el caso de los recién nacidos prematuros, en los cuales la enfermedad puede ser muy grave, se recomienda la vacunación igualmente. En 2019 la Sociedad Española de Neonatología y el CAV-AEP recomendaron la vacunación de los RN prematuros, incluso su administración en la unidad hospitalaria neonatal. Los datos existentes han mostrado resultados de eficacia y seguridad similares a los comunicados en niños a término y un riesgo bajo de diseminación nosocomial cuando la vacunación se realiza durante la hospitalización, siempre que se observen las necesarias medidas de precaución. Un porcentaje estimable de niños prematuros permanecen ingresados más allá de las 12 semanas de vida y en estos casos, siempre que su condición clínica lo permita, deberían recibir la vacunación frente al RV sin retrasos, incluso durante la hospitalización, como ya se viene haciendo en algunos hospitales españoles. En noviembre de 2019 el Ministerio de Sanidad ha establecido la recomendación de la vacunación de los RN prematuros menores de 32 semanas (31 semanas + 6 días) para todo el territorio nacional. Aquellos que han recibido la primera dosis en el ámbito hospitalario deben continuar la pauta de vacunación correspondiente desde atención primaria, estando la vacuna financiada en ambas situaciones al estar incluidos en los grupos de riesgo tributarios de dicha prestación.
Rotarix se administra en 2 dosis y RotaTeq en 3, por vía oral. Ambas vacunas no son intercambiables entre sí, aunque actualmente se admiten las pautas mixtas cunado no se conoce la vacuna administrada o se cambia de comunidad autónoma o por otra ciscunstancia. Se pueden coadministrar con las vacunas del calendario, debiéndose iniciar la vacunación a partir de las 6 semanas de edad (preferentemente no más tarde de las 12 semanas, lo que es importante para reducir el riesgo de invaginación [aunque la ficha técnica de Rotarix admitiría su administración hasta la 20 semana]), con un intervalo mínimo entre dosis de 4 semanas, debiendo completarse la pauta de 2 dosis antes de las 24 semanas y la de 3 dosis antes de las 33 semanas.
En enero de 2024, el Grupo de Trabajo de vacunación frente al rotavirus de la Ponencia de Programa y Registro de Vacunaciones estableció que la vacunación frente al RV reduciría la incidencia de GEA en la población infantil. Desde la perspectiva social, la introducción de esta vacuna resulta eficiente con un precio de la pauta completa de RV1 igual o menor a 118,20 euros y con RV5 de 115,50 euros. En este caso, se recomienda la vacunación frente al RV en lactantes a partir de las 6 semanas de vida, pudiendo utilizar cualquiera de las dos vacunas disponibles. Aunque en lactantes con edad gestacional inferior a la que figura en las fichas técnicas (≥25 semanas en RV5 y ≥27 semanas en RV1) se deberá utilizar la vacuna financiada. Finalmente, la Comisión de Salud Pública aprobó la inclusión de esta vacuna en toda España, dando de plazo para su incorporación en todas las CC. AA. antes del final de 2025
En España, Castilla y León incluyó la vacunación sistemática frente al RV para los lactantes nacidos a partir del 1 de enero de 2023 (el preparado elegido ha sido RV5, con pauta a los 2, 3 y 4 meses de edad). A continuación fue Galicia quien en octubre de 2023 introduce la vacuna, en este caso con la monovalente. A agosto de 2025 la han introducido Aragón, Canarias, Castilla La Mancha, Cataluña, Ceuta, Galicia, La Rioja, Madrid, Melilla, Navarra y Comunidad Valenciana a los 2 y 4 meses; Asturias, Cantabria, Extremadura, Islas Baleares, Murcia y País Vasco a los 2, 4 y 6 meses y Castilla y León a los 2, 3 y 4 meses. Finalmente, la última CC. AA. en introducir la vacunación sistematica frente al rotavirus ha sido la comunidad autónoma de Andalucía en enero de 2026.
11. Administración con otras vacunas y otros productos
Ambas vacunas se pueden coadministrar con las vacunas del calendario, pues no interfieren con la inmunogenicidad y eficacia de éstas ni con su perfil de seguridad, incluida la 4CMenB.
Por disminución de la serorrespuesta a la vacuna antirrotavirus, no se recomienda la administración simultánea con la vacuna de la poliomielitis oral (no comercializada en España).
En ausencia de estudios de compatibilidad, ninguna de las dos vacunas debe mezclarse con otros medicamentos.
Debido a su contenido en sacarosa es posible que tengan un efecto mitigante sobre el dolor por lo que lo que podría ser de utilidad administrarlas antes de las vacunas inyectables.
12. Efectos adversos
Los efectos adversos de ambas vacunas se han estudiado en un amplio número de niños procedentes de múltiples ensayos clínicos, con o sin uso concomitante de otras vacunas pediátricas. Las reacciones adversas notificadas más comúnmente fueron pirexia, irritabilidad, diarrea y vómitos, con frecuencias de aproximadamente entre el 1 % y el 10 %.
- Vacuna monovalente humana: el estudio de eficacia y seguridad en fase III en 63 225 sujetos no detectó riesgo asociado de invaginación. En los estudios realizados se observó una incidencia de diarrea, fiebre o vómitos similar al grupo control. La mayor incidencia de fiebre se dio en el estudio latinoamericano, en relación con la administración conjunta de la vacuna antitosferina de células enteras. Los estudios realizados en Finlandia con la formulación líquida en 1450 lactantes confirmaron un perfil de seguridad semejante al de los estudios con liofilizado.
- Vacuna pentavalente bovina-humana: el estudio de eficacia y seguridad realizado con esta vacuna en 68 038 sujetos confirmó la ausencia de riesgo asociado de invaginación. En el análisis de seguridad desarrollado en un subgrupo de 9605 sujetos no hubo diferencia tras la administración de vacuna en la incidencia de fiebre, diarrea o vómitos entre el grupo vacunado y el control. El subanálisis de recién nacidos prematuros tampoco ofreció diferencias en los efectos adversos observados.
13. Contraindicaciones y precauciones
Contraindicaciones
Además de las generales de reacción alérgica grave (anafilaxia) a algún componente de la vacuna, ambas vacunas están contraindicadas en los casos de:
- Historia de reacción anafiláctica después de la administración de una dosis previa o a alguno de los componentes de la vacuna.
- Historia previa de invaginación intestinal
- Inmunodeficiencia combinada grave
- Malformación congénita intestinal no corregida que pueda predisponer a una invaginación intestinal. Como se desconoce el teórico riesgo existente entre la vacunación (mínimo) en estos casos, con el de la propia enfermedad por ausencia de vacunación (también mínimo), se valorará individualmente pudiendo considerarse la vacunación como una precaución teniendo en cuenta el riesgo-beneficio de cada situación que deberá evaluarse individualmente con información a los padres de los riesgos y los beneficios
Precauciones
- Es recomendable esperar a la resolución del cuadro antes de vacunar un niño en el curso de una gastroenteritis aguda moderada o grave, así como con un cuadro febril.
- En niños inmunosuprimidos deben valorarse los riesgos y beneficios de la vacunación. La escasa información sobre la eficacia y seguridad de estas vacunas en lactantes con infección asintomática por VIH hace que se someta a la consideración del pediatra su indicación. La European Society for Paediatric Infectious Diseases (ESPID) recomienda la vacunación de los pacientes VIH positivos, sea cual sea su estatus de infección.
- Ambas vacunas están contraindicadas en las personas inmunodeprimidas. Sin embargo, sí se puede administrar a lactantes que convivan en el mismo domicilio, extremando las medidas higiénicas y el lavado de manos con gel alcohólico, y evitando que el paciente inmunodeprimido contacte con las heces o los pañales del niño vacunado, en la semana siguiente a la vacunación, sobre todo tras la primera dosis. Los rotavirus vacunales se eliminan por las heces del niño vacunado durante 1-2 semanas. En las dos vacunas hay eliminación de virus vacunal, aunque es mayor en Rotarix. La excreción es más alta en la primera semana tras la vacunación y cede a partir de la tercera semana. En general es también mayor tras la primera dosis de vacuna que tras las dosis ulteriores.
- Rotarix contiene 0,15 microgramos de fenilalanina por dosis. La fenilalanina puede ser perjudicial en caso de padecer fenilcetonuria.
13.1. Vacunación de los recién nacidos de madres tratadas con anticuerpos monoclonales y otros inmunosupresores
Infliximab, adalimumab o certolizumab pegol son anticuerpos monoclonales anti-TNFα tipo IgG1 que, como ocurre con las IgG naturales, tienen la capacidad de atravesar la placenta activamente por mecanismos aún no completamente dilucidados, pero donde juega un papel preponderante la unión a receptores tipo FcRn expresados en el sincitiotrofoblasto. El transporte activo transplacentario de anticuerpos ocurre especialmente en el segundo y, sobre todo, tercer trimestre de gestación y da lugar a que en la sangre del cordón y, por tanto, en el recién nacido los niveles de IgG sean, en condiciones normales, incluso superiores a los de la madre. Esto origina que los recién nacidos cuyas madres recibieron tratamientos biológicos anti-TNFα durante el embarazo presenten niveles detectables de dichos anticuerpos durante periodos de tiempo variables que dependen, sobre todo, del fármaco, de la duración del tratamiento materno y de la semana gestacional en la que se suspende el mismo. Una excepción es certolizumab pegol que al carecer de la fracción Fc prácticamente no atraviesa la placenta y por tanto no plantea problema con las vacunas vivas en el lactante.
Tradicionalmente, esta situación había generado cautela respecto a la administración de vacunas vivas a lactantes expuestos intraútero a anti-TNFα, debido a la posibilidad teórica de reacciones adversas. La Agencia Europea de Medicamentos (EMA) en 2022, en línea con un principio de precaución, recomendó diferir estas vacunas durante varios meses tras el nacimiento, especialmente en el caso de infliximab.
Sin embargo, la evidencia científica acumulada en los últimos años ha modificado de manera significativa la valoración riesgo-beneficio.
Diversos estudios han demostrado la seguridad de la vacunación contra rotavirus -y potencialmente de otras vacunas vivas, con la excepción de BCG- en lactantes expuestos intraútero a biológicos:
- Un trabajo canadiense publicado en la revista Lancet Child Adolesc Health en septiembre de 2023 y titulado "Efectos inmunológicos y seguridad de la vacunación contra rotavirus vivos después de la exposición prenatal a agentes biológicos inmunomoduladores: un estudio de cohorte prospectivo de la Red Canadiense de Investigación sobre Inmunización" en el que se evaluaron 191 lactantes expuestos a infliximab (67 [35 %] de 191), adalimumab (49 [26 %]), ustekinumab (18 [9 %]) y vedolizumab (17 [9 %]) en los que no se detectaron anomalías clínicamente significativas en los subconjuntos de linfocitos, las inmunoglobulinas cuantitativas o las respuestas de mitógenos. 187 recibieron la vacuna del rotavirus y se les realizó seguimiento. La conclusión es que los subconjuntos de linfocitos y la seguridad de la vacunación contra rotavirus vivos, generalmente, no se ven afectados por la exposición intrauterina a agentes biológicos, por lo que se puede ofrecer la vacuna frente al rotavirus a los lactantes expuestos a agentes anti-TNF en el útero (Fitzpatrick T, 2023)
- De forma concordante, se ha publicado recientemente otro trabajo canadiense, en el que se evalúa la función inmunológica y la seguridad de la vacuna oral viva contra el rotavirus en lactantes expuestos intraútero a agentes biológicos como infliximab, adalimumab, vedolizumab y ustekinumab. Los análisis inmunológicos revelaron una función inmune normal en todos los lactantes evaluados, a pesar de la presencia de concentraciones detectables de algunos de estos fármacos en sangre. La vacuna contra el rotavirus se administró a 50 lactantes a una edad media de 13 semanas, sin que se comunicaran efectos adversos posteriores. Estos hallazgos sugieren que la vacunación contra el rotavirus en lactantes expuestos a terapias biológicas durante el embarazo puede ser segura y no conlleva un riesgo inmunológico evidente (Ernest-Suarez K, 2025)
- Y otra reciente revisión sistemática ha analizado los datos de 10 estudios publicados entre 2006 y 2024, incluyendo más de 300 casos de vacunación en lactantes expuestos a biológicos anti-TNF (como infliximab o adalimumab) y no anti-TNF (como vedolizumab o ustekinumab). Los resultados no evidenciaron un aumento en el riesgo de eventos adversos, ni graves ni leves, asociados a la vacunación. Estos hallazgos respaldan la seguridad del uso de la vacuna oral viva contra el rotavirus en esta población, sugiriendo que, tras una evaluación individual de riesgos y beneficios, su administración puede ser considerada de manera segura (Schell TL, 2025)
Estos hallazgos sugieren de manera consistente y en base a la evidencia científica más actual que la vacuna oral atenuada contra el rotavirus se puede administrar con seguridad, eficacia y sin riesgo inmunológico significativo en lactantes expuestos a agentes anti-TNF (es decir, infliximab, adalimumab, golimumab, certolizumab y otras terapias biológicas (como eculizumab, belimumab, vedolizumab, natalizumab).
Adicionalmente, retrasar la vacunación implica exponer al lactante al riesgo de adquirir infecciones por virus salvajes, potencialmente más graves que la forma vacunal. Por ello, diversos grupos de expertos han señalado que la no vacunación podría suponer un perjuicio mayor que el riesgo teórico derivado de la exposición intraútero a biológicos.
Sin embargo, con la evidencia actual los niños expuestos intraútero a anticuerpos anti-CD20 (rituximab, ocrelizumab y ofatumumab) no deben recibir la vacuna frente al rotavirus debido a que los recuentos de células B (también se afectan los linfocitos TCD4 y TCD8) suelen ser bajos, al menos, durante los 6 primeros meses de vida y solamente si se monitorizan las poblaciones y subpoblaciones de células B y T y son normales se podría vacunar frente al rotavirus, aunque es importante conocer la funcionalidad.
Están en marcha estudios para conocer como funciona el sistema inmunológico humoral al nacer en niños que han estado expuestos al anticuerpo monoclonal CD20.
Si bien existen trabajos de casos aislados o pequeñas series de casos en los que se detecta una concentración extremadamente baja en leche materna de madres tratadas con infliximab e incluso en alguno de ellos se constata la presencia ocasional de niveles del fármaco medibles en suero (muy por debajo de los observados por paso transplacentario y del dintel terapéutico, obviamente); ponderando los múltiples beneficios conocidos que tiene la lactancia materna, este comité, al igual que otros grupos de expertos, como por ejemplo los editores del proyecto web e-lactancia, considera segura la administración de las vacunas contra el rotavirus en este contexto (vigilando las posibles complicaciones que pudieran acontecer).
Se puede consultar la tabla 14.8 sobre la acción de los distintos biológicos administrados en el embarazo, según sus fichas técnicas.
En cuanto a los fármacos modificadores de la enfermedad (FAME) como el metotrexato, la 6 mercaptopurina y la azatioprina se hacen las siguientes consideraciones:
- si la madre ha tomado durante el embarazo dosis consideradas "no inmunosupresoras (IDSA) " (metotrexato ≤0,4 mg/kg/semana, 6-mercaptopurina ≤1,5 mg/kg/día o azatioprina ≤3 mg/kg/día) el niño, sin ninguna duda, puede recibir la vacuna de rotavirus sin ningún problema. Estas dosis son las más habituales en la terapia de mantenimiento se las enfermedades reumáticas y autoinmunes
- si las dosis son inmunosupresoras no hay unanimidad, pero se ha demostrado que tanto la inmunidad humoral como la celular (no sólo número y subpoblaciones de células T, sino función de las mismas) es normal y, además, la vida media de estos farmacos (metotrexato 1-3 horas, 6 mercaptopurina 1-3 horas y azatioprina 3 horas) condiciona que en el momento de vacunarse frente al rotavirus el lactante no tenga niveles frente a ninguno de estos fármacos, dado que aunque hay transporte placentario no es trasporte activo, por lo que en el peor de los casos en el momento del nacimiento los niveles en el RN serían los de la madre, aunque siempre han sido más bajos, por ello este comité recomienda que se administre la vacuna frente al rotavirus sin ningún problema
RECOMENDACIONES DE ESTE COMITÉ
En base a la evidencia científica más actual, este comité recomienda (figura 35.5):
- Administrar la vacuna oral contra rotavirus de acuerdo con el calendario habitual en lactantes expuestos intraútero a infliximab, adalimumab u otros biológicos, sin necesidad de diferirla sistemáticamente
- Considerar igualmente la administración de otras vacunas vivas de calendario en el tiempo establecido, valorando individualmente la situación clínica del lactante, especialmente para la vacuna BCG
- Mantener vigilancia clínica tras la vacunación, como en cualquier lactante, especialmente si existen otros factores de riesgo de inmunodepresión
- Favorecer y promover la lactancia materna, dado que no se han documentado efectos adversos relevantes relacionados con la administración de vacunas vivas en este contexto
Con estos elementos, nuestro posicionamiento difiere del de la EMA, pero consideramos que, a la luz de la evidencia científica disponible, la administración de vacunas vivas (en particular, la vacuna contra el rotavirus) es segura y beneficiosa para los lactantes expuestos intraútero a terapias biológicas, y debe recomendarse como práctica estándar.
Figura 35.5. Vacunación en recién nacidos de madres tratadas con anticuerpos monoclonales y otros inmunosupresores
14. Seguridad y observaciones sobre la invaginación intestinal
Los beneficios de la vacunación siguen siendo muy superiores a los hipotéticos riesgos de invaginación intestinal (II), único efecto adverso grave relacionado con esta inmunización.
Los estudios poscomercialización realizados en los países de alto IDH, en los que se vacuna sistemáticamente frente al RV, indican que pueden ocurrir episodios de II como consecuencia de la vacunación, pero el riesgo es bajo (de aproximadamente 1 a 5 casos adicionales por cada 100 000 niños vacunados). Aplicada esta estimación a España (con 350 000 nacimientos al año), el riesgo sería de 4 a 16 casos al año de II, frente a la prevención de 4122 hospitalizaciones y 13 200 visitas a urgencias. Por tanto, se debe mantener una vigilancia activa de las reacciones adversas a estas vacunas, informando a los padres de los niños que van a ser vacunados de los beneficios y riesgos de estas, incluyendo y explicando claramente los signos de alarma de II, para poder actuar con rapidez y evitar las complicaciones de un retraso en el diagnóstico de este cuadro obstructivo.
Incluso el hecho de advertir a los familiares sobre la posible aparición de una II podría ser un factor protector ya que, de aparecer, el diagnóstico y tratamiento serían más rápidos. Recientemente, una revisión sistemática de los eventos adversos asociados con la vacunación frente al RV, en concreto la tasa de invaginación intestinal, no mostró diferencias, tras dos años de seguimiento, entre los niños vacunados, comparados con los que recibieron placebo y un metaanálisis con 20 años de revisión de estudios tampoco encontró diferencias significativas (Lu HL, 2019).
En una revisión más reciente de 2024, la OMS reevaluó el riesgo de invaginación intestinal reafirmando que ningún ensayo clínico había identificado un incremento del riesgo en vacunados al comparar con los receptores de placebo.
En 2022, se publicó un informe realizado por la Agencia de Evaluación de Tecnologías Sanitarias cuyos objetivos fueron evaluar la seguridad, eficacia, efectividad y eficiencia de distintas estrategias de vacunación frente al RV en menores de un año y la eficiencia de la vacunación universal y de la vacunación a población de riesgo en comparación con la no vacunación. Las conclusiones de la evaluación fueron que las dos vacunas disponibles en España presentan un buen perfil de seguridad. Datos que se reafirman en el documento de la Ponencia de Programa y Registro de Vacunaciones publicado en enero de 2024.
La evidencia clínica disponible hasta la fecha no ha encontrado ninguna asociación entre la vacuna oral de rotavirus con virus vivos atenuados y la aparición de enfermedad de Kawasaki, ni un aumento en el riesgo de desarrollar enfermedad celíaca o diabetes mellitus tipo 1..
15. Bibliografía
- Aanyu HT, et al. Effectiveness of monovalent rotavirus vaccine against hospital-attended rotavirus gastroenteritis among children in Uganda. Vaccine. 2025;48:126726.
- Agencia Española de Medicamentos y Productos Sanitarios. Informe de utilidad terapéutica de las vacunas frente al rotavirus (fecha de elaboración del informe: 6 de febrero de 2015).
- Agencia de Evaluación de Tecnologías Sanitarias - Instituto de Salud Carlos III (AETS-ISCIII). Carmona-Rodríguez M, et al. Evaluación de distintas estrategias de vacunación frente a rotavirus en España. Seguridad, eficacia, efectividad y eficiencia. Ministerio de Ciencia e Innovación, Ministerio de Sanidad. Madrid. 2022. Informes de Evaluación de Tecnologías Sanitarias.
- Álvarez Aldeán J, et al, en representación de la SENeo y del CAV-AEP. Recomendaciones para la vacunación frente al ROTAvirus de los recién nacidos PREMaturos (ROTAPREM). An Pediatr (Barc). 2019;91:205.e1-7.
- Álvarez Aldeán J, et al. Economic and psychosocial impact of rotavirus infection in Spain: a literature review. Vaccine. 2014;32:3740-51.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. An Pediatr (Barc). 2026;104:504051.
- American Academy of Pediatrics. Rotavirus Infections. En: Kimberlin DW, Banerjee R, Barnett ED, Lynfield R, Sawyer MH eds. Red Book: 2024-2027. Report of the Committee on Infectious Diseases. 33st ed, Itasca, IL.: American Academy of Pediatrics; 2024. pp. 730-5.
- Amin AB, et al. Rotavirus Genotypes in the Postvaccine Era: A Systematic Review and Meta-analysis of Global, Regional, and Temporal Trends by Rotavirus Vaccine Introduction. J Infect Dis. 2024;229:1460-9.
- Atchison CJ, et al. Rapid Declines in Age Group-Specific Rotavirus Infection and Acute Gastroenteritis Among Vaccinated and Unvaccinated Individuals Within 1 Year of Rotavirus Vaccine Introduction in England and Wales. J Infect Dis. 2016;213:243-9.
- Benchimol EI, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for Immunizations in Patients With Inflammatory Bowel Disease (IBD) - Part 1: Live Vaccines. J Can Assoc Gastroenterol. 2021;4:e59-71.
- Bergman H, et al. Vaccines for preventing rotavirus diarrhoea: vaccines in use. Cochrane Database Syst Rev. 2021;11:CD008521.
- Biggart R, et al. Lack of impact of rotavirus vaccination on childhood seizure hospitalizations in England - An interrupted time series analysis. Vaccine. 2018;36:4589-92.
- Bishop R. Natural history of human rotavirus infection. Arch Virol Suppl. 1996;12:119-28.
- Bishop RF, et al. Clinical immunity after neonatal rotavirus infection. A prospective longitudinal study in young children. N Engl J Med. 1983;309:72-6.
- Burnett E, et al. Global Impact of Rotavirus Vaccination on Childhood Hospitalizations and Mortality fron Diarrhea. J Infect Dis. 2017;215:1666-72.
- Burnett E, et al. Real-world effectiveness of rotavirus vaccines, 2006-19: a literature review and meta-analysis. Lancet Glob Health. 2020;8:e1195-202.
- Burnett E, et al. Rotavirus Vaccine Effectiveness Stratified By National-Level Characteristics: An Introduction to the 24-Country MNSSTER-V Project, 2007-2023. J Infect Dis. 2025;232:308-15.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP (CAV-AEP). Aspectos legales de las inmunizaciones. Manual de vacunas en línea de la AEP [internet]. Madrid. Capítulo 46.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026. [Internet]. Madrid: AEP; 2026.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP (CAV-AEP). Fichas técnicas vacunas comercializadas en España.
- CAV-AEP y SENEO. Recomendaciones para la vacunación frente al ROTAvirus de los recién nacidos PREMaturos (ROTAPREM). Documento de consenso del CAV-AEP y la SENeo. Actualización del 28 de mayo de 2019.
- Clarke E, et al. Correlates of protection against human rotavirus disease and the factors influencing protection in low-income settings. Mucosal Immunol. 2015;8:1-17.
- Cochrane Response. Update of a systematic review and meta-analysis of the safety, effectiveness and efficacy of childhood schedules using Rotavirus vaccines. 2017.
- Cohen R, et al. The Value of Rotavirus Vaccination in Europe: A Call for Action. Infect Dis Ther. 2023;12:9-29.
- Cortese MM, et al. Protection against gastroenteritis in US households with children who received rotavirus vaccine. J Infect Dis. 2015;211:558-62.
- Cortese MM, et al. Prevention of rotavirus gastroenteritis among infants and children: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2009;58(RR-2):1-25.
- Costantino C, et al. Safety of Rotavirus Vaccination in Preterm Infants Admitted in Neonatal Intensive Care Units in Sicily, Italy: A Multicenter Observational Study. Vaccines (Basel). 2023;11:718.
- Cunliffe NA, et al. A critical time for rotavirus vaccines: a review. Expert Rev Vaccines. 2005;4:521-32.
- Diallo AO, et al. Rotavirus Vaccine Effectiveness Against Severe Acute Gastroenteritis: 2009-2022. Pediatrics. 2024;154:e2024066879.
- Díez-Domingo J, et al. ¿Qué hemos aprendido sobre rotavirus en España en los uìltimos 10 años? An Pediatr (Barc). 2019;91:166-79.
- Dornbusch HJ, et al. Rotavirus vaccination for all children or subgroups only? Comment of the European Academy of Paediatrics (EAP) and the European Society for Paediatric Infectious Diseases (ESPID) recommendation group for rotavirus vaccination. Eur J Pediatr. 2020;179:1489-93.
- Ernest-Suarez K, et al. Live Rotavirus Vaccination Appears Low-risk in Infants Born to Mothers With Inflammatory Bowel Disease on Biologics. Clin Gastroenterol Hepatol. 2025;23:835-45.
- European Agency of Medicines. Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 7 - 10 February 2022. Advice to postpone use of live vaccines in infants exposed to infliximab during pregnancy or via breastfeeding.
- European Centre for Disease Prevention and Control. Immunisation schedules by target disease: rotavirus.
- European Society for Pediatric Infectious Diseases. Recommendations for Rotavirus Vaccination in Europe. Update 2014.
- European Rotavirus Surveillance Network (EuroRotaNet). Anual Report Season 2022/23. March 2025. [Internet]
- Fitzpatrick T, et al. mmunological effects and safety of live rotavirus vaccination after antenatal exposure to immunomodulatory biologic agents: a prospective cohort study from the Canadian Immunization Research Network. Lancet Child Adolesc Health. 2023;7:648-56.
- Fritzsche J, et al. Infliximab and adalimumab use during breastfeeding. J Clin Gastroenterol. 2012;46:718-9.
- Gastañaduy PA, Sánchez-Uribe E, Esparza-Aguilar M, et al. Effect of rotavirus vaccine on diarrhea mortality in different socioeconomic regions of Mexico. Pediatrics. 2013;131:e1115-20.
- Geddes L. Routine vaccines, extraordinary impact: Rotavirus. Gavi,The Vaccine Alliance. 30 March 2023. [Internet].
- Gibory M, et al. Genetic diversity of rotavirus strains circulating in Norway before and after the introduction of rotavirus vaccination in children. J Med Virol. 2022;94:2624-31.
- Gisbert JP, et al. Vaccines in Children Exposed to Biological Agents In Utero and/or During Breastfeeding: Are They Effective and Safe?. J Crohns Colitis. 2023;17:995-1009.
- Glass RI, et al. Rotavirus vaccines-balancing intussusception risks and health benefits. N Engl J Med. 2014;370:568-70.
- Gómez-Rial J, et al. Rotavirus infection beyond the gut. Infect Drug Resist. 2019;12:55-64.
- Grosen A, et al. Infliximab concentrations in the milk of nursing mothers with inflammatory bowel disease. J Crohns Colitis. 2014;8:175-6.
- Goulden B, et al. A systematic review of live vaccine outcomes in infants exposed to biologic disease modifying anti-rheumatic drugs in utero. Rheumatology (Oxford). 2022;61:3902-6.
- Hartman RM, et al. Risk Factors for Mortality Among Children Younger Than Age 5 Years With Severe Diarrhea in Low- and Middle-income Countries: Findings From the World Health Organization-coordinated Global Rotavirus and Pediatric Diarrhea Surveillance Networks. Clin Infect Dis. 2023;76:e1047-53.
- Hemming-Harlo M, et al. Long-term surveillance of rotavirus vaccination after implementation of a national immunization program in Finland (2008-2018). Vaccine. 2022;40:3942-7.
- Indwar P, et al. Neurological Manifestations in Rotavirus Gastroenteritis in Children Under two Years of Age. Indian Pediatr. 2023;60:495-6.
- International Vaccine Access Center (IVAC), Johns Hopkins Bloomberg School of Public Health. VIEW-hub. Rotavirus.
- Isanaka S, et al. Efficacy of a low-cost, heat-stable oral rotavirus vaccine in Niger. N Engl J Med. 2017;376:1121-30.
- Karafillakis E, et al. Effectiveness and impact of rotavirus vaccines in Europe, 2006-2014. Vaccine. 2015;33:2097-107.
- Kozawa K, et al. Rotavirus genotypes and clinical outcome of natural infection based on vaccination status in the post-vaccine era. Hum Vaccin Immunother. 2022;18:2037983.
- Kraay ANM, et al. Predicting indirect effects of rotavirus vaccination programs on rotavirus mortality among children in 112 countries. npj Vaccines. 2023;8:1-8.
- Kurosawa T, Watanabe H, Takahashi K. Cost-utility Analysis of Rotavirus Vaccines Including the Latest Evidence and Data as of June 2020 in Japan. Pediatr Infect Dis J. 2021;40:162-8.
- Libster R, et al ; VTEU Rotavirus Vaccine Study Work Group. Safety and Immunogenicity of Sequential Rotavirus Vaccine Schedules. Pediatrics. 2016;137:e20152603.
- López-Lacort M, et al. Effectiveness of self-financed rotavirus vaccines on acute gastroenteritis primary care episodes using real-world data in Spain: a propensity score-matched analysis of cohort study. Eur J Pediatr. 2024;183:2843-53.
- Lu HL, et al. Association Between Rotavirus Vaccination and Risk of Intussusception Among Neonates and Infants: A Systematic Review and Meta-analysis. JAMA Netw Open. 2019;2:e1912458.
- Macías-Parra M, et al. Immunogenicity of RV1 and RV5 vaccines administered in standard and interchangeable mixed schedules: a randomized, double-blind, non-inferiority clinical trial in Mexican infants. Front Public Health. 2024;12:1356932.
- Maguire JE, et al. Rotavirus Epidemiology and Monovalent Rotavirus Vaccine Effectiveness in Australia: 2010–2017. Pediatrics. 2019;144:e20191024.
- Marti SG, et al. Rotavirus Vaccine Impact since Its Introduction in the National Immunization Program of Argentina. Infect Dis Ther. 2023;12:513-26.
- Matro R, et al. Exposure concentrations of infants breastfed by women receiving biologic therapies for inflammatory bowel diseases and effects of breastfeeding on infections and development. Gastroenterology. 2018;155:696-704.
- Matthijnssens J, et al. Uniformity of Rotavirus Strain Nomenclature Proposed by the Rotavirus Classification Working Group (RCWG). Arch Virol. 2011;156:1397-413.
- Middleton BF, et al. Review of the health impact of the oral rotavirus vaccine program in children under 5 years in Australia: 2006 - 2021. Vaccine. 2023;41:636-48.
- Ministerio de Sanidad. Ponencia de Programa y Registro de Vacunaciones. Situación epidemiológica de las gastroenteritis producidas por rotavirus. Recomendaciones de la vacunación frente a rotavirus. Septiembre 2006.
- Ministerio de Sanidad. Grupo de trabajo vacunación frente a rotavirus de la Ponencia de Programa y Registro de Vacunaciones. Recomendaciones de vacunación frente a rotavirus. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, enero 2024.
- Ministerio de Sanidad. Ponencia de Programa y Registro de Vacunaciones. Vacunación en prematuros. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Consumo y Bienestar Social, noviembre 2019.
- Mohammed A, Immergluck L, Parker TC, et al. Association between mixed rotavirus vaccination types of infants and rotavirus acute gastroenteritis. Vaccine. 2015;33:5670-7.
- Molina-Salas Y, et al. Acceso a vacunación no financiada y factores socioeconómicos asociados en una cohorte de lactantes de un área sanitaria de la Región de Murcia. Rev Esp Salud Publica. 2025;99:14 de febrero e202502008.
- Monk HM, et al. Safety of rotavirus vaccine in the NICU. Pediatrics. 2014;133:e1555-60.
- Nakamura M, et al. Characteristics of intussusception in the period of arbitrary Rotavirus vaccination. Pediatr Int. 2022;64:e15332.
- Omatola CA, et al. Rotaviruses: From Pathogenesis to Disease Control-A Critical Review. Viruses. 2022;14:875.
- Ong DS, et al. Indirect Effects of Universal Infant Rotavirus Vaccination: A Narrative Systematic Review. Vaccines (Basel). 2025;13:503.
- Orrico-Sanchez A , et al. Long-term impact of self-financed rotavirus vaccines on rotavirus-associated hospitalizations and costs in the Valencia Region, Spain. BMC Infect Dis. 2017;17:267.
- Ortigosa del Castillo L. Invaginación intestinal y vacunas frente a rotavirus: ¿Es necesaria una vacuna frente a rotavirus en países industrializados? Evid Pediatr. 2015;11:21.
- Pham-Huy A, et al. The use and impact of monoclonal antibody biologics during pregnancy. CMAJ. 2021;193:E1129-36.
- Parashar U, et al. Rotavirus vaccines, in Plotkin's Vaccines, 7th edition, Plotkin S, Orenstein W, Offit P, et al. (eds). 2018. Elsevier: Philadelphia, US.
- Patel MM, et al. Fulfilling the promise of rotavirus vaccines: how far have we come since licensure? Lancet Infect Dis. 2012;12:561-70.
- Payne DC, et al. Long-term Consistency in Rotavirus Vaccine Protection: RV5 and RV1 Vaccine Effectiveness in US Children, 2012-2013. Clin Infect Dis. 2015;61:1792-9.
- Payne DC, et al; NVS Network. Evaluation of Effectiveness of Mixed Rotavirus Vaccine Course for Rotavirus Gastroenteritis. JAMA Pediatr. 2016;170:708-10.
- Pollard SL, et al. Estimating the herd immunity effect of rotavirus vaccine . Vaccine. 2015;33:3795-800.
- Pringle KD, et al. Trends in rate of seizure-associated hospitalizations among children <5 years old before and after rotavirus vaccine introduction in the United Sates, 2000–2013. J Infect Dis. 2018;217:581-8.
- Public Health England. National Norovirus and Rotavirus Bulletin.
- Public Health England. The rotavirus vaccination programme: information for healthcare practitioners. May 2024. [Internet].
- Rivero-Calle I, et al. Systemic features of rotavirus infection. J Infect. 2016;72 Suppl:S98-105.
- Rodriguez WJ, et al. Clinical features of acute gastroenteritis associated with human reovirus-like agent in infants and young children. J Pediatr. 1977;91:188-93.
- Rogawski E, et al. Quantifying the impact of natural immunity on rotavirus vaccine efficacy estimates: a clinical trial in Dhaka, Bangladesh (PROVIDE) and a simulation study. J Infect Dis. 2018;217:861-8.
- Román Riechmann E, et al. Rotavirus (gastroenteritis por). En: Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Vacunas en Pediatría. Manual de la AEP 2012, 5.ª ed. Madrid: Exlibris ediciones SL; 2012. p. 441-52.
- Rosettie KL, et al. Indirect Rotavirus Vaccine Effectiveness for the Prevention of Rotavirus Hospitalization: A Systematic Review and Meta-Analysis. Am J Trop Med Hyg. 2018;98:1197-201.
- Rosillon D, et al. Risk of intussuception after rotavirus vaccination. Meta- analysis of postlicensure studies. Ped Infect Dis J. 2015;34:763-8.
- Ruiz-Contreras J, et al. Rotavirus gastroenteritis hospitalizations in provinces with different vaccination coverage rates in Spain, 2013-2018. BMC Infect Dis. 2021;21:1138.
- Russell MD, et al. Rheumatology guideline on prescribing drugs in pregnancy and breastfeeding: immunomodulatory anti-rheumatic drugs and corticosteroids. Rheumatology (Oxford). 2023;62:1370-87.
- Ruuska T, et al. Rotavirus disease in Finnish children: use of numerical scores for clinical severity of diarrhoeal episodes. Scand J Infect Dis. 1990;22:259-67.
- Salas A, et al. Impact of rotavirus vaccination on childhood hospitalizations for seizures: Heterologous or unforeseen direct vaccine effects? Vaccine. 2019;37:3362-8.
- Schell TL, et al. Safety of Rotavirus Vaccination in Infants That Were Exposed to Biologics In Utero: A Systematic Review. Inflamm Bowel Dis. 2025;31:1789-96.
- Selinger CP, et al. Live vaccinations for infants exposed to maternal infliximab in utero and via breast milk – the need for nuanced decision making. BMJ Open Gastroenterology. 2022;9:e001029.
- Slotboom DEF, et al. Neurologic Complications of Rotavirus Infections in Children. Pediatr Infect Dis J. 2023;42:533-6.
- Smith RC, et al. Is Rotavirus Immunization Safe in Infants Born to Mothers Treated with Immunosuppressive Drugs for Inflammatory Bowel Disease During Pregnancy?. J Immunological Sci. 2020;4:41-4.
- Sociedad Andaluza de Medicina Preventiva, Salud Pública y Gestión Sanitaria. Guía de vacunación en pacientes tratados con anticuerpos monoclonales y otras terapias dirigidas inmunosupresoras: una revisión actualizada a 1 de octubre de 2025. Rivera Izquierdo M, Valero Ubierna C, Guerrero Fernández de Alba I, Martínez Nogueras R, Morales Portillo A, Fernández Martínez NF, et al. 4.ª Edición. Revisión 2025.
- Solastie A, et al. Success ofrotavirus vaccination in Finland, a register based study measuring impact beyond overall effectiveness. Vaccine. 2020;38:3766-72.
- Standaert B, et al. The sustained rotavirus vaccination impact on nosocomial infection, duration of hospital stays and age: The RotaBIS Study (2005-2012). Infect Dis Ther. 2016;5:509-24.
- Sun Z, et al. Association of Rotavirus Vaccines With Reduction in Rotavirus Gastroenteritis in Children Younger Than 5 Years: A Systematic Review and Meta-analysis of Randomized Clinical Trials and Observational Studies. JAMA Pediatr. 2021;175:e210347.
- Taddio A, et al. A randomized trial of rotavirus vaccine versus sucrose solution for vaccine injection pain. Vaccine. 2015;33:2939-43.
- The Australian Immunisation Handbook. Vaccination for people who are immunocompromised. Infants born to mothers who received bDMARDs during pregnancy. Last updated: October 2025 [Internet].
- The Lancet Gastroenterology Hepatology. Opacity over live vaccines in infants exposed to infliximab. Editorial. Lancet Gastroenterol Hepatol. 2022;7:379.
- Thomas SL, et al. Impact of the national rotavirus vaccination programme on acute gastroenteritis in England and associated costs averted. Vaccine. 2017;35:680-6.
- UK Health Security Agency. Green Book. Chapter 27b. Rotavirus.
- Vesikari T, et al. European Society for Paediatric Infectious Diseases Consensus Recommendations for Rotavirus Vaccination in Europe: Update 2014. Pediatr Infect Dis J. 2015;34:635-43.
- Walker JL, et al. Effectiveness of oral rotavirus vaccination in England against rotavirus-confirmed and all-cause acute gastroenteritis. Vaccine X. 2019;1:100005.
- World Health Organization (WHO). Global Advisory Committee on Vaccine Safety, 11-12 December 2013. Update on intussusception following rotavirus vaccine administration. Wkly Epidemiol Rec. 2014;89:53-60.
- World Health Organization (WHO). Information Sheet. Observed rate of vaccine reactions rotavirus vaccine. Jun/2018.
- World Health Organization (WHO). Recommendations to assure the quality, safety and efficacy of rotavirus vaccines. Replacement of Annex 3 of WHO Technical Report Series, No. 941. 6 Nov 2024 [Internet].
- World Health Organization (WHO). Rotavirus vaccines: WHO position paper – July 2021. Wkly Epidemiol Rec. 2021;96:301-20.
- Yandle Z, et al. Indirect impact of rotavirus vaccination on viral causes of acute gastroenteritis in the elderly. J Clin Virol. 2021;137:104780.
- Zerbo O, et al; Safety of Live-Attenuated Vaccines in Children Exposed to Biologic Response Modifiers in Utero. Pediatrics. 2022;150:e2021056021.
16. Enlaces de interés
- American Academy of Pediatrics. Healthy children. Rotavirus
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026
- Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine Preventable Diseases (The Pink Book 2021), 14th edition: Chapter 19. Rotavirus
- Centers for Disease Control and Prevention. Rotavirus
- Centers for Disease Control and Prevention. Rotavirus Vaccination
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Rotavirus
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente al rotavirus
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna del rotavirus
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre el rotavirus
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente al rotavirus
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada
- European Centre for Disease Control and Prevention. Expert opinion on rotavirus vaccination in infancy. Sept 2017
- European Centre for Disease Control and Prevention. Impact of rotavirus vaccination - Generic study protocol
- Immunisation Handbook. 2025, version 4. New Zealand. Rotavirus
- PATH. Rotavirus Vaccine Advocay Reosurces
- The Australian Immunisation Handbook. Rotavirus
- The International Vaccine Access Center (IVAC) Map Rotavirus
- The Children´s Hospital of Philadelphia. Rotavirus vaccine
- The Rotavirus Organization of Technical Allies (ROTA)
- WHO. Health topics: Rotavirus gastroenteritis
17. Historial de actualizaciones
| 11 de marzo de 2018 | Actualización de los apartados efectividad e indicaciones y esquemas de vacunación. Nuevas citas bibliográficas y enlaces de interés |
| 19 de julio de 2018 | Actualización de la efectividad. Nuevas citas bibliográficas |
| 1 de enero de 2019 | Nuevas citas bibliográficas y enlaces de interés |
| 28 de mayo de 2019 | Incorporación de ROTAPREM en el apartado indicaciones y esquemas de vacunación. Nuevas citas bibliográficas |
| 1 de enero de 2020 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2021 | Nuevas citas bibliográficas y enlaces de interés |
| 22 de junio de 2021 | Aclaración del apartado de "Precauciones y contraindicaciones" |
| 19 de agosto de 2021 | Actualización del apartado de "Precauciones y contraindicaciones" sobre FAME |
| 13 de enero de 2022 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 15 de febrero de 2022 | Se actualiza el subapartado "Vacunación de los recién nacidos de madres tratadas con anticuerpos monoclonales y otros inmunosupresores" con la nota de la EMA sobre infliximab |
| 6 de septiembre de 2022 | Corrección de errores de las figuras 35.3 y 35.4 |
| 1 de enero de 2023 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 18 de agosto de 2023 | Actualización de los apartados "Introducción", "Virología", "Epidemiología de la enfermedad", "Tipos de vacunas, composición y presentación", "Inmunogenicidad, eficacia y efectividad", "Vías de administración" e "Indicaciones y esquemas de vacunación". Nuevas citas bibliográficas y enlace de interés |
| 3 de octubre de 2023 | Actualización del subapartado "Vacunación de los recién nacidos de madres tratadas con anticuerpos monoclonales y otros inmunosupresores" con un trabajo canadiense que autoriza la vacuna aunque se reciban biológicos en el embarazo |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlace de interés |
| 1 de enero de 2025 | Nuevas citas bibliográficas y enlace de interés |
| 1 de abril de 2025 | Modificación enlace de interés de "Vacunación acelerada" |
| 31 de julio de 2025 | Actualización del apartado "Recomendaciones de vacunación" |
| 12 de agosto de 2025 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 10 de octubre de 2025 | Actualización del subapartado "Vacunación de los recién nacidos de madres tratadas con anticuerpos monoclonales y otros inmunosupresores" |
| 1 de enero de 2026 | Actualización de los apartados "Virología" y "Epidemiología de la enfermedad" y creación del apartado "Pautas de vacunación mixtas y aspectos legales". Nuevas citas bibliográficas y enlace de interés |
-oOo-