Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
29. Hepatitis B
Capítulo 29 - Hepatitis B
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de vacunas, composición y presentación
- Inmunogenicidad, eficacia y efectividad
- Vías de administración
- Indicaciones y esquemas de vacunación
7.1. Vacunación de lactantes
7.2. Vacunación de niños y adolescentes
8.1. Vacunación en recién nacidos hijos de madres HBsAg positivas
8.2. Prematuros de menos de 2000 gramos de peso al nacimiento
8.3. Pacientes inmunodeprimidos o hemodializados
8.4. Exposición accidental al VHB
8.5. Vacunación frente al VHB en el paciente celiaco
8.6. Vacunación acelerada
- Control serológico posvacunación
- Administración con otras vacunas y otros productos
- Efectos adversos
- Precauciones y contraindicaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figuras incluidas en el capítulo:
Tabla 29.1. Situaciones de riesgo elevado de hepatitis B
Tabla 29.2. Vacunas frente a la hepatitis B comercializadas en España
Tabla 29.3. Esquemas de vacunación de lactantes en España frente a la hepatitis B
Tabla 29.4. Esquema de vacunación de niños y adolescentes
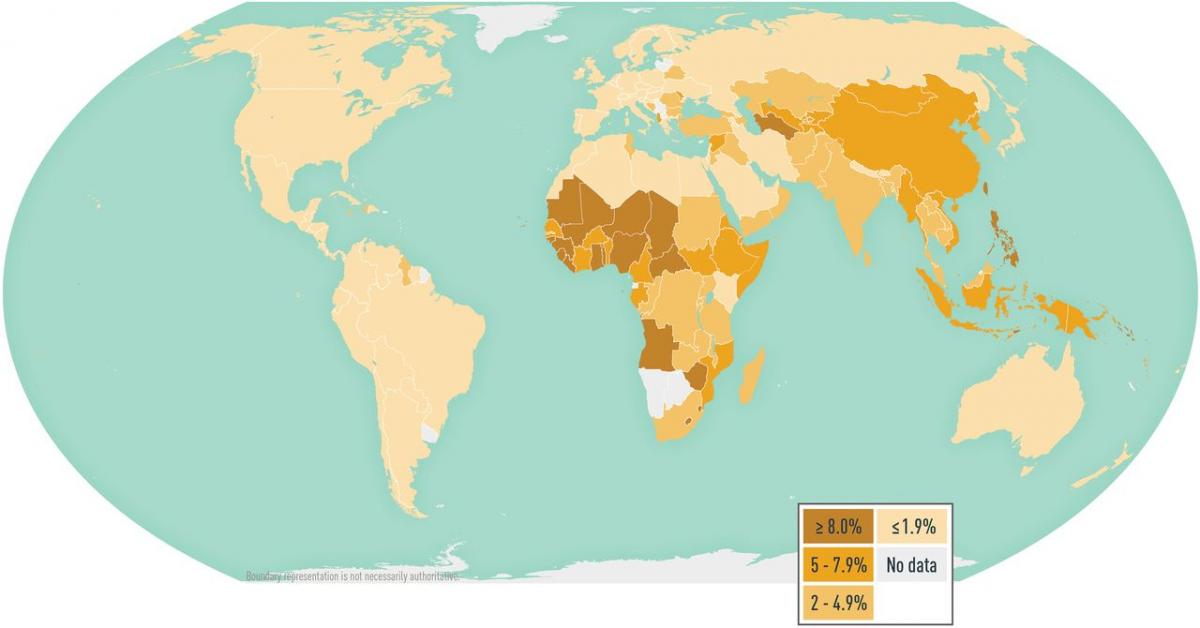
Figura 29.1. Prevalencia de hepatitis B en el mundo
Figura 29.2. Algoritmo del control posvacunal en función del riesgo
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Hepatitis B. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-29
1. Puntos clave
- La hepatitis B es una enfermedad infecciosa de transmisión fundamentalmente sexual y sanguínea, causada por el virus de la hepatitis B.
- A través del análisis de los marcadores virales en el suero del paciente en estudio se puede determinar la etapa de la infección.
- Cuanto menor es la edad del contagiado, mayor es el riesgo de desarrollar infección crónica. Esta se produce en el 90 % de los casos de infección perinatal.
- La prevención de la hepatitis B se basa en la inmunización, tanto activa como pasiva, el control adecuado en el manejo de la sangre, los fluidos corporales y los hemoderivados, así como en las medidas generales de prevención de contagio de infecciones de transmisión sexual.
- La transmisión vertical de la infección se combate mediante el cribado serológico de las embarazadas y el tratamiento con antivirales de las infectadas que muestren alta carga viral, junto con la inmunización neonatal precoz de los hijos de madres portadoras.
- La cobertura vacunal con 3 dosis de la hepatitis B alcanza al 84 % de la población mundial.
- España es un país de endemicidad baja. Tras la introducción de la vacunación universal ha descendido drásticamente la incidencia de infección por el VHB.
- Para la inmunización frente a la hepatitis B se dispone de dos tipos de productos: la vacuna, que confiere inmunidad duradera (memoria inmunológica), y la inmunoglobulina específica, que induce protección rápida, pero temporal.
- Existen vacunas seguras y muy eficaces que han sido incluidas en la mayoría de los países como parte del calendario de vacunación infantil de rutina. Estas vacunas son inactivadas y no contienen organismos vivos en su composición, y por tanto son incapaces de producir la enfermedad. Contienen sales de aluminio como adyuvante.
- Se ha generalizado el uso de vacunas combinadas que contienen el componente antihepatitis B. En todos los casos, los laboratorios fabricantes han demostrado que los componentes incluidos en estas vacunas son eficaces en cuanto a la inducción de una respuesta inmunitaria protectora y duradera.
2. Introducción
La hepatitis B es una hepatitis infecciosa causada por el virus de la hepatitis B (VHB). Este es un virus ADN y contiene numerosos componentes antigénicos como el antígeno de superficie (HBsAg, del inglés, Hepatitis B Surface Antigen), el antígeno del core (HBcAg) y el antígeno e (HBeAg). La nucleocápside del virus está formada por el HBcAg, que está fijado al hepatocito y que no puede ser detectado en el suero, por lo que su identificación serológica se realiza a través de la presencia de anticuerpos (anti-HBc), que pueden persistir durante toda la vida. La estructura viral también contiene otro antígeno que marca el mayor periodo de infectividad, que se denomina antígeno e (HBeAg). En la evolución a la curación de la enfermedad, la desaparición de estos antígenos da lugar a la presencia de anticuerpos, tanto contra el HBeAg (anti-HBe) como frente al antígeno de superficie (anti-HBs). En la actualidad se utiliza la determinación de la carga viral, mediante técnicas de detección de ADN VHB, como indicador cuantificable de replicación viral y por tanto también del grado de infectividad en los pacientes infectados.
La vacunación provoca, como respuesta inmunitaria, la aparición de anticuerpos anti-HBs en el suero, por el contrario, los anti-HBc no se originan como respuesta a la vacunación, sino únicamente debido a la infección natural. También pueden detectarse temporalmente anticuerpos anti-HBs hasta 24 meses después de la administración de inmunoglobulina específica IGHB frente a la hepatitis B.
A través del análisis de los diferentes marcadores virales comentados es posible determinar la etapa de infección, convalecencia y cronicidad del paciente en estudio, así como la respuesta a la vacunación.
Clínicamente, la infección por el VHB puede causar hepatitis aguda o crónica, pudiendo esta desembocar en cirrosis y carcinoma hepatocelular. Aunque la hepatitis aguda puede presentarse como fulminante, en 1-2 % de los casos, las formas crónicas, por su frecuencia, son las de mayor relevancia clínica. La infección perinatal se hace persistente en el 90·% de los casos, aunque este curso evolutivo es menos frecuente a medida que avanza la edad a la que se resulta infectado, de forma que solo el 5·% de los sujetos que contraen la enfermedad en la edad adulta desarrollarán una hepatitis crónica. Este porcentaje aumenta al 20 % y al 40·% en los pacientes inmunodeprimidos y en los hemodializados, respectivamente.
El virus de la hepatitis B, junto con el virus del papiloma humano, son causa demostrada de cánceres prevenibles mediante vacunación. A nivel mundial, se estima que más de la mitad de los carcinomas hepatocelulares son debidos al VHB.
La prevención de la enfermedad se basa fundamentalmente en la inmunización, tanto activa como pasiva, el manejo adecuado de la sangre, los fluidos corporales y los hemoderivados; así como en las medidas de evitación de infecciones de transmisión sexual. La transmisión vertical de la hepatitis B se combate a través del control serológico de las mujeres embarazadas y el tratamiento con antivirales de las infectadas con alta carga viral, junto con la inmunización neonatal precoz de los hijos de madres portadoras del HBsAg.
3. Epidemiología de la enfermedad
La infección por el VHB es de distribución universal (figura 29.1). La infección por este virus solo afecta a los humanos y no hay huéspedes ni vectores animales. Las principales vías de transmisión son el contacto sexual, la exposición percutánea a sangre o a fluidos corporales infectados y la transmisión perinatal. La Organización Mundial de la Salud (OMS) ha estimado que aproximadamente 296 millones de personas estaban infectadas de manera crónica por el VHB en 2019, con alto riesgo de enfermedad hepática grave, produciéndose unas 820 000 muertes por cirrosis hepática o hepatocarcinoma. Cada año se producen 1,5 millones de nuevos casos. La carga de la infección por hepatitis B es mayor en la Región del Pacífico Occidental de la OMS y la Región de África de la OMS, donde 116 millones y 81 millones de personas, respectivamente, están infectadas de forma crónica. Sesenta millones de personas están infectadas en la Región del Mediterráneo Oriental de la OMS, 18 millones en la Región de Asia Sudoriental de la OMS, 14 millones en la Región de Europa de la OMS y 5 millones en la Región de las Américas de la OMS. Según los últimos datos, la proporción de menores de cinco años con infección crónica por el VHB descendió a menos del 1 % en 2019.
En Europa, casi todos los países muestran tasas de incidencia anual por debajo de 1, siendo la media, en 2019, de 0,4 casos por 100 000 habitantes.
Figura 29.1. Prevalencia de hepatitis B en el mundo.
Fuente: CDC. Yellow Book 2024.
En función de la prevalencia de la enfermedad, existen regiones geográficas con endemicidad alta, donde la prevalencia de portadores de HBsAg es igual o mayor del 8 % y en las que la infección se adquiere con frecuencia a edades tempranas, por transmisión perinatal; regiones con endemicidad intermedia alta e intermedia baja (prevalencia de portadores de HBsAg entre el 2 y el 7 %), donde la transmisión horizontal precoz es más frecuente; y regiones con endemicidad baja (menos del 2 % de HBsAg), donde la enfermedad se adquiere predominantemente en la edad adulta y la transmisión está relacionada con prácticas de riesgo y que se producen principalmente en personas con múltiples parejas sexuales y usuarios de drogas por vía intravenosa.
La población con especial riesgo de padecer la infección se muestra en la tabla 29.1.
Tabla 29.1. Situaciones de riesgo elevado de hepatitis B.
| ● Hemodiálisis | |
| ● Exposición al virus de la HB | |
| - RN hijo de madre HBsAg positiva | |
| - Contacto domiciliario | |
| - Exposición accidental | |
| - Exposición profesional | |
| - Contacto sexual | |
| ● Inmunodepresión primaria y secundaria | |
En 2022, según datos de la OMS, 257,5 millones de personas padecían una infección crónica por el virus de la hepatitis B, lo que supone una prevalencia global del 3,2 % y 1,1 millones de fallecimientos, principalmente por cirrosis o hepatocarcinoma. Se estima que cada año se producen 1,2 millones de nuevas infecciones, por lo que, sin una respuesta amplia y acelerada, se prevé que el número de personas que viven con el virus de la hepatitis B se mantendrá en los mismos niveles durante los próximos 40 a 50 años, lo que significará una cifra acumulada de 20 millones de muertes entre 2015 y 2030. Por todo ello, la OMS ha planteado una “Estrategias mundiales del sector de la salud contra el VIH, las hepatitis víricas y las infecciones de transmisión sexual para el periodo 2022-2030”, con el objetivo de eliminarlas hacia 2030 que incluye como metas concretas, diagnosticar al 90 % de portadores crónicos, tratar al 80 % de las personas elegibles, reducir las nuevas infecciones en un 90 % y disminuir las muertes relacionadas con la hepatitis en un 65 %.
Los datos actuales estiman que, en la UE/EEE alrededor de 11,5 millones de personas presentan infección crónica, lo que supone una prevalencia del 1,2 %, que tan solo el 20 % de las personas infectadas han sido diagnosticadas, y que sólo el 10 % de la población elegible para terapia recibe tratamiento lo que las expone a un alto riesgo de desarrollar enfermedad hepática crónica y cáncer de hígado. En 2023, 30 países de (UE/EEE) notificaron 37 766 casos de infección por el virus de la hepatitis B (VHB), lo que corresponde a una tasa bruta de 8,1 casos por cada 100 000 habitantes. De todos los casos, el 6,3 % se notificaron como agudos, el 40,5 % como crónicos, el 46,1 % como desconocidos y el 7,1 % como no clasificables.
En España, la vacunación comenzó en grupos de riesgo en 1982, se extendió a adolescentes en la década de 1990 y a lactantes a partir de 2002 alcanzando coberturas que fluctúan entre el 75 % y el 90 % en adolescentes y en torno al 98 % en lactantes, superiores al 90 % de cobertura mínima de vacunación contra la hepatitis B en niños establecida en la Estrategia mundial OMS para el control de las hepatitis víricas.
Actualmente España es un país de baja endemicidad, con una prevalencia de HBsAg entre 0,1 % y 0,4 %, la enfermedad se adquiere predominantemente en la edad adulta y la transmisión está relacionada con prácticas de riesgo. La transmisión vertical es extremadamente rara debido a la baja incidencia y al cribado serológico sistemático que se realiza en todas las gestantes para el VHB.
Desde 2008, el número de casos ha ido en descenso, de tal manera que se ha pasado de 968 casos de hepatitis B aguda en ese año (tasa de 2,12/100 000 habitantes) a 369 casos (tasa de 0,50 casos/100 000) en 2023. En 2022, solo 2 casos ocurrieron en <15 años (0,6 %), uno en un niño de 8 años procedente de adopción internacional con antecedente de transmisión vertical documentada, y una niña de 12 años española con antecedente de vacunación desconocido. Según el Centro Nacional de Epidemiología, en España durante 2023 se notificaron 369 casos de hepatitis aguda (tasa de 0,50 casos/100 000), el 76,4 % (282 casos) en hombres, la mediana de edad fue de 48 años.
España mantiene una tasa de incidencia anual por debajo de 2 casos/100 000 habitantes; en 2023 se notificaron 359 casos, lo que supuso una tasa de 0,50 casos/100 000. Los casos se detectan en adultos jóvenes, habitualmente inmigrantes y ha desaparecido la transmisión vertical del virus gracias a la estrategia que se realiza para su prevención. España, con una prevalencia de portadores entre 0,2 y 0,5 %, se considera un país de prevalencia baja. El periodo de mayor riesgo para la adquisición de la infección en nuestro país es el final de la adolescencia y los primeros años de la edad adulta. La transmisión vertical es extremadamente rara debido a la baja incidencia y al cribado serológico sistemático de todas las gestantes para el VHB. En las mujeres embarazadas españolas se estima una prevalencia de HBsAg del 0,7-2 %, con algunas diferencias geográficas. En los últimos 10 años se han declarado tan solo 15 casos de hepatitis B en niños menores de 1 año, siendo 7 de ellos importados.
La hepatitis B está incluida dentro del sistema de notificación de la Red Nacional de Vigilancia Epidemiológica.
El VHB se transmite por vía percutánea o por contacto directo con membranas mucosas, exposición a sangre infecciosa o fluidos corporales. El VHB es muy infeccioso, puede transmitirse en ausencia de sangre visible y permanece viable en superficies ambientales durante, al menos, siete días. Las personas con infección crónica sirven como el principal reservorio para la transmisión del VHB. En las zonas endémicas, la principal vía de transmisión es vertical, durante el periodo perinatal (intraútero, canal del parto o tras el nacimiento) y en la primera infancia. Las madres HBeAg+ tienen una alta capacidad contagiosa y en ausencia de medidas profilácticas, hasta un 70-90 % de los hijos de madres HBeAg+ se infectarán y un 10-40·% de los hijos de madres HBeAg-. El riesgo de cronificación es de un 95 % en el período neonatal, pero suele cursar de forma asintomática, debido a una situación de inmunotolerancia: el paso transplancentario del HBeAg materno induce una ausencia de respuesta específica de los linfocitos T a los antígenos HBeAg y HBcAg del virus, esto condiciona una falta de reconocimiento del HBcAg expresado en los hepatocitos infectados en el periodo posnatal. Si la madre es HBeAg-, el riesgo de contagio es menor, pero si se produce, tienen mayor riesgo de desarrollar una hepatitis fulminante, debido a la mayor probabilidad de virus mutados.
4. Tipos de vacunas, composición y presentación
Para la inmunización frente a la hepatitis B se dispone de dos tipos de productos: la vacuna y la inmunoglobulina específica (IGHB). El uso de esta última viene detallado en el capítulo sobre inmunización pasiva de este manual (capítulo 45).
Aunque hay otras en fase experimental, la vacuna frente a la hepatitis B actualmente disponible es una vacuna inactivada y no contiene, por tanto, microbios vivos en su composición, ni material genético del VHB, por lo que no dispone de capacidad para contagiar ni para producir la enfermedad. Está desarrollada mediante ingeniería genética con técnicas de ADN recombinante y está constituida por la principal proteína de superficie del virus (HBsAg), producida en cultivo de levaduras (Saccharomyces cerevisiae) modificadas genéticamente mediante la inclusión de plásmidos con el gen viral que codifica esta proteína. El preparado contiene, como adyuvante, hidróxido o hidroxifosfato de aluminio y una de ellas, indicada en pacientes con insuficiencia renal (también en pacientes prehemodializados y hemodializados), incluye asimismo en su composición 3-O-desacil-4’-monofosforil lípido A (MPL), denominado por el fabricante AS04C. Todos los preparados comercializados portan, como antígeno del VHB, exclusivamente HBsAg en diferentes formulaciones de 5, 10, 20 y 40 µg.
La vacunación universal frente a la hepatitis B forma parte de las inmunizaciones básicas recomendadas por la OMS. En 2020, la cobertura de 3 dosis alcanzó el 83 % de la población mundial, comparada con el 30 % en el año 2000, y la proporción de niños menores de 5 años con infección crónica por VHB cayó por debajo del 1 %, cuando alcanzaba el 5 % en la era prevacunal.
En España, la vacuna se introdujo, como parte de la inmunización sistemática de los adolescentes, entre 1991 y 1996, según la comunidad autónoma de residencia de que se trate, y por tanto la primera cohorte de españoles incluidos en la vacunación universal sobrepasa ya la treintena. Actualmente, en todas las CC. AA. se vacuna frente a la hepatitis B en el primer año de vida y desde 2018, tras un periodo en el que se aplicó la vacunación neonatal universal, la primera dosis se administra a los 2 meses de edad, como vacuna hexavalente. En 2022, la cobertura con la primera dosis fue del 98,2 % (91,6-100 %, según las CC. AA.) y para la segunda del 95,2 % (84,8-97,6 %).
La vacuna de la hepatitis B está comercializada en España en forma monocomponente y también combinada de dos formas: bien sea incluida en los preparados hexavalentes utilizados en los calendarios sistemáticos (DTPa+Hib+VPI+HB) o como preparado bivalente, unida al componente de la hepatitis A (HA+HB). Ver tabla 29.2.
Las presentaciones pediátricas actuales disponibles en España, al igual que el resto de las vacunas infantiles, no contienen el conservante tiomersal.
Tabla 29.2. Vacunas frente a la hepatitis B comercializadas en España.
| Nombre (Laboratorio) | Composición | Presentación/vía | Edad de administración |
| Vacunas monocomponentes | |||
| Engerix B 20 mcg (GSK) |
20 mcg de HBsAg (recombinante) Hidróxido de aluminio Levadura |
Jeringa precargada 1 ml IM |
≥16 años |
| Engerix B Junior 10 mcg (GSK) |
10 mcg de HBsAg (recombinante) Hidróxido de aluminio Levadura |
Jeringa precargada 0,5 ml IM |
Desde el nacimiento hasta los 15 años |
| Fendrix (GSK) |
20 mcg de HBsAg (recombinante) AS04C, fosfato de aluminio Levadura |
Jeringa precargada 0,5 ml IM |
≥15 años con insuficiencia renal |
| HBVAXPRO 5 mcg (Sanofi Pasteur MSD) |
5 mcg de HBsAg (recombinante) Sulfato hidroxifosfato de aluminio amorfo Formaldehído |
Jeringa precargada 0,5 ml IM |
Desde el nacimiento hasta los 15 años |
| HBVAXPRO 10 mcg (Sanofi Pasteur MSD) |
10 mcg de HBsAg (recombinante) Sulfato hidroxifosfato de aluminio amorfo Formaldehído |
Jeringa precargada 1 ml IM |
≥16 años |
| HBVAXPRO 40 mcg (Sanofi Pasteur MSD) |
40 mcg de HBsAg (recombinante) Sulfato hidroxifosfato de aluminio amorfo Formaldehído |
Jeringa precargada 1 ml IM |
Adultos en prediálisis y diálisis |
| Vacunas combinadas hexavalentes | |||
| Hexyon (Sanofi Pasteur) |
10 mcg de HBsAg (recombinante); toxoides tetánico y diftérico; proteínas de B. pertussis: toxoide y HAF; virus de la polio inactivados y polisacárido capsular de Hib conjugado con toxoide tetánico Hidróxido de aluminio, neomicina, estreptomicina, polimixina B, formaldehído y glutaraldehído |
Jeringa precargada 0,5 ml IM |
≥6 semanas No hay estudios de seguridad e inmunogenicidad a partir de 24 meses de edad, pero probablemente segura en <7 años (off label) |
| Infanrix Hexa (GSK) | 10 mcg de HBsAg (recombinante); toxoides tetánico y diftérico; proteínas de B. pertussis: toxoide, HAF y PRN; virus de la polio inactivados, polisacárido capsular de Hib conjugado con toxoide tetánico Hidróxido y fosfato de aluminio, neomicina y polimixina B Levadura |
Jeringa precargada 0,5 ml para reconstituir con Hib liofilizado IM |
≥6 semanas No hay estudios de seguridad e inmunogenicidad a partir de 36 meses de edad, pero probablemente segura en <7 años (off label) |
| Vaxelis (MSD) |
10 mcg de HBsAg (recombinante), toxoides tetánico y diftérico: proteínas de B. pertussis: toxoide, HAF, PRN y FIM; virus de la polio inactivados, polisacárido capsular de Hib conjugado con proteína de meningococo Fosfato de aluminio, neomicina, estreptomicina y polimixina B, formaldehído y glutaraldehído Levadura |
Jeringa precargada 0,5 ml IM |
≥6 semanas No hay estudios de seguridad e inmunogenicidad a partir de 15 meses de edad, pero probablemente segura en <7 años (off label) |
| Vacunas combinadas con hepatitis A | |||
| Twinrix Adultos (GSK) |
20 mcg de HBsAg (recombinante) y virus inactivados de hepatitis A Hidroxido de alumunio Fosfato de aluminio Neomicina |
Jeringa precargada 1 ml IM |
≥16 años |
| Twinrix Pediátrico (GSK) |
10 mcg de HBsAg (recombinante) y virus inactivados de hepatitis A Hidroxido de alumunio Fosfato de aluminio Neomicina |
Jeringa precargada 0,5 ml IM |
≥1 año hasta los 15 años |
IM: intramuscular; FIM: fimbrias tipos 2 y 3; HAF: hemaglutinina filamentosa; PRN: pertactina.
5. Inmunogenicidad, eficacia y efectividad
La vacuna frente a la hepatitis B es muy efectiva en la prevención de la enfermedad. Los estudios poscomercialización han demostrado que un esquema de tres dosis induce concentraciones protectoras de anti-HBs en más del 95 % de los lactantes, niños y adolescentes sanos y en más del 90·% de los adultos sanos menores de 40 años. La inmunogenicidad desciende en relación inversa con la edad. Las personas en hemodiálisis y otros pacientes inmunodeprimidos pueden presentar menor seroconversión, por lo que puede ser necesario aumentar de 2 a 4 veces la dosis de antígeno, utilizar una vacuna adyuvada o bien aplicar un mayor número de dosis.
Los estudios de eficacia de la vacuna muestran que los sujetos que desarrollan títulos protectores de anti-HBs iguales o superiores a 10 mUI/ml resultan protegidos. Varios estudios han demostrado que, tras 3 dosis, tanto en niños como en adultos, las concentraciones de anticuerpos protectores se pierden, en la mitad de los casos, de 5 a 15 años después de la vacunación. A pesar de ello y debido a la presencia de memoria inmunológica, la vacuna confiere protección a largo plazo frente a la enfermedad, produciéndose una respuesta inmunitaria secundaria protectora tras la exposición al virus, a pesar de la ausencia de anti-HBs detectables con anterioridad. La duración ya comprobada de la inmunidad que confiere la vacunación es de, al menos, 30 años.
La eficacia preventiva de la vacuna en la posexposición está documentada en el caso de los lactantes nacidos de madres con serología HBsAg positiva. La inmunoprofilaxis con vacuna monocomponente frente a la hepatitis B, junto con inmunoglobulina específica (IGHB), tiene una efectividad de entre el 80 % y el 100 %, dependiendo de la carga viral materna.
Por los datos de que se dispone en la actualidad, no hay necesidad de dosis de refuerzo en niños y adultos inmunocompetentes.
6. Vías de administración
La administración de la vacuna se realiza por vía intramuscular en la región anterolateral externa del muslo o en el deltoides, en función de la edad. Está contraindicada, por ficha técnica, la administración en el glúteo, por resultar menos inmunógena. Se han realizado estudios, especialmente en pacientes en hemodiálisis, que demuestran la eficacia de la vía intradérmica.
7. Indicaciones y esquemas de vacunación
La mejor estrategia para luchar contra la hepatitis B es la vacunación universal. Asimismo, la vacuna está indicada específicamente en personas susceptibles no vacunadas incluidas en grupos de riesgo (ver tabla 29.1).
7.1. Vacunación de lactantes
La vacunación de los lactantes frente a la hepatitis B requiere 3 dosis, aunque se admiten 4 cuando existe vacunación neonatal.
En la vacunación de recién nacidos se empleará siempre el preparado monocomponente. A partir de las 6 semanas de vida se utilizarán preferentemente las vacunas hexavalentes, pues todas contienen la vacuna de la hepatitis B en su composición.
El intervalo mínimo recomendado entre la 1.ª y la 2.ª dosis es de 4 semanas, y entre la 2.ª y la 3.ª, de 8 semanas. La dosis final de la serie debe administrarse no antes de las 24 semanas de edad y, al menos, 16 semanas después de la 1.ª dosis. Las dosis administradas que no respeten estos intervalos mínimos recomendados en su aplicación deben considerarse no válidas. Sin embargo, los estudios demuestran que retrasar la administración de la dosis final de la serie a los 11 meses de edad se asocia con una mayor inmunogenicidad y por lo tanto mayor persistencia de los títulos de anticuerpos protectores, además de poder contrarrestar el efecto inhibitorio de los anticuerpos maternos, en el caso de madres con títulos altos de anti-HBs durante la gestación. Estos datos, añadidos a la drástica disminución de la transmisión vertical del virus en nuestro país, aconsejaron la aplicación de nuevos esquemas de vacunación, ya vigentes en otras regiones de Europa, manteniendo, al mismo tiempo, un adecuado control de la infección perinatal.
En la situación actual española, la vacunación en el primer año puede seguir cualquiera de las pautas equivalentes que se muestran en la tabla 29.3, si bien siguen siendo correctos los esquemas que finalizan a los 6 meses de edad y que continúan aplicándose en otros países.
Tabla 29.3. Esquemas de vacunación de lactantes en España frente a la hepatitis B.
| Pauta A | ------ | Pauta B | ||||
| Dosis | Edad | Intervalo mínimo |
Dosis | Edad | Intervalo mínimo |
|
| 1.ª | Nacimiento | - | 1.ª | 2 meses | - | |
| 2.ª | 2 meses | 4 semanas | 2.ª | 4 meses | 8 semanas1 | |
| 3.ª | 4 meses | 8 semanas1 | 3.ª | 11 meses | 8 semanas2 | |
| 4.ª | 11 meses | 8 semanas2 | ||||
1 Si se emplean vacunas combinadas hexavalentes con pauta 2+1, las dosis de los 2 y 4 meses de edad deben espaciarse, al menos, 8 semanas. Cuando se utilice vacuna monocomponente el intervalo mínimo será de 4 semanas.
2 Al menos, 16 semanas después de la 1.ª dosis.
La primera pauta, de 4 dosis, es la indicada para hijos de madres portadoras del virus de la hepatitis B (HBsAg positivo), pues incluye la preceptiva inmunización neonatal con vacuna monocomponente y estando también admitida la administración de la 2.ª dosis a los 2 meses de edad, en forma de vacuna hexavalente, independientemente del peso al nacimiento.
7.2. Vacunación de niños y adolescentes
La vacunación de rescate frente a la hepatitis B en niños mayores y adolescentes no vacunados con anterioridad se realiza habitualmente siguiendo la pauta 0, 1 y 6 meses (tabla 29.4), no siendo necesario añadir nuevas dosis o reiniciar la vacunación en los casos en que los intervalos hayan sido mayores de los recomendados, ni tampoco administrar dosis de refuerzo. Hay estudios que demuestran inmunogenicidad suficiente con pautas de 2 dosis (0 y 4-6 meses) en adolescentes de 11 a 15 años, utilizando la vacuna con dosificación para adultos, y así está aceptado su uso en EE. UU. por la FDA, desde 1999, para el preparado de la compañía Merck (en Europa, MSD).
Las vacunas hexavalentes han sido autorizadas por la AEMPS para ser administradas en menores de 7 años de edad en el caso que no hayan recibido la pauta de vacunación a su tiempo (2, 4, 11 meses de edad) o la tengan incompleta de acuerdo con las recomendaciones oficiales.
Cuando se emplee la vacuna combinada de hepatitis A+B deberán aplicarse tres dosis siguiendo el esquema 0, 1 y 6 meses. La presentación pediátrica de esta vacuna se utiliza en niños a partir de un año de edad, hasta los 15 inclusive. A partir de los 16 años de edad debe emplearse la presentación de adultos, para la que además está aprobada una pauta acelerada de 4 dosis, a los 0, 7, 21-30 días y 12 meses. El “período de gracia” no se admite para los intervalos únicos fijados entre dosis para la pauta acelerada de la combinada frente a las hepatitis A y B (Twinrix: 0, 7, 21-30 días): las administradas a intervalos inferiores a los asignados en sus series no deben considerarse válidas y deberán repetirse a las edades apropiadas. En caso de necesidad pueden utilizarse los preparados monocomponentes para completar pautas vacunales iniciadas con la vacuna combinada A+B y viceversa.
Tabla 29.4. Esquema de vacunación de niños y adolescentes.
| Dosis | Intervalo habitual |
Intervalo mínimo |
| 1.ª | - | - |
| 2.ª | 1 mes | 4 semanas |
| 3.ª | 5 meses | 8 semanas1 |
1 Al menos 16 semanas después de la 1.ª dosis.
8. Situaciones especiales
8.1. VACUNACIÓN DE RECIÉN NACIDOS HIJOS DE MADRES HBSAG POSITIVAS
El riesgo de transmisión vertical de la infección, en madres portadoras de HBsAg que son negativas para el HBeAg, es prácticamente inexistente si se vacuna al recién nacido, mientras que alcanza el 20 % en los hijos de madres HBeAg positivas vacunados al nacer. Esta situación ha llevado a la indicación actual de tratamiento antiviral (tenofovir y otros fármacos) de las embarazadas portadoras con elevada carga de VHB (ADN VHB >200·000 UI/ml).
Los hijos de madres HBsAg positivas deben recibir al nacimiento tratamiento profiláctico posexposición con una dosis de vacuna y otra de IGHB (0,5 ml) por vía intramuscular; ambas, preferiblemente en las primeras 12 horas de vida y en un lugar anatómico diferente (vasto externo contralateral).
Si la serología materna fuera desconocida, deberá administrarse al recién nacido la vacuna en las primeras 12 horas de vida e investigar la serología de la madre inmediatamente y, si resultara positiva, administrar 0,5 ml de IGHB dentro de la 1.ª semana de vida, preferentemente en las primeras 72 horas o bien, sin esperar más, en las primeras 12 horas de vida en el caso de los menores de 2 kg al nacer (ver apartado 8.2).
La 2.ª dosis de la vacuna puede aplicarse a los 2 meses de edad, en forma de vacuna combinada hexavalente, pero, si se administra al mes de vida, ha de hacerse entonces con el preparado monocomponente.
En la práctica, en nuestro país, se administrarán un total de 4 dosis cuando se vacune frente a la hepatitis B a un recién nacido hijo de madre portadora, siguiendo el esquema 0, 2, 4 y 11 meses de edad; es decir, la dosis neonatal seguida de las del calendario sistemático.
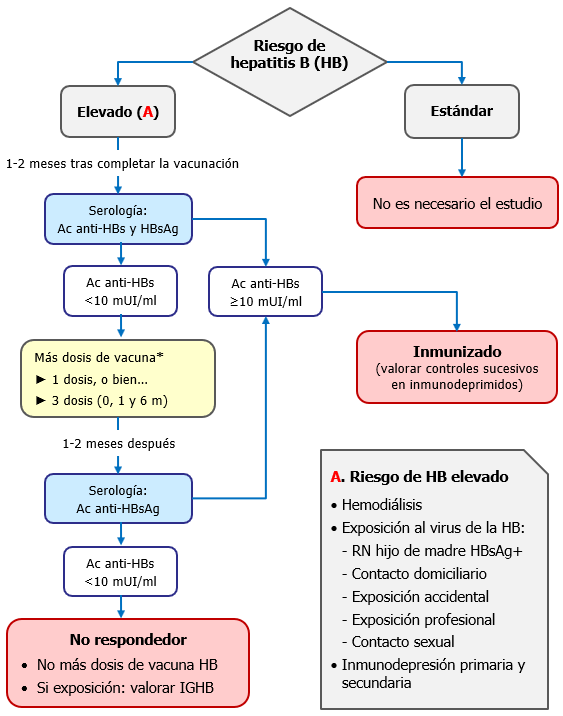
Se realizará un control serológico posvacunal (HBsAg y anti-HBs) al finalizar la serie completa, 1-2 meses después de administrar la dosis final, es decir, a los 12-13 meses de edad, o bien a los 9 meses de vida si se administra la dosis final a los 6 meses, para evitar así la posible interferencia de la IGHB recibida al nacer. En caso de que el nivel alcanzado de anticuerpos anti-HBs fuera inferior a 10 mU/ml hay dos posibles caminos: el clásico de repetir una nueva pauta completa de vacunación con esquema 0, 1 y 6 meses, o bien administrar una sola dosis y comprobar de nuevo la serología 1-2 meses después y, si el nivel fuera todavía insuficiente, completar la serie y repetir la determinación de anticuerpos a la finalización (ver algoritmo de la figura 29.2).
Los hijos de madres portadoras de HBsAg pueden ser amamantados desde el nacimiento.
8.2. Prematuros de menos de 2000 gramos de peso al nacimiento
Los países con esquemas de vacunación de 3 dosis frente a la hepatitis B, como EE. UU., que incluyen la dosis monocomponente neonatal (RN, 1-2 y 6 meses), se ven obligados, en la vacunación de niños que pesaron menos de 2000 g al nacer, a retrasar la primera dosis hasta el mes de edad, para que resulte suficientemente inmunógena. En estos mismos países, en el caso de hijos de madres HBsAg positivas con menos de 2000 g al nacer, se aplican pautas de 4 dosis, pues la vacunación inmediata al parto, siendo preceptiva, no debe considerarse como contabilizable en la serie vacunal, por su posible baja inmunogenicidad en estos niños. En el caso de España, todos los niños reciben actualmente 3 dosis de vacuna combinada a partir de los 2 meses, y los hijos de madres portadoras de HBsAg 4 dosis de vacuna: la monocomponente de recién nacidos, seguida de la serie de 3 hexavalentes a los 2, 4 y 11 meses de edad. Por lo tanto, en España ya no es preciso tener en cuenta el peso al nacimiento a la hora de la vacunación frente a la hepatitis B. En función de la serología materna, el esquema será como sigue:
- Si son hijos de madres HBsAg negativas se aplicará el calendario vigente sin modificaciones (3 dosis).
- Si son hijos de madres HBsAg positivas deberán recibir 4 dosis, administrando la primera monocomponente y la inmunoprofilaxis con IGHB en las primeras 12 horas de vida. Las 3 dosis restantes se aplicarán en forma de hexavalentes, de acuerdo con el calendario sistemático, a los 2, 4 y 11 meses de edad.
- Si son hijos de madre de situación serológica desconocida, nacidos con peso menor de 2000 g, se les administrará asimismo, además de la vacuna, la IGHB en las primeras 12 horas de vida, sin esperar al resultado de la serología materna, dada la posible baja inmunogenicidad en ellos de la dosis neonatal de vacuna.
8.3. Pacientes inmunodeprimidos o hemodializados
Los inmunodeprimidos y los pacientes en hemodiálisis presentan una menor respuesta de anticuerpos. Existe una vacuna específica adyuvada para los de 15 años de edad o más, que se aplica en 4 dosis con un esquema de 0, 1, 2 y 6 meses. Se recomienda practicar serologías periódicas, especialmente si hay exposición a VHB. No existe criterio unánime en cuanto a la actitud ante un niño inmunodeprimido vacunado que no tenga títulos protectores, respecto a administrar solo una dosis de refuerzo o la pauta completa de 3 dosis. Sin embargo, esta última opción parece asegurar mayor protección.
8.4. Exposición accidental al VHB
La profilaxis posexposición incluye 4 tipos diferentes de exposición al virus de la hepatitis B: perinatal (comentado anteriormente), sexual, percutánea (pinchazo accidental) o cutáneo-mucosa (salpicadura), y familiar o domiciliaria. La pauta consiste en la vacunación frente a la enfermedad, en caso de no haberla recibido, con pauta 0, 1 y 6·meses, junto con la administración de IGHB de forma inmediata si ha habido contacto, que puede ser simultánea con la primera dosis de la vacuna. Este uso preventivo de la vacuna en posexposición al VHB se detalla en el apartado correspondiente de este manual (ver capítulo 9, sección 4)
8.5. Vacunación frente al VHB en el paciente celiaco
La enfermedad celíaca (EC) es una afección autoinmune crónica del intestino delgado que resulta de una reacción inmune al gluten. Esta reacción daña las vellosidades del intestino delgado, alterando la absorción de nutrientes, incluidos los esenciales para la función inmune, comprometiendo así el sistema inmunológico y su respuesta a las vacunas. En comparación con la población general, las personas con EC responden peor a la vacuna frente a la hepatitis B1,2 con una tasa de falta de respuesta del 54 % al 78 %3, lo que se cree que aumenta su riesgo de infección por VHB1,2, 4-10.
Varios estudios (Aneja A, 2021; Tahir A, 2024; Ulrich JA, 2023) han propuesto diversas explicaciones para esta respuesta reducida, incluida la predisposición genética, la existencia de haplotipos específicos y el consumo de gluten. Los pacientes con EC con haplotipos HLA-B8, DR3 y DQ2 del antígeno leucocitario humano (HLA) específicos de la enfermedad demostraron una respuesta disminuida a la vacuna. En particular, HLA-DQ2 parece estar relacionado con esta falta de respuesta. La mayor tasa de falta de respuesta observada en estos individuos podría atribuirse a esta predisposición genética (Anania C, 2017).
En un estudio previo (Nemes E, 2008), se había planteado la hipótesis de que la ingesta de gluten durante la vacunación contra la hepatitis B altera las respuestas inmunitarias debido a la competencia por la unión de HLA-DQ2 entre los péptidos de gliadina y los fragmentos de proteína HBsAg; sin embargo, Zingone, et al. en 2013 informaron que la exposición al gluten no influye en la respuesta a la vacuna contra la hepatitis B y Trovato, et al. en 2021 objetivaron una asociación entre la ausencia de seroconversión a la vacuna contra la hepatitis B y anticuerpos IgA elevados contra la transglutaminasa 2 (TGA-IgA) y una edad más avanzada en el momento del diagnóstico en pacientes con EC.
Desde hace años, los CDC establecen que las personas que recibieron su serie primaria de vacuna contra el VHB y tienen títulos de anticuerpos del antígeno de superficie de la hepatitis B (anti-HBs) de 10 mUI/mL o más se consideran protegidas contra la infección por el VHB; el Comité Asesor sobre Prácticas de Inmunización de los CDC acepta la recepción documentada de la serie de vacunas primarias como evidencia de inmunidad al VHB superior a los títulos protectores anti-HBs (Scillie S, 2018). Y dado que se presume que los pacientes con EC tienen una respuesta humoral subóptima a la vacuna frente al VHB, consensos de expertos (Filipelli M, 2016; Passanisi S, 2020; Vitaliti G, 2013) han determinado la necesidad de evaluar la inmunidad al VHB y revacunar a quienes carecen de ella. No obstante, los hallazgos serológicos no distinguen entre la falta de respuesta primaria de anticuerpos después de recibir la serie primaria de vacunas y la disminución natural de los títulos de anticuerpos con el tiempo (Jones JL, 2021). Además, múltiples estudios han encontrado inmunidad celular efectiva y duradera en personas que recibieron la vacuna contra el VHB en la infancia, a pesar de tener títulos no protectores para anti-HBs (<10 mUI/ml), incluso en áreas de alta endemicidad (Simons C, 2016).
Por todo ello, diversos investigadores han cuestionado si la respuesta a la vacuna contra el VHB, determinada mediante la medición de los títulos anti-HBs, es precisa para los pacientes con EC. De hecho, en un reciente estudio (Ulrich JA, 2023) en el que se evaluaron los títulos anti-HBs para sujetos de la misma edad y sexo entre aquellos con EC o enfermedad inflamatoria intestinal (EII) en comparación con pacientes control, la disminución general observada en las tasas de títulos protectores anti-HBs con el tiempo fue similar en ambos grupos dentro de los primeros 15 años después de su última dosis de la vacuna frente al VHB. Además, no se observaron casos de infección por VHB en pacientes con EII/EC después de la fecha índice.
Dicho esto, parece que el diagnóstico temprano y el buen cumplimiento de la dieta sin gluten pueden mejorar la respuesta inmune a la vacuna contra el VHB en niños con EC y que una dosis única de refuerzo adicional podría ser suficiente para lograr una respuesta inmunitaria óptima (Aneja A, 2021).
A la luz de la reciente evidencia, desde el CAV-AEP sugerimos que, aunque se justifica la detección de infección por VHB latente, no estaría indicado realizar pruebas de detección de inmunidad frente al VHB en pacientes completamente vacunados, y recomendamos adoptar un enfoque más individualizado respecto a la vacunación en “no respondedores” que se base en factores de riesgo del VHB bien documentados.
8.6. Vacunación acelerada
En niños, adolescentes y adultos susceptibles en ciertas ocasiones puede plantearse la necesidad de lograr una inmunización más rápida (viaje próximo e inaplazable a zona endémica, etc.). En estos casos puede optarse por un esquema de vacunación con cuatro dosis: 0, 1 y 2 meses, con una dosis de refuerzo a los 12 meses de la primera. Esta pauta puede utilizarse también con las vacunas combinadas con hepatitis A. En jóvenes a partir de los 16 años y adultos se ha aprobado también la utilización de una pauta superacelerada para situaciones en las que se necesite una inmunización en un plazo de tiempo aún más corto, con cuatro dosis a los 0, 7 y 21 días y una cuarta dosis final a los 12 meses.
9. Control serológico posvacunación
En sujetos no incluidos en grupos de riesgo no es preciso realizar controles serológicos posvacunación (anticuerpos anti-HBs), tras completar la serie vacunal frente a la hepatitis B.
El control posvacunación mediante la determinación de Ac. anti-HBs está indicado en los lactantes hijos de madres portadoras de la infección (madres HBsAg positivas), en sujetos con riesgo aumentado de exposición al VHB y en otros casos que requieran profilaxis posexposición (ver tabla 29.1). Los niveles de anti-HBs ≥10 mUI/ml se consideran protectores. En la serología inicial debe incluirse también la determinación del antígeno HBsAg.
Recomendaciones en caso de control serológico posvacunal con resultado negativo
Un resultado serológico negativo (Ac anti-HBs <10 mU/ml) en una analítica posvacunal no implica necesariamente ausencia de inmunización. Este hallazgo es más frecuente cuanto mayor sea el intervalo entre la dosis final de la pauta y la determinación analítica, ya que el 15-50 % de los vacunados negativizan con el tiempo los anticuerpos anti-HBs, manteniéndose, no obstante, protegidos por la memoria inmunológica que induce la vacunación.
La indicación de control posvacunal y la actitud a seguir está en función del riesgo de infección por VHB:
a) Si el control posvacunal se realiza en una persona de riesgo y resultara negativo (anti-HBs <10 mUI/ml), se admiten dos pautas diferentes para comprobar si se trata de un individuo no respondedor a la vacunación:
- Pauta 1. Administrar una única dosis de vacuna y hacer una nueva serología 1-2 meses después. Si esta siguiera siendo negativa, aplicar entonces otras 2 dosis (0 y 5 meses) para completar una segunda serie completa. Si la determinación posterior de anti-HBs, 1-2 meses después de la dosis final, persistiese negativa, el individuo deberá ser considerado finalmente como no respondedor.
- Pauta 2. Aplicar una nueva serie de 3 dosis (0, 1 y 6 meses) y si la determinación posterior de anti-HBs, 1-2 meses después de la última dosis, persistiese negativa, deberá considerarse como no respondedor (ver algoritmo de la figura 29.2).
b) Si el control serológico posvacunal se realizara en una persona sana y sin riesgo (lo que constituye una práctica no recomendada) y este resultara negativo, independientemente del intervalo con la dosis final, no habría que hacer nada, salvo que esta persona se sometiera a una situación de riesgo por exposición a sangre o por posible contagio por vía sexual.
Las personas catalogadas de no respondedoras a la vacunación frente a la hepatitis B no han de recibir más dosis de vacuna y, en caso de exponerse a una situación de riesgo de contagio, deberá aplicárseles IGHB. Los pacientes hemodializados, y en algunos manuales también se incluyen los inmunodeprimidos, han de someterse a controles anuales de anticuerpos anti-HBs, recomendándose una dosis de refuerzo de vacuna cuando los niveles se sitúen por debajo de 10 mUI/ml.
Figura 29.2. Algoritmo del control posvacunal en función del riesgo.
* En el caso de que se realice la determinación de Ac. anti-HBs más allá de 2 meses después de la finalización de la pauta vacunal, se puede optar por administrar una única dosis de vacuna y repetir la analítica pasados 1-2 meses, y si esta persistiera por debajo de las cifras protectoras, completar entonces la serie con pauta 0 y 5 meses, y nueva serología 1-2 meses después. O por una segunda serie completa de 3 dosis (0, 1 y 6 meses), con control serológico 1-2 meses después de la dosis final.
10. Administración con otras vacunas y otros productos
No se ha observado aumento significativo de las reacciones adversas, ni interferencia en la respuesta de anticuerpos, cuando esta vacuna se administra simultáneamente con otras como BCG, DTP, Td, Hib, triple vírica, varicela, hepatitis A, meningococo C, neumococo y poliomielitis, así como con las vacunas habituales en el viajero, siempre que se administren en lugares anatómicos distintos, tanto en niños como en adultos.
Aunque en su momento en la ficha técnica se habían visto interferencias en un ensayo clínico entre la dosis de refuerzo de la vacuna hexavalente Hexyon y la vacunación frente a la varicela y se había aconsejado separarlas por 4 semanas; en mayo la EMA y la AEMPS tras conocer nuevos datos han determinado que se pueden administrar simultáneamente sin ningún problema al haber desaparecido dicha interferencia.
Posibles interferencias con otros fármacos o productos biológicos
La administración simultánea de la vacuna monocomponente frente a la hepatitis B y una dosis estándar de IGHB no produce menores títulos de anticuerpos anti-HBs, siempre que se inyecten en lugares diferentes. Si fuera necesario, aunque como norma no es recomendable, las diferentes vacunas comercializadas pueden intercambiarse para completar una inmunización primaria ya iniciada, utilizando una vacuna frente a la hepatitis B de diferente laboratorio fabricante.
11. Efectos adversos
Se ha demostrado que las vacunas antihepatitis B son seguras. Por lo general, las reacciones adversas son leves y de presentación transitoria, persistiendo menos de 24 horas. Las reacciones más habituales son las locales. Entre las reacciones adversas sistémicas, la fiebre (>37,7 °C) es la más frecuente (1-6 %), seguida del cansancio, malestar, cefalea y síntomas seudogripales. Otras reacciones adversas descritas como poco frecuentes son vértigo, parestesias, náuseas, vómitos, diarrea, dolor abdominal, alteración de las pruebas de función hepática, artralgias, prurito y urticaria. Según los numerosos estudios previos a su autorización y los estudios epidemiológicos realizados por los diferentes organismos encargados de la vigilancia de reacciones adversas, no hay asociación entre la vacunación frente a la hepatitis B y el desarrollo de esclerosis múltiple. Tampoco se ha encontrado asociación con el síndrome de Guillain-Barré ni con convulsiones.
12. Precauciones y contraindicaciones
Esta vacuna está contraindicada cuando existen antecedentes previos de reacciones alérgicas graves a cualquiera de los componentes de la vacuna o cuando ha existido reacción alérgica grave a una dosis previa de la vacuna frente a la hepatitis B. Dado que la producción del antígeno recombinante se realiza en cultivo de levaduras (Saccharomyces cerevisiae), como precaución, esta vacuna está contraindicada en los pacientes con alergia grave a la levadura de cerveza y a la de panadero. No obstante, hay pocos datos sobre la aparición de reacciones adversas tras la vacunación en estos pacientes. No existe contraindicación en el embarazo ni en la lactancia en mujeres con riesgo de infección. Tampoco está contraindicada en personas con inmunodeficiencias.
13. Bibliografía
- American Academy of Pediatrics. Hepatitis B. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 381-99.
- Agencia Española de Medicamentos y Productos Sanitarios. Informe de la AEMPS sobre el uso de vacunas hexavalentes para la inmunización activa en menores de 7 años.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. An Pediatr (Barc). 2026;104:504051.
- American Academy of Pediatrics. Hepatitis B. En: Kimberlin DW, Banerjee R, Barnett ED, Lynfield R, Sawyer MH, eds. Red Book: 2024-2027. Report of the Committee on Infectious Diseases. 33st ed, Itasca, IL.: American Academy of Pediatrics; 2024. pp. 437-457.
- An-Qun H, et al. Overt and occult hepatitis B infection after neonatal vaccination: mother-to-infant transmission and HBV vaccine effectiveness. Int J Infect Dis. 2021;104:601-9.
- Arístegui Fernández J, et al. Vacunación frente a la hepatitis B. Impacto de los programas de vacunación tras 20 años de su utilización en Espana. ¿Es tiempo de cambios? Enferm infecc Microbiol Clin. 2015;33:113-8.
- Bagheri-Jamebozorgi M, et al. The persistence of anti-HBs antibody and anamnestic response 20 years after primary vaccination with recombinant hepatitis B vaccine at infancy. Hum Vaccin Immunother. 2014;10:3731-6.
- Boix R, et al. Una visión general de la hepatitis B. Boletín Epidemiológico Nacional. 2016;24:48-50.
- Bruce MG, et al. Antibody Levels and Protection After Hepatitis B Vaccine: Results of a 30-Year Follow-up Study and Response to a Booster Dose. J Infect Dis. 2016;214:16-22.
- Bunthen E, et al. Residual risk of mother-to-child transmission of HBV despite timely Hepatitis B vaccination: a major challenge to eliminate hepatitis B infection in Cambodia. BMC Infect Dis. 2023;23:261.
- CDA Foundation; Coalition for Global Hepatitis Elimination, Hepatitis Australia; Hepatitis Fund; Hepatitis B Foundation, Médecins Sans Frontières Access Campaign; PATH, TREAT Asia/amfAR, The Foundation for AIDS Research, Union for International Cancer Control; World Hepatitis Alliance. Electronic address: contact@worldhepatitisalliance.org. An open letter to Gavi: hepatitis B birth dose vaccine can't wait. Lancet Gastroenterol Hepatol. 2023;8:115-6.
- Centers for Disease Control and Prevention. Prevention of Hepatitis B Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep. 2018;67:1–31.
- Centers for Disease Control and Prevention (CDC). Epidemiology and Prevention of Vaccine Preventable Diseases. Hall E, Wodi AP, Hamborsky J, Morelli V, Schillie S, eds. Hepatitis B. 14.ª ed. Washington DC. Public Health Found, Pink Book 2021.
- Centers for Disease Control and Prevention. Update: Shortened Interval for Postvaccination Serologic Testing of Infants Born to Hepatitis B-Infected Mothers. MMWR. 2015;64:1118-20.
- Centro Nacional de Epidemiología, Instituto de Salud Carlos III. Vigilancia epidemiológica de la Hepatitis B en España, 2022. Madrid; mayo 2024
- Chen X, et al. Maternal anti-HBVs suppress the immune response of infants to hepatitis B vaccine. J Viral Hepat. 2016;23:955-60.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026. [Internet]. Madrid: AEP; 2026.
- de la Vega Bueno A, et al. Hepatitis víricas. Pediatr Integral 2020;XXIV:15-27.
- Domínguez A, et al. Impact of the Universal Implementation of Adolescent Hepatitis B Vaccination in Spain. Vaccines (Basel). 2024;12:488.
- Ertem D, Gonen I, Tanidir C, et al. The response to hepatitis B vaccine: does it differ in celiac disease? Eur J Gastroenterol Hepatol. 2010;22:787-93.
- European Centre for Disease Prevention and Control. Hepatitis B. Annual epidemiological reports.
- European Centre for Disease Prevention and Control. Monitoring the responses to hepatitis B and C epidemics in EU/EEA Member States, 2019. Stockholm: ECDC; 2020.
- Indolfi G, et al. Hepatitis B virus in children and adolescents. Lancet Gastroenterol Hepatol. 2019;4:466-764.
- Jiang H, et al. The relationship of maternal hepatitis B e antigen and response to vaccination of infants born to women with chronic infection. BMC Pregnancy Childbirth. 2023;23:518.
- Koneru A, et al. National Perinatal Hepatitis B Prevention Program: 2009-2017. Pediatrics. 2021;147:e20201823.
- Le MH, et al. Prevalence of Hepatitis B Vaccination Coverage and Serologic Evidence of Immunity Among US-Born Children and Adolescents From 1999 to 2016. JAMA Netw Open. 2020;3:e2022388.
- Leonardi S, et al. Hepatitis B vaccination failure in celiac disease: is there a need to reassess current immunization strategies? Vaccine. 2009;27:6030-3.
- Lian WB, et al. Hepatitis B vaccination is effective for babies weighing less than 1800 g. J Paediatr Child Health. 2006;42:268-76.
- Mahmood S, et al. Immune Persistence After Infant Hepatitis-B Vaccination: A Systematic Review and Meta-Analysis. Sci Rep. 2018;8:12550.
- Miglietta A, et al. Impact of hepatitis B vaccination on acute hepatitis B epidemiology in European Union/European Economic Area countries, 2006 to 2014. Euro Surveill. 2018;23:17-00278.
- Ministerio de Sanidad. Grupo de trabajo para la guía de cribado de hepatitis B. Guía de Cribado de la infección por el virus de la hepatitis B en España. División de Control del VIH, ITS, Hepatitis Virales y Tuberculosis. 2025.
- Momeni A, et al. Comparing immune response of intradermal low dose versus intramuscular high dose of hepatitis B vaccination in hemodialysis patients. J Res Med Sci. 2011;16:536-40.
- Navarro-Alonso JA, et al en nombre del Grupo de Trabajo de Revisión del Calendario de Vacunación, 2015. Nuevo calendario de vacunación para España, 2016. (Parte 2). Rev Esp Salud Pública. 2016;90:e1-e9.
- Nemes E, et al. Gluten intake interferes with the humoral immune response to recombinant hepatitis B vaccine in patients with celiac disease. Pediatrics. 2008;121:e1570-6.
- Poorolajal J, et al. Booster dose vaccination for preventing hepatitis B. Cochrane Database Syst Rev. 2010;11:CD008256.
- Posuwan N, et al. The Success of a Universal Hepatitis B Immunization Program as Part of Thailand’s EPI after 22 Years’ Implementation. PLoS One. 2016;11:e0150499.
- Qin W, et al. Persistence of antibodies 5 years after hepatitis B vaccination in preterm birth children: A retrospective cohort study using real-world data. J Viral Hepat. 2024;31:143-50.
- Schönberger K, et al. Determinants of Long-term protection after hepatitis B vaccination in infancy: a meta-analysis. Pediatr Infect Dis J. 2013;32:307-13.
- Schweitzer A, et al. Estimations of world wide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013. Lancet. 2015;386:1546-55.
- Sharrock KC, et al. Monitoring progress towards elimination of hepatitis B and C in the EU/EEA. PLOS Glob Public Health. 2022;2:e0000841.
- Trickey A, et al. Estimating hepatitis B virus prevalence among key population groups for European Union and European Economic Area countries and the United Kingdom: a modelling study. BMC Infect Dis. 2023;23:457.
- Wang C, et al. Changes and gaps of global and regional disease burden of hepatitis B infection in children younger than 5 years old between 2015 and 2019: A real-world data review. J Med Virol. 2023;95:e29241.
- Whitford K, et al. Long-term impact of infant immunization on hepatitis B prevalence: a systematic review and meta-analysis. Bull World Health Organ. 2018;96: 484–97.
- World Health Organization. Global Hepatitis Report 2024.
- World Health Organization. Hepatitis B. 2025.
- World Health Organization. Hepatitis B vaccination and multiple sclerosis (MS). 2014.
- World Health Organization. Hepatitis B vaccines: WHO position paper, July 2017 - Recommendations. Vaccine. 2019;37:223-5.
- World Health Organization. Immunization program data: regional and country profiles 2022 (Data as of October 2023). Manila: World Health Organization Regional Office for the Western Pacific; 2022. Licence: CC BY-NC-SA 3.0 IGO.
- World Health Organization. Introduction of hepatitis B vaccine into childhood immunization services.Geneva, WHO, 2001. WHO/V&B/01.31.
- Xu B, et al. Minimal association of alleles of human leukocyte antigen class II gene and long-term antibody response to hepatitis B vaccine vaccinated during infancy. Vaccine. 2017;35:2457-62.
- Zanetti AR, et al. Hepatitis B immune memory in children primed with hexavalent vaccines and given monovalent booster vaccines: an open-label, randomised, controlled, multicentre study. Lancet Infect Dis. 2010;10:755-61.
- Zhao YL, et al. Immune persistence 17 to 20 years after primary vaccination with recombination hepatitis B vaccine (CHO) and the effect of booster dose vaccination. BMC Infect Dis. 2019;19:482.
SOBRE ENFERMEDAD CELIACA
- Anania C, et al. Immune response to vaccines in children with celiac disease. World J Gastroenterol. 2017;23:3205-13.
- Aneja A, et al. Clinical Characteristics of Children With Celiac Disease Not Responding to Hepatitis B Vaccination in India. JPGN Rep. 2021;2:e046.
- Balamtekin N, et al. Responsiveness of Children with Celiac Disease to Different Hepatitis B Vaccination Protocols. Turk. J. Gastroenterol. 2011;22:27-31.
- Filippelli M, et al. Immune Response to Hepatitis B Virus Vaccine in Celiac Subjects at Diagnosis. World J. Hepatol. 2016;8:1105-9.
- Jones JL, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for Immunizations in Patients With Inflammatory Bowel Disease (IBD)-Part 2: Inactivated Vaccines. Gastroenterology. 2021;161:681-700.
- Nemes E, et al. Gluten intake interferes with the humoral immune response to recombinant hepatitis B vaccine in patients with celiac disease. Pediatrics. 2008;121:e1570-6.
- Noh KW, et al. Hepatitis B vaccine nonresponse and celiac disease. Am J Gastroenterol. 2003;98:2289-92.
- Park SD, et al. Failure to respond to hepatitis B vaccine in children with celiac disease. J Pediatr Gastroenterol Nutr. 2007;44:431-5.
- Passanisi S., et al. Vaccinations and Immune Response in Celiac Disease. Vaccines. 2020;8:278.
- Rousseff T, et al. Hepatitis B virus vaccination and revaccination response in children diagnosed with coeliac disease: a multicentre prospective study. Acta Gastroenterol Belg. 2019;82:27-30.
- Schillie S, et al. Prevention of Hepatitis B Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep. 2018;67(No. RR-1):1-31.
- Simons BC, et al. A Longitudinal Hepatitis B Vaccine Cohort Demonstrates Long-lasting Hepatitis B Virus (HBV) Cellular Immunity Despite Loss of Antibody Against HBV Surface Antigen. J Infect Dis. 2016;214:273-80.
- Snyder J, et al. Evidence-Informed Expert Recommendations for the Management of Celiac Disease in Children. Pediatrics. 2016;138:e20153147.
- Tahir A, et al. A Comprehensive Review of Hepatitis B Vaccine Nonresponse and Associated Risk Factors. Vaccines (Basel). 2024;12:710.
- Trovato CM, et al. Association between Elevated TGA-IgA Titers and Older Age at Diagnosis with Absence of HBV Seroconversion in Celiac Children. Vaccines (Basel). 2021 Jan 28;9(2):101.
- Ulrich JA, et al. Effectiveness of Hepatitis B Vaccination for Patients With Inflammatory Bowel and Celiac Disease. Clin Gastroenterol Hepatol. 2023;21:2901-07.e2.
- Urganci N, et al. Response to hepatitis A and B vaccination in pediatric patients with celiac disease. J Pediatr Gastroenterol Nutr. 2013;56:408-11.
- Vitaliti G, et al. Hepatitis B vaccine in celiac disease: yesterday, today and tomorrow. World J Gastroenterol. 2013;19:838-45.
- Zingone F., et al. Role of Gluten Intake at the Time of Hepatitis B Virus Vaccination in the Immune Response of Celiac Patients. Clin. Vaccine Immunol. 2013;20:660-2.
14. Enlaces de interés
- American Academy of Pediatrics. Healthy children. Hepatitis B
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026
- CDA Foundation Polaris Observatory
- CDC. Prevention of Hepatitis B Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices
- CDC. CDC Guidance for Evaluating Health-Care Personnel for Hepatitis B Virus Protection and for Administering Postexposure Management
- CDC. Hepatitis B Vaccination
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Hepatitis B
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de las vacunas de la hepatitis B
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna de la hepatitis B
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la hepatitis B
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas sobre la vacuna de la hepatitis B
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada
- Ministerio de Sanidad. Información para el viajero: hepatitis B
- World Health Organization. Estrategias mundiales del sector de la salud contra el VIH, las hepatitis víricas y las infecciones de transmisión sexual para el periodo 2022-2030
- World Health Organization. Hepatitis B
⌂
15. Historial de actualizaciones
| 11 de agosto de 2015 | Actualización de todos los apartados, excepto administración con otras vacunas y otros productos; efectos adversos y precauciones y contraindicaciones. Nuevas citas bibliográficas y enlaces de interés |
| 18 de febrero de 2018 | Actualización de todos los apartados, excepto administración con otras vacunas y otros productos; efectos adversos y precauciones y contraindicaciones. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2019 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2020 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2021 | Nuevas citas bibliográficas y enlaces de interés |
| 4 de marzo de 2021 | Se actualizan los apartados de epidemiología y tipos de vacunas. Se modifica el algoritmo del control posvacunal en función del riesgo (figura 29.2), que permite la ampliación de la imagen, y también se cambia el texto acompañante del apartado 9 sobre el control serológico posvacunación. Nuevas citas bibliográficas y enlaces de interés |
| 23 de marzo de 2021 | Se añade el subapartado "Vacunación acelerada" |
| 31 de marzo de 2022 | Actualización del apartado de "Epidemiología". Nuevas citas bibliográficas y enlaces de interés |
| 1 de julio de 2022 | Actualización del apartado 10 sobre Hexyon y la vacuna de la varicela |
| 1 de enero de 2023 | Nuevas citas bibliográficas y enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de marzo de 2024 | Revisión de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2025 | Nuevas citas bibliográficas y enlaces de interés |
| 15 de enero de 2025 | Revisión exhaustiva del subapartado "Vacunación frente al VHB en el paciente celiaco". Nuevas citas bibliográficas |
| 1 de abril de 2025 | Modificación enlace de interés de "Vacunación acelerada" |
| 1 de enero de 2026 | Actualización del apartado "Epidemiología de la enfermedad". Nuevas citas bibliográficas y enlaces de interés |
-oOo-
PTE: Podías