Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
27. Haemophilus influenzae tipo b
Capítulo 27 - Haemophilus influenzae tipo b
- Puntos clave
- Introducción
- Epidemiología de la enfermedad
- Tipos de vacunas, composición y presentación
- Inmunogenicidad, eficacia y efectividad
- Vías de administración
- Indicaciones y esquemas de vacunación
- Administración con otras vacunas y otros productos
- Efectos adversos
- Precauciones y contraindicaciones
- Quimioprofilaxis posexposición
- Observaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tabla y figuras incluidas en el capítulo:
Tabla 27.1. Vacunas conjugadas frente al Hib disponibles en España
Figura 27.1. Tasas de incidencia de enfermedad invasora por Haemophilus influenzae en España. 2015-2023 (por 100 000 habitantes) por gupos de edad
Figura 27.2. Incidencia anual estimada (por 100 000 habitantes) de enfermedad invasora por Haemophilus influenzae tipo b en niños menores de 5 años - Estados Unidos, 1980-2012
Figura 27.3. Incidencia de meningitis por H. influenzae (línea continua gruesa) durante los primeros cinco años de vida (Finlandia 1975 y 1976) y nivel correspondiente de anticuerpos de polisacáridos capsulares de Haemophilus influenzae tipo b (Hib) (línea fina de puntos)
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Haemophilus influenzae tipo b. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-27
1. Puntos clave
- Los principales cuadros clínicos de la enfermedad por Haemophilus influenzae tipo b (Hib) incluyen meningitis, epiglotitis, neumonía (con afectación pleural en el 50 % de los casos), infección osteoarticular y celulitis bacteriémica. Se producen generalmente en niños menores de 5 años.
- Las vacunas disponibles frente al Hib están compuestas del polisacárido capsular purificado polirribosilribitol fosfato (PRP) conjugado a un transportador proteínico para producir una respuesta inmunológica timodependiente.
- Las vacunas conjugadas son altamente efectivas frente al Hib. Producen protección de grupo porque disminuyen las tasas de colonización nasofaríngea por Hib.
- La vacunación frente al Hib está recomendada de forma sistemática en los niños entre 2 y 59 meses de edad y se recomienda su administración a niños mayores de 59 meses con riesgo incrementado de enfermedad invasora por Hib.
- En la actualidad se administra en la serie primaria formando parte de las vacunas combinadas a los 2 y 4 meses, con una dosis de refuerzo a los 11 meses de vida.
- Los niños menores de 24 meses que hayan padecido una enfermedad invasora por Hib pueden no quedar suficientemente protegidos, por lo que deben vacunarse a pesar de este antecedente.
- Los fracasos vacunales han de ser investigados. Se recomienda confirmación del tipo capsular por técnicas de biología molecular en un centro especializado y estudio inmunitario del paciente.
2. Introducción
El Haemophilus influenzae (Hi) es patógeno exclusivamente humano, que coloniza la nasofaringe y, en menor medida, la conjuntiva y el tracto genital. Este cocobacilo gramnegativo puede producir enfermedades mucosales e invasoras. En función de las características antigénicas de su cápsula polisacarídica se describen 6 tipos capsulares (a-f). Existen, además, cepas no capsuladas a las que se denominan no tipables, las cuales predominan en la colonización y en la enfermedad localizada respiratoria. De todos los tipos capsulares, el Haemophilus influenzae tipo b (Hib) es el más virulento y era la causa de la mayoría de las infecciones invasoras debidas al género Hi antes de extenderse la vacunación, afectando principalmente a los niños menores de 5 años. Estas infecciones invasoras incluían meningitis, neumonía, epiglotitis, infección osteoarticular y celulitis bacteriémica.
El modo de transmisión de la enfermedad es por inhalación de gotitas del tracto respiratorio o por contacto directo con secreciones. No se conoce con certeza el periodo de incubación de la enfermedad, pero es posible que sea de dos a cuatro días.
3. Epidemiología de la enfermedad
La bacteria Haemophilus influenzae era el responsable de una significativa morbilidad y mortalidad en niños menores de 5 años antes de la vacunación. Fue la causa principal de las meningitis bacterianas en EE. UU. y otros países del centro y norte de Europa durante la época prevacunal, al contrario del Reino Unido y de España, donde era más frecuente la meningitis meningocócica en este periodo de tiempo. Estados Unidos llegó a tener un pico de incidencia de enfermedad invasora de 275 por 100 000 niños entre los 6 a 11 meses de edad, de los que aproximadamente las dos terceras partes de los casos correspondían a meningitis. En España, las tasas de incidencia de enfermedad invasora comunicadas tuvieron un rango de entre 8,4 y 26 por 100 000 niños menores de 5 años.
El ECDC en su informe publicado en julio de 2024 sobre la enfermedad invasora por H. influenzae en el año 2022 muestra un aumento significativo de casos, un total de 3967 frente a los 1694 casos de 2021 y los 1849 casos de 2020. Se observa un ligero aumento de los casos de Hib en menores de 1 año, que constituyeron el 9,1 % (211 casos) del total, frente al 7 % (153 casos) en 2018. Entre los casos con serotipo conocido, las cepas no encapsuladas continuaron predominando, representando el 81 % de las infecciones. La baja proporción de serotipo b (Hib) notificado (5 %) sigue reflejando el fuerte efecto de los programas de vacunación contra Hib en los países de la UE/EEE.
En España, también se evidencia este aumento, y así, en 2023, se registró la mayor incidencia de los últimos 9 años, con 674 casos de enfermedad invasora por H. influenzae con una tasa de incidencia acumulada de 1,39/100 000 habitantes (superando la tasa prepandémica de 0,95 en 2019, 416 casos) en 2024 se notificaron 382 casos. Las mayores tasas se observaron en <1 año y en >85 años. Se desconoce el serotipo de la mayoría de los casos notificados, pero en los que se pudo tipar, casi el 75 % fueron producidos por Haemophilus no tipables. La manifestación clínica más frecuente independientemente de la edad fue la neumonía bacteriémica (46,1 % de los casos). El 80,4 % de las defunciones ocurrieron en el grupo de 65 años o más (ver figura 27.1).
La meningitis por Hib se asocia con tasas de mortalidad de aproximadamente un 5-10 % y con secuelas neurosensoriales, incluyendo hipoacusia, parálisis cerebral y epilepsia, en una parte importante de los que sobreviven. Hib era también responsable del más del 95 % de los casos de epiglotitis, antes de la introducción de la vacuna.
Figura 27.1. Tasas de incidencia de enfermedad invasora por Haemophilus influenzae en España. 2015-2023 (por 100 000 habitantes) por gupos de edad
Tomado de Red Nacional de Vigilancia Epidemiológica. Enfermedad invasiva por Haemophilus influenzae. España 2023
La medida más eficaz de prevención es la vacunación. Las dos primeras vacunas conjugadas frente a Hib se autorizaron en España en el año 1993. El Consejo Interterritorial del Sistema Nacional de Salud aprobó la introducción de estas vacunas en el calendario de vacunación en diciembre de 1997. Se administró inicialmente en una pauta de primovacunación de tres dosis, a los 2, 4 y 6 meses y posteriormentese añadió una dosis de refuerzo a los 15-18 meses. Desde el año 2017, la pauta se modificó y se administró la primovacunación mediante dos dosis, a los 2 y 4 meses, con una dosis de refuerzo a los 11 meses, en forma de vacuna hexavalente, permaneciendo en la actualidad. Desde el año 2001 las coberturas de primovacunación y de refuerzo superan, a nivel nacional, el 95 %, con porcentajes del 98 y del 96,2 en el año 2023. Tras la comercialización y posterior introducción de la vacuna en el calendario sistemático, la incidencia de enfermedad invasora descendió en los menores de 5 años más de un 95 % respecto a su incidencia en la etapa prevacunal, desapareciendo prácticamente (ver figura 27.2).
Se estima que tras el primer cuarto de siglo tras la introducción de las primeras vacunas frente al Hib se han prevenido a nivel mundial más de 2,2 millones de casos de infecciones producidas por este germen y más de 520·000 muertes.
Figura 27.2. Incidencia anual estimada (por 100 000 habitantes) de enfermedad invasora por Haemophilus influenzae tipo b en niños menores de 5 años - Estados Unidos, 1980-2012
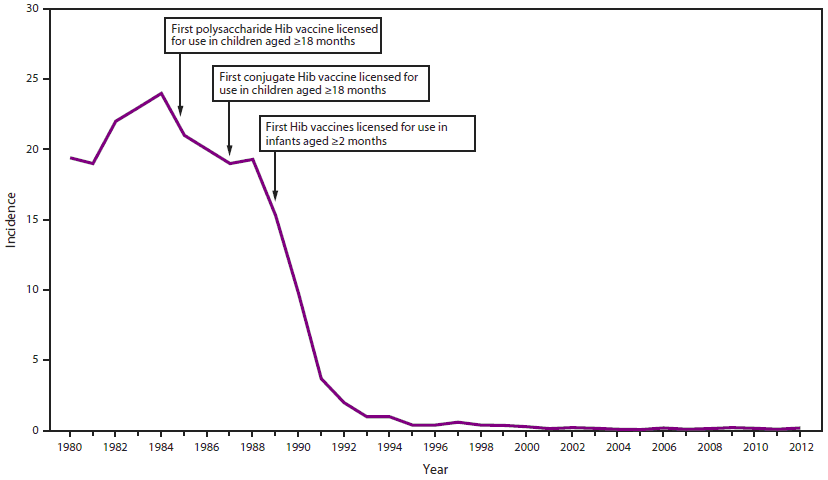
Tomado de CDC. MMWR. 2014
La edad menor de 5 años y los trastornos inmunitarios son los principales factores de riesgo para la enfermedad invasora por Hib. Los niños menores de 2 años no producen una respuesta de anticuerpos adecuada frente al polisacárido capsular en la colonización y en la enfermedad invasora y es a partir de los 5 años cuando se adquiere inmunidad específica natural protectora, como resultado de la colonización por Hib y otras especies que producen inmunidad cruzada (ver figura 27.3).
Figura 27.3. Incidencia de meningitis por H. influenzae (línea continua gruesa) durante los primeros cinco años de vida (Finlandia 1975 y 1976) y nivel correspondiente de anticuerpos de polisacáridos capsulares de Haemophilus influenzae tipo b (Hib) (línea fina de puntos).

Tomado de Peltola, et al. Pediatrics 1997
4. Tipos de vacunas, composición y presentación
Las vacunas de primera generación frente al Hib estaban compuestas por el polisacárido capsular purificado polirribosilribitol fosfato (PRP), con el inconveniente de su escasa inmunogenicidad en niños menores de 18 meses. Posteriormente se comercializaron vacunas conjugadas a transportadores proteínicos que, al inducir una respuesta inmunológica timodependiente, resultaron inmunógenas en lactantes pequeños, induciendo memoria y protección de grupo al eliminar la colonización nasofaríngea y, por tanto, disminuir la circulación del agente en la población.
En España existen en la actualidad diferentes vacunas disponibles frente al Hib. En su mayoría, estas vacunas están conjugadas a toxoide tetánico (PRP-T), tanto la monocomponente Hiberix (GSK), como las que forman parte de las vacunas combinadas pentavalentes Infanrix-IPV+Hib (GSK) o Pentavac (Sanofi), no comercializadas actualmente en España, o hexavalentes Infanrix Hexa (GSK) y Hexyon (Sanofi). Sólo una de ellas, la hexavalente Vaxelis (MSD) utiliza una proteína distinta para la conjugación: la proteína del meningococo, adsorbido en sulfato de hidroxifosfato de aluminio amorfo, formando un complejo proteico de la membrana externa de Neisseria meningitidis (PRP-OMP). En la tabla 27.1 se detalla la composición de estas vacunas.
Tabla 27.1. Vacunas conjugadas frente al Hib disponibles en España.
| Nombre comercial (Laboratorio) |
Tipo de vacuna | Composición* |
| Hiberix (PRP-T) (GlaxoSmithKline) |
Monocomponente Conjugada con toxoide tetánico |
- PRP: 10 µg - Toxoide tetánico: 25 µg - Lactosa: 10 mg |
|
Infanrix IPV+Hib No comercializada |
Combinada pentavalente (DTPa-VPI-Hib) Conjugada con toxoide tetánico |
- PRP: 10 µg - Toxoide tetánico: 25 µg - Lactosa |
|
Pentavac No comercializada |
Combinada pentavalente (DTPa-VPI-Hib) Conjugada con toxoide tetánico |
- PRP: 10 µg - Toxoide tetánico: No figura cantidad en FT - Trometamol - Sacarosa |
| Hexyon (Sanofi) |
Combinada hexavalente (DTPa-VPI-Hib-HB) Conjugada con toxoide tetánico |
- PRP: 12 µg - Toxoide tetánico: 22-36 µg - Trometamol - Sacarosa |
| Infanrix Hexa (GlaxoSmithKline) |
Combinada hexavalente (DTPa-VPI-Hib-HB) Conjugada con toxoide tetánico |
- PRP: 10 µg |
| Vaxelis (MSD) |
Combinada hexavalente (DTPa-VPI-Hib-HB) Conjugada con proteína de meningococo (OMV) |
- PRP: 3 µg - (OMPC) 50 µg |
En las vacunas combinadas únicamente se incluye la composición antigénica del componente frente a Hib (polvo liofilizado) y excipientes acompañantes. La composición de los restantes componentes antigénicos y excipientes acompañantes en la jeringa precargada se detallan en otros capítulos de este manual.
Presentación y reconstitución
Hiberix se presenta como un liofilizado en un vial de vidrio y un disolvente en jeringa precargada (0,5 ml). Las vacunas combinadas Infanrix IPV+Hib, Pentavac e Infanrix Hexa se presentan como un vial de polvo o pastilla de un liofilizado, que incluye el PRP-T, más una jeringa precargada de suspensión blanquecina y turbia inyectable (0,5 ml) con el resto de los componentes vacunales de cada preparado para reconstitución. Las vacunas combinadas, Hexyon y Vaxelis, se presentan como una suspensión inyectable precargada, sin necesidad de reconstitución.
En los preparados que requieren reconstitución, esta debe realizarse añadiendo todo el contenido de la jeringa precargada al vial que incluye el polvo o pastilla liofilizada, agitando posteriormente hasta formar una suspensión homogénea, que debe administrarse inmediatamente por vía intramuscular.
Todas las vacunas mencionadas deben conservarse en nevera entre +2 ºC y +8 ºC y no deben congelarse.
5. Inmunogenicidad, eficacia y efectividad
En los distintos estudios realizados se ha observado que la vacunación de niños a partir de los 2 meses de edad genera títulos de anticuerpos protectores frente al Hib a corto plazo (anti PRP >0,15 μg/ml) y a largo plazo (anti-PRP >1 μg/ml) en más del 95 % y del 90 % de los vacunados, respectivamente. También se ha observado una buena respuesta inmunológica en pacientes con riesgo elevado de infección invasora por Hib, como en los casos de asplenia, drepanocitosis, leucemia, trasplante de progenitores hematopoyéticos e infección por VIH, aunque, en este último caso, dependiendo del estadio y del grado de inmunosupresión que presenten.
Las vacunas conjugadas frente al Hib han sido también muy efectivas y han disminuido de forma muy importante (>95 %) la incidencia de la enfermedad invasora por Hib entre los niños vacunados, habiéndose ampliado además el impacto vacunal a nivel poblacional, por el efecto de inmunidad de grupo, al disminuir la circulación del Hib en la población.
Estudios recientes en países de nuestro entorno no hacen más que confirmar esos datos. Los pocos casos que aparecen en la actualidad son principalmente debidos a una ausencia de la vacunación completa más que a fallos vacunales verdaderos.
La vacuna conjugada frente al Hib no protege frente a cepas de H. influenzae distintas a las del serotipo b, tanto capsuladas como no tipables.
6. Vías de administración
Se debe administrar por vía intramuscular. En niños con alteraciones de la coagulación puede emplearse la vía subcutánea.
7. Indicaciones y esquemas de vacunación
La vacunación frente al Hib está recomendada de forma sistemática en todos los niños entre 2 y 59 meses. Se encuentra incluida en todos los calendarios de vacunación de las comunidades y ciudades autónomas españolas y, desde el año 2017, se administra en la serie primaria formando parte de las vacunas combinadas hexavalentes a los 2 y 4 meses, con una dosis de refuerzo a los 11 meses de vida. En menores de 12 meses no vacunados antes se recomiendan 2 dosis de primovacunación, con un intervalo de 2 meses entre ellas, más una dosis de refuerzo a partir del undécimo mes, con un intervalo tras la última dosis de primovacunación de 8 semanas. En los de 12-14 meses la pauta recomendada es de 2 dosis con un intervalo de 2 meses, y en los de 15 a 59 meses una sola dosis es suficiente.
La edad mínima de administración de la 1.ª dosis son las 6 semanas de vida. Si se administra en edades más precoces se puede producir tolerancia inmunológica a dosis posteriores. El intervalo mínimo recomendado entre las dosis de la serie primaria es de 8 semanas y la dosis de refuerzo debe estar separada, también, al menos, 8 semanas de la última dosis de la serie primaria.
Las vacunas hexavalentes han sido autorizadas por la AEMPS para ser administradas en menores de 7 años de edad en el caso que no hayan recibido la pauta de vacunación en tiempo (2, 4, 11 meses de edad) o la tengan incompleta de acuerdo con las recomendaciones oficiales.
Los niños mayores de 59 meses no vacunados previamente y que presentan factores de riesgo para enfermedad invasora por Hib, como asplenia anatómica o funcional, déficit de factores de complemento, tratamiento con eculizumab o ravulizumab, VIH y antecedente de enfermedad invasora por Hib, deberían recibir, al menos, una dosis de vacuna conjugada frente al Hib. En caso de esplenectomía programada se recomienda administrar la vacuna, al menos, 2 semanas antes de la intervención. En receptores de trasplante de células madre hematopoyéticas, la vacuna debería ser administrada a partir de los 3-6 meses del trasplante, aplicando 3 o 4 dosis, con un intervalo entre ellas de, al menos, 2 meses.
Los niños menores de 24 meses que hayan padecido una enfermedad invasora por Hib siguen siendo susceptibles a la infección y deben vacunarse tan pronto como sea posible en la fase de convalecencia (al menos, pasado un mes de la enfermedad), completando el calendario correspondiente a su edad.
8. Administración con otras vacunas y otros productos
La vacuna conjugada frente al Hib puede administrarse el mismo día, aunque en diferente lugar anatómico, que cualquier otra vacuna pediátrica, incluyendo las vacunas conjugadas antineumocócicas y antimeningocócicas. La vacuna Vaxelis no dispone en la actualidad de estudios de coadministración con la vacuna tetravalente frente al meningococo (MenACWY).
Aunque en su momento en la ficha técnica se habían visto interferencias en un ensayo clínico entre la dosis de refuerzo de la vacuna hexavalente Hexyon y la vacunación frente a la varicela y se había aconsejado separarlas por 4 semanas; en mayo de 2022 la EMA y la AEMPS tras conocer nuevos datos han determinado que se pueden administrar simultáneamente sin ningún problema al haber desaparecido dicha interferencia.
No hay interferencias con la administración de inmunoglobulinas o sangre. No debe administrarse paracetamol de forma profiláctica para posibles efectos adversos posvacunales, ya que podría disminuir la inmunogenicidad de la vacuna.
9. Efectos adversos
Las reacciones adversas son poco comunes. Se producen reacciones locales en forma de dolor, enrojecimiento o tumefacción en el 5-30 % de los casos, que tienden a resolverse en 12-24 horas y suelen disminuir su frecuencia con las dosis posteriores. Las reacciones sistémicas como fiebre o irritabilidad son infrecuentes.
10. Precauciones y contraindicaciones
Las precauciones y contraindicaciones de las vacunas conjugadas frente a Hib son las generales de las vacunas inactivadas. Están contraindicadas si hubo reacción anafiláctica a una dosis previa de la vacuna o frente a alguno de sus componentes. No ha de administrarse fuera de los rangos de edades establecidos y debe demorarse en caso de enfermedad aguda moderada o grave.
11. Quimioprofilaxis posexposición
La tasa de incidencia de enfermedad invasora por Haemophilus influenzae tipo b ha descendido de forma muy importante en España y en los países que han incluido la vacunación sistemática frente a Hib, incluyendo a niños y adultos no vacunados, como consecuencia de la inmunidad de grupo.
La probabilidad de infección secundaria por Hib se reduce a medida que aumenta la edad del niño:
- En menores de 1 año oscila entre 6-7,9 %.
- En niños de 1-2 años es del 4,9 %.
- En niños de 4 años, la probabilidad se sitúa entre 1,9-2,1 %.
- En niños de 4-6 años se reduce a menos del 0,5 %.
Aunque la enfermedad por Hib como consecuencia de la aparición de casos secundarios es baja (2 %), en niños con edades inferiores a 4 años se multiplica de forma importante el riesgo de desarrollar esta patología tras un contacto domiciliario fundamentalmente.
INDICACIONES DE QUIMIOPROFILAXIS
Si bien en la actualidad la necesidad de la quimioprofilaxis frente a Hib ha descendido mucho, las indicaciones respecto a los contactos domiciliarios, asistencia a colegios y guarderías y en circunstancias específicas son las siguientes:
1. Contactos domiciliarios.
- Se considera contacto domiciliario a toda persona conviviente con el caso índice.
- La quimiprofilaxis está indicada en todos los convivientes (niños y adultos) si uno de ellos es un niño menor de 4 años y no está vacunado o lo está de forma incompleta, o bien si hay un menor de 12 meses que no haya recibido las 2 dosis de la inmunización primaria.
- La quimiprofilaxis debe ser administrada a todas las personas que residan en el domicilio familiar (niños y adultos), si uno de los convivientes es un inmunodeprimido menor de 18 años, independientemente de su estado vacunal.
- La rifampicina es capaz de atravesar la placenta y como medida preventiva se recomienda evitarla en mujeres embarazadas, debiendo recibir ceftriaxona caso de ser un contacto familiar de un caso índice.
2. Guarderías y colegios.
- Cuando haya 2 o más casos de enfermedad invasora por Hib en el curso de 60 días, deben recibir quimioprofilaxis todos los contactos de la misma clase, incluyendo el personal del centro y, por supuesto, los contactos domiciliarios. Cuando haya un solo caso se puede administrar quimioprofilaxis a los niños menores de 2 años que hayan estado en contacto con el caso índice durante 25 o más horas por semana, aunque algunos autores no la recomiendan si solo hay un único caso.
- Es muy importante tener en cuenta que el éxito de la quimioprofilaxis en guarderías y colegios va a depender de la precocidad de su administración rigurosa a los compañeros del niño enfermo y al personal del centro.
3. Caso índice.
- El niño hospitalizado por enfermedad invasora por Hib deberá recibir quimioprofilaxis si es menor de 2 años o convive con un contacto susceptible y no ha sido tratado con cefotaxima o ceftriaxona, ya que el tratamiento de la infección sistémica con otros antibióticos no siempre evita continuar como portador nasofaríngeo. La quimioprofilaxis se iniciará preferiblemente durante su ingreso hospitalario.
4. Otras recomendaciones.
- Aquellos lactantes menores de 12 meses que hayan completado la primovacunación frente a enfermedad invasora por Hib (2 dosis), pueden incorporarse a la guardería.
- Solo deberá autorizarse la entrada en la guardería, durante las 8 semanas siguientes a la aparición del caso índice, a los niños correctamente vacunados de acuerdo con su edad.
FÁRMACOS Y PAUTAS DE ADMINISTRACIÓN
La rifampicina continúa siendo el antibiótico de elección en la quimioprofilaxis frente al Hib: erradica la bacteria de la nasofaringe en el 95 % de los portadores y disminuye el riesgo de infección secundaria en contactos domiciliarios y en colegios y guarderías, porque alcanza niveles bactericidas a nivel intracelular y en la secreciones respiratorias.
Pautas de administración:
- Lactantes menores de 1 mes: 10 mg/kg, una vez al día, durante 4 días.
- Lactantes mayores de 1 mes y niños: 20 mg/kg, una vez al día, durante 4 días (dosis máxima: 600 mg).
- Adultos: 600 mg, una vez al día, durante 4 días.
- Cuando no se tolere la rifampicina o no sea probable el cumplimiento del tratamiento durante los 4 días o durante el embarazo, se puede administrar ceftriaxona (menores de 12 años: 125 mg; mayores de 12 años y adultos: 250 mg), en dosis única, intramuscular.
Conviene indicar a quienes reciben quimioprofilaxis con rifampicina que la orina y las secreciones corporales pueden teñirse de color rojo-anaranjado y que puede colorear, de forma permanente, las lentes de contacto.
12. Observaciones
Los fracasos vacunales son raros y deben ser investigados. Se considera fracaso vacunal cuando ocurre una enfermedad invasora por Hib, después de 2 semanas tras una única dosis de vacuna administrada en niños mayores de un año; o después de una semana tras la administración de, al menos, 2 dosis en niños menores de un año (al menos, con un mes de intervalo entre ellas).
En caso de infección invasora en un niño correctamente vacunado, se debe investigar la posibilidad de fracaso vacunal o de infección invasora por Hib de serotipo no b. Si se confirma el aislamiento del Hib, el niño debe ser estudiado para descartar deficiencia inmunológica. Existen, además, otros factores de base genética que parecen aumentar el riesgo de fracaso vacunal, en relación con polimorfismos en genes implicados en la respuesta inmunológica. Se estima que más de la mitad de los niños con fracaso vacunal tienen títulos anti PRP <1 μg/ml, que indican la falta de protección a largo plazo. Por ello, algunos autores plantean la posibilidad de administrar una dosis adicional de vacuna frente al Hib.
13. Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de la AEMPS sobre el uso de vacunas hexavalentes para la inmunización activa en menores de 7 años.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. An Pediatr (Barc). 2026;104:504051.
- American Academy of Pediatrics. Haemophilus influenzae infections. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 345-54.
- Boisnard F, et al. DTaP-IPV-HB-Hib vaccine (Hexaxim): an update 10 years after first licensure. Expert Rev Vaccines. 2023;22:1196-213.
- Centers for Disease Control and Prevention. Prevention and Control of Haemophilus influenzae Type b Disease: Recommendations of the Advisory Committee on Immunization Practices (ACIP) Recommendations and Reports. MMWR. 2014;63(RR01):1-14.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Red Nacional de Vigilancia Epidemiológica. Protocolos de la Red Nacional de Vigilancia Epidemiológica. Madrid, 2013.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Red Nacional de Vigilancia Epidemiológica. Enfermedad invasora por Haemophilus influenzae 2015-2020.
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Red Nacional de Vigilancia Epidemiológica. Enfermedad invasiva por Haemophilus influenzae. España 2023.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026. [Internet]. Madrid: AEP; 2026.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Fichas técnicas de las vacunas frente al Haemophilus influenzae tipo b.
- Corretger JM, et al. Haemophilus Influenzae. En: Corretger JM, Cruz M, González Hachero J, Moraga F (eds). Infectología Pediátrica. Bases diagnósticas y tratamiento. 2.ª ed. Caracas (Venezuela): Amolca; 2011. p. 178-82.
- Dolhain J, et al. Hexavalent vaccines: increasing options for policy-makers and providers. A review of the data supporting interchangeability (substitution with vaccines containing fewer antigens) and mixed schedules from the same manufacturer. Expert Rev Vaccines. 2018;17:513-24.
- Drugs. Rifampin pregnancy warning.
- European Centre for Disease Prevention and Control. Haemophilus influenzae. Annual epidemiological reports.
- Giufrè M, et al. Invasive Haemophilus influenzae type b (Hib) disease in children in Italy, after 20 years of routine use of conjugate Hib vaccines. Vaccine. 2020;38:6533-8.
- Hani E, et al. Trends in invasive Haemophilus influenzae serotype b (Hib) disease in England: 2012/13 to 2022/23. J Infect. 2024;89:106247.
- Ladhani S, et al. Long-term immunological folow-up of children with Haemophilus influenzae serotype b vaccine failure in the United King-dom. Clin Infect Dis. 2009;49:372-80.
- Obando I, et al. Haemophilus influenzae tipo b (enfermedad por). En: Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Vacunas en Pediatría. Manual de la AEP 2012, 5.ª ed. Madrid: Exlibris ediciones SL; 2012. p. 351-8.
- Omeñaca F, et al. Immunization of preterm infants with GSK's hexavalent combined diphtheria-tetanus-acellular pertussis-hepatitis B-inactivated poliovirus-Haemophilus influenzae type b conjugate vaccine: A review of safety and immunogenicity. Vaccine. 2018;36:986-96.
- Otero MC, et al. Quimioprofilaxis en meningitis. Rev Esp Quimioter. 1998;11:118-27.
- Otero Reigada MC, et al. Infecciones por Haemophilus Influenzae. En Cruz Tratado de Pediatría. M Moro, S Málaga, L Madero editores. Editorial Médica Panamericana. Madrid 2014. p 808-11.
- Peltola H, et al. Haemophilus influenzae type b capsular polysaccharide vaccine in children: a double-blind field study of 100,000 vaccinees 3 months to 5 years of age in Finland.Pediatrics. 1977;60:730-7.
- Peltola H. Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century: global analysis of the disease burden 25 years after the use of the polysaccharide vaccine and a decade after the advent of conjugates. Clin Microbiol Rev. 2000;13:302-17.
- Ricci S, et al. Invasive Haemophilus influenzae Type b Disease in the Post Hexavalent Era: Ten Years of Molecular Surveillance in Tuscany. Pediatr Infect Dis J. 2020;39:294-7.
- Sanchíz Cárdenas S, et al. Meningitis bacteriana aguda. Protocolos de la Sociedad de Cuidados Intensivos Pediátricos de la Asociación Española de Pediatría. 2021.
- Soler-Soneira M, et al. Enfermedad invasiva por Haemophilus influenzae. España 2023. Boletín Epidemiológico Semanal. 2024;32:137-49.
- Talbird SE, et al. Impact of Routine Childhood Immunization in Reducing Vaccine-Preventable Diseases in the United States. Pediatrics. 2022;150:e2021056013.
- Wahl B, et al. Burden of Streptococcus pneumoniae and Haemophilus influenzae type b disease in children in the era of conjugate vaccines: global, regional, and national estimates for 2000-15. Lancet Glob Health. 2018;6:e744-57.
- WHO. PAHO. Haemophilus Influenzae.
14. Enlaces de interés
- American Academy of Pediatrics. Healthy children. Haemophilus Influenzae type b
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026
- CDC. Haemophilus influenzae Disease (Including Hib). For Clinicians
- CDC: Haemophilus influenzae Disease (Including Hib). Vaccination
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Haemophilus influenzae tipo b
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente al Haemophilus influenzae tipo b
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna del Haemophilus influenzae tipo b
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre el Haemophilus influenzae tipo b
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a Haemophilus influenzae tipo b
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada
- ECDC. Factsheet about Invasive Haemophilus influenzae disease
- WHO. Immunization, Vaccines and Biologicals. Haemophilus influenzae type b (Hib)
15. Historial de actualizaciones
| 9 de octubre de 2018 | Actualización de los apartados introducción; epidemiología de la enfermedad; tipos de vacunas, composición y presentación; indicaciones y esquemas de vacunación y administración con otras vacunas y otros productos. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2019 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2020 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2021 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2022 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de julio de 2022 | Actualización del apartado 8 sobre Hexyon y la vacuna de la varicela |
| 1 de enero de 2023 | Nuevas citas bibliográficas y enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 18 de mayo de 2023 | Actualización de todos los apartados. Nuevas citas bibliográficas |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2025 | Nuevas citas bibliográficas y enlaces de interés |
| 2 de mayo de 2025 | Actualización de todos los apartados. Nuevas citas bibliográficas y modificación enlace de interés de "Vacunación acelerada" |
| 1 de enero de 2026 | Actualización del apartado "Epidemiología de la enfermedad". Nuevas citas bibliográficas y enlaces de interés |
-oOo-




