Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
51. Nuevas inmunizaciones frente a las enfermedades tropicales
Capítulo 51 - Nuevas inmunizaciones frente a las enfermedades tropicales
3.1. Epidemiología de la enfermedad
3.2. Tipos de vacunas, composición y presentación
3.3. Inmunogenicidad, eficacia y efectividad
3.4. Vías de administración
3.5. Indicaciones y esquemas de vacunación
3.5.1. Recomendaciones de vacunación
3.6. Administración con otras vacunas y otros productos
3.7. Efectos adversos
3.8. Precauciones y contraindicaciones
3.9. Bibliografía
4.1. Epidemiología de la enfermedad
4.2. Tipos de vacunas, composición y presentación
4.3. Inmunogenicidad, eficacia y efectividad
4.4. Vías de administración
4.5. Indicaciones y esquemas de vacunación
4.6. Administración con otras vacunas y otros productos
4.7. Efectos adversos
4.8. Precauciones y contraindicaciones
4.9. Bibliografía
5.1. Epidemiología de la enfermedad
5.2. Tipos de vacunas, composición y presentación
5.3. Inmunogenicidad, eficacia y efectividad
5.4. Vías de administración
5.5. Indicaciones y esquemas de vacunación
5.6. Administración con otras vacunas y otros productos
5.7. Efectos adversos
5.8. Precauciones y contraindicaciones
5.9. Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figuras incluidas en el capítulo:
Tabla 51.1. Vacunas autorizadas frente al dengue
Tabla 51.2. Pautas de vacunación frente al dengue
Tabla 51.3. Recomendaciones de vacunación de la SEIMC
Tabla 51.4. Vacunas autorizadas frente al paludismo por P. falciparum
Tabla 51.5. Pautas de vacunación frente al paludismo por P. falciparum
Tabla 51.6. Vacunas autorizadas frente al virus chikunguña
Figura 51.1. Países endémicos para el dengue
Figura 51.2. Vigilancia entomológica de Aedes albopictus en España, 2008-2023
Figura 51.3. Aedes albopictus en España: situación en 2009, 2013, 2017 y 2020
Figura 51.4. Distribución geográfica del Aedes albopictus en Europa (2023)
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Nuevas inmunizaciones frente a las enfermedades tropicales. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-51
1. Puntos clave
- En los últimos años se han hecho importantes avances en la lucha contra varias enfermedades infecciosas transmitidas por vectores, entre los que se encuentran nuevas vacunas disponibles contra el dengue, el paludismo o la malaria y el chikunguña.
- Estas enfermedades, hasta ahora casi exclusivas de zonas tropicales y subtropicales, están emergiendo también en climas más templados como consecuencia de la influencia de múltiples factores.
- Dentro de las transmitidas por insectos, destacan por su incidencia las enfermedades adquiridas tras la picadura de mosquitos de los géneros Aedes (dengue, chikunguña, zika, fiebre amarilla), Culex (virus del Nilo Occidental y otras encefalitis víricas) y Anopheles (paludismo).
- Los factores que contribuyen a expansión de estas enfermedades fuera de las áreas tropicales son fundamentalmente el aumento de los viajes, los movimientos migratorios y el comercio internacional, la expansión demográfica, y, sin duda, los cambios en el clima que hacen más fácil la adaptación de los vectores en zonas de climas más fríos.
- El dengue ha multiplicado por 10 los casos en las últimas 2 décadas, y especialmente en la región de las Américas, donde en 2023 se comunicaron 4,6 millones de casos y en los 4 primeros meses de 2024 superan los 6,6 millones de casos. Están autorizadas 2 vacunas atenuadas tetravalentes frente al dengue, con pauta de 2 o 3 dosis por vía subcutánea, con una eficacia al año de la última dosis en torno al 80 %. Los datos de un ensayo fase III de otra vacuna atenuada por vía subcutánea se han publicado en febrero de 2024, mostrando también una eficacia global del 80 %, pero con la ventaja de administrarse en una única dosis.
- Se estima que cada año se producen más de 225 millones de casos de paludismo, con más de medio millón de fallecimientos, la mayoría de niños menores de 5 años. La OMS ha precalificado 2 vacunas para la prevención del paludismo en países con alta endemicidad: RTS,S/AS01 en julio de 2022, y R21/MATRIX-M el 21 de diciembre de 2023. Esta última es la primera vacuna candidata que cumple con el objetivo del 75 % de eficacia vacunal planteado por la OMS.
- La chikunguña puede producir manifestaciones de artritis y fatiga crónica, incluso de varios años de duración. Actualmente solo hay una vacuna aprobada, por una única agencia reguladora (FDA), para uso en personas a partir de 18 años con alto riesgo de exposición. Es una vacuna viva atenuada con pauta de una única dosis intramuscular.
- Aunque la mayor parte de las personas que se infectan por el virus zika permanecen asintomáticas, este virus representa un riesgo importante, especialmente para el feto, cuando la infección es adquirida durante el embarazo (síndrome congénito por virus zika). En la actualidad no existe ninguna vacuna disponible para su uso en humanos, aunque hay varias en distintas fases de investigación (ver apartado correspondiente en el capítulo 52 Inmunizaciones del futuro).
⌂
2. Introducción
Este capítulo del Manual está dedicado a los nuevos productos de inmunización que se hayan actualmente disponibles para la prevención de algunas de las enfermedades clásicamente denominadas “tropicales”. Dentro de las enfermedades tropicales se incluye a diversas enfermedades infecciosas especialmente prevalentes en regiones tropicales y subtropicales, siendo menos frecuentes en climas templados, y que son transmitidas por organismos vectores como los artrópodos (insectos como los mosquitos, y arácnidos como las garrapatas). En este apartado podrían tener cabida otras enfermedades tropicales inmunoprevenibles como el cólera, la encefalitis japonesa, la fiebre amarilla o la fiebre tifoidea, pero son enfermedades que cuentan con vacunas autorizadas hace muchos años y por tanto ya tienen sus capítulos específicos dentro del Manual.
Dentro de las transmitidas por insectos, se encuentran enfermedades víricas adquiridas tras la picadura de mosquitos de los géneros Aedes (dengue, chikunguña, zika, fiebre amarilla) y Culex (virus del Nilo Occidental y otras encefalitis víricas), que forman parte de los arbovirus (contracción del inglés de arthropod-borne viruses); y enfermedades por parásitos protozoarios, como el Plasmodium, transmitido por mosquitos del género Anopheles, causante del paludismo o malaria, o el Trypanosoma cruzi, transmitido por chinches triatominos, que es el agente causal de la enfermedad de Chagas.
Los factores que contribuyen a la propagación de las enfermedades transmitidas por vectores son fundamentalmente el aumento de viajes, los movimientos migratorios y el comercio internacional, la expansión demográfica con el aumento de la presencia de humanos en zonas geográficas donde tienen el hábitat estos vectores, y, sin duda, el cambio climático, que está provocando que algunos de estos vectores estén ampliando su hábitat hacia zonas templadas, o han ido recuperando su presencia en zonas donde en el pasado se habían encontrado hasta su erradicación, como por ejemplo en España, donde circularon de forma endémica provocando enfermedades como el paludismo, el dengue y la fiebre amarilla.
La historia natural de las enfermedades transmitidas por vectores es compleja. Para que la transmisión ocurra tienen que coincidir el agente infeccioso (muchas veces vinculado a un reservorio animal para su persistencia), el vector competente y un huésped susceptible, humano o animal, todo ello bajo unas condiciones ambientales adecuadas.
La Organización Mundial de la Salud (OMS) viene haciendo un llamamiento para preservar la salud aplicando un enfoque de «Una Sola Salud» (One Health) que abarque la interconexión de la salud humana, la salud animal y del medio ambiente en general (incluidos los ecosistemas).
Las enfermedades víricas transmitidas por Aedes constituyen el grupo que más está creciendo en el mundo, y con especial relevancia en el continente americano. La emergencia de estas enfermedades en las Américas vino precedida de la reintroducción, en la década de 1980, del vector Aedes aegypti, que había sido prácticamente eliminado en la década anterior. Una vez reintroducido, llegó rápidamente a los lugares que había ocupado con anterioridad. El dengue reemergió en los años 90, y en los siguientes años se fueron detectando los cuatro serotipos del virus. Actualmente, la incidencia y la presencia de cuadros graves de la enfermedad sigue aumentando. Más recientemente, emergieron dos virus para los que no se había detectado circulación en América y que afectaron a un gran número de personas en todo el continente: en 2013-2014 el chikunguña y, posteriormente, en 2015, el zika.
En los años 80, tuvo lugar la expansión en Europa del vector Aedes albopictus, también conocido como mosquito tigre. Originario de Asia, se desplazó por todo el mundo gracias al comercio de neumáticos usados y especies vegetales. Casi simultáneamente, llegó a Europa (Albania) en 1979 y a las Américas, en 1985. Está presente en la península Ibérica desde 2004, actualmente en toda la costa mediterránea, así como en otras CC. AA. como Andalucía, Aragón o País Vasco.
3. Dengue
3.1. EPIDEMIOLOGÍA DE LA ENFERMEDAD
El dengue es la arbovirosis más frecuente del mundo. El virus del dengue (DENV) pertenece al género de los Flavivirus, familia Flaviviridae. Se transmite por la picadura de mosquitos hembra del género Aedes (habitualmente Aedes aegypti, siendo menos frecuentes Aedes albopictus o Aedes polynesiensis) previamente infectadas. Actualmente hay descritos 4 tipos de DENV, numerados del 1 al 4. La infección con un serotipo del virus del dengue generalmente produce inmunidad de por vida contra ese serotipo, y se puede observar un período de protección cruzada (que a menudo dura de 1 a 3 años) contra la infección con los otros 3 serotipos. Después de este período de protección cruzada, la infección con un serotipo diferente puede predisponer a una enfermedad más grave. Una persona tiene un riesgo de por vida de hasta 4 infecciones por el virus del dengue.
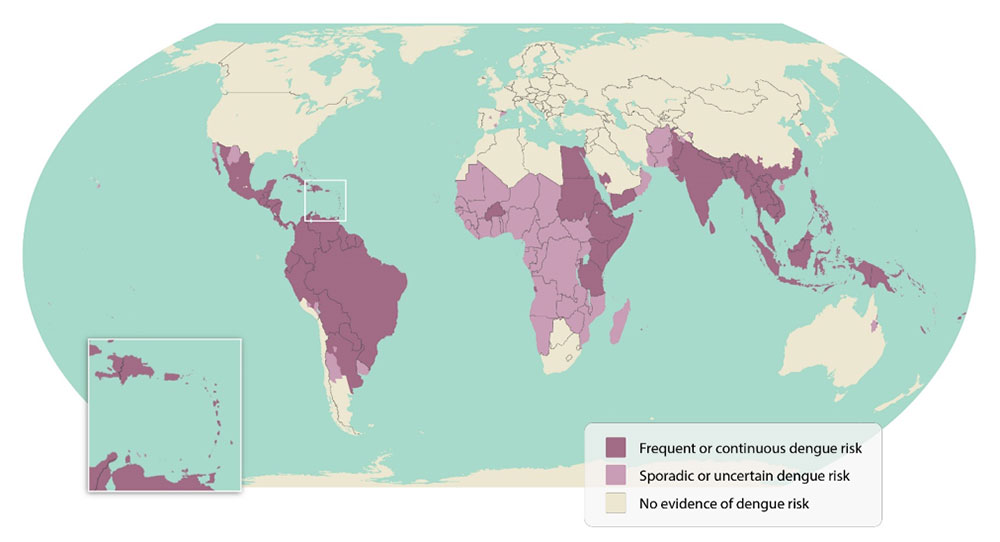
El número de casos de dengue notificados a la OMS se ha multiplicado por 10 en las dos últimas décadas. Estimaciones recientes sugieren que los virus del dengue causan entre 100 y 400 millones de infecciones y 58-96 millones de infecciones sintomáticas por año, resultando en 2,4 millones (IC95 %: 0,8 a 3,3) de años de vida ajustados por discapacidad y 36 055 muertes. Una gran mayoría de los casos son asintomáticos o leves y se autocontrolan, motivo por el cual las cifras reales de casos de dengue están infranotificadas. Muchos casos también se diagnostican erróneamente como otras enfermedades febriles. El alarmante aumento general del número de casos en las dos últimas décadas se explica, en parte, por el cambio en las prácticas de los países a la hora de registrar y notificar el dengue a los ministerios de salud y a la OMS. En 1970, solo estaba presente en 9 países, mientras que en 2024 es endémica en más de 130 y afecta a los cinco continentes, con un total de más de 3 900 000 millones de personas expuestas y con casos no sólo en climas tropicales como hasta la primera mitad del siglo XX, sino también en regiones con climas templados, sobre todo en zonas urbanas y semiurbanas (figura 51.1).
Figura 51.1. Países endémicos para el dengue.
Fuente: CDC. Dengue Around the World. [Internet]
El dengue es la principal causa de enfermedad febril entre los viajeros que regresan del Caribe, América Latina, y el sur de Asia, representando hasta el 85% de los casos. Aunque se presenta en personas de todas las edades, las tasas más altas se dan en adolescentes y adultos jóvenes, siendo más probable que cause una enfermedad grave en niños pequeños, embarazadas y pacientes con enfermedades crónicas (p. ej., asma, anemia de células falciformes y diabetes mellitus).
Según datos de la OMS, en 2024, se registró un máximo histórico de más de 14,6 millones de casos y más de 11 000 muertes relacionadas con el dengue, afectando a más de 130 países de todas las regiones de la OMS. Se estima que la mitad de la población mundial vive en zonas de riesgo de dengue. La Región de las Américas representó más del 90 % del total mundial de casos. Tan solo Brasil comunicó más de 10 millones de casos y 6321 muertes. Otros países con grandes epidemias fueron Argentina (581 559 casos), México (558 846), Colombia (320 982), Paraguay (295 785), Perú (271 531), Guatemala (188 585) y Honduras (177 209). Las regiones del Sudeste Asiático y el Pacífico Occidental contribuyeron en conjunto con más de 1 millón de casos, principalmente en Bangladesh, India, Indonesia, Malasia y Vietnam. La Región de África registró un fuerte aumento, con brotes notables en Burkina Faso y Cabo Verde. En la región del Mediterráneo Oriental, se produjeron epidemias recurrentes en Pakistán, mientras que se notificó una transmisión autóctona limitada en el sur de Europa y en la isla Reunión (Francia). Los datos demuestran tanto la magnitud récord de la transmisión como la continua expansión del virus a nuevas zonas geográficas y climáticas.
Según el ECDC, en 2025, hasta principios de diciembre, se notificaron más de 5 millones de casos y más de 3000 muertes relacionadas con dengue en 106 países/territorios de la OMS.
Por todo ello, algunos países como Brasil, Argentina, Indonesia y Tailandia tienen recomendaciones de vacunación en distintas franjas etarias y condiciones de riesgo. Las innovaciones en el control de vectores también progresaron con las liberaciones experimentales a gran escala de mosquitos infectados con Wolbachia en Indonesia, resultando en reducciones sustanciales en la incidencia del dengue.
En España el dengue es una enfermedad principalmente importada y desde 2016 la evolución de notificaciones ha sido variable, con un promedio de 204 casos anuales, sobre todo en verano (junio a septiembre), con un máximo en 2019 (435) y mínimo en 2020 (139) y 2021 (49). Desde el año 2015, el dengue es de declaración obligatoria a la Red Nacional de Vigilancia Epidemiológica (RENAVE). No obstante, Aedes albopictus se encuentra establecido en todo el litoral mediterráneo y en Baleares (figura 51.2), y ya se han producido 14 casos autóctonos. Los primeros se identificaron en 2018: un brote de 5 casos relacionados en Murcia y otro caso aislado en un residente en Cataluña, no relacionado con el brote anterior. En 2019 se detectó otro caso autóctono en Cataluña, además de un caso en Madrid, este último probablemente debido a transmisión sexual. En 2020 y 2021 no se identificaron nuevos casos. Más recientemente, en 2023 se han detectado en Alemania 2 brotes con origen en Ibiza que han afectado hasta 6 ciudadanos tras pasar las vacaciones en esa isla en 2022. Se ha detectado de forma ocasional la presencia de Aedes aegypti en Canarias (en las islas de Fuerteventura, Gran Canaria, La Palma y Tenerife), pero se estima que el riesgo de que se establezcan de forma estable es bajo, salvo en la isla de Gran Canaria, que se considera moderado, debido al tiempo transcurrido desde la primera detección, la persistencia de los hallazgos de ejemplares adultos y las dificultades para realizar las inspecciones y tomar las medidas de control adecuadas en numerosas viviendas del barrio afectado (Piletas, Las Palmas de Gran Canaria). En Cataluña, en 2023 hubo 3 casos autóctonos y 10 en 2024, todos diagnosticados entre agosto y octubre. En 2024, 17 CC. AA. y 1 ciudad autónoma notificaron un total de 1119 casos, de los que 788 (70,4%) fueron confirmados. La evolución del área geográfica donde se ha detectado Aedes albopictus en España se puede observar en la figura 51.3.
Figura 51.2. Vigilancia entomológica de Aedes albopictus en España, 2008-2023.
Fuente: Centro de Coordinación de Alertas y Emergencias Sanitarias. Resultados de la vigilancia entomológica de Aedes albopictus. [Internet]
Figura 51.3. Aedes albopictus en España: situación en 2009, 2013, 2017 y 2020.
Fuente: Centro de Coordinación de Alertas y Emergencias Sanitarias. Resultados de la vigilancia entomológica de Aedes albopictus. [Internet]
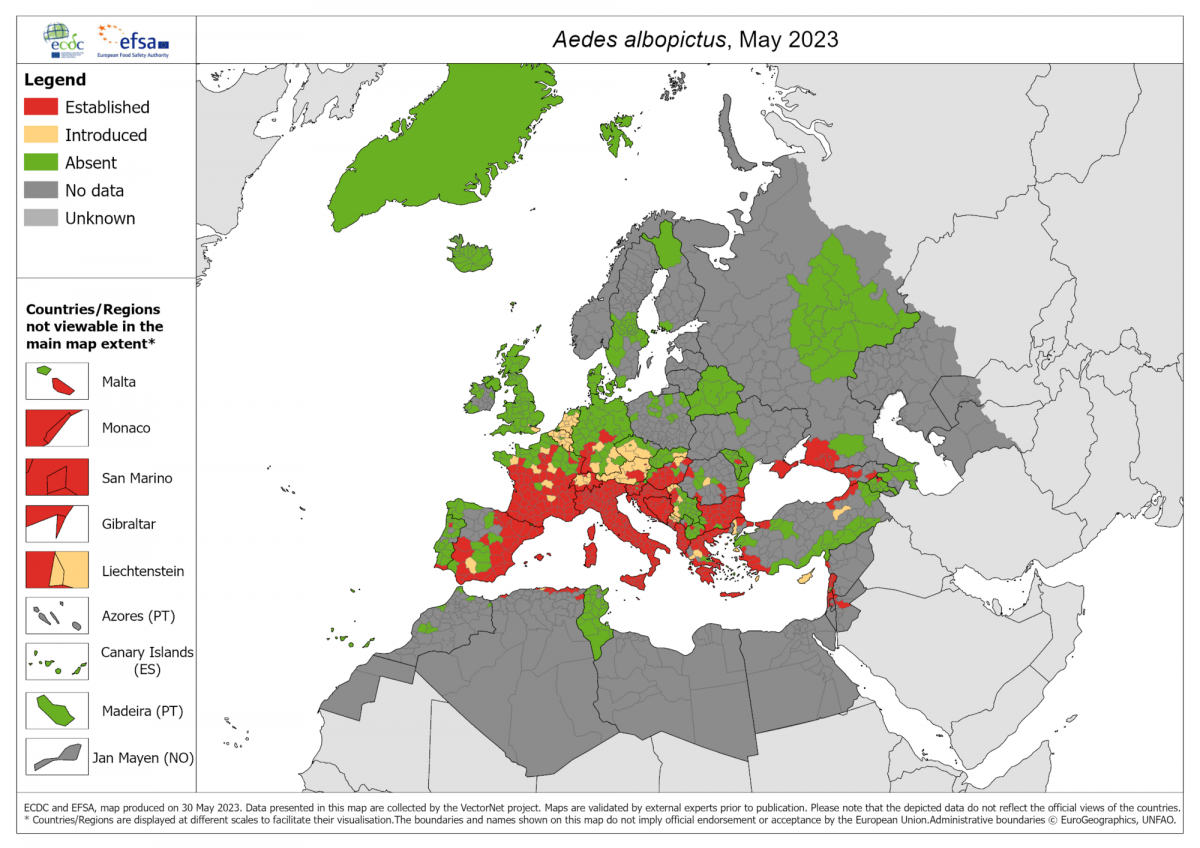
Europa está experimentando una tendencia al calentamiento en la que las olas de calor y las inundaciones son cada vez más frecuentes y graves, y los veranos son cada vez más largos y cálidos. Esto crea condiciones más favorables para especies de mosquitos invasores como Aedes albopictus y Aedes aegypti. Aedes albopictus apareció por primera vez en Albania en 1979, introducido a través de un envío de mercancías desde China; posteriormente, en 1990, en Italia en neumáticos usados procedentes de EE. UU. Desde entonces, y de manera gradual, el vector se ha ido extendiendo por todo el continente (figura 51.4). La última gran epidemia de dengue debida a Aedes aegypti se notificó en Grecia en 1928. Posteriormente, no se detectaron casos por transmisión vectorial autóctona hasta 2010. En 2012, tuvo lugar un brote en la Isla de Madeira con más de 2000 casos. Desde entonces, se han sucedido casos esporádicos de dengue y brotes autóctonos transmitidos por A. albopticus, generalmente pequeños en Croacia, España, Francia e Italia. En el último informe del ECDC sobre casos de dengue en Europa, publicado en junio de 2024 sobre datos de 2022, 27 países de la UE y del EEE notificaron 1757 casos de dengue, de los cuales 1560 (89 %) fueron confirmados. La tasa de notificación fue de 0,4 casos por 100 000 habitantes. Las tasas más altas se dieron entre las personas de 25 a 44 años, con la distribución hombres y mujeres 1,1:1. El número de casos se incrementó a partir de marzo, alcanzando su punto máximo en agosto. La mayoría de los casos asociados a viajes con un país probable conocido de infección fueron importados de América, principalmente de Cuba (584 casos, 38 %). Hubo brotes en siete regiones de Francia (9 brotes y 65 casos, el mayor número de brotes y casos autóctonos en un país en este siglo) y un brote en Ibiza (seis casos). En 2023 se notificaron hasta un total de 428 casos de los cuales 71 fueron autóctonos, la mayoría en Francia (9 brotes, 45 casos). Según la OMS, en 2024 la mayoría de los casos de dengue en la Región Europea de la OMS se produjeron en la iisla de Reunión (1227 casos) y en el archipiélago de Mayotte (68 casos), dos departamentos franceses de ultramar en el océano Índico, donde el dengue es endémico. Se documentó transmisión local esporádica en toda Europa continental, con 10 casos en España, 85 en Francia, y 213 en Italia, en consonancia con las tendencias observadas en los últimos años. Según el ECDC, hasta el 19 de noviembre de 2025, tres países de Europa (sin contar las regiones ultraperiféricas) han notificado casos de dengue: Francia (29), Italia (4) y Portugal (Madeira, 2).
Figura 51.4. Distribución geográfica del Aedes albopictus en Europa (2023).
Fuente: ECDC. Increasing risk of mosquito-borne diseases in EU/EEA following spread of Aedes species. 22 June 2023. [Internet].
Además de la transmisión por la picadura de mosquito, se han descrito vías alternativas como transfusiones de sangre, trasplante, pinchazo, transmisión vertical y por vía sexual (esta última muy infrecuente). El periodo de incubación desde la infección hasta la aparición de los síntomas generalmente dura entre 4 y 10 días. El espectro clínico de la infección por dengue es muy amplio. Por lo general la infección es asintomática, y cuando se producen síntomas, el curso clínico suele ser leve y autolimitado (“fiebre clásica por dengue”) que incluye un síndrome febril agudo acompañado de uno o varios síntomas inespecíficos tales como cefalea intensa, dolor retro-ocular, mialgias y artralgias. Los síntomas gastrointestinales son frecuentes, con náuseas y vómitos, dolor abdominal, diarrea, percepción distorsionada del sabor de los alimentos (disgeusia) o anorexia. No es infrecuente la aparición de un exantema que predomina en tronco y que se extiende a las extremidades.
Sin embargo, una pequeña proporción (<5 %) puede progresar hacia dengue grave, llamado dengue hemorrágico o síndrome de shock por dengue, que cursa con síntomas derivados del aumento de la permeabilidad vascular y la extravasación importante de plasma, con sangrado intenso y fallo orgánico. Puede ser mortal sin un adecuado manejo clínico en el que es fundamental mantener el equilibrio hidroelectrolítico. No existen en la actualidad fármacos antivirales específicos frente a la enfermedad.
La probabilidad de sufrir un dengue grave es mayor en los casos de dengue secundario que en los primeros episodios de dengue. Existen 4 serotipos del virus: DENV-1, DENV-2, DENV-3 y DENV-4, los cuales se extienden por todo el mundo y pueden coexistir en la misma región. La infección por un serotipo determinado brinda inmunidad homóloga de larga duración, pero la protección heteróloga (frente a los demás serotipos) es de sólo unos meses (por lo que se puede padecer dengue hasta en cuatro ocasiones). El factor de riesgo mejor conocido para padecer dengue grave es la reinfección por un serotipo diferente del que produjo la infección primaria, lo que puede desencadenar una respuesta heteróloga de anticuerpos (enfermedad intensificada por anticuerpos, ADE [antibody dependent enhancement, siglas en inglés]). Otros factores relacionados con la gravedad de la enfermedad son el intervalo de tiempo entre infecciones, la comorbilidad y la edad de la persona.
La prevención y control del dengue dependen, sobre todo, de la adopción de medidas de control efectivo de los vectores al no existir fármacos antivirales específicos frente a la enfermedad. La investigación de vacunas frente al dengue es pues un importante reto, disponiendo en la actualidad de dos vacunas autorizadas para su uso en zonas endémicas.
⌂
3.2. TIPOS DE INMUNIZACIÓN, COMPOSICIÓN Y PRESENTACIÓN
Existen dos vacunas comercializadas frente al dengue y autorizadas para su uso en varios países del mundo, como Argentina y Brasil. En Europa ambas están aprobadas por la EMA, pero solo una de ellas está disponible en España (tabla 51.1).
- Dengvaxia (Sanofi) es una vacuna tetravalente atenuada, elaborada con virus de la fiebre amarilla modificados mediante tecnología de ADN recombinante, para que expresen proteínas de los cuatro serotipos del DENV, aunque no induce respuesta frente a proteínas no estructurales. Solo debe utilizarse en personas de 6 a 45 años, aunque en varios países la indicación es partir de los 9 años, con infección previa demostrada por DENV mediante la detección de anticuerpos, ya que tras la vacunación en sujetos seronegativos aumenta el riesgo de dengue grave en las personas infectadas por segunda vez. En 2016, fue autorizada en Brasil y México; Argentina lo hizo al año siguiente, estando actualmente autorizada en 20 países endémicos. Está autorizada en Europa desde diciembre de 2018 y en EE. UU. desde mayo de 2019. No está disponible en España.
- Qdenga (Takeda) es también una vacuna tetravalente atenuada compuesta por una cepa del DENV-2 y tres virus quiméricos (basados en el DENV-2) a los que se les inserta mediante tecnología de ADN recombinante el material genético que codifica la proteína M premembrana y las proteínas de la envuelta del DENV-1, DENV-3 y DENV-4. La vacuna está autorizada para personas a partir de 4 años, hayan pasado o no la enfermedad anteriormente, no habiendo datos en individuos de más de 60 años, aunque la ficha técnica recoge que no es necesario ajustar la dosis en personas de ≥60 años. El primer país que la autorizó fue Indonesia en agosto de 2022, a la que siguieron Tailandia, región europea (5 de diciembre de 2022), y en 2023 lo fue en Reino Unido (enero), Brasil (marzo), Argentina (abril) y Colombia (noviembre), así como por la OMS en octubre. En julio de 2023, Takeda retiró voluntariamente la solicitud de autorización de la vacuna ante la FDA, alegando problemas de recopilación de datos. Hasta octubre de 2025, esta vacuna ha sido autorizado en 41 países, con 18,6 millones de dosis distribuidas en 11 países endémicos. En España, aunque puede estar disponible en los centros de vacunación internacional, generalmente se prescribe y se compra sin financiar por el SNS en oficinas de farmacia.
Tabla 51.1. Vacunas autorizadas frente al dengue.
| Vacuna (Laboratorio) | Composición | Presentación (dosis) | Edad |
| DENGVAXIA (Sanofi) |
Polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna tetravalente frente al dengue (virus vivos atenuados).
Excipientes con efecto conocido: una dosis (0,5 ml) contiene 41 microgramos de fenilalanina y 9,38 miligramos de sorbitol. |
Polvo (5 dosis) en vial + 0,5 ml de disolvente en vial Envase con 1 o 10 dosis |
6 a 45 años |
|
* Producido en células Vero mediante tecnología de ADN recombinante. Este producto contiene organismos modificados genéticamente (OMG) ** DICC 50: 50% de la dosis infecciosa en cultivo celular. |
|||
| QDENGA (Takeda) |
Polvo y disolvente para solución inyectable en jeringa precargada Vacuna tetravalente contra el dengue (viva, atenuada) Después de la reconstitución, 1 dosis de 0,5 ml contiene:
Excipientes (polvo): α,α-Trehalosa dihidrato, poloxámero 407, albúmina de suero humano, dihidrógenofosfato de potasio, hidrogenofosfato de disodio, cloruro potásico y cloruro de sodio |
Polvo y disolvente para solución inyectable: Envase con 1 o 10 dosis Polvo y disolvente para solución inyectable en jeringa precargada: Envase con 1 o 5 dosis |
≥4 años |
|
* Producido en células Vero mediante tecnología de ADN recombinante. Genes de las proteínas de superficie específicas de cada serotipo, insertados en el esqueleto del dengue tipo 2. Este producto contiene organismos modificados genéticamente (OMG) # Producido en células Vero por tecnología de ADN recombinante UFP = Unidades formadoras de placas |
|||
Todas las presentaciones requieren conservación con temperatura entre +2 °C y +8 °C.
Dengvaxia se presenta en polvo y disolvente para suspensión inyectable en jeringa precargada con tapón de halobutilo con envases de 1 o 10. Tras la reconstitución con el disolvente, Dengvaxia se debe administrar inmediatamente. El periodo de validez es de 3 años.
Qdenga tiene dos formas de presentación: polvo en vial y 0,5 ml de disolvente para solución inyectable (envases de 1 o 10) y polvo y disolvente en jeringa precargada de 0,5 ml (envases de 1 o 5). Una vez reconstituida si no se utiliza inmediatamente se debe utilizar en un plazo máximo de 2 horas a temperatura ambiente. El periodo de validez es de 18 meses.
En noviembre de 2024 fueron publicados los resultados del ensayo doble ciego controlado con placebo de fase 3 realizado en Brasil con otra vacuna atenuada tetravalente (Butantan-DV) contra el dengue, en dosis única subcutánea, producida por el Instituto Butantan brasileño y sobre la base de un desarrollo anterior del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAD) de EE. UU. Está compuesto por virus vacunales atenuados para DENV-1, DENV-3 y DENV-4 (rDENV1Δ30, rDENV3Δ30/31 y rDENV4Δ30) y un virus vacunal quimérico que contiene los genes DENV-2 que codifican la premembrana (prM) y proteínas de la envoltura (E) sobre el fondo atenuado de DENV-4 (rDENV2/4Δ30[ME]). Se realizó una estratificación según la edad (2 a 6 años, 7 a 17 años y 18 a 59 años). Los participantes fueron seguidos entre 2 y 5 años (media 3,7 años). Se detectaron 356 casos de dengue confirmado virológicamente durante el seguimiento (128 en el grupo vacunado y 228 en el grupo placebo). La EV frente a cualquier serotipo DENV fue del 67,3 % (IC95 %: 59,4 a 73,9). No se observaron casos causados por DENV-3 o DENV-4. Las proporciones de participantes que tuvieron eventos adversos graves fueron similares entre los grupos de tratamiento (637 [6,2 %] en el grupo vacunado y 395 [6,6 %] en el grupo placebo) (Nogueira ML 2024).
⌂
3.3. INMUNOGENICIDAD, EFICACIA Y EFECTIVIDAD
Dengvaxia
Entre los niños de 9 a 16 años con infección previa por el virus del dengue, tiene una eficacia global de alrededor del 80 %; contra el dengue sintomático confirmado virológicamente, la EV es del 82 % (IC95 %: 67 a 90), frente a hospitalización del 79 % (IC95 %: 69 a 86) y frente a dengue grave del 84 % (IC95 %: 63 a 93).
En la evaluación de la eficacia extendida en los individuos seropositivos basales, la eficacia de la vacuna para las infecciones sintomáticas fue del 61,0 % (IC95 %: 29,6 a 86,5) en el año siguiente a la tercera dosis. Después de 6 años se redujo a una eficacia acumulada del 39,4 % (IC95 %: 0,2 a 63,0) considerando todas las infecciones sintomáticas durante dicho período. Para las infecciones subclínicas, la eficacia acumulada cae del 50,3 % (IC95 %: 9,2 a 70,0) al 36,2 % (IC95 %: 12,2 a 49,6) en el mismo rango de tiempo. Los resultados son similares a los estimados en los sitios de ensayo de Fase III en América Latina y Asia en el año siguiente a la tercera dosis (eficacia de la vacuna del 41,7 % a la infección subclínica).
Esto pone de relieve que la eficacia protectora de la vacuna se concentra en los primeros años después de la vacunación. En cuanto a la duración de la protección, estudios recientes han demostrado que Dengvaxia brinda protección contra la hospitalización y enfermedades graves durante, al menos, 6 años después de la última dosis de la serie. Se están realizando estudios para determinar cuánto tiempo puede durar la protección.
Qdenga
La aprobación se ha basado en datos de seguridad, inmunogenicidad y eficacia de 19 ensayos de fase I, II y III con más de 28 000 participantes de un amplio rango de edades. La vigilancia del dengue en el ensayo de fase III se extendió por 4,5 años. El criterio de valoración principal del estudio de fase III fue la eficacia contra cualquier dengue, de cualquier gravedad, causado por cualquier tipo de DENV en receptores inmunes o no inmunes. A los 12 meses de la segunda dosis, la eficacia de la vacuna fue del 80,2 %. A los 18 meses, la eficacia de la vacuna contra todo el dengue en los receptores inmunes fue del 76,1 % y del 66,2 % en los receptores no inmunes al dengue; la eficacia frente a la hospitalización fue del 90,4 % y del 85,9 % contra el dengue hemorrágico; la eficacia específica del tipo fue del 69,8 % para DENV-1, del 95,1 % para DENV-2 y del 48,9 % para DENV-3, con intervalos de confianza variables. A los 54 meses, la eficacia general de la vacuna había disminuido al 61,2 %, con una eficacia del 64,2 % en receptores inmunes y del 53,5 % en no inmunes al dengue, siendo del 84,1 % frente a hospitalización; por tipos de DENV, pacientes no inmunes al dengue fue del 78,4 % para DENV-1, del 100 % para DENV-2, no hubo eficacia para DENV-3 y no hubo suficientes casos de DENV-4 para calcular un valor. Los datos de seguimiento del ensayo fase 3 TIDES (Tetravalent Immunization against Dengue Efficacy Study) ofrecidos por la compañía Takeda muestran que la EV de la vacuna TAK-003 (Qdenga) fue del 61,2 % para prevenir el dengue confirmado virológicamente y del 84,1% para prevenir la hospitalización asociada al dengue después de 4,5 años tras la pauta de vacunación. Al administrar una dosis de recuerdo tras ese tiempo, en los 2 años siguientes la EV frente a hospitalización aumentó al 90,6 %. Se observó una eficacia general en los cuatro serotipos de dengue, y no se informaron sobre nuevas señales de seguridad. En el ensayo participaron más de 20 000 niños y adolescentes sanos (de 4 a 16 años) de ocho países endémicos de dengue en América Latina.
En septiembre de 2023, el Grupo de Expertos en Asesoramiento Estratégico sobre Inmunización de la OMS (SAGE, por sus siglas en inglés) en la consideración de la importancia del dengue y su prevención concluía:
- La vacuna ha demostrado eficacia para los cuatro serotipos en individuos que ya han pasado el dengue (cualquier serotipo) y para los serotipos 1 y 2 en pacientes seronegativos
- La vacuna de Takeda no genera protección contra DENV-3 en seronegativos (naïve) previos a la vacunación y no hubo un número suficiente en los ensayos por baja circulación como para asegurar protección contra DENV-4 en seronegativos
- No se puede descartar la posibilidad de aparición de enfermedad generada por anticuerpos cuando se vacune a seronegativos y luego se expongan a DENV-3 y DENV-4 de forma natural, por lo que el beneficio en viajeros seronegativos pudiera ser bajo
- Se plantea la opción de realizar determinación serológica previa a viajeros para ver si indicar la vacuna o no. Esto sería poco práctico y quizás solo útil en viajeros frecuentes o de larga estancia a zonas endémicas por su mayor probabilidad de positividad
- Aunque en ficha técnica figura 4 años como edad mínima, el SAGE la recomienda la administración a partir de los 6 (por insuficiente información en los que tienen 4-5 años).
Un estudio de casos y controles de test negativos en adolescentes durante el brote de dengue de 2024 en el estado de São Paulo (Brasil) para estimar la efectividad de la vacuna de Takeda contra el dengue sintomático virológicamente confirmado, y contra la hospitalización por dengue después de una o dos dosis de la vacuna, mostró una efectividad ajustada del 50,2 % (IC95 %: 45,0 a 54,9) para la primera dosis y del 61,7 % (IC95 %: 39,9 a 75,6) para la segunda dosis contra el dengue sintomático, y del 67,5 % (IC95 %: 43,4 a 81,3) para la primera dosis contra la hospitalización por dengue. La protección contra la enfermedad sintomática comenzó 14 días después de la primera dosis (67,4 % [IC95 %: 57,2 a 75,1] a los 14-27 días), pero disminuyó al 49,7 % (IC95 %: 30,4 a 63,6) después de 90 días tras la primera dosis (Ranzani 2025).
En resumen, las vacunas vivas atenuadas contra el dengue han generado datos clínicos: mayor eficacia en los receptores inmunes del dengue; mayor eficacia contra formas clínicas más graves; variabilidad en la eficacia serotipo-específica del DENV, y necesidad de tener más datos para todos los objetivos finales clínicos deseados (cualquier dengue, dengue grave, dengue hospitalizado), en todos los tipos de DENV, tanto en receptores inmunes como no inmunes al dengue.
⌂
3.4. VÍAS DE ADMINISTRACIÓN
Ambas vacunas, una vez reconstituidas, se administran por vía subcutánea, preferiblemente en la región deltoidea de la parte superior del brazo. No se deben administrar mediante inyección intravascular, intradérmica o intramuscular.
⌂
3.5. INDICACIONES Y ESQUEMAS DE INMUNIZACIÓN
Dengvaxia: la pauta de vacunación en niños y adultos de 6 a 45 años de edad consiste en 3 dosis reconstituidas (0,5 ml) administradas en intervalos de 6 meses. No se ha establecido el valor añadido de la(s) dosis de refuerzo ni el momento adecuado para su administración. No se ha establecido la seguridad y eficacia en menores de 6 años de edad.
Qdenga: a partir de los 4 años de edad la pauta de vacunación consiste en dos dosis reconstituidas (0,5 ml) con un esquema de 0-3 meses. No se ha establecido datos de seguridad y eficacia en niños menores de 4 años no habiendo, por otra parte, datos en personas de más de 60 años.
Las pautas de vacunación se muestran en la tabla 51.2.
Tabla 51.2. Pautas de vacunación frente al dengue.
| Vacuna (Laboratorio) | Edad de administración (Vía) | N.º dosis | Dosis de refuerzo |
| DENGVAXIA (Sanofi) |
Edad 6 – 45 años (Vía subcutánea) |
3 dosis (intervalos 6 meses) |
No se ha establecido |
| QDENGA (Takeda) |
Edad >4 años (Vía subcutánea) |
2 dosis (0 – 3 meses) |
No se ha establecido |
3.5.1. Recomendaciones de vacunación
En Europa la EMA establece que aunque los datos sobre el uso de Qdenga en regiones no endémicas son limitados, no han generado hasta el momento preocupaciones sobre su uso en estas regiones. Qdenga ha demostrado eficacia en sujetos seronegativos y, por lo tanto, podría usarse en personas que viven en áreas no endémicas y que vayan a viajar a áreas endémicas. Hasta el momento países como Austria, Bélgica, Dinamarca, Alemania, Holanda. Noruega, han establecido recomendaciones de uso desde los 4 años. Sin embargo, parece juicioso tener en consideración las conclusiones de la SAGE (septiembre de 2023) en referencia a su uso en personas naïve.
En España el Grupo de Patología Importada de la Sociedad de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) ha establecido grados de recomendación según la circunstancia de contexto epidemiológico y de la situación de riesgo de la persona así como del estado serológico frente al dengue (tabla 51.3)
Tabla 51.3 Recomendaciones de vacunación de la SEIMC
| Vacunación fuertemente recomendada |
Personas seropositivas1 que viajen a zonas con un brote activo de dengue |
|
Personas seropositivas con factores de riesgo para dengue grave2 que viajan a zona endémica |
|
| Vacunación recomendada |
Personas seropositivas que viajan a zona endémica (≥14 días) |
|
Personas seronegativas que viajan a una zona con un brote activo de dengue |
|
|
Personas seronegativas con factores de riesgo para dengue grave que viajan a zona endémica con alto riesgo de transmisión (sudeste asiático, sur de Asia y Pacífico occidental, Latinoamérica) |
|
| Valorar vacunación |
Personas seronegativas con o sin factores de riesgo para dengue grave que van a pasar periodos prolongados en área endémica. |
Por vacunación se entiende la administración de la pauta completa de dos dosis. En aquellos casos en los que sólo se haya podido administrar una dosis, no puede garantizarse un grado protección equivalente
1. Se considera una persona seropositiva aquella que tiene acreditada una infección pasada por dengue por la realización de una serología prevacunal o recogida en su historial médico. El diagnóstico clínico o de sospecha no es suficiente
2. Hay que considerar que, además de una infección previa por DENV, existen otros factores de riesgo para desarrollar un dengue grave como edades extremas de la vida o la presencia de comorbilidades (diabetes, hipertensión arterial o insuficiencia renal).
Recientemente la OMS (mayo 2024) ha emitido un posicionamiento en el que además de analizar la situación epidemiológica de la enfermedad en constante aumento (llegando a considerar al dengue como una de las 10 mayores amenazas para la salud global del planeta) establece algunas consideraciones respecto de las indicaciones y uso de la vacuna tetravalente atenuada Qdenga. Esta vacuna supone un notable avance en las posibilidades de prevención de la enfermedad en las zonas endémicas, pero avanza algunas incertidumbres que conviene tener en cuenta a lo largo de la implantación de los esquemas y recomendaciones.
Se informó un exceso de ingresos hospitalarios por infección por el tipo DENV3 entre los niños seronegativos iniciales en el grupo del ensayo TAK-003, aun cuando la diferencia no fue estadísticamente significativa. También hubo un exceso de casos de dengue grave entre los vacunados seronegativos, todos los cuales fueron causados por DENV3, pero, nuevamente, la diferencia no fue estadísticamente significativa. En cualquier caso, no se puede descartar de manera concluyente un aumento en el riesgo de dengue que requiera hospitalización o dengue grave debido a DENV3 en sujetos seronegativos vacunados.
Por otra parte refiere que puede no descartarse un mayor riesgo para la infección por el tipo DENV4 en personas seronegativas. Además, el análisis del Imperial College estimó que la eficacia de la vacuna era menor en niños de 4 a 5 años en comparación con los de 6 a 16 años para todos los serotipos.y la probabilidad de que el riesgo de resultados negativos para DENV3 y DENV4 sea mayor en ese grupo de edad. Por dicho motivo la recomendación de uso propuesto por OMS es a partir de los 6 años.
Este posicionamiento pone en valor las recomendaciones de uso en pacientes seronegativos tal y como se señalaba anteriormente en las recomendaciones de la SEIMC, especialmente en personas que viven en zonas no endémicas y que van a viajar a zonas endémicas.
⌂
3.6. ADMINISTRACIÓN CON OTRAS VACUNAS Y OTROS PRODUCTOS
Los pacientes que reciben tratamiento con inmunoglobulinas o hemoderivados que contienen inmunoglobulinas, tales como sangre o plasma, se recomienda que esperen, al menos, 6 semanas, y preferiblemente 3 meses, después del final del tratamiento antes de la administración de estas vacunas, para evitar la neutralización de los virus atenuados contenidos en las mismas.
Dengvaxia se ha evaluado en la administración concomitante con Tdpa, vacunas bivalentes y tetravalentes de VPH. Respecto a Tdpa, la administración concomitante ha demostrado la no inferioridad respecto a la administración por separado, tanto frente a los componentes de difteria, tétanos y tosferina, como frente a los tipos de DENV. Respecto a la administración con las vacunas VPH-2 y VPH-4, no se pudo demostrar no inferioridad en los niveles de anticuerpos por el limitado número de sujetos estudiado. Respecto a la ratio de la concentración media geométrica de anticuerpos (GMT), para VPH-2 fueron cercanas a 1 tanto para los genotipos 16 y 18 como para los 4 serotipos de dengue, mientras que para VPH-4 fueron cercanas a 1 para el genotipo 6 y alrededor de 0,80 para el 11, 16 y 18, y cercanas a 1 para los DENV-1 y DENV-4, y cercanas a 0,80 para los serotipos 2 y 3. Se desconoce la relevancia clínica de estas observaciones.
Qdenga se puede administrar de forma concomitante con la vacuna contra la hepatitis A (aunque solo se ha estudiado en adultos) y la vacuna contra la fiebre amarilla. En un estudio clínico con aproximadamente 300 sujetos adultos que recibieron la vacuna de forma concomitante con la de la fiebre amarilla 17D, no hubo ningún efecto sobre la tasa de seroprotección contra la fiebre amarilla, aunque si disminuyó la inmunogenicidad frente al dengue. Se desconoce la trascendencia clínica de este hallazgo.
3.7. EFECTOS ADVERSOS
Dengvaxia. Cuando se usa en personas con evidencia por laboratorio de infección pasada por el virus del dengue, la vacuna es muy segura. Las reacciones notificadas con mayor frecuencia fueron cefalea (51 %), dolor en la zona de inyección (49 %), malestar general (41 %), mialgia (41 %), astenia (32 %) y fiebre (14 %). Las reacciones adversas se produjeron en los 3 días posteriores a la vacunación, excepto la fiebre, que apareció en los 14 días posteriores a la inyección, y fueron de corta duración (de 0 a 3 días). Las reacciones adversas sistémicas tendieron a ser menos frecuentes después de la segunda y tercera inyección de Dengvaxia comparado con la primera inyección.
Qdenga. Las reacciones notificadas con más frecuencia en sujetos de 4 a 60 años de edad fueron dolor en el lugar de inyección (50 %), cefalea (35 %), mialgia (31 %), eritema en el lugar de inyección (27 %), malestar (24 %), astenia (20 %) y fiebre (11·%). Éstas generalmente ocurrieron en los 2 días posteriores a la inyección, fueron de intensidad leve a moderada y una duración breve (de 1 a 3 días), siendo menos frecuentes tras la segunda inyección.
En el estudio clínico DEN-205 se observó una viremia vacunal transitoria después de la vacunación con Qdenga en el 49 % de los participantes del estudio que no habían sufrido la infección del dengue anteriormente y en el 16 % de los participantes del estudio que sí la habían sufrido con anterioridad. La viremia vacunal comenzaba normalmente en la segunda semana tras la primera inyección, y su duración media era de 4 días. La viremia vacunal se asoció en algunos sujetos a síntomas transitorios de leves a moderados, como cefalea, artralgia, mialgia y erupción. Rara vez se ha detectado viremia vacunal después de la segunda dosis.
En Argentina se llevó a cabo un estudio retrospectivo, observacional en centros privados mediante vigilancia pasiva de eventos adversos en vacunados con Qdenga en ≥4 años entre noviembre de 2023 y noviembre de 2024. Tras más de 150 000 dosis administradas a más de 112 000 individuos, se notificaron 303 eventos adversos, con una tasa de incidencia de 1,9/1000: 2,5/1000 para la primera dosis y 0,5/1000 para la segunda. El 95,1 % fueron leves, siendo los más frecuentes tras la primera dosis: exantema (41,8 %), mialgia (30,0 %), fiebre (29,2 %) y cefalea (26,0 %), y tras la segunda, fiebre (38,5 % ) y cefalea (26,9 %). La incidencia de anafilaxia fue del 0,006/1000, y de la reacción alérgica no anafiláctica del 0,14/1000, respectivamente. Se describieron casos aislados de síndrome nefrótico, púrpura trombocitopénica inmunitaria y linfoma de Hodgkin (Castellanos VE, 2025).
⌂
3.8. PRECAUCIONES Y CONTRAINDICACIONES
Contraindicaciones. Tanto Dengvaxia como Qdenga, al ser vacunas vivas atenuadas, están contraindicadas durante el embarazo. No se deben administrar a personas con inmunodeficiencia adquirida o congénita mediada por células, incluidos tratamientos inmunosupresores administrados durante las 4 semanas previas a la vacunación, VIH sintomático o con deterioro de la función inmunitaria, hipersensibilidad grave al principio activo o a alguno de los excipientes. Aunque las fichas técnicas de ambos productos contraindican la administración durante la lactancia, no existe contraindicación al no haberse demostrado transmisión por esa vía y, por otra parte, la lactancia protege al bebé del dengue. En consecuencia, hay que valorar riesgo beneficio y probablemente sea recomendable mantener la lactancia cuando la madre deba ser vacunada.
Precauciones. Posteriormente a la autorización y uso de Dengvaxia en México en 2015 se observó una señal de seguridad en los receptores de la vacuna que no eran inmunes al dengue en el momento de la administración de la vacuna. En el tercer año del ensayo clínico de fase III, los receptores de la vacuna más jóvenes y no inmunes experimentaron mayores tasas de hospitalización y dengue grave en comparación con sus pares no vacunados. Por este motivo el SAGE de la OMS modificó su respaldo original a Dengvaxia recomendando su uso únicamente en personas inmunes al dengue. Por tanto, en ausencia de datos clínicos que respalden la vacunación de personas que viven en zonas no endémicas con baja probabilidad de haber sufrido una infección por dengue en el pasado y que sólo viajan ocasionalmente a zonas endémicas, no se recomienda su vacunación.
⌂
3.9. Bibliografía
- Biswal S, et al. Efficacy of a Tetravalent Dengue Vaccine in Healthy Children and Adolescents. N Engl J Med. 2019;381:2009-19.
- Castellano VE, et al. Retrospective analysis of one year of passive safety surveillance data following implementation of the dengue vaccine, Qdenga® (TAK-003) at private vaccination centers, in Buenos Aires, Argentina. Vaccine: X. 2025;27:100749.
- Centro de Coordinación de Alertas y Emergencias Sanitarias. Riesgo de aparición de nuevos casos autóctonos de enfermedades transmitidas por Aedes en España. 5 de julio de 2023. [Internet]
- Centro Nacional de Epidemiología. Instituto de Salud Carlos III. CIBERESP. Informe epidemiológico sobre la situación de dengue en España. Año 2024. Madrid, 30 mayo 2025.
- CDC. Dengue Around the World. [Internet]
- Christie CDC, et al. Dengue, chikungunya and zika arbovirus infections in Caribbean children. Curr Opin Pediatr. 2023;35:155-65.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ago/2025.
- Deng SQ, et al. A Review on Dengue Vaccine Development. Vaccines (Basel). 2020;8:63.
- ECDC. Dengue. Annual epidemiological report for 2022. Stockholm: ECDC; June 2024.
- ECDC. Increasing risk of mosquito-borne diseases in EU/EEA following spread of Aedes species. 22 Jun 2023. [Internet].
- Fonseca SNS. Changing epidemiology of dengue fever in children in South America. Curr Opin Pediatr. 2023;35:147-54.
- Halstead SB. Three Dengue Vaccines - What Now? N Engl J Med. 20241;390:464-5.
- Kallás EG, et al. Live, Attenuated, Tetravalent Butantan-Dengue Vaccine in Children and Adults. N Engl J Med. 2024;390:397-408.
- Kok BH, et al. Dengue virus infection - a review of pathogenesis, vaccines, diagnosis and therapy. Virus Res. 2023;324:199018.
- Nogueira ML, et al. Efficacy and safety of Butantan-DV in participants aged 2–59 years through an extended follow-up: results from a double-blind, randomised, placebo-controlled, phase 3, multicentre trial in Brazil. Lancet Infect Dis. 2024;24:1234-44.
- OPS. Evaluación de riesgos sobre Dengue en la Región de las Américas. 12 de diciembre del 2023. [Internet].
- PAHO. PLISA (Plataforma de Información en Salud para las Américas). Casos reportados de dengue por subregiones en las Américas. [Internet].
- Paz-Bailey G, et al. Dengue Vaccine: Recommendations of the Advisory Committee on Immunization Practices, United States, 2021. MMWR Recomm Rep. 2021;70:1-16.
- Ranzani OT, et al. Effectiveness of the TAK-003 dengue vaccine in adolescents during the 2024 outbreak in São Paulo, Brazil: a test-negative, case-control study. Lancet Infect Dis. 2026;26:91-100.
- Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Evaluación de la vacunación frente al dengue en viajeros. Grupo de estudio de Patología Importada (GEPI) de la SEIMC.
- Thomas SJ. Is new dengue vaccine efficacy data a relief or cause for concern? NPJ Vaccines. 2023;8:55.
- Torres-Flores JM, et al. Dengue Vaccines: An Update. BioDrugs. 2022;36:325-36.
- White LJ, et al. Defining levels of dengue virus serotype-specific neutralizing antibodies induced by a live attenuated tetravalent dengue vaccine (TAK-003). PLoS Negl Trop Dis. 2021;15:e0009258.
- WHO. Global dengue surveillance. [Internet].
- WHO. Meeting of the Strategic Advisory Group of Experts on Immunization, September 2023: conclusions and recommendations. Weekly Epidemiological Record. 2023;98:599-620. [Internet].
- WHO. The Global Advisory Committee on Vaccine Safety. Dengue vaccines. [Internet].
- WHO. WHO position paper on dengue vaccines – May 2024. Weekly Epidemiological Record. 2024;99:203-24.
- Wong JM, et al. Dengue: A Growing Problem With New Interventions. Pediatrics. 2022;149:e2021055522.
- Yang X, et al. Global burden for dengue and the evolving pattern in the past 30 years. J Travel Med. 2021;28:taab146.
4. PALUDISMO O MALARIA
4.1. EPIDEMIOLOGÍA DE LA ENFERMEDAD
El protozoo Plasmodium es el parásito causante del paludismo (del latín paludis, genitivo de palus, “pantano”), también conocida como malaria (del italiano, mal'aria que es la contracción de mala aria, “mal aire”), enfermedad endémica en 85 países. Son transmitidos por los mosquitos hembras del género Anopheles. Hay cinco especies de Plasmodium que pueden causar paludismo en los seres humanos: falciparum, vivax, malariae, ovale y knowlesi. La infección por P. falciparum es la más frecuente, la predominante en África y responsable de la mayor morbilidad y mortalidad, mientras que P. vivax es el predominante en la región de las Américas.
La OMS define los niveles de transmisión según la incidencia de casos: los entornos de alta transmisión de paludismo son aquellos con una incidencia anual aproximada de parásitos (API) mayor a 450 casos por 1000 habitantes o una prevalencia de P. falciparum en niños de 2 a 10 años (PfPR2-10) mayor del 35 %; los entornos de transmisión moderada son aquellos con un API entre 250 y 450 casos por 1000 habitantes o entre 10 y 35 % PfPR2-10; y los entornos de baja transmisión son aquellos con un API entre 100 y 250 casos por 1000 habitantes o entre 1 y 10 % PfPR2-10. Estos umbrales son indicativos y no deben considerarse absolutos para determinar la aplicabilidad de las recomendaciones de la OMS para las intervenciones contra el paludismo.
Plasmodium necesita dos hospedadores para completar su ciclo. En el mosquito se realiza la reproducción sexual del parásito y es, por tanto, el hospedador definitivo; en el hombre se realiza la multiplicación asexual, siendo el hospedador intermediario. El ciclo comienza cuando el mosquito hembra infectado pica al humano para alimentarse de su sangre, inoculándole en el torrente sanguíneo, junto con la saliva, el estado esporozoíto del parásito o estado infectante para humanos. Por vía sanguínea los esporozoítos llegan al hígado unos 30 minutos tras su inoculación, donde se desarrollan y multiplican en las células hepáticas (esquizogonia preeritrocítica), madurando hacia el estado de esquizonte, que tras su rotura libera miles de merozoítos que pasarán al torrente circulatorio completando así el ciclo exoeritrocítico. Cada merizoíto invade un eritrocito, donde se transforma en trofozoítos, algunos de los cuales se transforman en esquizontes (fase de reproducción asexual del parásito o esquizogonia eritrocítica) y otros en gametocitos macho (microgametocitos) y hembra (macrogametocitos). En el caso de P. vivax y P. ovale los esporozoítos puede estar en las células hepáticas durante meses o años sin evolucionar, denominándose hipnozoítos. Cuando el mosquito vector pica o se alimenta de un humano infectado ingiere los eritrocitos con los gametocitos. En el estómago del insecto los gametocitos quedan libres y se forman los verdaderos gametos masculinos y femeninos. Tras producirse la fecundación, el cigoto formado evoluciona a oocineto, que penetra en el epitelio estomacal y se transforma en ooquiste que, tras varias divisiones mitóticas y una meiosis, libera miles de esporozoítos, que migran a las glándulas salivales del mosquito, de forma que el mosquito infectado al picar a un nuevo humano comienza de nuevo el ciclo. El ciclo de vida del parásito en la hembra del mosquito infectado varía en función de la temperatura: cuanto más cálido es el ambiente, más corto es el ciclo, aumentando así las posibilidades de transmisión. El ciclo suele durar entre 9-21 días a temperatura de 25 ºC; y a temperatura de 15 ºC para P. vivax o de 20 ºC para P. falciparum el ciclo no se puede completar y, por tanto, la infección no se puede transmitir.
Con las medidas de prevención, vigilancia, diagnóstico y tratamiento con antipalúdicos durante las últimas dos décadas se estima que entre los años 2000 y 2024 se evitaron 2300 millones de casos y 14 millones de muertes, la mayoría de los casos (82 %) y muertes (95 %) evitadas en la región de África de la OMS.
Según el último Informe Mundial sobre el Paludismo, en 2024 hubo 282 millones de casos (9 millones más de casos [3 %] que el año anterior) en 80 países endémicos de paludismo (incluido el territorio de la Guayana Francesa) y 610 000 muertes (12 000 más que el año anterior. Tres países: Etiopía (+2,9 millones), Madagascar (+1,9 millones) y Yemen (+378 000)- representaron el 58 % del aumento estimado de casos entre 2023 y 2024, y otros tres el 85 % del aumento de muertes por paludismo –Madagascar (+4900), Etiopía (3800) y Yemen (932)–.
Desde 2015 los casos de paludismo han aumentado un 22,6 % y los fallecimientos por esta enfermedad un 5,5 %. África soporta una fracción desproporcionadamente alta de la carga mundial de esta enfermedad, con alrededor del 94 % de los casos y el 95 % de las muertes, de las que alrededor del 78 % corresponde a niños menores de 5 años. Once países africanos representaron en 2024 casi el 70 % de los casos de paludismo a nivel mundial, correspondiendo el 49,5 % del total a tan solo cinco países: Nigeria (24,3 %), República Democrática del Congo (12,5 %), Uganda (4,7 %), Etiopía (4,4 %) y Mozambique (3,6 %), y el 51,5 % de las muertes a 4 países: Nigeria (30,3 %), República Democrática del Congo (11,1 %), Níger (5,8 %) y República Unida de Tanzania (4,3 %).
En 2022, en 33 países con transmisión moderada y alta en la Región de África de la OMS, se produjeron unos 35,4 millones de embarazos, de los cuales 12,7 millones (36 %) estuvieron expuestos a la infección por paludismo durante el embarazo. Alrededor del 64 % de las embarazadas recibieron una dosis de tratamiento preventivo intermitente durante el embarazo, el 54 % recibieron dos dosis y el 42 % recibieron tres dosis.
Entre 2000 y 2021, en la Región de las Américas, los casos de paludismo disminuyeron un 60 % (de 1,5 millones a 0,6 millones) y la incidencia un 70 % (de 14,1 a 4,2 casos por 1000 habitantes en riesgo). Durante el mismo período, las muertes por paludismo se redujeron en un 64 % (de 919 a 334) y la tasa de mortalidad un 73 % (de 0,8 a 0,2 muertes por 100 000 habitantes en riesgo), respectivamente. La República Bolivariana de Venezuela, Brasil y Colombia concentran el 79 % de todos los casos en esta región.
Desde que la OMS aprobó las primeras vacunas contra el paludismo en 2021, 24 países las han incorporado a sus programas de inmunización sistemática. La quimioprofilaxis del paludismo estacional ya se está implementando en 20 países, llegando a 54 millones de niños en 2024.
A fecha de diciembre de 2025, son 47 países y 1 territorio con la certificación de haber eliminado el paludismo (España lo consiguió en 1964 y la Región Europea de la OMS en 2015). Desde el comienzo del siglo actual hasta finales de 2023, veinticinco países habían notificado la interrupción de la transmisión del paludismo durante tres años o más, los últimos la República Islámica de Irán en 2020 y Belice y Cabo Verde en 2021. De estos, 20 han recibido la certificación de la OMS como países que han eliminado el paludismo: Emiratos Árabes Unidos (2007), Marruecos (2010), Turkmenistán (2010), Armenia (2011), Sri Lanka (2016), Kirguistán (2016), Paraguay (2018), Uzbekistán (2018), Argelia (2019), Argentina (2019), El Salvador (2021), China (2021), Azerbaiyán, Belice y Tayikistán en 2023 y en 2024, Cabo Verde el 12 de enero y Egipto el 20 de octubre, mientras que en 2025 la consiguieron Georgia (30 enero), Surinam (30 junio; primer país en la región de la amazonia en conseguir la certificación) y Timor oriental (24 julio). El Salvador fue el primer país de América Central en recibir la certificación de eliminación de paludismo de la OMS. China el 30 de junio de 2021, fue el primer país de la región del Pacífico Occidental en recibir esta certificación en más de 30 años. La República Islámica de Irán ha solicitado oficialmente a la OMS la certificación de eliminación de paludismo. Sin embargo, hubo un resurgimiento de casos en 2022, con 1439 casos tras 4 años consecutivos de cero casos autóctonos, motivado por los frecuentes movimientos fronterizos de personas, que contribuyeron a la introducción de casos y al posterior restablecimiento de la transmisión local. Los países y territorios certificados por la OMS como libres de paludismo se pueden consultar en este enlace.
Las manifestaciones clínicas dependen de la especie, del número de parásitos y del estado inmunitario del huésped. Tras un período de incubación de 1 a 4 semanas, aunque también se han observado períodos de varios meses, los primeros síntomas son parecidos a un cuadro gripal, con fiebre, dolor de cabeza, dolores musculares, cansancio, náuseas, vómitos y diarrea. Después se produce el ataque agudo con los síntomas característicos o paroxismos palúdicos, con escalofríos, fiebre y sudoración que se repiten cada 48 horas aproximadamente en el caso de P. vivax, P. ovale y P. falciparum (fiebres tercianas), o cada 72 horas aproximadamente en caso de P. malariae (fiebres cuartanas). También se produce esplenomegalia y, como consecuencia de la pérdida de glóbulos rojos, puede aparecer anemia e ictericia. P. falciparum es la especie que produce las infecciones más graves, ya que si no se trata precozmente puede llegar a causar insuficiencia renal, siendo el paludismo cerebral la complicación más importante. Su comienzo puede ser gradual y el paciente se vuelve violento y desorientado, puede sufrir cefaleas intensas, hemorragias retinianas, fibrilaciones musculares o un cuadro de meningoencefalitis que evoluciona repentinamente al coma. Hasta el 25 % de los supervivientes pediátricos de paludismo cerebral presentan secuelas neurológicas persistentes, como deterioro cognitivo, de las habilidades motoras y de la coordinación visual, así como convulsiones y trastorno por déficit de atención e hiperactividad. La anemia también puede contribuir al deterioro a largo plazo de la capacidad cognitiva. Las tasas de letalidad en casos de paludismo grave se han estimado en 13-20 % para los niños hospitalizados o >90 % si el niño permanece en casa.
En entornos de transmisión moderada a alta, el paludismo durante el embarazo es una de las principales causas de mortalidad materna (aproximadamente del 50 %), fetal, neonatal e infantil (abortos espontáneos, muerte fetal, prematuridad y bajo peso al nacer).
La presencia de fiebre en un viajero procedente de un país con riesgo de paludismo dentro de los 3 meses siguientes a su llegada, es una potencial emergencia médica que se ha de investigar con urgencia para excluir la infección por Plasmodium, de tal manera que, si no hubiera acceso a pruebas de diagnóstico rápido, está indicado el tratamiento de emergencia.
⌂
4.2. TIPOS DE INMUNIZACIÓN, COMPOSICIÓN Y PRESENTACIÓN
A pesar de los avances obtenidos de lo largo de un siglo de investigación, ha sido difícil obtener una vacuna contra el paludismo que sea altamente efectiva y capaz de inducir una inmunidad protectora duradera. Las razones para ello son varias: factores del parásito, como su complejo ciclo de vida, la respuesta inmune del huésped y la capacidad del parásito para evadir y modular la respuesta inmune humana.
Las vacunas contra el paludismo deben forman parte de una estrategia integral para el control de esta enfermedad. Todas las intervenciones, incluidas las vacunas, brindan protección parcial; el mayor impacto se logra cuando se utiliza una combinación de intervenciones (mosquiteras tratadas con insecticida, quimioprofilaxis, vacunas, etc.).
Actualmente se cuenta con dos vacunas precalificadas por la OMS (tabla 51.4) para la prevención del paludismo por P. falciparum actuando en la fase pre-eritrocícica, basadas en la proteína circumsporozoito (CSP), principal diana de los anticuerpos frente a la enfermedad al ser la proteína predominante en la capa externa del esporozoito y que desempeña un papel fundamental en la invasión de los hepatocitos (destinadas, por tanto, a limitar la capacidad de Plasmodium falciparum para infectar, madurar y multiplicarse en el hígado), combinada con el antígeno de superficie de la hepatitis B en forma de partículas similares a virus (VLP, virus like particles) no infecciosas producidas en células de levadura mediante tecnología de ADN recombinante.
Tabla 51.4. Vacunas autorizadas frente al paludismo por P. falciparum.
| Vacuna (Laboratorio) | Composición | Presentación (dosis) | Edad |
| MOSQUIRIX (GSK) |
Después de la reconstitución, 1 dosis (0,5 ml) contiene 25 microgramos de RTS,S1 adyuvado con AS01 AS01 está compuesto por Quillaja saponaria, fracción 21 (QS-21) (25 microgramos) y 3-O-desacil-4’-monofosforil lípido A (MPL) (25 microgramos). |
Cajas con 50 viales de polvo y 50 viales de suspensión (líquido opalescente, de incoloro a marrón pálido) Cada vial reconstituido, suministra 2 dosis (100 dosis por caja) |
EMA: niños entre 6 semanas y los 17 meses de edad para la primera dosis OMS: niños entre 5-17 meses para la primera dosis |
| R21/MATRIX-M1 (Serum Institute of India & University of Oxford) |
Después de la reconstitución, 1 dosis (0,5 ml) contiene 5 mcg de R21, y 50 mcg de adyuvante Matrix-M1 Matrix-M1 (Novavax) está compuesto por Matrix-A (85 partes) y Matrix-C (15 partes) con fosfolípidos y colesterol |
Cajas con 50 viales de suspensión (clara, incolora a ligeramente turbia) Cada vial reconstituido, suministra 2 dosis (100 dosis por caja). |
Niños de 5 a 36 meses para la primera dosis |
R21 comprende repeticiones centrales de Asn-Ala-Asn-Pro (NANP) y la secuencia C-terminal de CSP fusionada al antígeno de superficie de la hepatitis B (HBsAg). Se diferencia de RTS,S1 en que todas las moléculas de HBsAg están fusionadas a la repetición NANP y al extremo C-terminal de CSP, en vez del 20% de RTS,S1.
La OMS ha precalificado ambas (Mosquirix el 8 de julio de 2022, y R21/Matrix-M1 el 21 de diciembre de 2023) y recomendado su uso en regiones con transmisión de moderada a alta de paludismo por P. falciparum, especialmente en el África subsahariana. La precalificación hace que sean suministradas por la OMS y adquiridas por agencias y entidades como UNICEF y GAVI a través de un mecanismo de acceso ampliado, que permite a los países adquirir las vacunas a un precio asequible, sin necesidad de negociar directamente con los fabricantes. En el caso de Mosquirix, el mecanismo está gestionado por GAVI, la Alianza para las Vacunas, mientras que para R21/Matrix-M1 está gestionado por la OMS. Los países que participan en el mecanismo de acceso ampliado deben cumplir una serie de requisitos, como garantizar la sostenibilidad de los programas de vacunación y la disponibilidad de sistemas de vigilancia para evaluar la eficacia y la seguridad de las vacunas.
Además de Ghana, Kenia y Malawi, los 18 millones de dosis de RTS,S/AS01 suministrados por OMS, GAVI y UNICEF, ayudarán a introducir esta vacuna como sistemática en otros 9 países africanos: Benin, Burkina Faso, Burundi, Camerún, Liberia, Níger, República Democrática del Congo, Sierra Leona y Uganda. De hecho, el 22 de enero de 2024, Camerún ha sido el primer país en iniciar un programa de vacunación sistemática para niños en 42 de los distritos más afectados, con pauta de tres dosis a partir de los 5 meses de edad con un intervalo de cuatro semanas entre dosis, y un refuerzo en el segundo año de vida.
Tras la precalificación por las OMS en diciembre de 2023 de la vacuna R21, la República Centroafricana fue el primer país en recibir dosis (43 000) en mayo de 2024, mientras que el primer país en introducirla como sistemática en niños fue Costa de Marfil en julio de 2024, al recibir a través de Gavi y el apoyo de OMS, UNICEF y U.S. President´s Malaria Initiative (PMI) 656 600 dosis para vacunar a 250 000 niños de 38 distritos con mayor incidencia de paludismo en el país, estando pendiente de introducirla en los 75 distritos restantes. Posteriormente, han iniciado la vacunación sistemática Mozambique, Sudán del Sur y República Centroafricana.
Se espera que para finales de 2024 sean 15 los países africanos en haber introducido alguna de las dos vacunas frente al paludismo, con el objetivo de que para 2025 se hayan podido vacunar a 6,6 millones de niños.
⌂
4.3. INMUNOGENICIDAD, EFICACIA Y EFECTIVIDAD
RTS,S/AS01 (Mosquirix). Entre 2009 y 2014 se llevó a cabo un estudio de fase 3 controlado con placebo en más de 15 000 lactantes de 7 países africanos, divididos en dos grupos: de 6 a 12 semanas de edad, entre 5 a 17 meses. La pauta vacunal de RTS,S/AS01 constaba de cuatro dosis, para 3 grupos: grupo 1 (0, 1 y 2 meses, más un refuerzo a los 18 meses de terminar la primovacunación); grupo 2 (igual, pero a los 18 meses se administraba otra vacuna, como por ejemplo MenC) y grupo 3 (no recibieron ninguna RTS,S/A01 y sí otro tipo de vacunas). El seguimiento medio fue de 48 meses desde la primera dosis. En el grupo de 5 a 17 meses de edad, la eficacia de la vacuna durante los primeros 6 meses después de completar las 3 dosis iniciales fue del 68 %, disminuyendo con el tiempo, de tal manera que a los 6 meses de la cuarta dosis fue del 43%; por tanto, aunque la cuarta dosis extendió el período de protección, no restableció la eficacia al nivel observado después de las primeras 3 dosis. La vacuna previno aproximadamente 4 de cada 10 casos durante 4 años de seguimiento (EV del 36,3 %; IC95 %: 31,8 a 40,5) y aproximadamente 3 de cada 10 casos graves (EV del 32,2 %; IC95 %: 13,7 a 46,9), con reducciones significativas también de los ingresos hospitalarios. El número de casos evitados por cada 1000 niños de 5 a 17 meses fue de 983 (IC95 %: 592-1337) en el grupo 1 y 558 (IC95 %: 158-926) en el grupo 2. La vacuna también redujo en un 60 % los casos de anemia grave, la causa de muerte más frecuente en niños, y en un 29 % la necesidad de transfusiones de sangre. La eficacia de la vacuna contra el paludismo clínico se mantuvo positiva durante 48 meses de seguimiento y durante el seguimiento prolongado de 7 años para los niños que recibieron 3 o 4 dosis de la vacuna, mientras que la eficacia contra al paludismo grave siguió siendo positiva para los niños que recibieron el régimen de 4 dosis, pero no para aquellos que solo 3 dosis. La eficacia fue menor en los lactantes de 6-12 semanas de edad. En los niños de 5 a 17 meses, los eventos adversos graves fueron ligeramente menos frecuentes en los grupos vacunados con RTS,S/AS01 que en el grupo control. Hubo más casos de convulsiones febriles en los 7 días posteriores a la dosis de refuerzo (2,22 por 1000 dosis en lactantes de 6 a 12 semanas, y 2,5 por 1000 dosis en niños de 5 a 17 meses). Durante el ensayo se identificaron dos señales de seguridad para las que no se ha establecido la causalidad: meningitis (cualquier causa) y paludismo cerebral. En 2015, los grupos asesores de la OMS recomendaron realizar en estudio piloto para completar la información sobre la efectividad de la vacuna. En enero de 2016, la OMS asumió la necesidad de completar los estudios antes de recomendar el despliegue de la vacunación en el continente africano, y así surgió el programa piloto con RTS,S/AS01 que se puso en marcha en 2019 en Ghana, Kenia y Malawi, con la colaboración de los ministerios de salud de esos países, el PATH y GSK, y la financiación de GAVI, el Fondo Mundial para la lucha contra el SIDA, la tuberculosis y el paludismo (Global Fund) y Unitaid. El programa se cerró a finales de 2023, pero los tres países mantendrán a largo plazo sus programas de vacunación.
R21/Matrix-M1. El ensayo de fase 2b de esta vacuna se llevó a cabo en 2019, controlado y doble ciego, con 12 meses de seguimiento, en Nanoro, la capital de Burkina Faso, una región elegida por presentar un patrón tropical clásico (temporada seca y calurosa en diciembre a febrero y lluvias en verano y otoño) y estar sometida a una elevada transmisión de la infección en la temporada de lluvias, mostró una eficacia a los 12 meses tras pauta de 3 dosis más la dosis de refuerzo del 75 %. No se detectaron problemas en cuanto al perfil de reactogenicidad y seguridad. Los efectos adversos más frecuentes fueron fiebre (31 %) y dolor en el sitio de inyección (12 %). El 1 de febrero de 2024 se ha publicado los resultados del estudio en fase 3 con la participación de 4800 niños de 5 a 36 meses de edad a realizar en Burkina Faso, Kenia, Mali y Tanzania, localizaciones con distinto nivel de incidencia de la infección. La vacuna fue bien tolerada y tiene un buen perfil de seguridad. La eficacia de la vacuna durante 12 meses fue del 75% (IC95 %: 71 a 79; p<0,001) en los sitios con alta transmisión estacional de malaria y del 68% (IC95 %: 61 a 74; p<0,001) en los sitios con más transmisión perenne. Hubo cierta disminución de la eficacia durante el primer año de seguimiento en los sitios de transmisión estacional y perenne, pero una dosis de refuerzo restauró la eficacia en los sitios estacionales con una eficacia de la vacuna durante 18 meses del 74 % (IC95 %: 70 a 77; p<0,001). Se observaron títulos de anticuerpos inducidos por la vacuna significativamente más altos en el grupo de edad de 5 a 17 meses en comparación con el de 18 a 36 meses (p<0,0001). El grupo de edad más joven, en el que es más probable que se implemente ampliamente esta vacuna, mostró la mayor eficacia de la vacuna a los 12 meses tanto en los sitios estacionales, 78 % (IC95 %: 73 a 84; p<0,001), como en los perennes, 75 % (IC95 %: 65 a 83; p<0,001). Estos resultados mejoran la comprensión de cómo la eficacia de la vacuna varía con la edad y entre regiones en relación con la intensidad de la transmisión y la estacionalidad. Es la primera vacuna candidata que cumple con el objetivo del 75 % de eficacia vacunal planteado por la OMS.
⌂
4.4. VÍAS DE ADMINISTRACIÓN
Ambas vacunas se administran por vía intramuscular. Según la ficha técnica de Mosquirix, el muslo anterolateral externo es el lugar preferido para la inyección en niños menores de 5 meses de edad, y el deltoides en niños de 5 meses en adelante. Según la ficha del Serum Institute of India, R21 el muslo anterolateral externo es el lugar preferido para la inyección en niños menores de 24 meses, mientras que el músculo deltoides es el lugar preferido para la inyección en niños mayores de 24 meses.
Sin embargo, la vacuna se puede administrar en la parte anterolateral externa del muslo por vía intramuscular en niños mayores de 24 meses de edad, si no hay suficiente masa muscular en la zona deltoides.
No se deben administrar por vía intravascular, intradérmica o subcutánea.
Una vez reconstituidas, deben administrarse en un plazo máximo de 6 horas.
4.5. INDICACIONES Y ESQUEMAS DE INMUNIZACIÓN
La OMS recomienda el uso de vacunas contra el paludismo para la prevención de la malaria por P. falciparum en niños que viven en áreas endémicas de paludismo, dando prioridad a las áreas de transmisión moderada y alta. Sin embargo, los países también pueden considerar proporcionar la vacuna en entornos de baja transmisión. Las decisiones sobre ampliar la vacunación contra esta enfermedad a entornos de baja transmisión deben considerarse a nivel nacional sobre la base de la estrategia general de control del paludismo, la asequibilidad, la rentabilidad y consideraciones programáticas, como por ejemplo si la inclusión de dichas áreas simplificaría la entrega.
Las pautas de vacunación se muestran en la tabla 51.5.
Tabla 51.5. Pautas de vacunación frente al paludismo por P. falciparum.
| Vacuna (Laboratorio) | Edad de administración (vía) | N.º dosis | Dosis de refuerzo |
| MOSQUIRIX (GSK) |
EMA: niños entre 6 semanas y los 17 meses de edad para la primera dosis* OMS: niños entre 5-17 meses para la primera dosis Vía intramuscular |
Primovacunación: 3 dosis a intervalos de 4 semanas |
A los 12-18 meses tras la primovacunación |
| R21/MATRIX-M1 (Serum Institute of India & University of Oxford) |
Niños de 5 a 36 meses para la primera dosis Vía intramuscular |
Primovacunación: 3 dosis a intervalos de 4 semanas | A los 12 meses tras la primovacunación |
* No se ha establecido la seguridad y eficacia de Mosquirix en niños menores de 6 semanas y mayores de 17 meses para la primera dosis.
Se puede administrar una quinta dosis, administrada un año después de la cuarta dosis, en zonas de transmisión altamente estacional.
La serie de vacunación contra el paludismo para cada niño debe ser completarse con el mismo producto siempre que sea posible. Sin embargo, si el producto utilizado para una dosis anterior no está disponible o se desconoce, la serie debe completarse con cualquiera de las vacunas contra la misma disponibles recomendadas por la OMS. No se recomienda reiniciar la pauta de vacunación.
No se recomienda el uso de las vacunas en adultos (incluidos trabajadores sanitarios y embarazadas). La vacuna no está indicada para viajeros, quienes deben utilizar quimioprofilaxis y métodos de control de vectores para prevenir la infección cuando viajan a entornos endémicos.
⌂
4.6. ADMINISTRACIÓN CON OTRAS VACUNAS Y OTROS PRODUCTOS
Mosquirix. Puede administrarse concomitantemente con cualquiera de las siguientes vacunas monovalentes o combinadas, incluidas difteria, tétanos, tosferina de células enteras o acelular, hepatitis B, Hib, polio oral, sarampión, rubeola, fiebre amarilla, rotavirus y vacunas conjugadas neumocócicas (VNC). La coadministración de Mosquirix con VNC aumenta el riesgo de fiebre dentro de los 7 días posteriores a la vacunación. La administración concomitante de vacunas contra rotavirus o VNC con Mosquirix puede reducir la respuesta de anticuerpos al CSP, aunque se desconoce el impacto de esta observación en el nivel de protección inducido por Mosquirix.
R21/Matrix-M1. En un estudio de fase 1b, no hubo diferencias significativas en la magnitud de la respuesta IgG anti-NANP a R21 cuando se coadministra con la vacuna contra el sarampión, la rubeéola y la fiebre amarilla administrada a los 9 meses de edad. Además, las tasas de seroconversión al sarampión y la rubeola fueron similares en los participantes que recibieron la vacuna R21 junto con la vacuna contra el sarampión y la rubeola en comparación con los participantes que recibieron la vacuna R21 sola.
A falta de datos, no se puede descartar que la eficacia de ambas vacunas se vea afectada en niños que reciben tratamiento inmunosupresor.
⌂
4.7. EFECTOS ADVERSOS
Mosquirix. Las reacciones adversas notificadas con más frecuencia fueron fiebre (27 %), irritabilidad (14 %) y reacciones en el lugar de la inyección, como dolor (16 %) e hinchazón (7 %). Se notificaron convulsiones febriles en los 7 días posteriores a la vacunación en el 0,15 % de vacunados.
R21/Matrix-M1. Las reacciones adversas sistémicas notificadas con mayor frecuencia fueron fiebre (46,7 %), pérdida de apetito (3,7 %), somnolencia (2,5 %) y reacciones locales en el lugar de la inyección, como dolor (18,6 %) e hinchazón (4,1 %). Se notificaron convulsiones febriles en los 7 días posteriores a la vacunación en el 0,15 % de vacunados.
⌂
4.8. PRECAUCIONES Y CONTRAINDICACIONES
Están contraindicadas en reacción anafiláctica a una dosis anterior de estas vacunas o de una vacuna frente a la hepatitis B, así como alergia grave a algún componente incluido en las vacunas.
No hay datos en niños que reciben tratamiento inmunosupresor ni en niños con inmunodeficiencias distintas a la infección por VIH. En estos niños no se puede descartar que la eficacia se vea afectada. Se dispone de datos limitados sobre niños infectados por el VIH.
4.9. Bibliografía
- Aderinto N, et al. A perspective on Oxford's R21/Matrix-M™ malaria vaccine and the future of global eradication efforts. Malar J. 2024;23:16.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ago/2025.
- Datoo MS, et al. Efficacy of a low-dose candidate malaria vaccine, R21 in adjuvant Matrix-M, with seasonal administration to children in Burkina Faso: a randomised controlled trial. Lancet. 2021;397:1809-18.
- Datoo MS, et al. Safety and efficacy of malaria vaccine candidate R21/Matrix-M in African children: a multicentre, double-blind, randomised, phase 3 trial. Lancet. 2024;403:533-44.
- Duffy PE, et al. Malaria vaccines since 2000: progress, priorities, products. NPJ Vaccines. 2020;5:48.
- El-Moamly AA, et al. Malaria vaccines: the 60-year journey of hope and final success—lessons learned and future prospects. Trop Med Health. 2023;51:29.
- EMA. Ficha técnica de Mosquirix. [Internet].
- Laurens MB. RTS,S/AS01 vaccine (Mosquirix™): an overview. Hum Vaccin Immunother. 2020;16:480-89.
- OMS. Vacunas antipalúdicas (RTS,S y R21). Preguntas y respuestas. 17 enero de 2024. [Internet].
- Stanisic DI, et al. Malaria Vaccines: Progress to Date. BioDrugs. 2023;37:737-56.
- Serum Institute of India. R21 malaria vaccine. Product information. [Internet].
- Willyard C. The slow roll-out of the world’s first malaria Vaccine. Nature. 2022;612:S48-9.
- WHO. Countries and territories certified malaria-free by WHO. 15 July 2025.
- WHO. Malaria vaccine: WHO position paper – May 2024. Weekly Epidemiological Record. 2024;99:225-48.
- WHO. Mosquirix. Product Information. [Internet].
- WHO. Review of malaria vaccine clinical development. November 2022. [Internet].
- WHO. World malaria report 2025. [Internet].
5. CHIKUNGUÑA
5.1. EPIDEMIOLOGÍA DE LA ENFERMEDAD
La enfermedad por el virus Chikungunya o Chikunguña (CHIKV) o fiebre del Chikunguña (CHIKF) es transmitida por mosquitos del género Aedes, en especial Aedes aegypti y Aedes albopictus. En la lengua africana makonde, chikunguña significa “doblarse por el dolor”, debido a que las personas que la padecen suelen caminar encorvadas por las fuertes artralgias que provoca. El virus tiene un importante tropismo por el músculo esquelético, las articulaciones y la piel, aunque es capaz de infectar una gran variedad de tipos celulares, como epitelios, endotelios, fibroblastos, osteoblastos, hepatocitos, neuronas y células de la glía.
Es un virus ARN perteneciente al género Alfavirus de la familia Togaviridae. A partir de análisis filogenéticos se identificaron cuatro genotipos que fueron denominados según su origen geográfico, como el del oeste de África (WA), este-centro y sur de África (ECSA), el asiático y el del océano Índico (IOL).
Fue descrita en Tanzania por primera vez en 1952 durante una epidemia de enfermedad febril. En los años 60, la enfermedad llegó a Asia y causó brotes en India, Sri Lanka y Tailandia; luego, se extendió a Filipinas e Indonesia en los 80 y, al final de los 90, a Malasia. Entre el 2001 y el 2009, la enfermedad resurgió en numerosos lugares del sureste asiático, en el este y sur de África, en las islas del océano Índico y por primera vez se detectó en Europa. El mayor riesgo de infección se encuentra en las regiones tropicales y subtropicales de África, el sudeste asiático y partes de América donde los mosquitos portadores del CHIKV son endémicos.
La primera gran epidemia ocurrió en la isla Reunión en 2005 y 2006, donde afectó a más de un tercio de la población y causó la muerte de 250 personas. A finales del 2013, se documentaron los primeros casos de la enfermedad en las Américas, en la isla Saint Martin. En diciembre de 2013, una gran epidemia de fiebre chikunguña, afectó al Caribe, América Central y del Sur, causada por el genotipo asiático del virus, donde se notificaron más de 1,5 millones de casos de la enfermedad en más de 20 países. En América entre 2013 y 2017 el número de casos acumulados ascendió a cerca de 2,7 millones, siendo Brasil, Colombia, Costa Rica, Guadalupe y República Dominicana los países más afectados, y desde 2018 hasta 2023 se han notificado otros 2,4 millones de casos, 400 000 en 2023, siendo los países con más incidencia Brasil (257 000 casos) y Paraguay (140 000). Todos los fallecidos por la enfermedad (403) fueron en estos países, 106 en Brasil y 297 en Paraguay. En 2024 se notificaron en América 431 000 casos, casi todos en el Cono Sur, destacando Brasil con 425 000 casos.
El 75-90 % de los infectados son sintomáticos. La enfermedad se manifiesta a los 4-8 días de la picadura del mosquito infectado, con fiebre alta de inicio súbito, cefalea, poliartralgias, artritis y exantema maculopapular, entre otros signos y síntomas. La viremia desaparece después de dos semanas y, con ella, la mayoría de los síntomas. Cuando los dolores articulares persisten por más de tres meses, se considera alcanzada la fase crónica (hasta en el 25-50 % de infectados), conocida también como reumatismo inflamatorio crónico poschikunguña, pudiendo deberse por la persistencia del virus en las articulaciones o por desequilibrio entre la reacción inmunitaria proinflamatoria y la antiinflamatoria. Además de la artritis, las principales complicaciones son las neurológicas (encefalopatías y encefalitis, mielopatías y mielitis, síndrome de Guillain- Barré, enfermedades neuro-oculares) y el síndrome de fatiga crónica.
Tras pasar la enfermedad, según la evidencia disponible hasta el momento, se generan anticuerpos que protegen de por vida.
Los grupos que tienen un mayor riesgo de sufrir una enfermedad grave son los recién nacidos, personas mayores y personas inmunocomprometidas, pudiendo provocar un rápido deterioro con insuficiencia multiorgánica y muerte. La infección congénita y perinatal se ha evidenciado desde la epidemia de la isla Reunión y en varios países de la región de las Américas.
⌂
5.2. TIPOS DE INMUNIZACIÓN, COMPOSICIÓN Y PRESENTACIÓN
Hay 2 vacunas disponibles frente al chikunguña:
- Una vacuna viva atenuada (IXCHIQ), fabricada por Valneva, que fue la primera vacuna contra el chikungunya autorizada por la FDA y la EMA
- Una vacuna de partículas similares a virus (VLP, por sus siglas en inglés) (VIMKUNYA), fabricada por Bavarian Nordic, también aprobada por ambas agencias reguladoras
IXCHIQ contiene CHIKV atenuado basado en el linaje este-centro y sur de África (ECSA) y generado mediante genética inversa a partir del clon LR2006 OPY1 de la cepa LRCHIKV de La Reunión. El virus atenuado tiene una deleción en la proteína no estructural 3 (nsP3), que codifica un componente del complejo viral de replicasa, y se replica con menos eficiencia que el CHIKV de tipo salvaje.
VIMKUNYA contiene proteínas de partículas seudovirales (VLP) 1 y 2 derivadas de la cepa Senegal 37997 del CHIKV constituidas por la proteína de la cápside y por las proteínas de la envoltura E1 y E2. Están producidas en células renales embrionarias humanas mediante tecnología de DNA recombinante.
La composición y presentación de ambas vacunas puede consultarse en la tabla 51.6.
Tabla 51.6. Vacunas autorizadas frente al virus chikunguña.
| Vacuna (Laboratorio) | Composición | Presentación (dosis) | Edad |
| IXCHIQ (Valneva) |
Después de la reconstitución, 1 dosis (0,5 ml) contiene no menos de 3,0 log10 TCID50 (dosis infecciosa en cultivo de tejidos al 50 %) de CHIKV vivo atenuado También contiene 0,05 mg de albúmina humana recombinante, 25 mg de sacarosa, 2,5 mg de D-sorbitol, 0,75 mg de L-metionina, 0,51 mg de cloruro de magnesio hexahidrato, 3,68 mg de citrato trisódico dihidrato, 0,313 mg de hidrogenofosfato dipotásico y 0,098 mg de albúmina humana recombinante. mg de dihidrogenofosfato de potasio Cada dosis puede contener cantidades residuales de proteínas de células Vero (menos de 5 ng/dosis), ADN de células Vero (menos de 10 pg/dosis), albúmina sérica bovina (menos de 500 pg/dosis) y sulfato de protamina (menos de 1 mcg /dosis) |
Caja con un vial de antígeno liofilizado vivo (polvo de color blanco a ligeramente amarillento) y una jeringa precargada no graduada con diluyente (agua estéril) Después de la reconstitución, es una solución transparente, de incolora a ligeramente amarillenta Empaquetada sin agujas |
FDA: personas a partir de 18 años con riesgo alto de exposición al CHIKV. Suspendida la licencia el 22/08/2025 EMA: aprobada para la prevención de la enfermedad causada por CHIKV en personas de entre 12 y 64 años de edad |
| VIMKUNYA (Bavarian Nordic) |
Una dosis (0,8 ml) contiene 40 microgramos de VLP, adsorbidas en hidróxido de aluminio hidratado (aproximadamente 300 microgramos de Al3+ por dosis) También contiene sacarosa, fosfato de dipotasio, dihidrogenofosfato de potasio, citrato de sodio y agua para preparaciones inyectables |
Jeringa precargada unidosis con: cilindro de vidrio (vidrio de tipo I), adaptador de bloqueo de Luer (policarbonato), cápsula de cierre rígida (polipropileno transparente), cierre de seguridad de caucho (mezcla de isopreno-bromobutilo), pistón de caucho (caucho de clorobutilo), vástago del émbolo (polipropileno blanco) y reborde de sujeción (polipropileno blanco) Antes de agitar, la vacuna es un líquido transparente con un precipitado de color blanco Empaquetada sin aguja |
Aprobada por FDA y EMA para la prevención de la enfermedad causada por CHIKV en personas a partir de 12 años |
⌂
5.3. 3 INMUNOGENICIDAD, EFICACIA Y EFECTIVIDAD
El estudio pivotal fase 3 sobre el que se basó la aprobación acelerada de IXCHIQ se realizó en Estados Unidos en 4115 adultos sanos de 18 o más años de edad. Los resultados fueron presentados en marzo de 2022 y publicados en junio de 2023. La eficacia de IXCHIQ contra la enfermedad causada por CHIKV se basó en una evaluación de la serorrespuesta definida como un nivel de anticuerpos neutralizantes anti-CHIKV por encima de un umbral (título de μPRNT50 ≥150). Este umbral se derivó de un modelo de primate no humano. La imunogenicidad se hizo en un subgrupo de 266 participantes mientras que la seguridad se estudió en todos. Tras una dosis única, 28 días después la vacuna, esta indujo en los participantes niveles seroprotectores de anticuerpos neutralizantes del CHIKV en el 98,9 % (IC95 %: 96,7 a 99,8), sin diferencias según edad. El 96 % de los participantes mantuvieron la respuesta serológica seis meses después de la vacunación.
La aprobación acelerada de VIMKUNYA se basó en los resultados de dos ensayos clínicos de fase 3 que inscribieron a más de 3500 personas sanas de 12 años o más. Los criterios de valoración primarios se cumplieron en los ensayos de fase 3, y los resultados mostraron que 21 días después de la vacunación, VIMKUNYA indujo anticuerpos neutralizantes en hasta el 97,8 % de las personas vacunadas y demostró una respuesta inmunitaria rápida (el 46,6 % generó anticuerpos a la semana y el 96,8 % a las 2 semanas). A los 6 meses, el 85,5 % de las personas de 12 a 64 años todavía tenían una respuesta serológica, junto con el 75,5 % de las personas de 65 años o más. La vacuna fue bien tolerada y los eventos adversos fueron principalmente de naturaleza leve o moderada.
⌂
5.4. VÍAS DE ADMINISTRACIÓN
Amabs vacunas se administran por vía intramuscular (en el músculo deltoides).
5.5. INDICACIONES Y ESQUEMAS DE INMUNIZACIÓN
La FDA aprobó IXCHIQ el 9 de noviembre de 2023, para uso en personas a partir de 18 años con riesgo alto de exposición al CHIKV, mientras que el 14 de febrero de 2025 aprobó VIMKUNYA para su uso a partir de los 12 años. La pauta de ambas es de una única dosis.
Las recomendaciones del ACIP (28 febrero de 2024) para el uso de IXCHIQ son: personas mayores de 18 años que viajen a un país o territorio donde hay un brote de chikungunya; además, se puede considerar la vacuna para las siguientes personas que viajen a un país o territorio sin un brote, pero con evidencia de transmisión del CHIKV entre humanos en los últimos 5 años: personas mayores de 65 años, en particular aquellas con afecciones médicas subyacentes, que probablemente tengan una exposición moderada a los mosquitos durante, al menos, 2 semanas, o personas mayores de 18 años que permanezcan por un período acumulado de 6 meses o más en esas zonas de transmisión.
Las recomendaciones del ACIP (abril de 2025) para VIMKUNYA son: personas ≥12 años que viajen a un país o territorio donde hay un brote de chikunguña; además, se puede considerar la vacuna para las siguientes personas ≥12 años que viajen a un país o territorio sin un brote, pero con un riesgo elevado para los viajeros estadounidenses si planean viajar durante un período prolongado de tiempo, por ejemplo, 6 meses o más.
El ACIP también recomienda cualquiera de ellas para los trabajadores de laboratorio con potencial de exposición al CHIKV.
El 9 de mayo de 2025, la FDA restringió el uso de IXCHIQ a personas de 18 a 59 años, mientras se llevaba a cabo una revisión de seguridad (ver apartado 5.7). El 9 de agosto, se levantó la restricción de uso en personas de 60 años o más, con indicación para personas con alto riesgo de contraer la enfermedad. Para los viajeros, los factores a considerar incluyen el nivel de actividad de la enfermedad en el destino, la duración del viaje o la residencia y la probabilidad de exposición a los mosquitos. Los CDC advierten que la vacunación no es aconsejable para la mayoría de los viajeros estadounidenses, ya que el riesgo de exposición al CHIKV es bajo.
La Comisión Europea autorizó IXCHIQ el 28 de junio de 2024, con indicación de uso entre 18 y 64 años, y VIMKUNYA el 28 de febrero de 2025 (indicada a partir de los 12 años). ). VIMKUNYA está disponible en oficinas de farmacia en España desde noviembre de 2025.
El 7 de mayo de 2025 la EMA anunció una restricción temporal para su uso en personas de 65 años o más, mientras se hacía una revisión de seguridad (ver apartado 5.7). El 11 de julio, tras terminar el Comité de Seguridad (PRAC) la revisión, la EMA anunció que se levantará la restricción temporal sobre la vacunación de personas de 65 años o más. Sin embargo, el Comité concluyó que, para personas de todas las edades, la vacuna solo debe administrarse cuando existe un riesgo significativo de infección por chikunguña y después de una cuidadosa consideración de los beneficios y riesgos. Por el momento, la ficha técnica (última actualización en mayo de 2025) sigue indicándola para personas entre 12 y 64 años. Unos días más tarde, el 22 de agosto, el Centro de Evaluación e Investigación de Productos Biológicos de la FDA (CBER) anunció la suspensión de la licencia de IXCHIQ, tras registrar una muerte por encefalitis directamente atribuible a la vacuna, comunicándose más de 20 eventos adversos graves compatibles con una enfermedad similar al chikunguña, con 21 hospitalizaciones y 3 fallecimientos. El 19 de enero de 2026, la compañía anunció que retiraba voluntariamente la solicitud de licencia de productos biológicos (BLA) y la solicitud de nuevo medicamento en investigación (IND) para su vacuna en Estados Unidos, al ser informada de la decisión de la FDA de suspender la IND a la espera de la investigación de un nuevo evento adverso grave notificado en el extranjero.
El 22 de diciembre de 2025, la Sociedad Española de Medicina del Viajero (SEMEVI) y la Asociación Española de Vacunología (AEV) publicaron un posicionamiento sobre vacunación frente a la infección por el virus chikunguña:
- la vacunación debería indicarse o ser considerada en :
- viajeros a zonas de brotes activos (especialmente si la estancia es mayor de 1 mes o la exposición se prevé elevada)
- viajeros que presenten un mayor riesgo de enfermedad crónica o grave (≥65 años, enfermedades crónicas, inmunodeprimidos, embarazadas): si el riesgo de exposición es significativo y tras valorar beneficio-riesgo individual.
- viajeros de larga estancia (>6 meses) o viajeros frecuentes a países que hayan presentado transmisión local de CHIKV en los últimos cinco años. Si la transmisión local está descrita de forma sostenida en el destino en los últimos años, se considerará la indicación en viajeros de estancias menos prolongadas, entre 1 y 6 meses
- personal de laboratorio que manipule muestras del virus
- Dado el riesgo muy bajo para viajeros y la existencia de una vacuna VLP con mejor perfil de seguridad, es razonable favorecer la vacuna VLP para viajeros mayores, personas con comorbilidades y embarazadas
- La vacunación no está indicada en individuos con antecedente documentado de infección. No obstante, no existe contraindicación en administrar la vacuna si se desconoce el estado serológico, ya que la determinación de IgG no debe considerarse requisito previo para la toma de decisión
⌂
5.6. ADMINISTRACIÓN CON OTRAS VACUNAS Y OTROS PRODUCTOS
No hay datos de coadministración con otras vacunas o productos con ninguna de las dos vacunas.
⌂
5.7. EFECTOS ADVERSOS
En los estudios clínicos de IXCHIQ, la reacción local más común fue dolor en el sitio de inyección (10,6 %). Las reacciones adversas sistémicas más comunes fueron cefalea (31,6 %), cansancio (28,5 %), mialgia (23,9 %), artralgia (17,2 %), fiebre (13,5 %) y náuseas (11,2 %).
Se produjeron reacciones adversas graves similares a la enfermedad de chikunguña (chikungunya-like) que impidieron la actividad diaria o requirieron intervención médica en el 1,6 % de las personas que recibieron IXCHIQ, y en ninguna de las personas receptoras de placebo. Por este motivo, la FDA requiere que la compañía realice un estudio poscomercialización para evaluar este riesgo. Dos vacunados con reacciones adversas graves similares a la chikunguña fueron hospitalizados. Además, algunos vacunados presentaron reacciones adversas prolongadas similares a la chikunguña que duraron, al menos, 30 días. A nivel mundial, se han comunicado 17 efectos adversos graves en personas de entre 62 y 89 años que recibieron la vacuna, dos de ellos mortales, ambos en la Isla Reunión: uno por encefalitis y otro por neumonía por aspiración en enfermo de Parkinson donde empeoró la capacidad de tragar tras la vacunación.
A finales de abril de 2025, las autoridades reguladoras farmacéuticas francesas actualizaron sus recomendaciones para IXCHIQ tras los informes de reacciones adversas en personas mayores con afecciones subyacentes, a quienes se les dio prioridad para recibir la vacuna en un gran brote en curso en La Reunión y Mayotte. El 7 de mayo, la EMA anunció que su comité de seguridad había iniciado una revisión de Ixchiq en personas mayores y declaró que la vacuna no debe utilizarse en personas de 65 años o más. El 11 de julio, la EMA anunció que levantará esa restricción de edad para la vacunación.
El 9 de mayo de 2025, la FDA y los CDC recomendaron suspender el uso de IXCHIQ en personas de 60 años o mayores mientras se investigaban los efectos adversos graves, algunos de tipo neurológico y cardíaco, en los vacunados. La suspensión recomendada del uso en personas mayores de 60 años se produjo tras una alerta de los CDC a principios de marzo, que indicaba que estaban investigando cinco hospitalizaciones en personas mayores de 65 años que habían recibido la vacuna. Esta restricción se levantó el 9 de agosto.
En los ensayos clínicos de VIMKUNYA, las reacciones adversas solicitadas más comunes (>10 %) en personas de 12 a 64 años de edad fueron dolor en el lugar de la inyección (23,7 %), cansancio (19,9 %), dolor de cabeza (18 %) y mialgia (17,6 %). Las reacciones adversas solicitadas notificadas con mayor frecuencia (>5 %) en personas de 65 años o más fueron dolor en el lugar de la inyección (5,4 %), mialgia (6,3 %) y cansancio (6,3 %).
⌂
5.8. PRECAUCIONES Y CONTRAINDICACIONES
IXCHIQ está contraindicada en inmunodeprimidos o personas en tratamiento con terapia inmunosupresora, y en personas con anafilaxia a algún componente de la vacuna.
En un estudio que evaluó si el virus de la vacuna estaba presente en la sangre después de la vacunación, a la mayoría de las personas se les detectó el virus de la vacuna en la sangre dentro de la primera semana tras de la vacunación, mientras que no se detectó 14 días después de la vacunación. La información del producto incluye una advertencia para informar que no se sabe si el virus de la vacuna puede transmitirse de personas embarazadas a recién nacidos, ni si el virus de la vacuna puede causar algún efecto adverso en el recién nacido. La advertencia también comunica que, al considerar la administración de la vacuna a las mujeres embarazadas, los proveedores de atención médica deben tener en cuenta el riesgo por la exposición al CHIKV, la edad gestacional y los riesgos para el feto o el recién nacido debido a la enfermedad causada por el CHIKV en la mujer embarazada.Se desconoce si se excreta en la leche materna. No se han realizado estudios específicos sobre la fertilidad.
VIMKUNYA está contraindicada en hipersensibilidad grave al principio activo o a alguno de los excipientes. No se han evaluado la seguridad y eficacia en pacientes con inmunodeficiencia ni en pacientes que estén recibiendo tratamientos inmunosupresores sistémicos. Se dispone de datos limitados respecto su uso en embarazadas. La decisión de administrarla durante el embarazo debe tener en cuenta el riesgo de exposición de la persona al CHIKV natural, la edad gestacional y los riesgos para el feto o el neonato. Se desconoce si se excreta en la leche materna. No se han realizado estudios específicos sobre la fertilidad.
⌂
5.9. Bibliografía
- Bettis AA, et al. The global epidemiology of chikungunya from 1999 to 2020: A systematic literature review to inform the development and introduction of vaccines. PLoS Negl Trop Dis. 2022;16:e0010069.
- Calvo EP, et al. Rediscovering the chikungunya virus. Biomedica. 2021;41:353-73.
- Cherian N, et al. Strategic considerations on developing a CHIKV vaccine and ensuring equitable access for countries in need. NPJ Vaccines. 2023;8:123.
- de Lima Cavalcanti TYV, et al. A Review on Chikungunya Virus Epidemiology, Pathogenesis and Current Vaccine Development. Viruses. 2022;14:969.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ago/2025.
- FDA. US FDA’s Center for Biologics Evaluation and Research has suspended the biologics license for Valneva Austria GmbH’s live-attenuated IXCHIQ. August 22, 2025.
- Ficha técnica de IXCHIQ (FDA). [Internet].
- Ficha técnica de IXCHIQ (EMA). [Internet].
- Ficha técnica de VIMKUNYA (FDA). [Internet].
- Ficha técnica de VIMKUNYA (EMA). [Internet].
- Freedman DO. A new non-live chikungunya vaccine for travellers. J Travel Med. 2025;32:taaf039.
- Hamer MJ, et al. Safety and immunogenicity of an adjuvanted chikungunya virus virus-like particle (CHIKV VLP) vaccine in previous recipients of other alphavirus vaccines versus alphavirus vaccine-naive controls: an open-label, parallel-group, age-matched, sex-matched, phase 2 randomised controlled study. Lancet Microbe. 2025;6:101000.
- Ly H. Ixchiq (VLA1553): The first FDA-approved vaccine to prevent disease caused by Chikungunya virus infection. Virulence. 2024;15:2301573.
- McCarty JM, et al. Chikungunya virus virus-like particle vaccine is well tolerated and immunogenic in chikungunya seropositive individuals. Vaccine. 2023;41:6146-9.
- PAO. Chikungunya. [Internet].
- Raju S, et al. A chikungunya virus-like particle vaccine induces broadly neutralizing and protective antibodies against alphaviruses in humans. Sci Transl Med. 2023;15:eade8273.
- Richardson JS, et al; EBSI-CV-317-004 Study Group. Chikungunya virus virus-like particle vaccine safety and immunogenicity in adolescents and adults in the USA: a phase 3, randomised, double-blind, placebo-controlled trial. Lancet. 2025;405:1343-52.
- Richardson JS, et al. 2888. Safety and Immunogenicity of an Adjuvanted Chikungunya Virus (CHIKV) Virus-like Particle (VLP) Based Vaccine in Two Pivotal Phase 3 Trials, ≥12 Years of Age. Open Forum Infect Dis. 2023;10(Suppl 2):ofad500.2471.
- Roongaraya P, et al. Chikungunya vaccines: An update in 2023. Asian Pac J Allergy Immunol. 2023;41:1-11.
- SEMEVI y AEV. Posicionamiento SEMEVI-AEV. Indicaciones y pautas de vacunación frente a la infección por el virus chikungunya para viajeros. 11 de diciembre de 2025.
- Schneider M, et al. Safety and immunogenicity of a single-shot live-attenuated chikungunya vaccine: a double-blind, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2023;401:2138-47.
- Stephenson KE. Live-attenuated Chikungunya vaccine: a possible new era. Lancet. 2023;401:2090-1.
- Torres JR, et al. Congenital and perinatal complications of chikungunya fever: a Latin American experience. Int J Infect Dis. 2016;51:85-8.
- Weber WC, et al. Chikungunya Virus Vaccines: A Review of IXCHIQ and PXVX0317 from Pre-Clinical Evaluation to Licensure. BioDrugs. 2024;38:727-42.
- WHO. Health topics. Chikungunya. [Internet].
6. Enlaces de interés
- ANDAVAC. Vacunación para viajeros internacionales
- CDC. Travelers Health. Yellow Book 2026
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles
- European Centers for Disease Prevention and Control. Mosquito-borne diseases
- European Centers for Disease Prevention and Control. Tick-borne diseases
- Ministerio de Sanidad. Plan Nacional de Prevención, Vigilancia y Control de las Enfermedades Transmitidas por Vectores (abril 2023)
- Ministerio de Sanidad. Sanidad Exterior. Centros de Vacunación Internacional
- National Travel Health Network and Centre (NaTHNac)
- OPS/PAHO. Cambio climático y salud
- OPS/PAHO. Enfermedades desatendidas, tropicales y transmitidas por vectores
- WHO. Fact sheets
- WHO guidelines for clinical management of arboviral diseases: dengue, chikungunya, Zika and yellow fever. Geneva: World Health Organization; 2025
- WHO. Global Arbovirus Initiative
7. Historial de actualizaciones
| 4 de marzo de 2024 | Creación de todos los apartados del capítulo |
| 16 de mayo de 2024 | Dengue. Creación del subapartado "Recomendaciones de vacunación" con una nueva tabla 51.3. Nuevas citas bibliográficas. Paludismo o malaria. Revisión de todos los apartados y nueva cita bibliográfica |
| 7 de agosto de 2024 | Actualización del subapartado "Epidemiología de la enfermedad" del dengue; del suabapartado "Indicaciones y esquemas de vacunación" del paludismo o malaria y de la chikunguña. Nuevas citas bibliográficas. |
| 22 de octubre de 2024 | Pequeños cambios en el subapartado "Epidemiología de la enfermedad" del paludismo |
| 14 de mayo de 2025 | Actualización del apartado "Chikunguña" |
| 20 de agosto de 2025 | Actualización del apartado "Paludismo" con los países libres del mismo |
| 22 de agosto de 2025 | Actualización del apartado "Dengue" con una nueva figura y del apartado "Chikunguña" en todos sus subapartados con nueva vacuna VIMKUNYA y la suspensión de IXCHIQ en EE. UU. Nuevos enlaces de interés |
| 10 de noviembre de 2025 | Actualización del apartado "Dengue" en los subapartados "Epidemiología de la enfermedad", "Tipos de vacunas, composición y presentación" y "Inmunogenicidad, eficacia y efectividad" |
| 1 de enero de 2026 | Actualización del apartado "Dengue" en los subapartados "Epidemiología de la enfermedad", "Tipos de vacunas, composición y presentación" y "Efectos adversos" y del apartado "Chikunguña" en el subapartado "Indicaciones y esquemas de vacunación". Nuevas citas bibliográficas |
-oOo-