Para evitar confusiones, le informamos de que ESTE NO ES el formulario para enviar PREGUNTAS SOBRE VACUNAS al comité. Si esa fuera su intención, diríjase a la sección de preguntas de profesionales o de preguntas de familias.
A través de este formulario, el responsable del mismo, la Asociación Española de Pediatría (AEP) y su Comité Asesor de Vacunas, recaba los datos necesarios para gestionar el envío de sus comentarios y sugerencias sobre el Manual de Inmunizaciones en línea de la AEP, que ponemos a su disposición en nuestra página web.
Los campos marcados con asterisco son obligatorios y, sin ellos, no se tramitará su comentario o sugerencia.
Este tratamiento de datos no puede realizarse sin su consentimiento, por lo que deberá validar la casilla de protección de datos antes de enviar la consulta.
Sus datos no serán cedidos a otras entidades, ni transmitidos a otros países. Tiene derecho a acceder, rectificar y suprimir los datos, así como otros derechos, como se explica en la información común a los tratamientos que efectúa la AEP.
Puede consultar la información detallada sobre protección de datos, así como la información común a los tratamientos que efectúa la AEP.
48. Inmunología e inmunizaciones
CAPÍTULO 48 - INMUNOLOGÍA E INMUNIZACIONES
- Puntos clave
- Introducción: la razón de las vacunas
- Componentes del sistema inmunitario: innato y adquirido
3.1. El sistema inmune innato: inmediato, pero inespecífico y sin memoria
3.2. El sistema inmune adquirido: altamente específico y con capacidad de recordar para mejorar la respuesta
5.1. La inyección da la señal de alarma
5.2. Acontecimientos en el ganglio linfático
5.3. Respuesta de los linfocitos B
5.4. Respuesta de los linfocitos T
5.5. La vía mucosa
6.1. Mediadores de protección inducidos por las vacunas
6.2. Correlatos de protección inducidos por las vacunas
7.1. Características de la respuesta de los linfocitos B de memoria
7.2. Características de la respuesta de los linfocitos T de memoria
7.3. Diferencias entre inmunidad protectora y memoria inmunológica
8.1. Memoria inmunológica
8.2. El concepto de “inmunidad entrenada”
8.3. BCG e inmunidad entrenada
8.4. Inducción de inmunidad entrenada para luchar frente a las infecciones
9.1. Introducción
9.2. ¿Qué son los adyuvantes?
9.3. Funcionamiento y mecanismos de acción de los adyuvantes
9.4. Principales adyuvantes utilizados en las vacunas actuales
9.5. Nuevos adyuvantes en desarrollo y uso reciente
9.6. Adyuvantes del futuro y necesidades no cubiertas
9.7. Conclusiones
10.1. El sistema inmunitario materno y fetal
10.2. Impacto de la vacunación materna en el sistema inmunitario en los primeros años de vida
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figuras incluidas en el capítulo:
Tabla 48.1. Funciones y distribución de los principales isotipos de inmunoglobulinas en el ser humano
Tabla 48.2. Mecanismos efectores inducidos por las vacunas
Tabla 48.3. Correlatos de protección inducidos por las vacunas
Tabla 48.4. Características de las respuestas de los linfocitos B de memoria
Tabla 48.5. Características de las respuestas de los linfocitos T de memoria
Tabla 48.6. Principales adyuvantes vacunales: mecanismos de acción y respuestas inmunitarias
Figura 48.1. Principales células del sistema inmunitario innato y adquirido
Figura 48.2. Iniciación de la respuesta inmunitaria a la vacuna
Figura 48.3. Respuesta inmunitaria primaria y secundaria al patógeno o antígeno vacunal
Figura 48.4. Diferentes fases de la respuesta inmunitaria: respuesta primaria, inmunidad protectora, memoria inmunológica y respuesta secundaria
Figura 48.5. Mecanismos celulares y moleculares de la inmunidad entrenada
Figura 48.6. Esquema de funcionamiento propuesto de la vacuna BCG frente a otras infecciones virales
Figura 48.7. Mecanismo de acción de los adyuvantes a través de las tres señales de activación de la respuesta inmunitaria (presentación del péptido antigénico, señales de co-estimulación y microambiente inflamatorio)
Figura 48.8. Mecanismo de acción de los adyuvantes
Figura 48.9. Esquema de los mecanismos celulares activados por el adyuvante AS01, combinación de MPL y QS-21
Figura 48.10. Anticuerpos maternos a través de la placenta y de la lactancia materna
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunología e inmunizaciones. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-48
1. PUNTOS CLAVE
- Nuestro sistema inmunitario está organizado en un sistema inmune innato y un sistema inmune adquirido.
- El sistema inmune innato es de rápida respuesta, pero altamente inespecífico y no genera memoria. El sistema inmune adquirido es de respuesta lenta, con alta especificidad y genera memoria inmunológica.
- El componente celular de la inmunidad innata lo forman las células fagocíticas (principalmente neutrófilos, macrófagos y células dendríticas) mientras que el componente humoral está constituido por las proteínas del sistema del complemento.
- El componente celular de la inmunidad adquirida incluye los linfocitos T (linfocitos T-CD4+ o T colaboradores y linfocitos T-CD8+ o T citotóxicos) y los linfocitos B, mientras que el componente humoral lo forman los anticuerpos o inmunoglobulinas.
- Las células natural killer (NK) forman un tipo especial de linfocitos “inespecíficos”, a medio camino entre el sistema innato y adquirido.
- Nuestro sistema inmunitario se organiza en el tejido linfoide periférico, que incluye los ganglios linfáticos, el bazo y el tejido no encapsulado de las mucosas (MALT).
- La respuesta inmunitaria a las vacunas se inicia tras la inyección, que supone la señal de alarma, mediante la liberación de alarminas en la piel.
- Las células dendríticas transportan el antígeno vacunal al ganglio linfático para su presentación a los linfocitos T-CD4+.
- Tras la activación del linfocito T-CD4+ se inicia la respuesta inmunitaria adquirida, con la generación de células efectoras (células T citotóxicas y células plasmáticas) y células de memoria.
- En la vía mucosa, la respuesta inmunitaria es similar a la sistémica y el reconocimiento se realiza en estructuras similares al ganglio, como por ejemplo las placas de Peyer a nivel intestinal.
- Los mediadores de protección generados tras la vacunación son, por un lado, los anticuerpos creados por las células plasmáticas y, por otro lado, los linfocitos T efectores: T citotóxicos y T colaboradores (que se subdividen en Tfh, Th1, Th2, Th9 y Th17).
- La memoria inmunológica permite, tras el primer encuentro, responder de forma más rápida, más eficiente y con mayor afinidad en los siguientes encuentros con el antígeno.
- La memoria inmunológica es dependiente de la intervención de los linfocitos T (respuesta T-dependiente).
- Se debe destacar la diferencia entre la inmunidad protectora (presencia de efectores en circulación) y la memoria inmunológica (sin efectores en circulación, pero con células de memoria).
- Los adyuvantes incluidos en el diseño de las vacunas no-vivas tienen una función primordial, que es modular la activación del sistema inmune innato e iniciar la respuesta inmunitaria.
- Las vacunas vivas no precisan de adyuvantes, al contener múltiples señales asociadas al patógeno que activan directamente la inmunidad innata.
- La inmunización maternal protege al neonato en el período posnatal temprano, cuando el riesgo de infecciones es mayor.
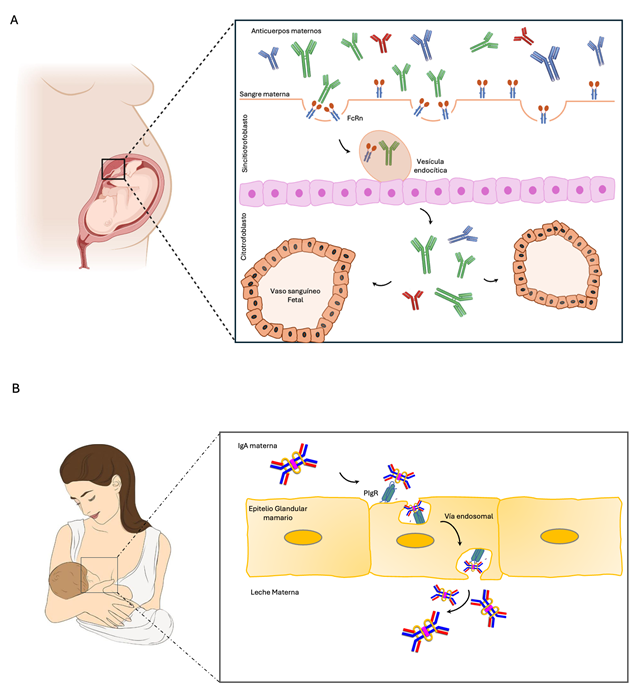
- Los anticuerpos maternos se transfieren en los últimos meses del embarazo a través de la placenta (principalmente IgG) y tras el parto, a través de la lactancia materna (principalmente IgA).
- Se ha demostrado presencia de células inmunitarias maternas (microquimerismo) en la sangre fetal que ejercerían una función de entrenamiento de las células inmunitarias neonatales.
- Contamos con diversas vacunas de administración a la mujer embarazada con excelentes perfiles de seguridad y efectividad demostrados.
2. INTRODUCCIÓN: LA RAZÓN DE LAS VACUNAS
Vivimos en un mundo potencialmente hostil, expuestos a un gran número de agentes infecciosos de formas, tamaños y peligrosidad diversa, dispuestos a utilizar al ser humano como huésped para su perpetuación. En contrapartida, el ser humano ha desarrollado un conjunto de mecanismos de defensa, denominado sistema inmunitario, cuya función principal es establecer un estado de inmunidad contra la infección (inmunitas, término del latín que significa exento de).
El objetivo de las vacunas es el control de las infecciones, equiparable a cualquier otra medida de salud pública, como el suministro de agua potable, los sistemas de tratamiento de aguas residuales y la higiene personal. La prevención de las infecciones a través de la vacunación es una estrategia de ayuda al sistema inmunitario, a través de la exposición a antígenos de los agentes infecciosos que estimulen la respuesta adquirida, con el fin de generar células de memoria.
El ser humano, durante siglos, observó que los supervivientes de enfermedades infecciosas graves rara vez contraían de nuevo la infección. En la antigua Grecia, Tucídides comprobó que aquellos que atendían a los enfermos de peste eran los individuos que se habían infectado y recuperado de la enfermedad. En China, durante la Edad Media, eran comunes los intentos deliberados de controlar las infecciones mediante la inducción de formas menores de la enfermedad en los sujetos. Así se desarrolló en Turquía la práctica de la variolización, que consistía en inocular material proveniente de las costras de la viruela en pequeñas laceraciones de la piel. Por tanto, los principios de la vacunación son anteriores al desarrollo de la ciencia de la inmunología, que aparece a finales del siglo XIX, cuando, por un lado, Elie Metchnikoff describía el mecanismo de la fagocitosis y ponía los primeros cimientos para el desarrollo de la inmunología celular, mientras que, por otro lado, Paul Ehrlich descubría los anticuerpos y sentaba las bases para el desarrollo de la inmunología humoral.
Desde entonces, el desarrollo de la ciencia de la inmunología ha ido paralelamente unido al desarrollo de las técnicas de vacunación. A medida que se ha ido conociendo más en detalle el modo de acción de la respuesta inmunitaria, se ha ido mejorando sustancialmente el desarrollo de las vacunas.
3. COMPONENTES DEL SISTEMA INMUNITARIO: INNATO Y ADQUIRIDO
Nuestro sistema inmunitario, como buen ejército, está perfectamente estructurado y organizado en dos grandes componentes: sistema innato y sistema adquirido. Ambos sistemas están estrechamente interconectados funcionalmente y su óptima respuesta depende de la acción coordinada de ambos.
3.1. El sistema inmune innato: inmediato, pero inespecífico y sin memoria
El sistema inmune innato es el más ancestral desde el punto de vista evolutivo y es compartido por el resto de los seres vivos, tanto del reino animal como vegetal. Es un mecanismo de defensa inespecífico, por lo tanto, reconoce y responde a los patógenos de forma genérica y su respuesta no mejora con la exposición repetida a la infección. Su función principal es la de generar una respuesta defensiva inmediata frente a la infección y constituye, por lo tanto, la primera línea de defensa frente al patógeno.
El componente más básico del sistema inmunitario innato lo conforman las barreras físicas y químicas que impiden el acceso de los microorganismos al cuerpo del individuo. En efecto, la primera línea defensiva es la piel, que cuando está intacta, resulta impermeable a la mayoría de los agentes infecciosos; cuando se rompe la integridad de la piel como, por ejemplo, en las quemaduras, la infección se convierte en un problema importante. Además de la piel, los microorganismos son mantenidos a raya con secreciones de líquidos bactericidas (por ejemplo, lágrimas), moco, ácido gástrico y la acción ciliar, cuya función es expulsar al microorganismo invasor.
El componente celular del sistema inmune innato lo conforman las células fagocíticas, cuya función asignada es la endocitosis y la digestión de microorganismos, para su posterior presentación a las células del sistema inmunitario adquirido (actúan como células presentadoras de antígeno, CPA). Las principales células fagocíticas de nuestro cuerpo son los neutrófilos polimorfonucleares, los macrófagos y las células dendríticas. Estas células fagocíticas usan unos receptores genéricos que reconocen estructuras comunes de los microorganismos (por ejemplo, ácido lipoteicoico, común a todas las bacterias Gram positivas). Estos receptores celulares se denominan receptores de reconocimiento de patrón (RRP) y las estructuras que reconocen se denominan patrones moleculares asociados con patógenos (PMAP) y se localizan siempre en la superficie del microorganismo invasor. Entre los RRP más conocidos se encuentran los receptores tipo Toll (TLR, toll like receptors), implicados en la interacción con los adyuvantes vacunales y críticos en la iniciación de la respuesta inmunitaria.
Los microorganismos reconocidos a través de sus PMAPs por los RRP de las células fagocíticas activan el proceso de la endocitosis y son internalizados por la célula, tras lo cual se fusionan con diferentes gránulos citoplasmáticos. Estos gránulos contienen diferentes especies reactivas del oxígeno y óxido nítrico, que actúan como formidables sistemas antimicrobianos, digiriendo la pared y las membranas celulares de los microorganismos invasores, que conducen a su degradación.
El componente humoral del sistema inmune innato lo forma un conjunto de aproximadamente 20 proteínas, denominadas sistema de complemento. Es un sistema de respuesta rápida y muy amplificada frente a un estímulo desencadenante, mediado por un fenómeno de activación en cascada, donde el producto de una reacción es el catalizador enzimático de la siguiente reacción. De este modo se producen una serie de reacciones de activación secuencial, cuyo resultado final es, por un lado, generar una respuesta inflamatoria para atraer las células fagocíticas hacia los microorganismos y, por otro lado, generar un complejo de ataque de membrana que vuelve a la célula sobre la que actúa muy permeable y produce la lisis por ósmosis.
Hay tres vías que conducen a la activación del sistema del complemento y que se conocen como la vía clásica, la vía alternativa y la vía de las lectinas, según el elemento desencadenante, que son, respectivamente, los inmunocomplejos, la hidrólisis espontánea del componente C3 y la superficie polisacarídica del patógeno.
Las tres vías confluyen en un mismo punto común, que es la formación del complejo C3-convertasa, complejo enzimático cuya función es degradar el componente C3 (componente mayoritario en el plasma). A partir de ese punto, las tres vías confluyen en una vía común que genera por un lado potentes mediadores inflamatorios (anafilotoxinas, C3a y C5a) y, por otro lado, el complejo de ataque a membrana (MAC, formado por los componentes C5b-9).
Dada su extremada potencia lítica, el sistema del complemento se encuentra en el ser humano perfectamente regulado para evitar el ataque a componentes propios. En este control intervienen diversas proteínas reguladoras, tanto solubles como de membrana, entre las que destacan el C1-inhibidor (vía clásica) y el factor H/factor I (vía alternativa). El factor H también es conocido por ser el elemento que emplea el patógeno Neisseria meningitidis para evadir el sistema inmunitario, a través de una proteína de membrana del patógeno (fHbp, proteína de unión al factor H) que se une al factor H humano, recubriéndose de él y evitando de esta forma el ataque del sistema del complemento. Las vacunas frente a MenB, actualmente existentes, utilizan como estrategia el bloqueo de la proteína patogénica fHbp, consiguiendo anular de este modo el mecanismo de evasión.
Además del sistema del complemento, hay otras proteínas plasmáticas denominadas proteínas de fase aguda, ya que muestran un aumento notable de su concentración en las primeras horas de la infección, cuya función es fijar proteínas del sistema de complemento y recubrir (“opsonizar”) al patógeno para su posterior degradación.
3.2. El sistema inmune adquirido: altamente específico y con capacidad de recordar para mejorar la respuesta
Los patógenos han desarrollado estrategias, por medio de mutaciones, que les permiten evadir en muchos casos nuestro sistema de defensa innato. Esto ocurre, por ejemplo, con las bacterias, que alteran la conformación de su estructura exterior para evitar la activación del complemento. Es obvio, por lo tanto, que el organismo necesita diseñar mecanismos de defensa dirigidos individualmente contra cada uno de los patógenos, son los mecanismos del sistema inmunitario adquirido.
Este sistema conforma la segunda línea de defensa de nuestro organismo, su activación no es tan rápida como la del sistema innato y puede llegar a necesitar varios días para su completa activación; pero, por el contrario, es altamente específico, capaz de reconocer miles de millones de antígenos diferentes y responder a cada uno de ellos de forma individual. Además, y esta es la característica principal en que se asienta la ciencia de la vacunología, nuestro sistema inmunitario adquirido tiene “memoria”, ya que recuerda el contacto previo con el antígeno para que, en un segundo encuentro, pueda responder de forma mejor y con mayor rapidez al patógeno.
El componente celular del sistema inmune adquirido lo constituye todo un ejército de células altamente especializadas, denominadas linfocitos, con funciones perfectamente definidas en la respuesta frente a los patógenos. Dentro de este ejército destaca, por encima de todo, un tipo celular que actúa como coordinador de toda la respuesta inmunitaria, el linfocito T colaborador (T helper) identificado por la proteína específica de membrana CD4 (linfocitos T-CD4+). Este tipo celular es el responsable de la iniciación de la respuesta inmunitaria adquirida y va a coordinar a todos los demás tipos celulares implicados, a través de la liberación de mediadores solubles específicos (denominadas citocinas). La interacción entre el linfocito T-CD4+ colaborador y una célula presentadora de antígeno (CPA) con actividad fagocítica supone el vínculo entre la inmunidad innata (CPA) y la inmunidad adquirida (Linfocito T colaborador). Estos linfocitos T cuentan en su membrana con receptores de antígeno altamente específicos, capaces de reconocer y diferenciar miles de millones de moléculas de antígenos diferentes, es lo que se denomina el receptor de célula T (TCR, T-cell receptor).
Otra clase de linfocitos T, denominados linfocitos T citotóxicos, se identifican por la proteína específica de membrana CD8 (linfocitos T-CD8+). Este tipo celular tiene capacidad lítica (como su propio nombre indica) y están especializados en la neutralización de células infectadas por microorganismos intracelulares (virus principalmente), mediante ataque directo a las células infectadas, liberando enzimas tóxicas (granzimas y perforinas) que provocan su destrucción. A través de su receptor de membrana TCR, altamente específico, reconocen proteínas de origen viral que las células infectadas presentan en su superficie.
Un tipo especial de linfocitos, denominados linfocitos natural killer (linfocitos NK), poseen receptores en su membrana “inespecíficos”, que van a reconocer células infectadas por virus, células tumorales y células recubiertas por anticuerpos en un mecanismo denominado citotoxicidad celular dependiente de anticuerpos (ADCC, antibody-dependent celular cytotoxicity). Presentan un mecanismo similar al de los linfocitos T-CD8+ citotóxicos, salvo por la diferencia que los linfocitos NK no necesitan presentación de antígeno, atacan directamente a la célula diana. Este tipo celular, carente de receptor especifico para el antígeno, estaría a medio camino entre el sistema inmune innato y el sistema adquirido.
Otro tipo celular, los linfocitos B, son los responsables de la respuesta humoral, transformándose en células plasmáticas que van a producir unas glucoproteínas denominadas anticuerpos o inmunoglobulinas (Ac o Ig), las cuales se van a unir a antígenos específicos que reconocen de forma unívoca. Todos los anticuerpos producidos por un linfocito B son específicos para un solo antígeno (anticuerpo monoclonal) y se sitúan en la membrana de las células B, actuando como receptor específico (BCR, B-cell receptor). Estos anticuerpos, una vez secretados, funcionan como adaptadores de alta especificidad que se unen a los microorganismos por medio de su región de reconocimiento específico (Fab, antigen-binding fragment) y que por medio de su región de estructura constante (Fc, fragment crystallizable) activan el sistema del complemento (vía clásica) y a células fagocíticas (a través de receptores Fc), para destruir al patógeno invasor. Existen hasta cinco clases de anticuerpos, denominados isotipos (IgG, IgA, IgM, IgD e IgE), con estructuras y funciones diferentes. El isotipo IgG es el que proporciona mayor nivel de protección inmunitaria frente a los patógenos invasores, además de ser el único anticuerpo con capacidad para cruzar la placenta y proporcionar al feto inmunidad de forma pasiva (tabla 48.1) El isotipo de anticuerpo cambia durante el desarrollo y activación de los linfocitos B, expresando en un primer momento el isotipo IgM e IgD y, tras la activación de la célula B, se produce el denominado cambio isotípico (switching) y las formas IgM/IgD se transmutan en los otros tipos IgG, IgA o IgE, que desempeñan distintos papeles dentro de la respuesta inmunitaria.
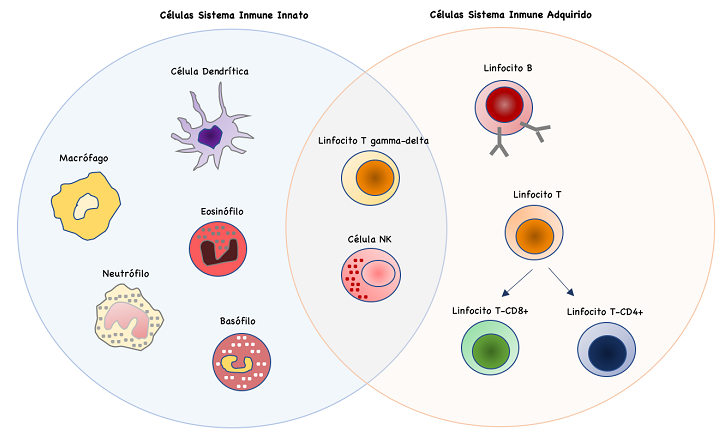
En la figura 48.1 se aprecian las principales células de los sistemas inmunitarios innato y adquirido.
Tabla 48.1. Funciones y distribución de los principales isotipos de inmunoglobulinas en el ser humano.
| Actividad funcional | IgM | IgD | IgG1 | IgG2 | IgG3 | IgG4 | IgA | IgE |
| Neutralización | + | - | ++ | ++ | ++ | ++ | ++ | - |
| Opsonización | - | - | +++ | + | ++ | + | + | - |
| Sensibilización a células NK | - | - | ++ | - | ++ | - | - | - |
| Sensibilización a mastocitos | - | - | + | - | + | - | - | +++ |
| Activación del complemento | +++ | - | ++ | + | +++ | - | + | - |
| Distribución | IgM | IgD | IgG1 | IgG2 | IgG3 | IgG4 | IgA | IgE |
| Transporte a través del epitelio | + | - | - | - | - | - | +++ | - |
| Transporte a través de placenta | - | - | +++ | + | ++ | + | - | - |
| Difusión a sitios extravasculares | - | - | +++ | +++ | +++ | +++ | ++ | + |
| Nivel medio en suero (mg/ml) | 1,5 | 0,04 | 9 | 3 | 1 | 0,5 | 2,1 | 3x105 |
Figura 48.1. Principales células del sistema inmunitario innato y adquirido. Los linfocitos T gamma-delta y las células NK se sitúan a medio camino entre la inmunidad innata y la adquirida.
4. Organización de la respuesta inmunitaria
Una respuesta inmunaria eficaz es el resultado de una serie intrincada de acontecimientos e interacciones celulares que necesitan de una estructura anatómica organizada. La integración de estas complejas interacciones celulares tiene lugar dentro del tejido linfoide periférico (o secundario), que incluye los ganglios linfáticos, el bazo y el tejido no encapsulado de las mucosas de las vías respiratorias, del sistema digestivo y del sistema genitourinario (MALT, mucosal-associated lymphoid tissue). Estos tejidos linfoides periféricos se pueblan con células linfoides provenientes de los tejidos linfoides primarios (médula ósea y timo) y establecen complejas interacciones con células reticulares, macrófagos y otras células accesorias.
Los ganglios linfáticos filtran la linfa que fluye desde los tejidos corporales recogiendo a su paso las bacterias, virus, células cancerosas y otras sustancias indeseadas, que son retenidas y eliminadas. El ganglio linfático se encuentra perfectamente organizado en diferentes compartimentos anatómicos donde se separan los linfocitos T de los linfocitos B, por tanto, podemos hablar en el ganglio de un área de células B (corteza externa) organizadas en folículos primarios y un área de células T (paracorteza). La interacción entre los linfocitos T y los linfocitos B tiene lugar cuando ingresa en el ganglio una sustancia indeseada, activa a los linfocitos T y se dirigen hacia la zona de linfocitos B, lo que supone el inicio de la respuesta inmunitaria, con la proliferación de los linfocitos B en centros germinales y la formación de folículos secundarios.
La función del bazo es filtrar la sangre de una forma similar a como hace el ganglio con la linfa. También se encuentra organizado en áreas bien definidas de linfocitos T (vainas periarteriolares) y linfocitos B (zona marginal) y al igual que en el ganglio, los folículos primarios de linfocitos B se activan y proliferan en centros germinales para convertirse en folículos secundarios, tras el encuentro con una sustancia extraña.
Mención aparte especial merece el sistema inmunitario de las mucosas (MALT), que protege las superficies mucosas de las vías respiratoria, digestiva y genitourinaria. Forma un tejido linfoide no encapsulado, en parte organizado en estructuras bien definidas (amígdalas, placas de Peyer, apéndice), pero también formando colecciones celulares difusas a lo largo de la lámina propia. Los linfocitos que forman parte de este tejido linfoide se denominan linfocitos intraepiteliales, son sobre todo linfocitos T y contienen algunas subpoblaciones especiales no presentes en el tejido linfoide sistémico (como, por ejemplo, linfocitos T-CD8αα)
5. Respuesta inmunitaria a las vacunas
Veamos ahora como se produce la activación del sistema inmunológico tras la administración de la vacuna. Empezaremos primero por la respuesta a una vacuna parenteral y luego veremos la respuesta a las vacunas de vía mucosa.
5.1. LA INYECCIÓN DA LA SEÑAL DE ALARMA
La mayoría de las vacunas son administradas a través de la ruta parenteral, que incluye generalmente las tres rutas principales: intramuscular (IM), subcutánea (SC) e intradérmica (ID). La inmunogenicidad relativa de las vacunas administradas por estas tres rutas varía según cada vacuna y está influenciada por varios factores, como el tipo de vacuna y el adyuvante empleado. De esta forma, es durante los estudios de inmunogenicidad en fases iniciales de los ensayos clínicos, cuando se elige la vía de administración.
En general, la inmunización por vía ID es la que genera una mayor respuesta inmunitaria, mientras que las inmunizaciones por vía SC e IM inducen respuestas muy similares. El motivo es la alta concentración de células dendríticas que contiene la dermis, que facilitan la captura del antígeno vacunal. Además, la mayor inflamación local generada por esta vía induce la rápida maduración y migración de las células dendríticas hacia los ganglios linfáticos. Sin embargo, la vía ID produce reacciones adversas locales más serias, por lo que su uso actual se restringe a casos concretos y en grupos de población que no responden a la inyección IM (vacuna HB en pacientes en diálisis). Por regla general, los CDC recomiendan que las vacunas inactivadas que contienen adyuvantes se administren por vía IM, ya que parece que la vía SC puede causar mayor irritación local, dolor, induración o formación de granuloma.
Sea cual sea la vía de administración, la primera señal de activación que se produce en nuestro sistema inmunitario es la inyección, dado que produce un daño en el epitelio, al romper la integridad de la primera barrera del sistema inmunitario innato, que es la piel. Este fenómeno genera la liberación de mediadores solubles por parte de las células epiteliales de la piel, cuya función, como su propio nombre indica, es la de dar la señal de alarma de que un elemento invasor ha penetrado en el organismo. Estas moléculas, denominadas alarminas (defensinas, catecidinas), actúan como mediadores quimiotácticos que van a atraer hacia el lugar de la inyección a diferentes tipos celulares, entre los que se encuentran las células dendríticas de la piel (denominadas células de Langerhans). Estas células dendríticas actúan como células presentadoras de antígeno (CPA) (APC, antigen-presenting cells); una vez que capturan el antígeno en la epidermis, migran hacia los ganglios linfáticos regionales para transportar el antígeno vacunal (o el elemento invasor) y presentarlo a las células especializadas del ganglio (figura 48.2). Estas células dendríticas se encuentran habitualmente en reposo en un estadio inmaduro, pero una vez atraídas hacia el foco de la invasión, maduran por acción de las alarminas, pero sobre todo por acción de los adyuvantes que incluye la vacuna (volveremos más adelante sobre el papel de los adyuvantes).
Figura 48.2. Iniciación de la respuesta inmunitaria a la vacuna. Las señales de alarma generadas tras la inyección atraen a las células dendríticas circulantes, que capturan el antígeno vacunal y lo trasportan al ganglio linfático, donde será presentado al linfocito T CD4+ y se activará así la respuesta inmune adquirida.
5.2. Acontecimientos en el ganglio linfático
Una vez que las células dendríticas de Langerhans ingresan en el ganglio linfático se producen una serie de acontecimientos que van a culminar en el inicio de la respuesta inmunitaria frente a los antígenos de la vacuna. En primer lugar, se va a producir una compleja interacción entre la célula dendrítica que actúa como CPA y el linfocito T virgen presente en la paracorteza. Ambas células se unen en una compleja sinapsis, en la que intervienen multitud de proteínas de membrana, que van a interaccionar con receptores de membrana en la otra célula (sinapsis inmunológica). Este acontecimiento conduce a la activación de los linfocitos T por los antígenos que incluye la vacuna. Estos linfocitos T activados migran hacia las zonas de linfocitos B del ganglio linfático, activando estas células, que comienzan a proliferar formando el centro germinal (folículo secundario), señal de que la respuesta inmune se ha iniciado.
5.3. Respuesta de los linfocitos B
Una vez activados, comienza en los centros germinales una proliferación de linfocitos B, que van a sufrir dos fenómenos claves para el éxito de la respuesta inmunitaria. Por un lado, se va a producir una alta tasa de mutaciones a nivel genético en las regiones variables que codifican para las inmunoglobulinas (hipermutación somática), que permite seleccionar, de entre todos los linfocitos que proliferan, a aquellos que reconozcan los antígenos vacunales con mayor afinidad (maduración de la afinidad). Por otro lado, se producen recombinaciones a nivel genético en la región de las cadenas pesadas de las inmunoglobulinas, que van a suponer un cambio en el isotipo, que pasará de ser isotipo IgM/D a isotipo IgG/A/E (cambio de isotipo), con funciones especializadas para cada isotipo.
Una vez que las células B son activadas en el ganglio van a elegir dos destinos, evolucionar a célula plasmática productora de anticuerpos, que migrará a la médula ósea, preferentemente, y desde allí secretará miles de moléculas de anticuerpos específicos que entrarán en circulación; o bien se diferenciará en células B de memoria circulante, de larga duración, que porta un receptor en su membrana de alta afinidad para el antígeno y cuya función repasaremos posteriormente.
5.4. Respuesta de los linfocitos T
Tras la activación de los linfocitos T virgen por parte de las células dendríticas, los linfocitos T activados van a activar a las células B del ganglio y por otro lado se convierten en linfocitos T efectores productores de citocinas. Los linfocitos T efectores salen del ganglio y migran hacia el sitio de la infección, atraídos por el gradiente de mediadores quimiotácticos liberados. Una vez allí, comienzan a liberar citocinas que actúan como mensajeros intercelulares, activando otros tipos celulares implicados en la respuesta inmunitaria, como son los linfocitos T citotóxicos, células NK, macrófagos, etc. Al igual que las células B, una parte de los linfocitos T activados se diferenciarán en linfocitos T de memoria circulantes, a la espera de un nuevo encuentro con el antígeno.
5.5. La vía mucosa
La gran mayoría de los patógenos invaden al huésped a través de las membranas mucosas del tracto respiratorio, digestivo y genitourinario. Por tanto, generar inmunidad a nivel mucoso, donde se produce la infección y la transmisión, parece ser la mejor estrategia de protección. Además, la administración por vía mucosa presenta otra serie de ventajas, como evitar el pinchazo y el dolor asociado, con lo que se hace más adecuado para los programas de vacunación y presenta también menos reacciones sistémicas adversas, comparada con la administración parenteral.
Sin embargo, la vía mucosa presenta una serie de limitaciones y desventajas, como, por ejemplo, el uso de vacunas basadas en subunidades no genera una respuesta inmunológica efectiva, debido a la acción de las enzimas presentes en los tejidos mucosos, que degradan los antígenos presentes en las vacunas, o al menor conocimiento que se tiene del sistema inmunitario de las mucosas (MALT), en comparación con el sistema inmunitario sistémico.
En los últimos años hemos asistido al desarrollo de nuevos candidatos vacunales administrados por vía mucosa, seleccionando los antígenos apropiados con alta inmunogenicidad y diseñando nuevas rutas de administración (oral, nasal, pulmonar y vaginal), y seleccionando moléculas adyuvantes y transportadores que estimulen el sistema inmunitario de la mucosa de forma apropiada. Debido a que, en teoría, la respuesta inmunitaria de las vacunas de vía mucosa es menor que la administración parenteral, ahora mismo es una prioridad la búsqueda de adyuvantes efectivos en la formulación de estas vacunas. El reto actual es conseguir que la inmunización en los compartimentos de la mucosa induzca inmunidad protectora, tanto a nivel de la mucosa como a nivel sistémico.
La respuesta inmunitaria en la mucosa se produce de un modo similar a la vía sistémica, pero con otros lugares y células implicadas. Quizás la ruta más estudiada sea la intestinal, donde el antígeno vacunal se introduce a través de células transportadoras especializadas (células M), que actúan como centinelas e ingresan el antígeno directamente en las placas de Peyer, que son el equivalente al ganglio linfático sistémico. La organización en las placas de Peyer recuerda a la del ganglio linfático, con agregados de linfocitos T y B compartimentalizados y generación de centros germinales tras la activación celular. Desde aquí, la respuesta se transmite a los ganglios linfáticos mesentéricos intestinales, que conducen la respuesta efectora a todo el organismo.
6. Mecanismos efectores de la vacunación
Una vez activados, tanto los linfocitos B como los linfocitos T van a entrar en un ciclo de división celular (proliferación clonal) y se diferenciarán en linfocitos efectores. Las funciones efectoras que adquieren los linfocitos T consisten en la capacidad de activar macrófagos, la cooperación con los linfocitos B para la producción de anticuerpos y la capacidad de eliminar las células diana infectadas por virus, mediante la inducción del proceso de apoptosis (muerte celular programada). Los linfocitos T pueden diferenciarse a lo largo de vías diferentes para producir subpoblaciones de células T efectoras que secretan grupos de citocinas distintas, ampliamente adaptadas a la naturaleza del patógeno invasor (según sea intracelular o extracelular) que inició la respuesta inmunitaria. Los linfocitos B activados también proliferan extensamente en el centro germinal del ganglio y algunas de ellas se diferencian en células plasmáticas productoras de anticuerpos, que se alojan por largos periodos de tiempo en la médula ósea.
6.1. Mediadores de protección inducidos por las vacunas
Las vacunas ejercen su mecanismo de protección induciendo mecanismos efectores (bien a través de moléculas o a través de células) en el huésped, capaces de controlar rápidamente cualquier intento de replicación del patógeno o inactivando sus componentes tóxicos.
Los efectores inmunes inducidos por las vacunas son esencialmente los anticuerpos capaces de unirse específicamente al patógeno o a toxinas. Pero los anticuerpos no son el único mecanismo efector, ya que otros potenciales efectores son las células inducidas tras la vacunación, como linfocitos T-CD8+ citotóxicos (LTC), cuya función es limitar la diseminación del agente infeccioso, reconociendo y matando células infectadas o secretando citocinas antivirales especificas (interferón alfa, IFN-α). Por otro lado, los linfocitos T-CD4+ colaboradores (T helper) contribuyen a la protección a través de la producción de citocinas y proporcionan soporte a la generación y mantenimiento de las respuestas de linfocitos B y linfocitos T-CD8+.
Estos linfocitos T colaboradores inicialmente se clasificaron en linfocitos T helper 1 (Th1) y T helper 2 (Th2), dependiendo de cuál sea su producción de citocinas (interferón-γ e interleucina-4, respectivamente) Sin embargo, esta dicotomía actualmente está obsoleta, dado que se ha demostrado la existencia de un número mayor de subconjuntos de linfocitos T helper con diferente capacidad de producción de citocinas y patrón de migración. Recientemente se ha identificado un subconjunto de linfocitos T helper con un papel crítico en la respuesta efectora de las vacunas, los linfocitos T-helper foliculares (Tfh). Estas células están especialmente equipadas y posicionadas en el ganglio linfático para promover la activación de los linfocitos B y su diferenciación en células plasmáticas productoras de anticuerpos. Otro subconjunto importante son los linfocitos T-helper 17 (Th17), con una función esencial en la defensa frente a las bacterias extracelulares que colonizan la piel y las mucosas, reclutando neutrófilos y promoviendo inflamación local. Todas las poblaciones de células efectoras están estrechamente controladas por una población especial denominada linfocitos T reguladores (Tregs) implicados en el mantenimiento de la tolerancia inmunológica, a través de su acción supresora.
Lo que está claro es que las vacunas, al igual que los antígenos naturales, inducen respuestas efectoras basadas en linfocitos B (inmunidad humoral), pero también basadas en linfocitos T (inmunidad celular), por tanto, no hay razón para pensar en clasificar a las vacunas según favorezcan una u otra inmunidad. Además, la función de los linfocitos T-CD4+ es requerida para la producción de anticuerpos y, a su vez, los anticuerpos ejercen una gran influencia en la respuesta de los linfocitos T a los patógenos intracelulares.
El resumen de los mecanismos efectores inducidos por las vacunas se puede ver en la tabla 48.2.
Tabla 48.2. Mecanismos efectores inducidos por las vacunas.
| Anticuerpos. Previenen y reducen las infecciones eliminando a los patógenos extracelulares mediante: |
| Unión a los sitios enzimáticos activos de las toxinas o evitando su difusión por el organismo Neutralizando la replicación viral (por ejemplo, evitan la unión del virus y la entrada al interior celular) Opsonizando las bacterias extracelulares y activando la fagocitosis por parte de macrófagos y neutrófilos Activando la cascada del sistema del complemento |
| Linfocitos T-CD8+. No previenen la infección, pero reducen, controlan y eliminan patógenos intracelulares mediante: |
| Eliminando directamente las células infectadas a través de la liberación de enzimas líticas (granzima, perforina) Indirectamente liberando citocinas antimicrobianas |
| Linfocitos T-CD4+. No previenen la infección, pero reducen, controlan y eliminan patógenos intra y extracelulares según su capacidad de producir citocinas y patrón de migración. Las principales subpoblaciones son: |
| Linfocitos T-helper foliculares (Tfh) que producen principalmente IL-21 y proporcionan soporte a los linfocitos B Linfocitos T-helper 1 (Th1) productores de interferón IFN-γ, factor de necrosis tumoral TNF-α/β e IL-2, implicados en la defensa frente a patógenos intracelulares (virus, Mycobacterium tuberculosis) Linfocitos T-helper 2 (Th2) productores de IL-4, IL-5, IL-13 implicados en la defensa frente a patógenos extracelulares Linfocitos T-helper 9 (Th9) productores de IL-9 implicados también en la defensa frente a patógenos extracelulares Linfocitos T-helper 17 (Th17) productores de IL-17, IL-22 e IL-26 implicados en la defensa en las mucosas (Streptococcus pneumoniae, Bordetella pertussis, Mycobacterium tuberculosis) |
6.2. Correlatos de protección inducidos por las vacunas
La naturaleza de la vacuna influye en el tipo de efector inmunitario que se genera y que media la eficacia protectora. Así, las vacunas polisacarídicas inducen respuestas de linfocitos B en un modo denominado T-independiente, dado que los linfocitos T no reconocen antígenos que no sean proteínas presentadas por las CPA. La conjugación del polisacárido bacteriano a un transportador (carrier) proteico (vacunas conjugadas) proporciona el modo en que se activa al linfocito T y genera una respuesta de anticuerpos en un modo T-dependiente. La característica principal de la respuesta T-dependiente es que induce anticuerpos de alta afinidad y generan respuestas de memoria, algo que la respuesta T-independiente no consigue.
La gran mayoría de las vacunas actuales median su eficacia protectora a través de la inducción de anticuerpos (tabla 48.3), pero, como hemos visto anteriormente, la respuesta es global y también se generan linfocitos T-CD4+/CD8+ que colaboran en la protección. Por lo general, las vacunas vivas atenuadas generan potentes respuestas de linfocitos T-CD8+ citotóxicos.
Tabla 48.3. Correlatos de protección inducidos por las vacunas.
| Vacuna | Tipo de vacuna | IgG suero | IgG mucosa | IgA mucosa | Linfocitos T |
| Cólera inyectable | Inactivada | ++ | + | - | - |
| Cólera oral | Viva atenuada | + | ++ | - | - |
| Difteria | Toxoide | ++ | (+) | - | - |
| Encefalitis japonesa | Inactivada | ++ | - | - | - |
| Fiebre amarilla | Viva atenuada | +++ | - | - | - |
| Fiebre tifoidea | Polisacarídica | + | (+) | - | - |
| Gripe intranasal | Viva atenuada | ++ | + | + | + (CD8+) |
| Gripe inyectable | Inactivada, subunidades | ++ | (+) | - | - |
| Hepatitis A | Inactivada | +++ | - | - | - |
| Hepatitis B | Proteínica | ++ | - | - | - |
| Hib conjugada | Conjugada | +++ | ++ | - | - |
| Hib polisacarídica | Polisacarídica | ++ | (+) | - | - |
| Meningococo B | Proteínica | ? | ? | ? | ? |
| Meningococo conjugada | Conjugada | +++ | ++ | - | - |
| Meningococo polisacarídica | Polisacarídica | ++ | (+) | - | - |
| Neumococo conjugada | Conjugada | +++ | ++ | - | - |
| Neumococo polisacarídica | Polisacarídica | ++ | (+) | - | - |
| Papilomavirus | Virus like particles | (+) | (+) | ++ | - |
| Rubeola | Viva atenuada | +++ | - | - | - |
| Sarampión | Viva atenuada | +++ | - | - | + (CD8+) |
| Tétanos | Toxoide | +++ | - | - | - |
| Tosferina acelular | Proteínica | ++ | - | - | + (CD4+) |
| Tosferina celular | Inactivada | ++ | - | - | + (CD4+) |
| Tuberculosis (BCG) | Viva atenuada | - | - | - | ++ (CD4+) |
| Varicela | Viva atenuada | ++ | - | - | + (CD4+) |
| Zóster | Viva atenuada | - | - | - | ++ (CD4+) |
BCG: bacilo Calmette-Guérin; Hib: Haemophilus influenzae tipo b.
7. El concepto de memoria inmunológica
Con la desaparición de la fuente de antígeno que inició su producción, la inmensa mayoría de los linfocitos efectores son eliminados mediante el mecanismo de apoptosis. Sin embargo, se mantiene una fracción de células que responde al antígeno, posiblemente las que presentan mayor afinidad para este, formando el compartimento de células de memoria, que persisten para desencadenar una respuesta inmunitaria secundaria más rápida y eficaz, tras la reexposición al mismo antígeno.
7.1. Características de la respuesta de linfocitos B de memoria
Los linfocitos B de memoria se generan durante la respuesta primaria a vacunas T-dependientes (tabla 48.4). Estas células persisten en ausencia del antígeno, pero no producen anticuerpos (por lo tanto, no protegen), a menos que se produzca la reexposición al antígeno que conduce a su diferenciación en células plasmáticas productoras de anticuerpos. Esta reactivación es rápida, por lo que las respuestas booster o de refuerzo se caracterizan por un rápido incremento en los títulos de anticuerpos, con gran afinidad por los antígenos, mayor que los anticuerpos generados durante la respuesta primaria.
Dado que la afinidad de las inmunoglobulinas de superficie de los linfocitos B de memoria es mayor, los requerimientos para la reactivación de estas células son menores que los de los linfocitos B virgen: los linfocitos B de memoria pueden, por lo tanto, ser activados con cantidades de antígeno mucho menores y sin cooperación de los linfocitos T-CD4+.
Además, los linfocitos de memoria específicos para el antígeno, que se generan tras la primera inmunización, son mucho más numerosos que los linfocitos B inicialmente capaces de reconocer el antígeno. La consecuencia es que los niveles de anticuerpos generados por los linfocitos B de memoria reactivados son sustancialmente mayores que los alcanzados tras la inmunización primaria. Otra característica principal de la respuesta de los linfocitos B de memoria es que producen y secretan anticuerpos con una afinidad marcadamente mayor que aquellos que producían las células plasmáticas de la respuesta primaria. Esto es debido a que el proceso de maduración de afinidad, iniciado en los centros germinales, se extiende varios meses después de iniciado.
La persistencia de los linfocitos B de memoria es de gran importancia en la efectividad a largo plazo de las vacunas. La persistencia del antígeno en la superficie de las células de los folículos puede contribuir a la duración de la memoria inmunológica. De todas formas, los linfocitos B de memoria pueden sobrevivir por periodos prolongados de tiempo (varias décadas), incluso en ausencia de reexposición al antígeno, a través de un mecanismo de activación homeostática policlonal.
La demostración de la persistencia de los linfocitos B de memoria, largo tiempo después de que los anticuerpos de la vacuna han desaparecido, y la evidencia de su enérgica reactivación tras la exposición al antígeno, tiene consecuencias importantes en los programas de vacunación. En primer lugar, implica que un calendario de inmunización no debe nunca empezar todo de nuevo, sino continuarse donde fue interrumpido, independientemente de la duración de la interrupción. Segundo, implica que determinados programas de inmunización no precisan dosis de refuerzo si el individuo es expuesto a refuerzos naturales de forma regular.
Tabla 48.4. Características de las respuestas de linfocitos B de memoria.
| Se generan solo durante las respuestas T-dependientes |
| Los linfocitos B de memoria son células en reposo que no producen anticuerpos |
| El proceso de maduración de la afinidad dura 4-6 meses |
| Ante la reexposición al antígeno se diferencian rápidamente (días) en células plasmáticas productoras de anticuerpos |
| Los anticuerpos que producen son de mayor afinidad que los que producían las células plasmáticas originarias |
7.2. Características de las respuestas de los linfocitos T de memoria
Las respuestas de los linfocitos T efectores son de vida corta, y la mayoría (>90 %) de las células mueren mediante apoptosis en pocos días. Por tanto, la memoria inmunológica es esencial para la eficacia de la vacunación, y depende de cuatro factores principales: la frecuencia de linfocitos T de memoria específicos para el antígeno, su fenotipo, su persistencia y su localización (tabla 48.5). Los linfocitos T de memoria pueden persistir durante toda la vida, incluso en ausencia de exposición antigénica.
La frecuencia de linfocitos T de memoria refleja directamente la magnitud de la expansión de linfocitos T inicial y de su contracción posterior, durante los cuales unas pocas células se diferencian hacia linfocitos T de memoria. El principal determinante de la fase de expansión es el nivel o la duración de la estimulación con el antígeno en la respuesta primaria. Esta es la principal limitación para las vacunas no replicantes (no vivas) que fallan a la hora de alcanzar el nivel de antígeno suficiente y requieren de la presencia del adyuvante o las dosis de recuerdo. La fase de contracción y la transición hacia linfocitos de memoria tiene lugar rápidamente una vez el antígeno es eliminado, algo que ocurre rápidamente en las vacunas no replicantes.
El fenotipo de los linfocitos T de memoria también es importante. Se han identificado hasta tres tipos principales de linfocitos T de memoria, basándose en su fenotipo y su función: linfocitos de memoria central, linfocitos de memoria efectores y linfocitos de memoria residentes. Los linfocitos de memoria central (Tcm) preferentemente circulan hacia los ganglios linfáticos y la médula ósea y no muestran capacidad citotóxica, pero tienen gran capacidad de proliferación. Su función es reconocer antígenos en los ganglios linfáticos presentados por las CPA y rápidamente expandirse y diferenciarse, generando una ola de linfocitos T efectores. Por otro lado, los linfocitos T de memoria efectores (Tem) conservan un alto potencial citotóxico que les permite reconocer inmediatamente al patógeno. Normalmente no se encuentran en los ganglios linfáticos y recirculan entre la sangre y los órganos no-linfoides, escaneando los tejidos en busca de péptidos microbianos específicos. Muy recientemente se ha descrito un tercer tipo, los linfocitos T de memoria residentes (Trm), que permanecen asentados en el interior de órganos como el intestino, los pulmones y la piel. Esta población ha demostrado un papel central en la protección frente a infecciones de la mucosa, por lo que las nuevas estrategias de vacunación frente a patógenos de la mucosa (influenza, VRS, pertussis) tratan de conseguir su inducción y mantenimiento.
En la figura 48.3 se puede ver la respuesta inmune primaria y secundaria al patógeno o antígeno vacunal.
Tabla 48.5. Características de las respuestas de linfocitos T de memoria.
| Factores principales | Determinantes |
| Frecuencia de linfocitos T de memoria | Magnitud de la expansión de linfocitos T (carga antigénica inicial, persistencia del antígeno) |
| Fenotipo de linfocitos T de memoria | |
| Memoria efectores Memoria central Memoria residentes |
|
| Respuesta efectora rápida en la periferia Activación y proliferación retardada en el ganglio linfático Localización en tejidos que permite la inmediata reactivación |
|
| Persistencia de linfocitos T memoria | Favorecida por IL-7 e IL-15 |
Figura 48.3. Respuesta inmunitaria primaria y secundaria al patógeno o antígeno vacunal. La exposición primaria de los linfocitos T y B virgen al patógeno o al antígeno vacunal resulta en un rápido incremento en el número de células específicas para el antígeno. A medida que el patógeno es eliminado, se produce una veloz contracción de la población por apoptosis. Sin embargo, un pequeño número de células específicas para el antígeno sobreviven y son mantenidas durante largos períodos de tiempo como linfocitos de memoria. Estas poblaciones rápidamente se expanden tras la reexposición al antígeno y son capaces de proporcionar protección y eliminar rápidamente el patógeno en el lugar de la infección.
7.3. Diferencias entre inmunidad protectora y memoria inmunológica
Las vacunas, por lo tanto, se han diseñado adaptándose a las características de la respuesta inmunitaria. Mediante la vacunación (inmunización artificial) generamos una respuesta primaria capaz de generar una protección en el individuo y una memoria inmunológica, para que en una segunda exposición al antígeno (patógeno) la respuesta sea más rápida, de mayor intensidad y de mayor afinidad.
Es interesante destacar la diferencia entre inmunidad protectora y memoria inmunológica. La respuesta inmunitaria se desarrolla en varias fases que evolucionan con el tiempo, tras el encuentro inicial con el antígeno. La primera fase corresponde a la respuesta primaria, como ya hemos visto, a continuación de la cual sigue una fase de inmunidad protectora, en la cual, la presencia de anticuerpos y linfocitos T específicos del antígeno confieren protección frente al patógeno, cuyas infecciones son rápidamente abortadas con presentación subclínica o leve.
Con el tiempo, los linfocitos T efectores primero, y a continuación los anticuerpos específicos, desaparecen de la circulación, entrando en una fase de memoria inmunológica, en la que solo persisten los linfocitos de memoria que se han generado durante la respuesta primaria, pero como se ha destacado anteriormente, estas células de memoria no son efectoras.
Ante un segundo encuentro con el antígeno, los linfocitos de memoria van a reconocer su antígeno específico, se activarán y evolucionarán a linfocitos efectores y células productoras de anticuerpos de una forma más rápida y con mayor intensidad que en la respuesta primaria, es lo que se denomina respuesta secundaria, a continuación de la cual vendrá una nueva fase de inmunidad protectora, de mayor duración que la anterior.
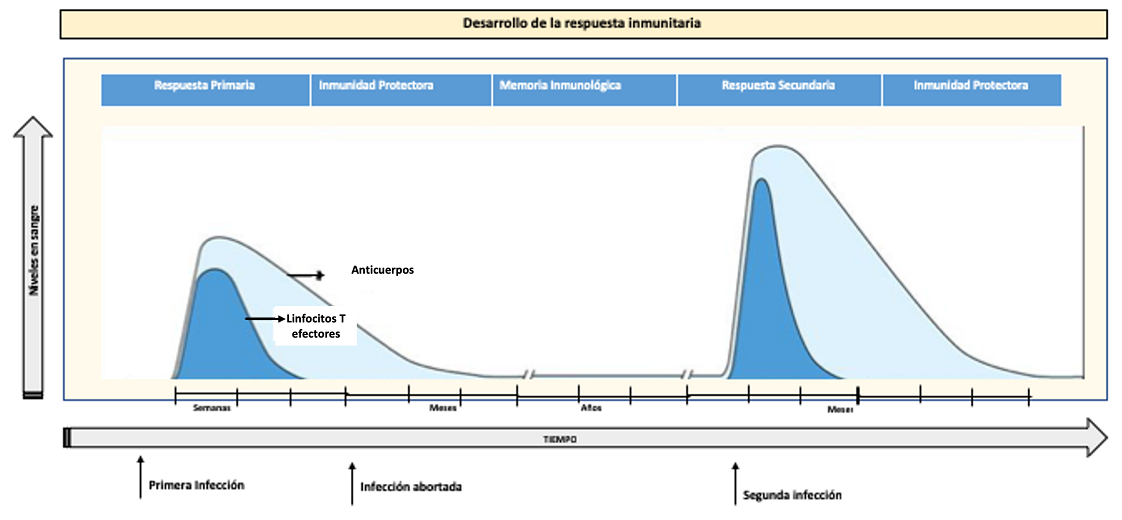
Se puede ver gráficamente en la figura 48.4.
Figura 48.4. Diferentes fases de la respuesta inmunitaria: respuesta primaria, inmunidad protectora, memoria inmunológica y respuesta secundaria. Durante la fase de inmunidad protectora se producen infecciones que son rápidamente abortadas o subclínicas. Durante la fase de memoria inmunológica, nuestro sistema inmunitario responde de forma rápida a la infección, generándose a continuación una nueva fase de inmunidad protectora.
8. Vacunas e inmunidad entrenada
Memoria inmunológica
Durante mucho tiempo se ha pensado que la capacidad de memoria de nuestro sistema inmune residía exclusivamente en el componente específico o adaptativo, cuyas células especializadas (linfocitos T y B) poseían la capacidad de recordar el encuentro previo con el patógeno para reactivarse mucho más rápido y de forma mucho más eficiente en el segundo y posterior encuentro. Esta memoria inmunológica es la base sobre la que se sustenta la vacunación. Sin embargo, durante los últimos años, se han acumulado evidencias que muestran como las células del sistema inmune innato (células dendríticas, monocitos-macrófagos, células Natural Killer) pueden mostrar capacidades similares, lo que ha supuesto una revolución en uno de los principales dogmas de la inmunología. Merece la pena señalar, que las plantas e invertebrados, que carecen de sistema inmune adaptativo, muestran cierta protección frente a la reinfección sustentada sobre la capacidad de memoria de las células inmunes innatas.
El concepto de “inmunidad entrenada”
El concepto de entrenamiento inmunitario o inmunidad entrenada describe la reprogramación funcional a largo plazo que adquieren las células inmunes innatas y que es evocada tras su estimulación con un antígeno y que conlleva a una respuesta modificada en encuentros posteriores, habiendo pasado previamente por el estado de reposo o no activación. La respuesta secundaria a estímulos no específicos posteriores se ve afectada de modo que la respuesta es modulada y responde de forma diferente que en la respuesta primaria. En este caso, y a diferencia de los mecanismos de recombinación génica que dirigen la memoria inmune en el sistema adaptativo, los mecanismos que rigen la inmunidad entrenada serían procesos de reprogramación epigenética en vías de transcripción. Además, este nuevo fenotipo adquirido se ha demostrado que perdura desde, al menos, tres meses y hasta por lo menos un año, aunque algunos estudios apuntan a una duración de hasta cinco años.
Los mecanismos moleculares que conducen a esta reprogramación de naturaleza epigenética (figura 48.5) se desencadenarían tras la activación del sistema inmune innato a infecciones con patógenos vivos o bien tras la inmunización artificial a través de la vacunación. Los cambios transcripcionales afectarían a la producción de citocinas inflamatorias y genes importantes para la defensa del huésped. La respuesta transcripcional de la célula inmune innata entrenada es cualitativamente diferente y cuantitativamente mayor comparada con las células que nunca se han encontrado con el patógeno o con alguna señal de peligro. Esta respuesta es posible gracias a cambios en la accesibilidad a los genes que codifican para estas citocinas inflamatorias, que pasan de un estado de accesibilidad limitada a una configuración accesible para los factores de transcripción. Es una reprogramación a nivel epigenético en las células inmunes innatas (monocitos, macrófagos, células Natural Killer) que facilita el acceso a los genes de respuesta inflamatoria una vez se ha activado la respuesta inmunitaria.
Además de estos cambios a nivel epigenético, producen en la célula modificaciones a nivel metabólico con un cambio en la forma de obtención de energía, hacia una glicolisis aeróbica como un modo más eficiente de obtención de energía que le proporciona mayor facilidad de respuesta a estímulos posteriores.
Figura 48.5. Mecanismos celulares y moleculares de la inmunidad entrenada. La exposición a BCG produce un entrenamiento en las células mielomonocíticas con una función efectora aumentada frente a agentes microbianos. Se produce un remodelado epigenético a nivel de los ácidos nucleicos que produce una activación de la expresión de genes específicos relacionados con las funciones efectoras frente a patógenos y una mayor capacidad para activar la inmunidad adaptativa.
BCG e inmunidad entrenada
La vacunación con el Bacilo de Calmette-Guerin (BCG) ha sido la primera vacuna documentada que muestra este efecto de entrenamiento inmunitario en la población de células inmunes innata. Los trabajos del grupo de Mihai Netea pusieron de manifiesto que esta vacuna inducía una protección no específica a la reinfección mediante la reprogramación epigenética de los monocitos del huésped. La vacuna viva atenuada frente a la tuberculosis, una de las vacunas más empleadas en todo el mundo, había demostrado durante años protección más allá de la tuberculosis, asociándose su uso con un descenso de la mortalidad debida a otras causas, según multitud de estudios epidemiológicos. Sin embargo, el mecanismo inmunológico subyacente se desconocía y se apuntaba a efectos de inmunidad heteróloga o de reacción cruzada como mecanismo principal.
Los primeros trabajos del grupo de Netea mostraban un papel relevante del sistema inmune innato. Los macrófagos de individuos vacunados con BCG eran más eficientes en la liberación de radicales libres de oxígeno y en el mecanismo de destrucción intracelular mediante estallido respiratorio, que los provenientes de los individuos no vacunados. Posteriormente, describieron los mecanismos de reprogramación epigenética inducidos tras la vacunación por BCG como mediadores de este efecto de entrenamiento inmunitario en los monocitos y otras poblaciones celulares innatas.
Diversos esfuerzos se están realizando actualmente para comprobar si otras vacunas similares pueden ejercer este efecto de entrenamiento inmunitario de igual modo al descrito para la BCG. Quizás otras vacunas vivas atenuadas sean las más idóneas para buscar este efecto, dado su mecanismo de actuación.
Inducción de inmunidad entrenada para luchar frente a las infecciones
El descubrimiento que la vacuna BCG puede ofrecer protección frente a infecciones heterólogas, especialmente demostrada en infecciones respiratorias, permite hipotetizar que la inducción de la inmunidad entrenada a través de la vacunación en general, y de la vacuna BCG en particular, podría emplearse como una potente medida preventiva frente a la infección por SARS-CoV-2 y/o actuar reduciendo la gravedad de la infección, a la espera de la vacunación efectiva frente a esta enfermedad (figura 48.6).
Figura 48.6. Esquema propuesto de funcionamiento de la vacuna BCG frente a otras infecciones virales. El entrenamiento inmunitario generado por la vacuna BCG produciría un aumento en la actividad del sistema inmune innato que ayudaría a que la respuesta posterior frente a una infección viral no relacionada fuese mas efectiva.
La enfermedad producida por SARS-CoV-2 se caracteriza por una respuesta hiperinflamatoria y descontrolada de nuestro sistema inmunitario frente al patógeno, que desarrolla la inmunopatología asociada responsable de la elevada morbimortalidad de la covid-19. El componente celular innato de nuestro sistema inmunitario se ha identificado como elemento principal en la fisiopatogenia de la enfermedad, principalmente por la falta de plasticidad y adaptación a nuevos estímulos, unido a una tendencia inflamatoria con la edad (inflammaging) y a factores genéticos, aún por descubrir. La inducción de inmunidad entrenada a través de la vacunación con BCG podría proporcionar protección frente a la covid a través de los cambios epigenéticos y metabólicos que se han demostrado previamente sobre las células inmunitarias, principalmente innatas. El entrenamiento inmunitario de estas células previo al encuentro con el patógeno SARS-CoV-2 podría atenuar la respuesta hiperinflamatoria asociada y evitar la inmunopatología asociada. En individuos sanos vacunados con BCG, los mecanismos antimicrobianos innatos se verían reforzados a través del entrenamiento inmunitario proporcionado por la vacuna, lo que conduciría muy probablemente a la inhibición de la replicación viral, haciendo descender la carga viral y, subsecuentemente, la inflamación y los síntomas. Actualmente hay varios ensayos clínicos en marcha que tratan de evaluar esta hipótesis, que podría no estar restringida a la BCG dado que otras vacunas vivas atenuadas (polio oral) han demostrado un efecto similar en la prevención de infecciones virales no relacionadas.
En resumen, la capacidad de memoria inmunológica es una cualidad de nuestro sistema defensivo que hasta hace poco era exclusiva del componente adaptativo o específico del sistema inmunitario. Sin embargo, durante los últimos años, han surgido múltiples evidencias de una cierta capacidad del sistema inmune innato para aumentar y modular su capacidad de respuesta a estímulos sucesivos tras su activación inicial. Este fenómeno se ha venido a denominar “inmunidad entrenada” y actualmente es considerado de hecho como la memoria del sistema inmune innato.
9. Adyuvantes y su papel en las vacunas actuales
9.1. Introducción
Las vacunas constituyen una de las intervenciones sanitarias más eficaces en la prevención de enfermedades infecciosas en la infancia. Sin embargo, muchos antígenos vacunales, especialmente aquellos obtenidos mediante técnicas de subunidades, polisacáridos o plataformas recombinantes, presentan una inmunogenicidad limitada cuando se administran solos, particularmente en lactantes y niños pequeños cuyo sistema inmunitario se encuentra en desarrollo.
En este contexto, los adyuvantes desempeñan un papel fundamental al potenciar y modular la respuesta inmune inducida por las vacunas. Su incorporación ha permitido no solo mejorar la magnitud y la calidad de la respuesta inmunitaria, sino también optimizar los esquemas de vacunación, reducir la cantidad de antígeno necesario y prolongar la duración de la protección.
Desde el uso histórico de las sales de aluminio hasta el desarrollo de sistemas adyuvantes más complejos y dirigidos, la ciencia de los adyuvantes ha evolucionado de forma paralela al conocimiento del sistema inmunitario.
En la actualidad, los adyuvantes no se consideran meros potenciadores inespecíficos, sino herramientas clave para dirigir la respuesta inmunológica hacia perfiles más eficaces y seguros, adaptados a las características de la población pediátrica.
En este punto revisamos qué son los adyuvantes, cómo actúan y cuáles son los principales adyuvantes utilizados en las vacunas actuales, así como las nuevas estrategias en desarrollo. Asimismo, se analizan los retos pendientes y las oportunidades futuras, especialmente en relación con la inmunización mucosa, la generación de memoria inmunológica duradera y la mejora de la respuesta celular, aspectos de particular relevancia en la vacunación infantil.
9.2. ¿Qué son los adyuvantes?
Los adyuvantes son componentes de las vacunas que, administrados junto con el antígeno, incrementan y/o modulan la respuesta inmunitaria específica frente a dicho antígeno, sin conferir por sí mismos protección frente a la enfermedad. Su función principal es mejorar la eficacia inmunológica de la vacuna, especialmente cuando el antígeno es poco inmunógeno o cuando la respuesta del huésped es limitada, como ocurre en las primeras etapas de la vida.
Desde el punto de vista conceptual, las vacunas modernas se componen de dos elementos fundamentales:
- el antígeno, responsable de inducir la respuesta inmune específica, y
- el adyuvante, que actúa facilitando el reconocimiento inmunológico del antígeno y optimizando la respuesta inducida
Tradicionalmente, los adyuvantes se consideraban simples potenciadores inespecíficos de la inmunidad. Sin embargo, el avance en el conocimiento de la inmunología ha demostrado que los adyuvantes ejercen efectos más complejos y específicos, actuando sobre distintos componentes de la inmunidad innata y adaptativa, y condicionando tanto la intensidad como la calidad de la respuesta inmune.
Desde un punto de vista funcional, los adyuvantes pueden clasificarse de forma general en:
- Adyuvantes clásicos, como las sales de aluminio, con amplia experiencia de uso en vacunas pediátricas
- Adyuvantes de nueva generación, que incluyen emulsiones, liposomas y agonistas de receptores de la inmunidad innata, diseñados para dirigir de forma más precisa la respuesta inmunitaria
En vacunas pediátricas, el uso de adyuvantes es especialmente relevante debido a las características del sistema inmunitario infantil, que presenta una menor capacidad de respuesta frente a determinados antígenos. En este contexto, los adyuvantes permiten superar la inmadurez inmunológica, mejorar la respuesta a vacunas inactivadas o de subunidades y contribuir a una protección eficaz y duradera desde edades tempranas.
9.3. Funcionamiento y mecanismos de acción de los adyuvantes
La respuesta inmunitaria inducida por una vacuna requiere la activación coordinada del sistema inmunitario innato y adaptativo. En la actualidad, esta activación se explica de forma didáctica mediante la teoría de las tres señales, que describe los requisitos necesarios para una activación eficaz de los linfocitos T y el desarrollo de una respuesta inmune protectora y duradera. Los adyuvantes desempeñan un papel central en este proceso, especialmente en la segunda y tercera señal de activación (figura 48.7).
Figura 48.7. Mecanismo de acción de los adyuvantes a través de las tres señales de activación de la respuesta inmunitaria (presentación del péptido antigénico, señales de co-estimulación y microambiente inflamatorio).
Los adyuvantes pueden actuar como estimuladores de la respuesta inmunitaria (ligando agonistas receptores TLR) o a través de los sistemas de entrega y biodisponibilidad del antígeno (nanopartículas) Obtenido de Zhao T, et al. Signal Transduction and Targeted Therapy. 2023; 8:1-24.
9.3.1. La teoría de las tres señales en la activación inmunitaria
- Señal 1: reconocimiento antigénico
Corresponde al reconocimiento específico del antígeno por el receptor del linfocito T (TCR), tras su presentación por las células presentadoras de antígeno (CPA) en el contexto del complejo mayor de histocompatibilidad (MHC). Esta señal es proporcionada exclusivamente por el antígeno vacunal y, por sí sola, resulta insuficiente para inducir una respuesta inmune eficaz
- Señal 2: co-estimulación
La señal co-estimuladora se produce a través de la interacción entre moléculas co-estimuladoras expresadas en la superficie de las CPA (como CD80/CD86) y sus receptores en los linfocitos T. En ausencia de esta señal, el reconocimiento antigénico puede conducir a anergia o tolerancia inmunológica
- Señal 3: citocinas y entorno inflamatorio
La tercera señal está mediada por citocinas y otros mediadores inflamatorios que condicionan la diferenciación funcional de los linfocitos T y la calidad de la respuesta inmunitaria (humoral, celular o mixta).
9.3.2. Papel de los adyuvantes en la señal 2: co-estimulación
Uno de los principales mecanismos de acción de los adyuvantes es la activación de las células presentadoras de antígeno, especialmente las células dendríticas. Los adyuvantes inducen la maduración de estas células, aumentando la expresión de moléculas co-estimuladoras y mejorando su capacidad para activar linfocitos T específicos (figura 48.8).
Este efecto es crucial en vacunas compuestas por antígenos purificados o recombinantes, que carecen de señales de peligro intrínsecas. En la población pediátrica, donde la capacidad de co-estimulación puede ser limitada, la presencia de adyuvantes permite superar esta restricción y garantizar una activación inmunitaria eficaz.
Figura 48.8. Mecanismo de acción de los adyuvantes.
Los adyuvantes activan receptores de reconocimiento de patrones (TLR) y el inflamasoma en células presentadoras de antígeno, promoviendo la expresión de citocinas y la co-estimulación de linfocitos T. Esto conduce a la activación de células T helper (TH1 y TH2), linfocitos B productores de anticuerpos y células efectoras (CTL, NK, macrófagos), integrando respuestas humorales y celulares. Obtenido de Reed SG, et al. Nature Medicine. 2013;19:1597-608.
9.3.3. Papel de los adyuvantes en la señal 3: citocinas y microambiente inmunológico
Además de inducir co-estimulación, los adyuvantes generan un microambiente inflamatorio controlado en el lugar de administración de la vacuna. Este entorno se caracteriza por la producción local de citocinas y quimiocinas que influyen decisivamente en la diferenciación de los linfocitos T colaboradores.
Dependiendo del tipo de adyuvante, puede favorecerse una respuesta predominantemente humoral (Th2), celular (Th1) o una respuesta más equilibrada. Esta capacidad de modulación es esencial para adaptar la respuesta inmune a las características del patógeno y para inducir una inmunidad eficaz y duradera desde edades tempranas.
9.3.4. Consecuencias funcionales de la acción de los adyuvantes
La participación de los adyuvantes en la señal 2 (coestimulación) y en la señal 3 (citocinas y microambiente inflamatorio) se traduce en una activación más eficiente y sostenida del sistema inmunitario adaptativo, con una mayor expansión clonal de linfocitos T y B específicos frente al antígeno vacunal. Como consecuencia, se induce la producción de anticuerpos de mayor afinidad y más prolongados en el tiempo, se favorece una generación más robusta de células de memoria inmunológica y se optimiza la eficacia global de la vacunación, lo que permite en muchos casos reducir el número de dosis necesarias o la cantidad de antígeno administrado sin comprometer la protección.
En conjunto, los adyuvantes actúan como elementos clave para transformar el reconocimiento antigénico en una respuesta inmune completa y eficaz, permitiendo que las vacunas actuales y futuras sean seguras, inmunógenas y adaptadas a las necesidades específicas de la población pediátrica.
⌂
9.4. Principales adyuvantes utilizados en las vacunas actuales
En la actualidad, solo un número limitado de adyuvantes cuenta con autorización para su uso en vacunas humanas, y aún menos en vacunas destinadas a la población pediátrica. Estos adyuvantes han demostrado un perfil de eficacia y seguridad bien establecido, fruto de décadas de experiencia clínica y farmacovigilancia (tabla 48.6).
9.4.1. Sales de aluminio
Las sales de aluminio (principalmente hidróxido y fosfato de aluminio) son los adyuvantes más utilizados en vacunas pediátricas y los que cuentan con una mayor experiencia de uso. Se emplean desde hace más de 70 años y forman parte de numerosas vacunas inactivadas y de subunidades.
Su mecanismo de acción incluye la inducción de un microambiente inflamatorio local, la activación de células presentadoras de antígeno y el aumento de la respuesta humoral, con una clara predominancia de respuestas tipo Th2. Las sales de aluminio favorecen la producción de anticuerpos y la generación de memoria inmunológica, aunque su capacidad para inducir respuestas celulares citotóxicas es limitada.
Desde el punto de vista clínico, presentan un perfil de seguridad ampliamente contrastado, siendo las reacciones locales leves y transitorias los efectos adversos más frecuentes. Se utilizan, entre otras, en vacunas frente a difteria, tétanos, tosferina acelular, hepatitis B y Haemophilus influenzae tipo b.
9.4.2. Emulsiones oleosas
Las emulsiones aceite en agua, como MF59 (Fluad) y AS03 (Pandemrix), representan una generación más reciente de adyuvantes. Actúan promoviendo un potente reclutamiento de células inmunitarias en el lugar de inyección y una activación eficaz de las células dendríticas, sin generar un efecto depósito clásico.
Estos adyuvantes inducen respuestas humorales intensas y más amplias, con una mejor respuesta en poblaciones con menor reactividad inmunológica. Han sido utilizados principalmente en vacunas frente a la gripe, incluyendo formulaciones autorizadas en población pediátrica, y han demostrado un perfil de seguridad favorable.
9.4.3. Sistemas adyuvantes combinados
Los sistemas adyuvantes combinan distintos componentes con mecanismos de acción complementarios, con el objetivo de potenciar y dirigir de forma más precisa la respuesta inmunitaria. Ejemplos de estos sistemas son AS04 (Cervarix) y AS01 (Shingrix, Arexvy).
AS04 combina sales de aluminio con un agonista de receptores tipo Toll (TLR4), lo que permite una mayor activación de la inmunidad innata y una respuesta más robusta que la inducida por el aluminio solo. AS01, por su parte, incluye liposomas y componentes inmunoestimuladores que favorecen tanto la respuesta humoral como la celular (figura 48.9).
Estos sistemas adyuvantes representan un avance significativo en la vacunología moderna, al permitir una modulación más específica de la respuesta inmunitaria, con especial relevancia para vacunas frente a patógenos complejos o con elevada carga antigénica.
Tabla 48.6. Principales adyuvantes vacunales: mecanismos de acción y respuestas inmunitarias.
| Tipo de adyuvante | Mecanismo de acción principal | Respuesta inmunitaria predominante | Ejemplos de vacunas pediátricas |
| Sales de aluminio (hidróxido, fosfato) | Activación local de inflamasoma, inducción de microambiente inflamatorio, activación de células presentadoras de antígeno | Humoral (Th2), anticuerpos de alta afinidad | Difteria, tétanos, tosferina acelular (DTPa), hepatitis B, Haemophilus influenzae tipo b |
| Emulsiones aceite-en-agua (MF59, AS03) | Reclutamiento de células inmunitarias al sitio de inyección, aumento de captación y presentación de antígeno | Humoral y celular equilibrada (Th1/Th2) | Vacuna antigripal adyuvada |
| Sistemas combinados (AS01, AS04) | Activación de TLR y co-estimulación de células T mediante combinación de aluminio y agonistas de TLR o liposomas | Humoral y celular (Th1 preferente en AS01) | Vacuna frente al virus del papiloma humano (AS04), vacuna frente al paludismo (AS01) |
| Saponinas en nanopartículas (Matrix-M) | Activación de células dendríticas, inflamación local controlada, liberación de citocinas, activación de linfocitos T y B | Humoral y celular equilibrada, generación robusta de memoria | Vacuna COVID-19 basada en proteína recombinante (Novavax) |
| Agonistas de receptores de PRRs (TLR3, TLR7, TLR9) | Simulan señales de peligro, activan inmunidad innata, favorecen co-estimulación y citocinas proinflamatorias | Humoral y celular (dependiendo del TLR), inducción de memoria | Vacunas en desarrollo frente a virus respiratorios y virales recombinantes |
Figura 48.9. Esquema de los mecanismos celulares activados por el adyuvante AS01, combinación de MPL y QS-21.
MPL se une al receptor TLR4 en células del sistema inmune innato, activando vías proinflamatorias y la liberación de citocinas. QS-21 es endocitada y activa el inflamasoma ASC NLRP3, promoviendo la liberación de IL 1β e IL 18. Ambos componentes pueden actuar en la misma célula o en diferentes, generando efectos autocrinos y paracrinos que contribuyen al efecto adyuvante de AS01. Obtenido de Roman F, et al Expert Review of Vaccines. 2024;23:715-29.
⌂
9.5. Nuevos adyuvantes en desarrollo y uso reciente
El avance en el conocimiento de la inmunología y de las interacciones entre el sistema inmunitario innato y adaptativo ha impulsado el desarrollo de nuevos adyuvantes más específicos y dirigidos, con el objetivo de mejorar la eficacia vacunal manteniendo un elevado perfil de seguridad, especialmente en población pediátrica.
Uno de los principales campos de investigación es el uso de agonistas de receptores de reconocimiento de patrones, como los receptores tipo Toll (TLR). Estos adyuvantes imitan señales de peligro propias de los patógenos y permiten una activación más fisiológica de la inmunidad innata, favoreciendo una adecuada co-estimulación y un entorno de citocinas que dirige la respuesta adaptativa. Su uso permite potenciar respuestas celulares y mejorar la calidad de la memoria inmunológica.
Otro grupo relevante lo constituyen los adyuvantes basados en saponinas, generalmente formulados en sistemas liposomales o nanoparticulados. Estos adyuvantes inducen respuestas humorales potentes y una activación eficaz de linfocitos T, contribuyendo a una respuesta inmune más equilibrada. Aunque su uso en pediatría es todavía limitado, representan una estrategia prometedora para vacunas frente a patógenos complejos.
Las nanopartículas y liposomas se están consolidando como plataformas adyuvantes y de entrega antigénica. Estos sistemas permiten una presentación más eficiente del antígeno a las células presentadoras, mejorando la activación inmunitaria con dosis menores y ofreciendo un mayor control sobre el tipo de respuesta inducida.
Un ejemplo relevante de adyuvante de este tipo es Matrix-M, utilizado en vacunas basadas en proteínas recombinantes, como la vacuna frente al SARS-CoV-2 desarrollada por Novavax. Matrix-M es un adyuvante compuesto por saponinas purificadas formuladas en nanopartículas, que facilita una potente activación de la inmunidad innata y una presentación antigénica eficiente.
Su mecanismo de acción incluye el reclutamiento de células presentadoras de antígeno al lugar de la inyección y a los ganglios linfáticos de drenaje, así como la inducción de un entorno de citocinas que favorece tanto la respuesta humoral como la respuesta celular. A diferencia de los adyuvantes clásicos, Matrix-M permite una respuesta inmune más equilibrada, con producción de anticuerpos de alta afinidad y activación significativa de linfocitos T.
Además, este adyuvante ha demostrado permitir una reducción de la dosis de antígeno necesaria para alcanzar respuestas inmunitarias protectoras, un aspecto de gran interés en el desarrollo de las vacunas pediátricas. Los datos disponibles hasta la fecha muestran un perfil de seguridad favorable, lo que refuerza su potencial aplicación en futuras vacunas destinadas a la población infantil.
Finalmente, el desarrollo de vacunas basadas en nuevas plataformas, como las vacunas de ARN mensajero, ha puesto de relieve el papel de los propios sistemas de formulación como adyuvantes funcionales. Estas plataformas inducen activación innata y adaptativa de forma integrada, abriendo nuevas posibilidades para el diseño de vacunas más eficaces y flexibles.
En conjunto, estos nuevos adyuvantes y sistemas adyuvantes representan un paso adelante hacia vacunas más precisas, capaces de generar respuestas inmunitarias adaptadas a las necesidades específicas de la población pediátrica.
9.6. Adyuvantes del futuro y necesidades no cubiertas
A pesar de los avances significativos en el desarrollo de adyuvantes, las vacunas actuales siguen presentando limitaciones que condicionan su eficacia frente a determinados patógenos y en grupos de población específicos, como los lactantes y niños pequeños. Los adyuvantes del futuro están diseñados para cubrir estas lagunas y permitir una respuesta inmunitaria más completa, duradera y adaptada a las necesidades clínicas.
9.6.1. Limitaciones de los adyuvantes actuales
La mayoría de los adyuvantes actualmente disponibles inducen principalmente respuestas humorales sistémicas, con una capacidad limitada para generar inmunidad en superficies mucosas, que constituyen la principal puerta de entrada de muchos patógenos respiratorios y entéricos. Asimismo, la inducción de respuestas celulares citotóxicas y de memoria inmunológica de larga duración sigue siendo subóptima para determinados antígenos.
Otra limitación relevante es la necesidad de múltiples dosis o dosis de refuerzo para mantener la protección, lo que dificulta la adherencia a los calendarios vacunales, especialmente en edades tempranas.
9.6.2. Objetivos de los adyuvantes del futuro
Los nuevos adyuvantes en investigación persiguen objetivos claramente definidos. Uno de los más relevantes es la inducción de inmunidad mucosa, mediante la activación de respuestas inmunes locales y la producción de inmunoglobulina A secretora, lo que permitiría una protección más eficaz frente a infecciones respiratorias y digestivas.
Otro objetivo clave es la potenciación de la memoria inmunológica, tanto humoral como celular, favoreciendo la generación de linfocitos B de memoria y de linfocitos T de larga vida, incluidos los linfocitos T residentes en tejidos. Esta estrategia podría traducirse en una protección más duradera y en una reducción del número de dosis necesarias.
Asimismo, los adyuvantes del futuro buscan una mejor activación de la inmunidad celular, especialmente de linfocitos T CD8+, fundamental para la protección frente a patógenos intracelulares y para determinadas vacunas virales.
9.7. Conclusiones
Los adyuvantes son componentes esenciales de las vacunas modernas, que permiten potenciar y dirigir la respuesta inmunitaria frente a antígenos que, por sí solos, serían poco inmunógenos, especialmente en la población pediátrica. Su papel va más allá de la simple intensificación de la respuesta, ya que influyen en la calidad, duración y tipo de inmunidad inducida, actuando principalmente sobre la co-estimulación y el microambiente inflamatorio que condicionan la activación de linfocitos T y B.
Los adyuvantes clásicos, como las sales de aluminio, han demostrado eficacia y seguridad durante décadas, mientras que las emulsiones, sistemas combinados y adyuvantes de nueva generación, como Matrix-M, ofrecen respuestas más equilibradas y adaptadas a distintos tipos de patógenos. Los avances recientes abren la puerta a vacunas capaces de inducir inmunidad mucosa, memoria prolongada y activación eficiente de la inmunidad celular, áreas todavía poco cubiertas por los adyuvantes tradicionales.
En vacunología, el desarrollo y aplicación de adyuvantes más específicos y eficaces permite optimizar los esquemas vacunales, reducir el número de dosis necesarias y garantizar una protección más temprana y duradera.
En definitiva, los adyuvantes constituyen una herramienta clave para mejorar la efectividad, seguridad y sostenibilidad de la vacunación infantil, y su innovación continua es fundamental para afrontar los retos de la prevención de enfermedades infecciosas en las próximas décadas.
10. Aspectos inmunológicos de la inmunización maternal
A pesar de los importantes avances logrados en las últimas décadas en supervivencia infantil, las enfermedades infecciosas siguen estando entre las principales causas de morbilidad y mortalidad, especialmente durante el período neonatal. Los recién nacidos tienen un mayor riesgo de sufrir infecciones porque cuentan con un sistema inmune en desarrollo que no siempre es capaz de generar una respuesta inmune protectora eficiente contra los patógenos.
Los programas de vacunación sistemáticos han mejorado significativamente la supervivencia infantil en todo el mundo al prevenir infecciones como la polio, la tosferina, la viruela y el sarampión. Sin embargo, en lo que respecta a la inmunización neonatal, sólo existen unas pocas vacunas autorizadas para su administración en los primeros días de vida debido a la respuesta poco eficiente del sistema inmunitario a estas edades inmaduras.
La inmunización maternal es una estrategia de salud pública altamente eficiente para proteger a la madre, el feto y el lactante de las infecciones. Los anticuerpos específicos de origen maternal transferidos a través de la placenta al feto en desarrollo representan una herramienta óptima para proteger a los bebés vulnerables hasta que su sistema inmunitario pueda responder adecuadamente a las vacunas o infecciones. Estos anticuerpos generados por la madre se transfieren pasivamente a través de la placenta y posteriormente en el calostro y la leche materna, y se encuentran preparados para combatir las infecciones en las primeras etapas de la vida. Es motivo de discusión en estos últimos años la concentración óptima necesaria para una protección efectiva en el neonato y el momento más adecuado de vacunación para alcanzarla.
Una cuestión de debate abierta sigue siendo el llamado “blunting” inmunológico, es decir, el fenómeno por el cual los anticuerpos maternos pueden interferir con la respuesta posterior del niño a la vacunación. Por otro lado, se ha sugerido que la madre también puede transmitir células inmunitarias al niño mediante transferencia placentaria. Las células maternas pueden ayudar al desarrollo del sistema inmunológico fetal y neonatal.
10.1. El sistema inmunitario materno y fetal.
Sistema inmunológico materno y la interfaz materno-fetal
Al comienzo del embarazo, el sistema inmunológico materno sufre una remodelación programada con objeto de permitir la implantación, preservación y crecimiento del feto semi-alogénico y que no sea rechazado como elemento extraño. Los sistemas inmunológicos materno y fetal cooperan en un delicado equilibrio entre factores anatómicos, endocrinos, metabólicos y del microbioma. Es importante destacar que, en las mujeres embarazadas, la capacidad de generar una respuesta inmunitaria adecuada tras una infección o tras la vacunación no se ve afectada, por tanto, no podemos hablar de una inmunodepresión en la mujer embarazada, sino de inmunomodulación.
Los principales cambios en el sistema inmunológico materno se pueden resumir en tres fases:
- el 1er trimestre requiere un fuerte estado pro-inflamatorio para garantizar la correcta implantación del blastocisto en el útero. Este proceso implica la rotura del revestimiento epitelial del útero, daño del tejido endometrial y un reordenamiento del endotelio y del músculo liso vascular de los vasos sanguíneos maternos para establecer un suministro sanguíneo placentario-fetal adecuado. Todas estas actividades requieren un ambiente inflamatorio para asegurar la adecuada reparación del epitelio uterino y la eliminación de los restos celulares;
- en el 2.º y 3er trimestre prevalece la respuesta anti-inflamatoria, permitiendo la tolerancia del feto semialogénico, su rápido crecimiento y desarrollo.
- Finalmente, el cambio a un nuevo estado pro-inflamatorio favorece la cascada de eventos que conducen al parto. Poblaciones celulares específicas median la transición del estado pro- al anti-inflamatorio y viceversa.
En primer lugar, los linfocitos T participan a través de un cambio desde una respuesta de linfocitos T auxiliares (Th1) tipo 1, orientada hacia la inmunidad mediada por células, hacia una respuesta de linfocitos T auxiliares (Th2) tipo 2, que favorece la inmunidad humoral al estimular las células B para aumentar la producción de anticuerpos maternos. Los linfocitos Th2 son fundamentales para la tolerancia inmunológica madre-hijo hasta el momento del parto, suprimiendo la actividad de las células T citotóxicas. Además, las células T reguladoras (Treg), un subtipo de células T CD4+ que expresan CD25, aumentan durante el embarazo y contribuyen al mantenimiento de la tolerancia inmunológica del feto al suprimir activamente los linfocitos autorreactivos. Durante el embarazo, la barrera inmunitaria materna contra las infecciones utiliza una combinación de señales y moduladores inmunitarios que se originan en la díada feto-placentaria, incluidas la placenta y la decidua.
De hecho, la placenta es un sitio activo de la respuesta inmune innata capaz de reaccionar ante patógenos mediante la liberación de péptidos antimicrobianos y citoquinas. Sin embargo, un segundo sitio importante de respuestas inmunes innatas se localiza en la capa decidual. La interfaz materno-fetal representa el contacto directo entre el embrión y la madre y está poblada por células trofoblásticas fetales, células estromales deciduales maternas (DSC) y células inmunitarias deciduales (DIC) La decidua es un sitio activo de síntesis de quimiocinas durante la gestación, atrayendo neutrófilos, células asesinas naturales, células dendríticas y macrófagos. Sin embargo, la transferencia de mediadores inflamatorios innatos de la madre al feto no se comprende tan bien.
Finalmente, a principios del segundo trimestre, el sistema inmunitario materno protege al feto mediante la transferencia pasiva de anticuerpos maternos (isotipo IgG) y células inmunitarias maternas a través de la placenta.
Sistema inmunológico fetal y neonatal
El sistema inmunológico humano comienza a desarrollarse después de las primeras 2 a 3 semanas de vida fetal, cuando la hematopoyesis y la generación de células madre hematopoyéticas (HSC) pluripotentes y autorrenovables comienzan en el saco vitelino y en la región aorta-gónada- mesonefros del embrión. Posteriormente, las HSC migran al hígado fetal, lo que representa el principal sitio hematopoyético durante la vida fetal, ya que la localización en la médula ósea ocurre en la semana 20. La diferenciación y maduración de las células T ocurren en el timo. Durante la embriogénesis, las células inmunitarias también habitan en órganos periféricos, incluidos la piel, el intestino, los riñones y los pulmones, y participan en el entorno del órgano respectivo. Las células inmunes innatas son las primeras en aparecer: se detectan granulocitos, células NK y precursores de linfocitos en la circulación fetal entre la semana gestacional 8-10. Desde la semana 8, las HSC migran al rudimento tímico y, entre la semana 16 y 20, las células T maduras se liberan a la sangre periférica. Las células precursoras linfoides se convierten en linfocitos B con posterior maduración funcional en el tejido linfoide secundario (p. ej., ganglios linfáticos y bazo) hacia el final del primer trimestre.
Así, durante el segundo trimestre, las células inmunitarias, predominantemente linfocitos, aumentan en número, maduran y se diferencian.
Hacia el final del tercer trimestre, el sistema inmunológico fetal es funcional y capaz de producir una respuesta. Diversos tipos de células inmunes se desarrollan y maduran en diversas etapas gestacionales, lo cual es necesario para establecer la tolerancia feto-materna y respuestas funcionales de acuerdo con demandas específicas. La respuesta de las células T fetales y neonatales se desplaza hacia la supresión de la citotoxicidad: con una fuerte polarización Th2, un perfil de citoquinas anti-inflamatorias dominante y Tregs que dominan la circulación fetal, suprimiendo la reactividad a antígenos maternos no heredados. Al nacer, la respuesta innata del neonato se caracteriza por una alta producción de IL-10, IL-6 e IL-23, que inducen células T auxiliares productoras de IL-17 (células Th17). El predominio de un patrón similar a Th17, combinado con una producción considerable de IL-10, puede contribuir a una disminución de las respuestas de T helper tipo 1 (Th1), lo que resulta en una mayor susceptibilidad a infecciones víricas y una disminución de las respuestas a las vacunas durante la infancia.
Desde el parto, la exposición a amenazas ambientales durante la infancia y la niñez promueve una mayor adaptación del sistema inmunológico. La exposición a un mundo de antígenos extraños durante las primeras semanas después del nacimiento conduce a un aumento masivo de linfocitos. Las células B y T son abundantes al nacer, seguidas de una disminución gradual durante los primeros años de vida hasta la edad adulta. Como era de esperar, el recién nacido presenta una menor cantidad de células B de memoria en comparación con los de mayor edad, lo que refleja la falta de exposición a antígenos extraños durante la vida fetal. La frecuencia de células B de memoria aumenta lentamente con la edad y alcanza niveles adultos en niños de 10 a 15 años.
En resumen, el sistema inmunológico humano sigue una trayectoria de desarrollo precisa con extraordinaria plasticidad en respuesta a las diferentes necesidades. Sin embargo, tras la exposición al antígeno, la generación de una inmunidad protectora específica lleva tiempo; por tanto, la inmunización materna representa una gran oportunidad para reducir el riesgo de enfermedad en la madre, el feto y el lactante.
⌂
10.2. Impacto de la vacunación materna en el sistema inmunitario en los primeros años de vida.
Transferencia de anticuerpos maternos a través de la placenta y la leche materna
La inmunización de la madre durante el embarazo aumenta los anticuerpos específicos generados por acción de la vacunación para garantizar una protección eficiente no solo de la madre, sino también del niño en los primeros meses de vida. La concentración de anticuerpos maternos en el suero del recién nacido determina la efectividad de la protección. Es necesario comprender bien los mecanismos mediante los cuales se transfieren los Ac IgG a través de la placenta para desarrollar estrategias óptimas de inmunización materna e infantil y poder tomar decisiones sobre el momento óptimo de vacunación durante el embarazo.
Los mecanismos de transferencia dependen de varios factores, incluido el sincitiotrofoblasto y la barrera capilar. Los Ac IgG se transportan selectivamente desde la sangre materna al feto a través del receptor Fc neonatal (FcRn) expresado en el sincitiotrofoblasto de la placenta. El FcRn es un receptor Fc relacionado con el complejo principal de histocompatibilidad (MHC) de clase I implicado en la transcitosis bidireccional de IgG y complejos inmunes IgG a través de varios epitelios humanos. Se une al fragmento Fc de los anticuerpos Ig a pH ácido. En la sangre materna, con un pH fisiológico de 7,4, la IgG no puede unirse al FcRn en el lado apical de los sincitiotrofoblastos y necesita ser transportada por endocitosis (Figura 1A). En el ambiente ácido de los endosomas, los complejos FcRn-IgG son transportados al lado fetal del sincitiotrofoblasto, donde se libera IgG tras la exposición a un pH normal. Posteriormente, la IgG cruza el estroma de las vellosidades y el endotelio capilar fetal y entra en la circulación fetal, aunque este mecanismo no es del todo comprendido. Varios factores afectan la transferencia de IgG de la madre a la circulación fetal, es decir, la cantidad de FcRn expresada por los sincitiotrofoblastos y los niveles maternos totales de IgG. De hecho, se ha observado que cuando la cantidad de IgG materna alcanza un nivel de 15 g/L, el receptor FcRn se satura y se detiene la transferencia de Ac.
La transferencia placentaria de IgG también depende de la edad gestacional. El proceso comienza durante el primer trimestre del embarazo y aumenta exponencialmente con el tiempo. La mayor parte de la transferencia de IgG ocurre después de las 28 semanas de gestación. A medida que avanza el embarazo y la placenta crece en masa celular, la expresión de FcRn podría aumentar con una tasa de transporte de anticuerpos relativamente mayor. Aunque en los bebés prematuros el período reducido de gestación conduce a una transferencia placentaria de IgG más baja y menos eficiente, varios estudios respaldan la eficacia de la vacunación materna temprana para reducir el riesgo de infecciones en el nacimiento.
La eficacia de la transferencia a través de la placenta depende de la afinidad del subtipo de IgG por el receptor FcRn. IgG1 es el subtipo de anticuerpos que se transfiere con mayor eficacia al feto, seguido de IgG4, IgG3 e IgG2. Esta capacidad diferencial de transferencia de inmunoglobulinas es importante en el contexto de la vacunación durante el embarazo. Mientras que la IgG1 y cantidades más pequeñas de IgG3 e IgG4 son inducidas predominantemente por vacunas que contienen antígenos proteicos, como el tétanos, la difteria, la tosferina (Tdpa), la IgG2 y parcialmente la IgG1, son inducidas predominantemente por vacunas que contienen antígenos polisacáridos, como Haemophilus influenzae tipo b o Neisseria meningitidis.
Las infecciones maternas previas son otro factor que puede afectar la cantidad y la cantidad específica de anticuerpos IgG maternos que se transportarán a través de la placenta, como se observó en madres infectadas por el virus de la inmunodeficiencia humana-1 (VIH-1) o malaria.
La lactancia materna representa otro mecanismo mediante el cual la madre protege al recién nacido contra patógenos en las primeras etapas de la vida (figura 48.10). De hecho, la IgA secretora materna (sIgA) y, en menor medida, la IgG y la IgM, se secretan en el calostro y la leche materna y siembran el tracto luminal del recién nacido, lo que confiere un beneficio inmunológico añadido. En particular, la sIgA proporciona defensa a nivel de la mucosa contra patógenos del tracto gastrointestinal y respiratorio mediante la neutralización directa, la inactivación y la prevención de la adherencia a las células epiteliales de toxinas y otros factores de virulencia. Varios estudios sobre el papel protector de la leche materna en mujeres vacunadas durante el embarazo identificaron una gran cantidad de sIgA específica de la vacuna en las muestras de leche materna hasta varias semanas después del parto. No es sorprendente que también se haya informado de una menor incidencia de enfermedades respiratorias con episodios de fiebre en bebés pequeños de madres vacunadas contra la influenza. Es de destacar que en la leche materna también se detectan presencia de diferentes poblaciones de células inmunitarias maternas, incluidas células dendríticas, macrófagos, células asesinas naturales (NK) y células T y de memoria. Se ha sugerido que estas células pueden modular el sistema inmunológico neonatal e infantil en desarrollo.
Figura 48.10. Anticuerpos maternos a través de la placenta y de la lactancia materna.
(A) Los anticuerpos maternos IgG atraviesan la placenta a través de la vía específica del receptor neonatal (FcRn) hasta llegar a la circulación fetal y proteger al neonato en los primeros meses de vida.
(B) A través de la lactancia materna se produce transferencia de anticuerpos maternos, principalmente (pero no exclusivamente) de tipo IgA que permiten prolongar la protección durante varios meses tras el parto.
Posible interferencia de los Ac maternos con la vacunación infantil: efecto blunting
A pesar de las evidencias del papel protector de los anticuerpos IgG maternos, existen preocupaciones sobre su posible interferencia con la respuesta de anticuerpos infantiles a las vacunas administradas en los primeros meses de vida. Se ha sugerido que la presencia de anticuerpos maternos podría dar lugar a una disminución de la producción de anticuerpos por parte del lactante después de la vacunación y, en consecuencia, a una menor protección del niño. Este fenómeno, llamado “blunting”, se ha asociado no sólo a los anticuerpos transferidos por la madre al feto tras la vacunación, sino también a los generados en respuesta a una infección natural antes o durante el embarazo.
Se ha observado “blunting” inmunológico en varios estudios sobre la vacunación materna contra el tétanos, la difteria, la tosferina, la gripe, el sarampión y las paperas, pero los resultados son controvertidos y la etiopatogenia y la relevancia clínica están aún por demostrar. De hecho, los niveles bajos de anticuerpos tras la vacunación no implican necesariamente un bajo grado de protección clínica. Los niños nacidos de madres inmunizadas y vacunadas contra la difteria, el tétanos, la polio, la hepatitis B y el Hib tenían niveles de anticuerpos más bajos que los niños de madres no vacunadas. Sin embargo, los anticuerpos específicos alcanzaron niveles considerados protectores para todos los antígenos. Además, no se ha encontrado evidencia de un efecto clínicamente significativo del blunting en los EE. UU. y el Reino Unido, donde se implementó la vacunación materna Tdpa desde 2011 (EE. UU.) y 2012 (Reino Unido). La protección inducida por las vacunas está relacionada no sólo con la concentración de anticuerpos, sino también con sus capacidades funcionales, como la avidez y el potencial de neutralización, y con la generación de células B de memoria, aspectos todos ellos aún no evaluados exhaustivamente en ningún trabajo.
Finalmente, el efecto de los anticuerpos maternos sobre las respuestas inmunes celulares tras la vacunación infantil es otro aspecto interesante para considerar. Estudios recientes en humanos muestran que los anticuerpos maternos preexistentes no afectan a la respuesta inmune celular de los bebés tras la vacunación primaria.
Transferencia de células maternas a través de la placenta
El sistema inmunológico fetal tiene capacidad para responder a antígenos extraños durante el embarazo. Cada vez hay más evidencia que sugiere que la infección materna o la vacunación durante la gestación pueden moldear y entrenar el sistema inmunológico fetal incluso en ausencia de infección fetal, afectando las respuestas inmunes de los bebés a los patógenos y las vacunas durante la vida extrauterina.
Los mecanismos exactos por los cuales el sistema inmune fetal es entrenado en ausencia de infección fetal aún no están claros. Una posible explicación es la transmisión vertical de un bajo nivel de antígenos de la madre al feto. Una segunda hipótesis es que las células maternas que transportan el antígeno o las microvesículas cargadas de antígeno cruzan la barrera placentaria. De hecho, las células maternas se encuentran en los tejidos fetales humanos a partir del segundo trimestre del embarazo. Este fenómeno natural se conoce como microquimerismo (Mc). Se define como la presencia en un organismo de un pequeño número de células o cantidad de ADN procedente de un individuo genéticamente diferente. El Mc se origina en el intercambio celular bidireccional durante el embarazo. Entre las funciones aceptadas de Mc, cabe mencionar la de promover la tolerancia feto-materna y mejorar el resultado de futuros embarazos. La tolerancia feto-materna es el proceso que permite que las células y tejidos fetales y maternos eviten el rechazo inmunológico y permitan su coexistencia. Los componentes inmunes fetales, expuestos a los tejidos maternos, toleran antígenos maternos extraños no heredados (NIMA). Por otro lado, las madres durante el embarazo abarcan antígenos paternos genéticamente extraños expresados por el feto en desarrollo. Esto coincide con una transferencia bidireccional a través de la placenta de células que se exponen tanto en los tejidos maternos como fetales.
La presencia de células microquiméricas maternas en el feto favorece la generación de células T reguladoras (T reg) fetales, que se generan en el útero contra las NIMA expresadas por las células maternas y aseguran la tolerancia fetal suprimiendo las funciones de las células T fetales. Además de promover la tolerancia, Mc podría ser crucial para preparar el sistema inmunológico fetal para enfrentar los patógenos después del nacimiento. A pesar del contexto tolerogénico predominante, se ha informado de la existencia de células T de memoria fetal en el bazo y el intestino del feto, así como en la sangre del cordón umbilical. La generación de células T de memoria requiere la exposición fetal a antígenos extraños presentados por células presentadoras de antígenos (APC). Se ha supuesto que la APC materna cargada con antígeno puede atravesar la placenta y preparar el sistema inmunológico fetal. También se han encontrado células T de memoria fetal en niños no infectados nacidos de madres infectadas con el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB), el virus de la hepatitis C (VHC) o el plasmodio. En regiones endémicas, se ha observado que la infección materna por helmintos, incluidas la filariasis, la esquistosomiasis, la oncocercosis y la ascariasis, se asociaba con respuestas linfocíticas fetales y la consiguiente producción de inmunoglobulinas específicas. Si las células inmunitarias fetales responden a los antígenos de los agentes infecciosos transportados por la madre, parece razonable que el sistema inmunitario fetal también responda a la exposición del antígeno materno a los patógenos. Curiosamente, la inmunización materna con toxoide tetánico produjo anticuerpos IgM antitetánicos en la sangre de los niños antes de la inmunización neonatal con la vacuna antitetánica, lo que demuestra que el antígeno de la vacuna está disponible y que activa el sistema inmunológico fetal.
Es de destacar que se detectaron células T específicas del virus de la gripe en células de la sangre del cordón umbilical de recién nacidos cuyas madres recibieron la vacuna durante el embarazo. La exposición a antígenos mediados por células maternas en el útero también podría afectar el desarrollo de células inmunes innatas fetales, como macrófagos y monocitos. No es sorprendente que la programación fetal de los monocitos sea funcionalmente diferente a la del adulto. Se ha demostrado que en los monocitos fetales la estimulación con IFN-γ, IL-6 o IL-4 genera distintas respuestas de señalización JAK/STAT, desencadenando así respuestas innatas y actividades antimicrobianas en lugar de promover una fuerte respuesta inflamatoria adaptativa y potencialmente dañina. Los monocitos fetales pueden generar una respuesta antimicrobiana innata más primitiva, pero potencialmente protectora, que también puede optimizar las posibilidades del feto y del recién nacido de combatir con éxito un invasor microbiano. Estas observaciones añaden información importante para comprender el potencial de la vacunación durante el embarazo, incluida la capacidad de modular el desarrollo del sistema inmunológico innato del feto. El momento de la vacunación materna puede influir en la transferencia transplacentaria de los antígenos de la vacuna y la posterior respuesta inmune fetal.
11. Bibliografía
- Cinicola B, et al. The Protective Role of Maternal Immunization in Early Life. Front Pediatr. 2021;9:638871.
- Clem AS. Fundamentals of Vaccine Immunology. J Glob Infect Dis. 2011;3:73-8.
- Delves P, et al. Fundamentos de Inmunología 11.ª edición. Editorial Panamericana 2008.
- Etti M, et al. Maternal vaccination: a review of current evidence and recommendations. Am J Obstet Gynecol. 2022;226:459-74.
- Kurosaki T, et al. Memory B cells. Nat Rev Immunol. 2015;15:149-59.
- Lagousi T, et al. Protecting the Offspring, the Gift of Maternal Immunization: Current Status and Future Perspectives. Vaccines (Basel). 2022;10:1953.
- Leo O, et al. Vaccine immunology. Understanding modern vaccines: perspectives in vaccinology Ed. Elsevier 2011. pp. 25-59.
- Maisonneuve C, et al. Unleashing the potential of NOD and Toll-like agonists as vaccine adjuvants. Proc Natl Acad Sci USA. 2014;111:12294-9.
- Netea MG, et al. Defining trained immunity and its role in health and disease. Nat Rev Immunol. 2020;20:375-88.
- Netea MG, et al. Trained Immunity: a Tool for reducing susceptibility to and the severity of SARS-Cov-2 infection. Cell. 2020;181:969-77.
- Netea MG, et al. Trained immunity: a program of innate immune memory in health and disease. Science. 2016;352:aaf1098.
- Murphy K, Weaver. Janeways´s Immunobiology 9th edition Garland Science 2017.
- Plotkin SA, et al. Vaccines 4th edition Ed Saunders 2004.
- Pulendran B, et al. Emerging concepts in the science of vaccine adjuvants. Nat Rev Drug Discov. 2021;20:454-75.
- Pulendran B, et al. Immunological mechanisms of vaccination. Nat Immunol. 2011;12:509-17.
- Quincer EM; et al. Prenatal Maternal Immunization for Infant Protection: A Review of the Vaccines Recommended, Infant Immunity and Future Research Directions. Pathogens 2024,13:200.
- Reed SG, et al. Key roles of adjuvants in modern vaccines. Nat Med. 2013;19:1597-608.
- Roman F, et al. Adjuvant system AS01: from mode of action to effective vaccines. Expert Rev Vaccines. 2024;23:715-29.
- Siegrist CA. Vaccine immunology from the immunological basis for immunization series. Edited by Elsevier and World Health Organization (WHO) 2017.
- Stertman L, et al. The Matrix-MTM adjuvant: A critical component of vaccines for the 21st century. Hum Vaccin Immunother.2023;19:2189885.
- van der Meer JW, et al. Trained immunity: a smart way to enhance immune defence. Mol Immunol. 2015;68:40-4.
- Vojtek, I., et al. Maternal immunization: where are we now and how to move forward? Ann Med. 2018;50:193-208.
- Xing J, et al. The recent advances in vaccine adjuvants. Front Immunol. 2025;16:1557415.
- Zhang L, et al. Effect of vaccine administration modality on immunogenicity and efficacy. Expert Rev Vaccines. 2015;14:1509-23.
- Zhao T, et al. Vaccine adjuvants: mechanisms and platforms. Signal Transduct Target Ther. 2023;8:283.
12. Enlaces de interés
- British Society for Immunology. All about vaccines
- Centers for Disease Control and Prevention. Principles of Vaccination
- World Health Organization. Vaccine Immunology
13. Historial de actualizaciones
| 8 de febrero de 2019 | Creación de todos los apartados del capítulo |
| 23 de enero de 2021 | Se añade el apartado "Vacunas e inmunidad entrenada". Nuevas citas bibliográficas |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 23 de abril de 2024 | Se añade el apartado "Aspectos inmunológicos de la inmunización maternal" y la figura 48.7. Nuevas citas bibliográficas |
| 14 de enero de 2026 | Actualización de todos los apartados y creación de un nuevo apartado "Adyuvantes y su papel en las vacunas actuales". Nuevas citas bibliográficas |
-oOo-