Vacunas contra la covid de ARN: BNT162b2 de BioNTech y Pfizer
Fecha de actualización: 8 de enero de 2021
Se continúa el repaso a los datos más relevantes sobre el desarrollo y evaluación de las vacunas frente a la covid. Hace unos días fue la vacuna de Moderna, ahora es el caso la vacuna de ARN BNT162b2, de BioNTech y Pfizer.
Vacunas de ARN: BNT162b2 (BioNTech & Pfizer)
- Desarrollada por: BioNTech (Mainz, Alemania) y Pfizer (EE. UU.).
- Vacuna basada en ARNm que codifica la proteína S del SARS-CoV-2 en una nanopartícula lipídica.
Toda la información en una tabla (PDF, 3 páginas).
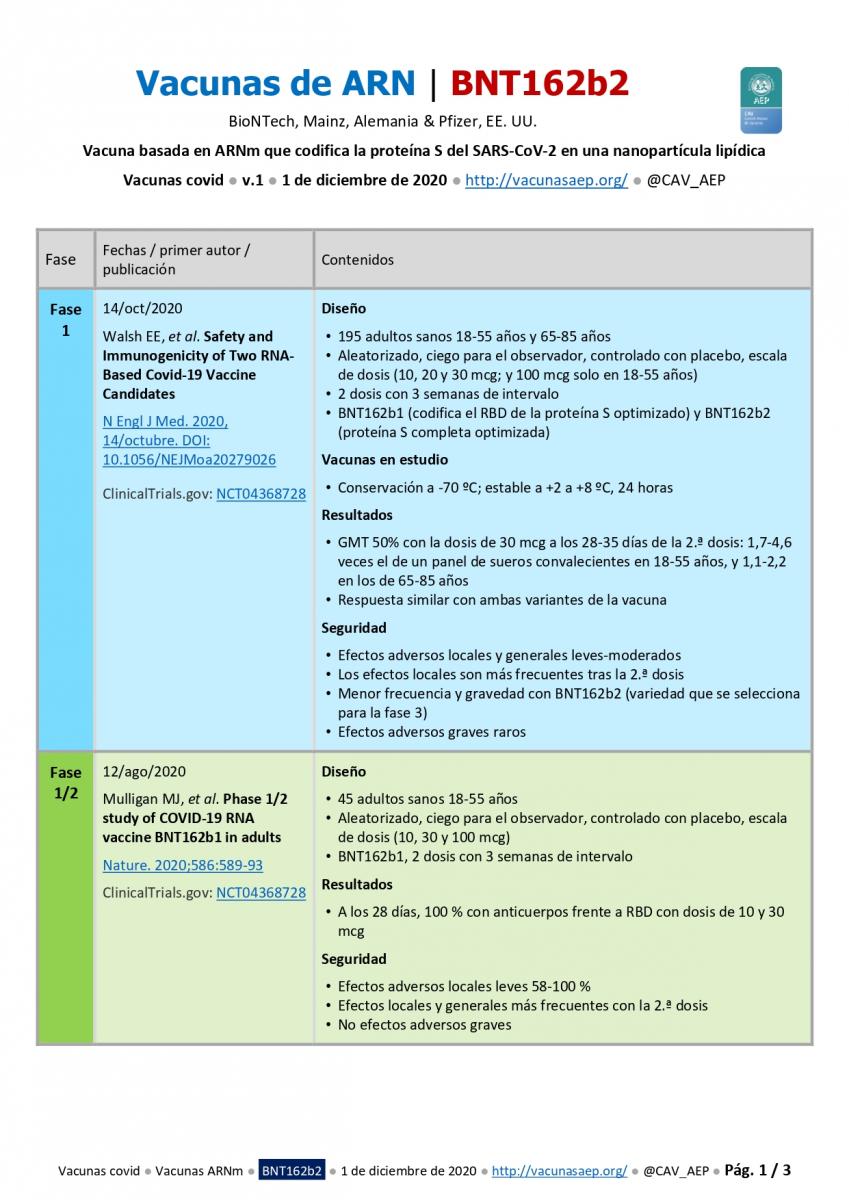
Fase 1
 14 de octubre de 2020 ● Walsh EE, et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N Engl J Med. 2020;383:2439-50.
14 de octubre de 2020 ● Walsh EE, et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N Engl J Med. 2020;383:2439-50.
- Diseño: a) 195 adultos sanos 18-55 años y 65-85 años; b) Aleatorizado, ciego para el observador, controlado con placebo, escala de dosis (10, 20 y 30 mcg; y 100 mcg solo en 18-55 años); c) BNT162b1 (codifica el RBD de la proteína S optimizado) y BNT162b2 (proteína S completa optimizada), 2 dosis con 3 semanas de intervalo.
- Vacunas en estudio: conservación a -70 ºC; estable a +2 a +8 ºC, 24 horas.
- Resultados: a) GMT 50% con la dosis de 30 mcg a los 28-35 días de la 2.ª dosis: 1,7-4,6 veces el de un panel de sueros convalecientes en 18-55 años, y 1,1-2,2 en los de 65-85 años; b) Respuesta similar con ambas variantes de la vacuna.
- Seguridad: a) Efectos adversos locales y generales leves-moderados; b) Los efectos locales son más frecuentes tras la 2.ª dosis; c) Menor frecuencia y gravedad con BNT162b2 (variedad que se selecciona para la fase 3); d) Efectos adversos graves raros.
- ClinicalTrials.gov: NCT04368728.
Fase 1/2
 12 de agosto de 2020 ● Mulligan MJ, et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 2020;586:589-93.
12 de agosto de 2020 ● Mulligan MJ, et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 2020;586:589-93.
- Diseño: a) 45 adultos sanos 18-55 años; b) Aleatorizado, ciego para el observador, controlado con placebo, escala de dosis (10, 30 y 100 mcg); c) BNT162b1, 2 dosis con 3 semanas de intervalo.
- Resultados: a) A los 28 días, 100 % con anticuerpos frente a RBD con dosis de 10 y 30 mcg.
- Seguridad: a) Efectos adversos locales leves 58-100 %; b) Efectos locales y generales más frecuentes con la 2.ª dosis; c) No efectos adversos graves.
- ClinicalTrials.gov: NCT04368728.
30 de septiembre de 2020 ● Sahin U, et al. COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses. Nature. 2020;586:594-9.
- Diseño: a) 35 adultos sanos de 18-55 años; b) Abierto, no aleatorizado, escala de dosis 1 y 50 mcg; c) BNT162b1, 2 dosis con 3 semanas de intervalo.
- Resultados: a) Respuesta celular CD4+ y CD8+ y de anticuerpos neutralizantes.
Fase 3
Septiembre de 2020 ● Pfizer. Protocolo del estudio en fase 3.
7 de octubre de 2020 ● Noticia AEMPS ● La EMA inicia la evaluación de la segunda propuesta de vacuna contra la COVID-19
 9 de noviembre de 2020 ● Nota de prensa de Pfizer y BioNTech ● Pfizer and BioNTech announce vaccine candidate against Covid-19 achieved success in first interim analysis from phase 3 study.
9 de noviembre de 2020 ● Nota de prensa de Pfizer y BioNTech ● Pfizer and BioNTech announce vaccine candidate against Covid-19 achieved success in first interim analysis from phase 3 study.
Primer análisis intermedio:
- Diseño: a) Comienzo de la fase 3 el 27/julio; b) Participantes con heterogeneidad de sexo, edad (≥16 años) y etnicidad; el 41 % con edad 56-85 años; c) BNT162b2, con pauta de 2 dosis de 30 mcg y 3 semanas de intervalo; d) 43.538 participantes, de los cuales 89 % han recibido ya dos dosis.
- Resultados: a) 94 casos, eficacia vacunal (EV) >90 % a los 28 días, una semana después de la 2.ª dosis.
- Seguridad: a) No efectos adversos graves.
7 de octubre de 2020 ● Opinión ● Callaway E. What Pfizer’s landmark COVID vaccine results mean for the pandemic. Nature News. 2020. DOI: 10.1038/d41586-020-03166-8.
- Comentarios: a) Primera evidencia convincente de que una vacuna puede prevenir el COVID-19; b) Pero quedan dudas sobre cuánta protección ofrece, a quién y durante cuánto tiempo.
 18 de noviembre de 2020 ● Nota de prensa de Pfizer y BioNTech ● Pfizer and BioNTech conclude phase 3 study of COVID-19 vaccine candidate, meeting all primary efficacy endpoints.
18 de noviembre de 2020 ● Nota de prensa de Pfizer y BioNTech ● Pfizer and BioNTech conclude phase 3 study of COVID-19 vaccine candidate, meeting all primary efficacy endpoints.
Segundo análisis intermedio:
- Diseño: a) 43 661 participantes, finaliza el reclutamiento.
- Resultados: a) 170 casos, 162 en el grupo placebo y 8 en el de vacuna, a los 28 días, una semana después de la 2.ª dosis; b) Eficacia vacunal 95 % (p<0,0001), en ≥65 años EV 94 %; c) Casos graves: 10 en el grupo de placebo y uno en el de vacuna.
- Seguridad: a) No efectos adversos graves; b) Efectos adversos leves-moderados: cefalea 2 % y fatiga 3,8 %.

26 de noviembre de 2020 ● Opinión ● Doshi P. Pfizer and Moderna’s “95% effective” vaccines - let’s be cautious and first see the full data. BMJ, Opinion, 26 de noviembre.
- Limitaciones de los datos conocidos: a) Los datos aportados son de reducción del riesgo relativo (RRR); la RRA parece ser <1%; de prevención de cualquier forma de enfermedad, no la grave ni la transmisión; a un plazo corto (<3 meses); b) Tampoco informa de eficacia en colectivos especialmente frágiles; niños, adolescentes e inmunodeprimidos excluidos; c) La información difundida puede haber comprometido el cegamiento; d) No se asegura que se hacen PDIA en presencia de cualquier síntoma compatible; e) El uso de fármacos para aliviar efectos secundarios de la vacuna/placebo pueden enmascarar síntomas de infección por SARS-CoV-2; f) Los estudios deben proseguir aun después de la eventual aprobación de emergencia; g) No se ha dado a conocer la información que se proporciona a los participantes.
 10 de diciembre de 2020 ● Polack FP, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383:2603-15.
10 de diciembre de 2020 ● Polack FP, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383:2603-15.
- Infografía y vídeo (3 minutos) originales de NEJM, con un resumen este artículo.
- Comentario. Rubin EJ, et al. SARS-CoV-2 Vaccination - An Ounce (Actually, Much Less) of Prevention. N Engl J Med. 2020;383:2677-8.
Aprobación de uso por las agencias reguladoras
20 de noviembre de 2020 ● Nota de prensa de Pfizer y BioNTech ● Pfizer y BioNTech to submit emergency use authorization request today to the U.S. FDA for COVID-19 vaccine.
Solicitud de aprobación condicional:
- Pfizer y BioNTech envian solicitud de aprobación condicional a la FDA estadounidense.
- También solicitud de “rolling review” en Australia, Canadá, Japón, Reino Unido y Unión Europea.
20 de noviembre de 2020 ● Opinión IDSA ● IDSA Response to Pfizer Request for COVID-19 Vaccine EUA.
- Comentarios: a) Prioridad para los criterios técnicos de eficacia y seguridad, b) Los estudios deben continuar pese a la eventual aprobación.
1 de diciembre de 2020 ● Noticias ● Notas de prensa de la AEMPS y la EMA ● Solicitud de aprobación condicional.
- La EMA recibe la solicitud de autorización condicional de las vacunas contra la COVID-19 de BioNTech/Pfizer y Moderna.
- Fecha prevista pata la evaluación y decisión final: 29 de diciembre.
 2 de diciembre de 2020 ● Noticia de la BBC ● La BBC informa de que la agencia reguladora del Reino Unido, Medicines & Healthcare products Regulatory Agency (MHRA), ha aprobado el uso de la vacuna BNT162b2 y que su uso comenzará en pocos días:
2 de diciembre de 2020 ● Noticia de la BBC ● La BBC informa de que la agencia reguladora del Reino Unido, Medicines & Healthcare products Regulatory Agency (MHRA), ha aprobado el uso de la vacuna BNT162b2 y que su uso comenzará en pocos días:
- Aprobación de la MHRA, 2/dic de 2020.
- Información para profesionales, 2/dic de 2020. Ficha técnica del producto (html y pdf). Vacunación de sanitarios.
- Priorización para la vacunación de los grupos de riesgo, 3/dic de 2020.
- Información general para la población, para adultos de mayor edad, ¿qué efectos puede esperar tras la vacunación? (ver), etc.
- Mahase E. Vaccinating the UK: how the covid vaccine was approved, and other questions answered. BMJ. 2020;371:m4759.
 9 de diciembre de 2020 ● Canadá aprueba de la vacuna BNT162b2 de BioNTech y Pfizer, mediante una orden provisional.
9 de diciembre de 2020 ● Canadá aprueba de la vacuna BNT162b2 de BioNTech y Pfizer, mediante una orden provisional.
10 de diciembre de 2020 ● La FDA estadounidense reune el 10/dic a un comité asesor externo (Vaccines and Related Biological Products Advisory Committee, VRBPAC) en lo que puede ser el paso definitvo para una aprobación de emergencia.
- También ha publicado diverso material preparatorio, como: a) un documento elaborado por la propia FDA, de 53 páginas, en el que presenta el análisis de los expertos propios de la información disponible; y b) un documento similar proporcionado por Pfizer, de 92 páginas. En conjunto, es mucho más que lo conocido hasta ahora a través de notas de prensa del fabricante, Pfizer y BioNTech. Esta noticia comentada en CIDRAP, el 8/dic de 2020.
- Finalmente el VRBPAC emite una opinión favorable a la autorización de la vacuna BNT162b2.
 11 de diciembre de 2020 ● La FDA, tras valorar la recomendación favorable del panel de expertos externos (VRBPAC), otorga una autorización de uso de emergencia a la vacuna BNT162b2:
11 de diciembre de 2020 ● La FDA, tras valorar la recomendación favorable del panel de expertos externos (VRBPAC), otorga una autorización de uso de emergencia a la vacuna BNT162b2:
- Comunicación de la autorización a Pfizer.
- Nota de prensa.
- Información para profesionales y ficha técnica del producto (PDF, 29 páginas), información para la pacientes (PDF, 6 páginas).
13 de diciembre de 2020 ● Recomendaciones:
- ACIP. Interim Clinical Considerations for Use of Pfizer-BioNTech COVID-19 Vaccine.
- Vaccinating Pregnant and Lactating Patients Against COVID-19. ACOG, 13/dic 2020.
 21 de diciembre de 2020 ● La EMA emite una opinión favorable y la Comisión Europea autoriza la vacuna Comirnaty en la Unión Europea. Toda la información se encuentra en la web de la EMA dedicada a la covid, en el apartado dedicado a los tratamientos y vacunas:
21 de diciembre de 2020 ● La EMA emite una opinión favorable y la Comisión Europea autoriza la vacuna Comirnaty en la Unión Europea. Toda la información se encuentra en la web de la EMA dedicada a la covid, en el apartado dedicado a los tratamientos y vacunas:
- Información general de Comirnaty (en PDF, 4 páginas).
- Ficha técnica de Comirnaty (en español, EMA, 23/dic de 2020) (PDF, 33 páginas). Ficha técnica actualizada 08/ene de 2021 (en inglés).
- La EMA autoriza (8/ene de 2021) la obtención y uso de 6 dosis por vial (nota de prensa, AEMPS, 08/ene de 2021).
 31 de diciembre de 2020 ● La OMS incluye a la vacuna Comirnaty en el Emergency Use Listing para facilitar los procesos de aprobación en los países que no cuentan con agencias reguladoras. Asímismo, permite que UNICEF y otras agencias internacionales adquieran y faciliten la vacuna a países con menos recursos.
31 de diciembre de 2020 ● La OMS incluye a la vacuna Comirnaty en el Emergency Use Listing para facilitar los procesos de aprobación en los países que no cuentan con agencias reguladoras. Asímismo, permite que UNICEF y otras agencias internacionales adquieran y faciliten la vacuna a países con menos recursos.
-oOo-
Más información:
- The covid-19 messenger RNA vaccine tozinameran (Comirnaty, from Pfizer and BioNTech) in elderly patients: limited data, many uncertainties. Prescrire, 23/dic de 2020.
- CAV, 30 de noviembre de 2020. Vacunas contra la covid de ARN: mRNA-1273 de Moderna.
- Draft landscape of COVID-19 candidate vaccines. OMS, 12 de noviembre de 2020.
- The Treatments and Vaccines Considered for COVID-19. The Medical Letter, 1 de diciembre de 2020.
- CAV-AEP. Noticias sobre las vacunas de la covid en esta web.
- CAV-AEP, 18 de octubre de 2020. ¿Cómo seguir la evolución del desarrollo de las vacunas de la covid?
- Reino Unido. COVID-19 vaccination programme: COVID-19: vaccination programme guidance for healthcare practitioners y cap. 14 del Green Book.
- Goodman JL, et al. Answering Key Questions About COVID-19 Vaccines. JAMA. 2020;324(20):2027-8. Traducción al español por el Grupo de Trabajo COVID-19 de la Región de Murcia en APS.
- Welcome, 2 de diciembre de 2020. Seven vital questions about RNA Covid-19 vaccines.
- The COVID vaccine challenges that lie ahead. As positive results emerge at last, researchers must help the world to address vaccine hesitancy, supply logistics and pricing. Nature. 2020;587:522.
- N. Domínguez, A. Galocha. ARN, la molécula que puede evitar la pandemia. El País, 28 de noviembre de 2020.