Se acaban de publicar los resultados preliminares de un estudio de fase 2/3 de la versión pediátrica de la vacuna Comirnaty (Pfizer & BioNTech), que se resumen a continuación:
Se acaban de publicar los resultados preliminares de un estudio de fase 2/3 de la versión pediátrica de la vacuna Comirnaty (Pfizer & BioNTech), que se resumen a continuación:
- Walter EB, et al. Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 2021, 9/nov. DOI: 10.1056/NEJMoa2116298 [1].
Algunos de los datos presentados fueron adelantados por Pfizer & BioNTech [2] hace unas semanas.
Hace pocos días la FDA y los CDC estadounidenses han culminado la evaluación de esta vacuna [3] en los niños de 5-11 años de edad, concluyendo en su aprobación de emergencia y su recomendación activa, tras lo cual EE. UU. se dispone a comenzar la vacunación de este grupo de edad inmediatamente. Con esta ocasión se conocieron los documentos técnicos que estudiaron los comités asesores de la FDA (el VRBPAC) y de los CDC (el ACIP), que se complementan con la publicación que se comenta ahora.
La vacuna Comirnaty se autorizó en la Unión Europea el 21 de diciembre de 2020 en las personas de 16 o más años [4] de edad, y el 28 de mayo de 2021 en los adolescentes de 12-15 años [5]. En EE. UU., además, se ha autorizado, el pasado 29 de octubre, con la dosis de 10 mcg en los niños de 5-11 años.
Evaluación de la vacuna Comirnaty pediátrica en niños de 5-11 años de edad
En un estudio de fase 1 previo se estudiaron dosis de 10, 20 y 30 mcg, y se estableció la dosis a usar en las investigaciones posteriores (10 mcg). Finalmente se puso en marcha un estudio de fase 2/3, aún en curso (NCT04816643 [6]), para determinar la seguridad, inmunogenicidad y eficacia de 2 dosis de 10 mcg de la vacuna BNT162b2 en niños de 6 meses a 11 años de edad. En el artículo que se acaba de publicar se muestran los resultados iniciales en el grupo de niños de 5-11 años. Los autores hicieron sus declaraciones de potenciales conflictos de interés [7].
Los participantes de este grupo se reclutaron en 94 centros de investigación situados en EE. UU., España, Finlandia y Polonia. Los centros españoles han sido: Hospital Clínico Universitario (Santiago de Compostela, Coruña), EAP Centelles (Barcelona), Hospital Sant Joan de Deu (Esplugues De Llobregrat, Barcelona), Hospital Universitari General de Catalunya (Sant Cugat del Valles, Barcelona), Hospital Universitario HM Monteprincipe (Boadilla del Monte, Madrid), Hospital de Antequera (Málaga), Grupo Pediátrico Uncibay (Málaga), Hospital Universitario 12 de Octubre (Madrid), Hospital HM Puerta del Sur (Móstoles, Madrid), y Instituto Hispalense de Pediatria (Sevilla).
Metodología
- Estudio aleatorizado y controlado con placebo, doble ciego, en el que los participantes se distribuyeron según una razón 2:1 entre los grupos de intervención (vacunación: dos dosis de 10 mcg, con un intrervalo de 3 semanas) y placebo (solución salina). A los asignados en el grupo placebo se les ofrecerá la vacunación estándar después de 6 meses del inicio del estudio.
- Se ha registrado la reactogenicidad durante 7 días tras cualquier dosis y se vigilarán los eventos adversos graves hasta los 6 meses después de la segunda dosis.
- Se determinó la respuesta inmune un mes después de la segunda dosis en un subgrupo seleccionado aleatoriamente (322 en el grupo de vacuna y 163 en el grupo de placebo), y fue comparada, con análisis en paralelo, con la del grupo de 16-25 años con dosis de 30 mcg, también seleccionado al azar (300 en el grupo de vacuna y 50 en el de placebo). Un mes después de la 2.ª dosis se determinó la razón de la GMT de anticuerpos neutralizantes y la diferencia del porcentaje de serorespondedores.
- La eficacia vacunal [100x(1-RR)] se evaluó tras 7 días o más después de la segunda dosis.
- Se hará seguimiento de los participantes hasta 2 años después de recibir la vacuna.
Resultados
- Fecha de corte para la presentación de estos datos: 6 de septiembre de 2021.
- Participantes: 2268 (sin comorbilidad o con una situación estable de ellas; se excluyeron niños con inmunodeficiencias, antecedentes de SIM-P o con tratamientos inmunosupresores), 1517 recibieron la vacunación y 751 el placebo. Edad media: 8,2 años, y características demográficas similares entre los grupos estudiados.
- Mediana de seguimiento: 2,3 meses (en más del 90 % se completaron, al menos, 2 meses de seguimiento).
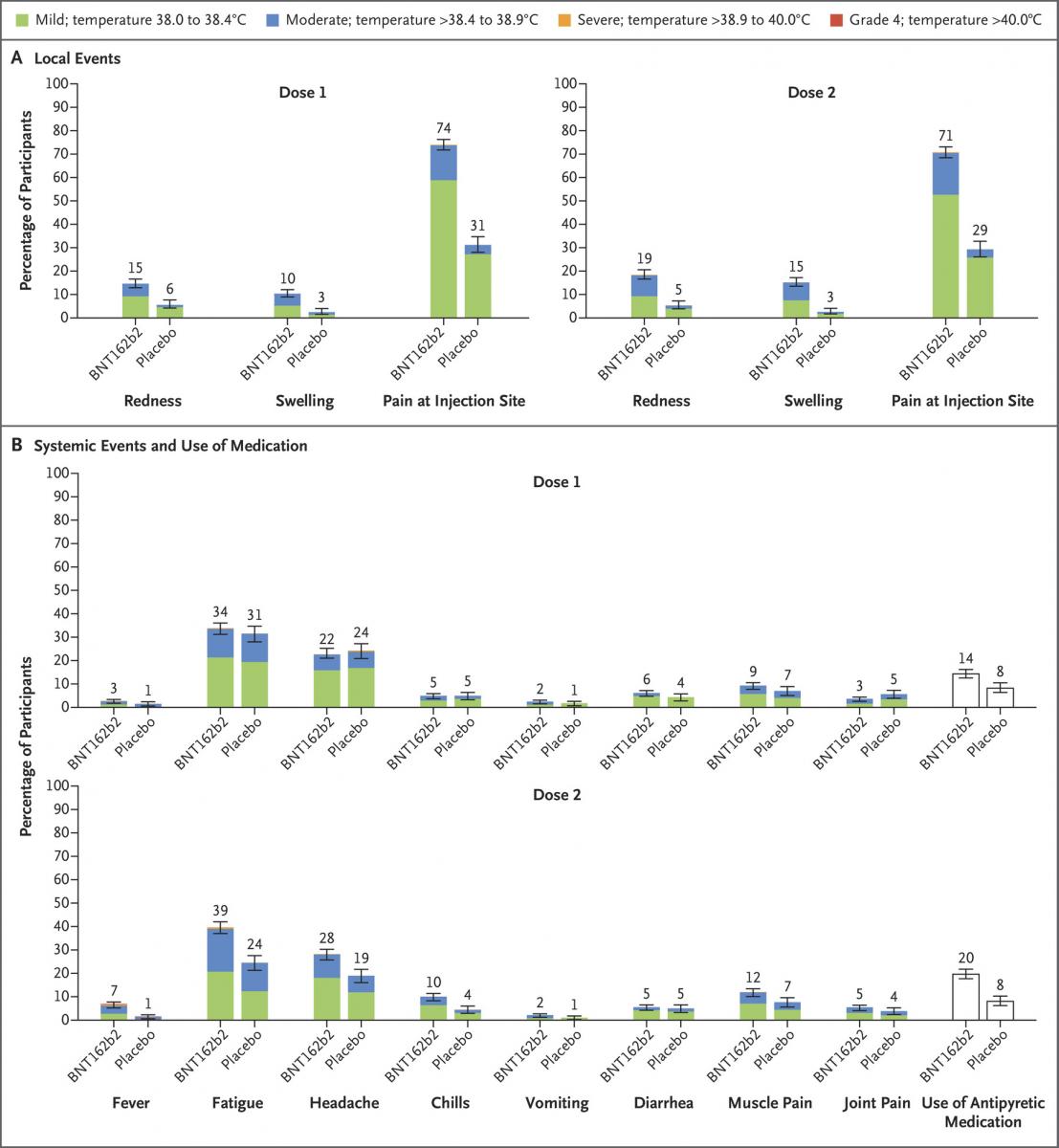
- Seguridad. Perfil de seguridad favorable. Los más frecuentes fueron dolor en el lugar de la inyección, cefalea y cansancio. Ver imagen adjunta. La reactogenicidad fue similar entre ambas dosis, y los síntomas sistémicos más frecuentes en la segunda dosis. No hubo efectos adversos graves relacionados con la vacunación.
- Inmunogenicidad:
- La razón de las medias geométricas (GMT) de los títulos de anticuerpos neutralizantes en el grupo de 5-11 años y el de 16-25 años (estos con dosis de 30 mcg) fue de 1,04 (IC 95 %: 0,93-1,18), cumpliendo así el criterio preestablecido de un límite inferior del intervalo de confianza de 0,67 (elevado hasta 1 a petición de la FDA). Ver imagen adjunta.
- Diferencia de porcentajes de serorespondedores de 0 (IC 95 %: -2 a 2,2), cumpliendo así el criterio de éxito preestablecido.
- Eficacia vacunal (EV) (ver imagen adjunta): una semana o después de la 2.ª dosis se detectaron 3 casos de infección por SARS-CoV-2 en el grupo de vacunación, por 16 en el grupo del placebo, estimando la EV en el 90,7 % (IC 95 %: 67,7-98,3 %).
Conclusiones de los autores
La pauta vacunal estudiada es segura, inmunógena y eficaz para prevenir la infección sintomática por el SAR-CoV-2 en los niños de 5-11 años de edad estudiados.
-oOO-
Más información
- Walter EB, et al. Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 2022;386:35-46 [1].
- CAV-AEP, 26 de octubre de 2021. Vacuna Comirnaty en niños de 5-11 años de edad: evalucación de la FDA [3].
- CAV-AEP, 24 de octubre de 2021. Efectividad de la vacuna Comirnaty en adolescentes [8].
- CAV-AEP, 28 de septiembre de 2021. Pfizer y BioNTech anuncian resultados preliminares de su vacuna de la covid en niños de 5-11 años [2].