Vacuna Comirnaty en niños de 5-11 años: evaluación de la FDA
Fecha de actualización: 3 de noviembre de 2021
 En los últimos días se han conocido nuevos datos de los ensayos de fase 2/3 de las vacunas de la covid Comirnaty y Spikevax en niños de 5 a 11 años de edad. También, que la FDA estadounidense se dispone a decidir sobre la autorización del uso de emergencia de la vacuna de Pfizer & BioNTech en este rango de edad.
En los últimos días se han conocido nuevos datos de los ensayos de fase 2/3 de las vacunas de la covid Comirnaty y Spikevax en niños de 5 a 11 años de edad. También, que la FDA estadounidense se dispone a decidir sobre la autorización del uso de emergencia de la vacuna de Pfizer & BioNTech en este rango de edad.
Se presenta una reseña breve de estos resultados y de las deliberaciones de la FDA.
Vacuna Comirnaty (Pfizer & BioNTech) en niños de 5-11 años de edad
 El pasado 20 de septiembre Pfizer & BioNTech anunciaron algunos datos preliminares del estudio de fase 2/3 de una versión adaptada de su vacuna Comirnaty en niños de 5-11 años de edad.
El pasado 20 de septiembre Pfizer & BioNTech anunciaron algunos datos preliminares del estudio de fase 2/3 de una versión adaptada de su vacuna Comirnaty en niños de 5-11 años de edad.
- Pocos días después, el 28 de septiembre, solicitaron su aprobación de emergencia a la FDA.
- La EMA ha anunciado el 18 de octubre que ha comenzado la evaluación de esta vacuna en niños de 5-11 años, tras la correspondiente solicitud de Pfizer & BioNTech.
Evaluación de la FDA
En el proceso de evaluación de la FDA estadounidense, el siguiente paso es que el Vaccines and Related Biological Products Advisory Committee (VRBPAC, comité independiente asesor de la FDA) revise los datos disponibles, lo que ha ocurrido en la reunión de este comité del pasado 26 de octubre de 2021. En esta reunión el VRBPAC ha recomendado (por 17 votos a favor y una abstención) la autorización de uso de emergencia de esta vacuna en los niños de 5-11 años de edad. Los dictámenes del VRBPAC no son vinculantes, pero generalmente la FDA los asume. Se presenta a continuación una breve reseña de algunos de los documentos evaluados por este comité:
- Documento remitido por Pfizer & BioNTech (PDF, 82 págs.) al VRBPAC para esta reunión.
- Análisis de la FDA sobre el balance beneficio/riesgo de la vacunación en este grupo de edad, publicado el 22 de octubre de 2021 (PDF, 39 págs.).
Todos los documentos presentados y evaluados en la reunión del VRBPAC del 26 de octubre de 2021 se pueden consultar en la web de la FDA.
[volver al inicio]
Diseño del estudio origen de los datos
 Estudio de fase 2/3, aleatorizado, ciego para los observadores, controlado con placebo en el estudio de seguridad, para evaluar la inmunogenicidad y eficacia de dos dosis de 10 mcg de la vacuna BNT162b2 en niños de 5-11 años de edad.
Estudio de fase 2/3, aleatorizado, ciego para los observadores, controlado con placebo en el estudio de seguridad, para evaluar la inmunogenicidad y eficacia de dos dosis de 10 mcg de la vacuna BNT162b2 en niños de 5-11 años de edad.
- El estudio se ha llevado a cabo en EE. UU., Finlandia, España y Polonia. El reclutamiento comenzó en marzo de 2021.
- Los participantes fueron distribuidos en los grupos de intervención y placebo a razón 2:1. El grupo de intervención recibió 2 dosis de 10 mcg (una tercera parte de la usada en los de 12 o más años de edad) con 3 semanas de intervalo. El placebo fue suero salino.
- Fueron en total dos cohortes de estudio (una con, al menos, 2 meses de seguimiento tras la segunda dosis y otra con 2,4 semanas de seguimiento) con 3109 niños en el grupo de intervención y 1528 en el del placebo.
[volver al inicio]
Reactogenicidad y seguridad
- Estudiada en el conjunto de los participantes de las dos cohortes.
- Reactogenicidad con síntomas de intensidad leve y moderada, en los dos días tras la vacunación y de 1-2 días de duración.
- Los síntomas registrados fueron más frecuentes tras la segunda dosis: dolor en el lugar de inyección (71 %), cansancio (39,4 %), dolor de cabeza (28 %), mialgia (11,7 %) y malestar general (9,8 %).
- No se han registrado efectos adversos graves en el periodo de observación; ningún caso de peri/miocarditis.
- El perfil es similar al observado en los grupos de 12-15 y 16-25 años de edad.
[volver al inicio]
Inmunogenicidad
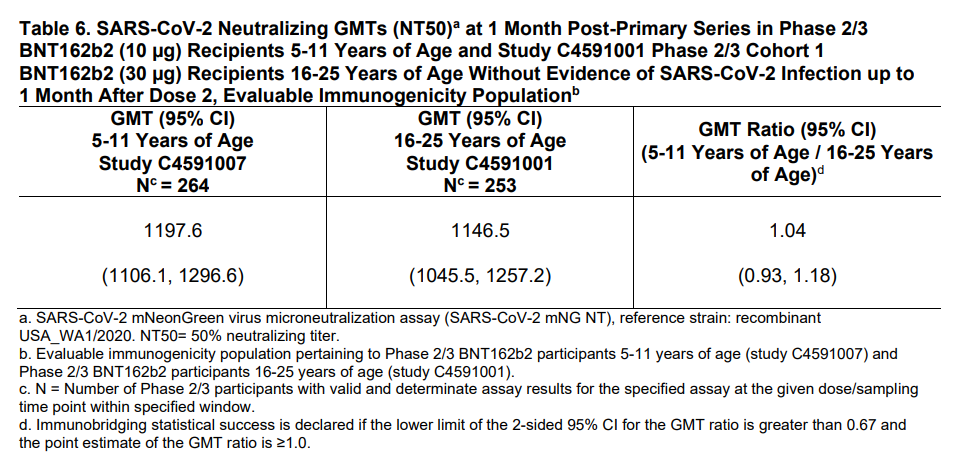
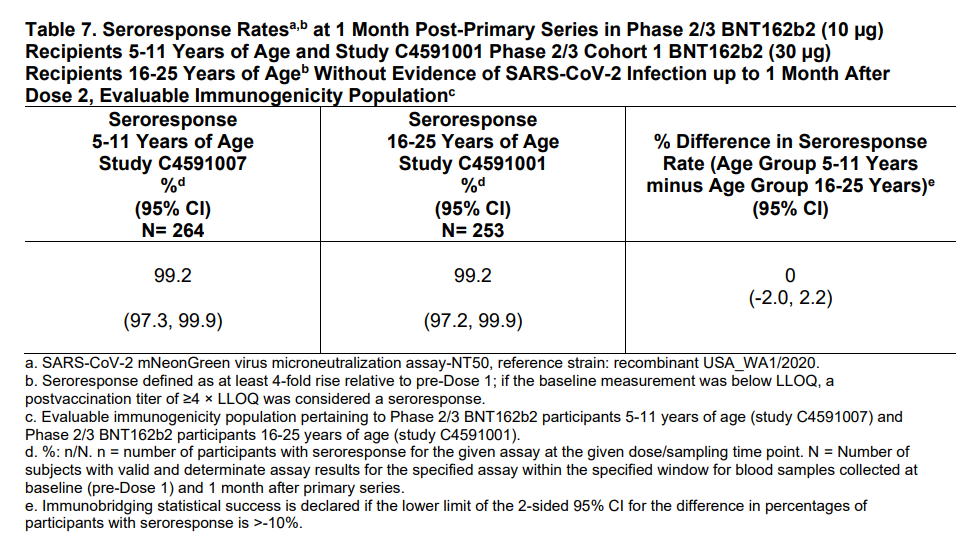
Estudiada mediante comparación con los resultados obtenidos en los participantes del estudio de 16-25 años de edad. Ver tablas adjuntas extraídas del documento de la FDA. Se midieron dos variables en un subgrupo seleccionado al azar de 322 participantes del grupo de intervención y 163 del de placebo; una, de immunobridging analysis o la razón de las GMT de anticuerpos neutralizantes en los niños de 5-11 y los participantes de 16-25 años; y la segunda, la diferencia de porcentajes de seroconversión entre los mismos grupos de edad, medidas un mes después de la vacunación completa. Se añade el análisis complementario de 38 muestras elegidas al azar frente a la variante delta.
Para ambas variables se superaron los criterios de éxito preespecificados para la declaración de no inferioridad respecto al grupo de 16-25 años de edad (ver la nota final al pie de cada tabla).
[volver al inicio]
Eficacia vacunal
- La eficacia vacunal (EV) se evaluó desde 7 días después de la 2.ª dosis, en participantes sin antecedentes de infección: 90,7 % (IC 95 %: 67,7-98,3 %), con 3 casos en el grupo de vacunados y 16 en el del placebo.
- No hubo casos graves ni de síndrome inflamatorio multisistémico.
[volver al inicio]
Balance riesgo-beneficio
Las estimaciones de Pfizer & BioNTech sobre esta cuestión, por millón de vacunados con dos dosis y en un periodo de 4 meses (asumiendo una eficacia vacunal del 90 %), son:
- Eventos de covid evitados: 33·600 casos y 170 hospitalizaciones.
- Eventos esperados de peri/miocarditis en vacunados: 21 casos.
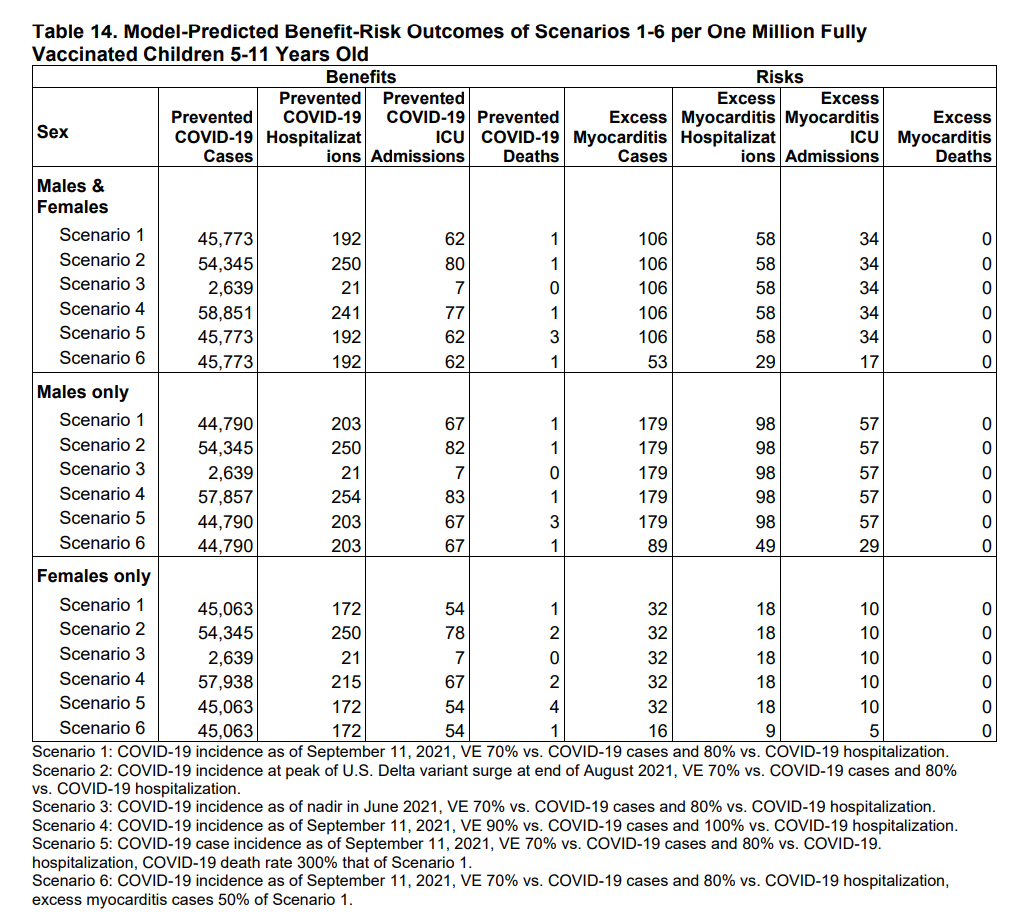
A partir de los datos aportados por Pfizer & BioNTech, la FDA ha hecho su propio análisis del balance riesgo/beneficio a partir de la modelización de 6 posibles escenarios (ver tabla adjunta). Compara el beneficio esperado por la vacunación al evitar casos, hospitalizaciones, necesidades de cuidados intensivos y muertes por la covid, y los riesgos de peri/miocarditis y sus implicaciones y complicaciones asociadas. Los cálculos se hacen por millón de niños completamente vacunados y suponiendo que las condiciones se mantienen durante 6 meses.
Los escenarios contemplados varían en función de la incidencia de la covid en la comunidad y la EV frente a infección, hospitalización, ingreso en UCI y muerte de la vacunación. Los 5 primeros escenarios asumen que el riesgo de peri/miocarditis en los niños de 5-11 años con dosis de 10 mcg es igual que en el grupo de 12-15 años con dosis de 30 mcg* (lo cual es una presunción conservadora a la vista de los datos de Israel, donde el riesgo de los de 16-19 años fue superior al de los de 12-15 años).
* En un documento de la FDA del 23 de agosto de 2021 se estima un exceso de casos de peri/miocarditis por millón de vacunados con dos dosis, de 200 en el grupo de 16-17 años y de 180 en los de 12-15 años. En contraste, los datos del VAERS son más reducidos: 71,5 casos/millón en los de 16-17 años y 42,6/millón en los de 12-15 años.
El análisis de la FDA encuentra que el balance riesgo/beneficio es dependiente de la EV y de la intensidad de la transmisión de la infección en la comunidad:
- En los escenarios 1, 2, 4 y 5, el balance es favorable a la vacunación.
- En el escenario 6 (menor incidencia de peri/miocarditos en los niños de 5-11 años) es aún más favorable.
- En el escenario 3 (menor transmisión comunitaria) el número de casos de hospitalización por peri/miocarditis posvacunal sería mayor que los de hospitalización por covid evitados. No obstante, dice la FDA que, considerando las implicaciones clínicas de las hospitalizaciones por covid (más prolongadas y con más complicaciones) y las de las miocarditis (generalmente breves, con recuperación sin apenas necesidad de tratamiento) el balance sigue siendo favorable a la vacunación.
Concluyen, por tanto, que, basándose en los datos estudiados, el balance es favorable a la vacunación.
[volver al inicio]
-oOo-
Aprobación final de la FDA y los CDC
Adenda, 30 de octubre de 2021. La FDA finalmente acepta el dictamen del VRBPAC y, el 29 de octubre, ha autorizado el uso de emergencia de la versión pediátrica de mla vacuna de Pfizer & BioNTech en niños de 5-11 años de edad (noticia comentada en CIDRAP, 29 de octubre de 2021).
Adenda, 3 de noviembre de 2021. El ACIP, por unanimidad de sus 14 miembros, ha aprobado la recomendación de la vacuna pediátrica de Pfizer & BioNTech en niños de 5-11 años de edad. El último paso, ya cumplido, es la aprobación de los CDC, que lo hizo apenas horas después de la reunión del ACIP.
- Pueden consultarse los documentos presentados en la reunión del ACIP en este enlace.
- Woodworth KR, et al. The Advisory Committee on Immunization Practices’ Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine in Children Aged 5-11 Years - United States, November 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1579-83.
Más información
- Beers LS. Yes, You’ll Want to Vaccinate Your Kids Against Covid. An Expert Explains Why. The New York Times, 26 de octubre de 2021.
- CIDRAP. FDA panel green-lights Pfizer COVID vaccine for young kids. CIDRAP, 26 de octubre de 2021.
- Fox M. FDA vaccine advisers vote to recommend Pfizer's Covid-19 vaccine for children 5 to 11. CNN, 26 de octubre de 2021.
- LaFraniere S, et al. A F.D.A. panel recommends the Pfizer-BioNTech vaccine for young children. The New York Times, 25 de octubre de 2021.
- Linde P. Vacunar a los niños contra la covid: un debate abierto cuando hay pocos contagios. Los expertos que asesoran a Estados Unidos recomiendan aprobar la inyección, que evita el 91% de los casos, según los ensayos. Si se autoriza en Europa, la incidencia será un factor clave para decidir si administrarla masivamente en menores de 12 años. El País, 27 de octubre de 2021.
- Slotnik DE. Now that the F.D.A. panel has recommended pediatric Covid shots, here’s what happens next. The New York Times, 26 de octubre de 2021.
Otras referencias
- CIDRAP. Less than a third of US parents eager to vaccinate young kids against COVID-19. CIDRAP, 28/oct de 2021.
- Kozlov M. What COVID vaccines for young kids could mean for the pandemic. As US Food and Drug Administration advisers recommend authorizing shots for children aged 5 to 11, researchers predict what this might mean for populations. Nature. 2021, 27/oct. DOI: 10.1038/d41586-021-02947-z.
- Pfizer & BioNTech, 28/oct de 2021. Pfizer and Biontech to provide U.S. Government an additional 50 million pediatric doses of covid-19 vaccine to support further preparedness for future needs.
- Woodworth KR, et al. The Advisory Committee on Immunization Practices’ Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine in Children Aged 5-11 Years - United States, November 2021. MMWR Morb Mortal Wkly Rep. ePub: 5 November 2021. DOI: 10.15585/mmwr.mm7045e1.
Historial de actualizaciones
- 3 de noviembre de 2021. Se añade una nota informando de que el ACIP y los CDC han aprobado el uso de la vacuna en niños de 5-11 años.
- 30 de octubre de 2021. Se añade la nota de autorización final de la FDA.
[volver al inicio]