La EMA aprueba la vacuna Comirnaty en adolescentes
Fecha de actualización: 28 de noviembre de 2021
 Finalmente el pasado 28 de mayo de 2021 la EMA ha aprobado recomendar la ampliación de la edad de uso de la vacuna Comirnaty a los adolescentes de 12 o más años de edad. Tras la aprobación formal de la Comisión Europea, los cambios quedarán reflejados en la ficha técnica del producto.
Finalmente el pasado 28 de mayo de 2021 la EMA ha aprobado recomendar la ampliación de la edad de uso de la vacuna Comirnaty a los adolescentes de 12 o más años de edad. Tras la aprobación formal de la Comisión Europea, los cambios quedarán reflejados en la ficha técnica del producto.
Antecedentes próximos de los cambios regulatorios de Comirnaty
- El 31 de marzo de 2021 Pfizer & BioNTech presentaron mediante una nota de prensa los resultados preliminares de un ensayo de fase 3 con la vacuna Comirnaty en 2260 adolescentes de 12-15 años de edad.
- El 9 de abril, Pfizer & BioNTech solicitan la aprobación de la FDA en este rango de edad.
- El 3 de mayo, la EMA informa de que comienza el estudio de la ampliación de la vacuna Comirnaty a los adolescentes.
- El 10 de mayo, finalmente, la FDA aprueba la ampliación de la edad de uso de esta vacuna. Los CDC y el ACIP trasladan el 14 de mayo lo aprobado a sus recomendaciones (MMWR. 2021;70:749-52).
- Antes de esta fecha, el 5 de mayo, Canadá aprobó el mismo cambio, incluyendo a los adolescentes de 12-15 años.
Al mismo tiempo, el 25 de mayo, Moderna ha presentado los resultados preliminares de un estudio de fase 3 en adolescentes de 12-17 años de edad, y anuncia su interés en solicitar la ampliación de la edad de uso de su vacuna, COVID-19 Vaccine Moderna,
Propuesta inicial del Ministerio de Sanidad sobre la vacunación de los adolescentes
El pasado 13 de mayo el Ministerio de Sanidad publicó la 7.ª actualización de la estrategia de vacunación española, en la cual se aborda de forma inicial la vacunación de algunos adolescentes, los de alto riesgo de exposición e infección, aquellos en situación de dependencia y los que residen o acuden a centros de educación especial o centros tutelados.
En los próximos días el Ministerio deberá establecer con mayor precisión qué criterios usar para seleccionar a los adolescentes a vacunar con carácter prioritario.
Publicados los resultados completos de Comirnaty en adolescentes
 El 27 de mayo de 2021 se han publicado los datos referidos al estudio de fase 3 (N Engl J Med. 2021;385:239-50) del cual se había adelantado algunos detalles el 31 de marzo:
El 27 de mayo de 2021 se han publicado los datos referidos al estudio de fase 3 (N Engl J Med. 2021;385:239-50) del cual se había adelantado algunos detalles el 31 de marzo:
- Estudio de fase 3, aleatorizado, controlado con placebo, ciego.
- 2264 participantes de 12-15 años de edad (finalizaron el estudio 2220), sin antecedentes de covid o infección, en EE. UU.
- Pauta vacunal estándar: 2 dosis con 21 días de intervalo.
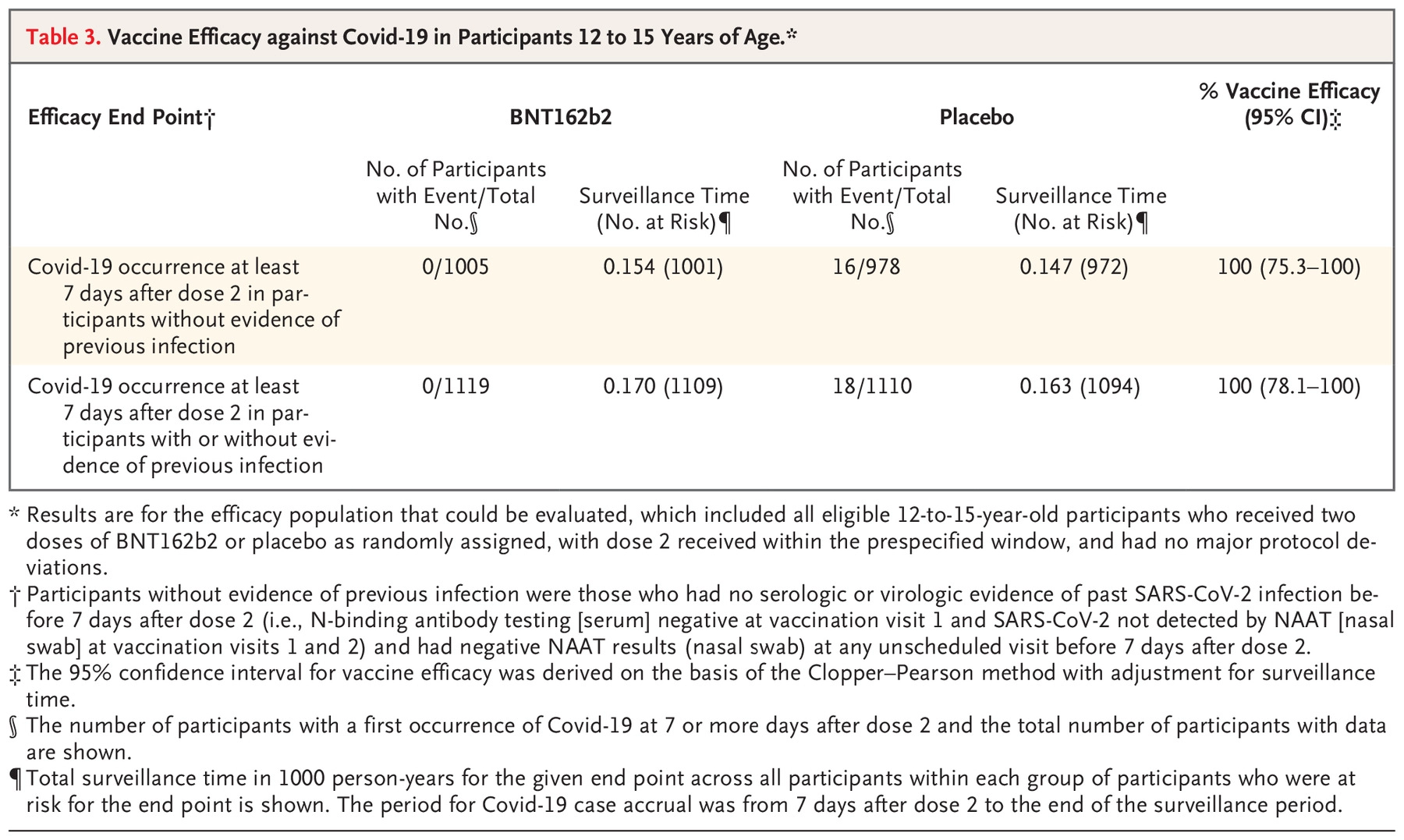
En las imágenes adjuntas se muestran los principales resultados referidos a la reactogenicidad, inmunogenicidad y eficacia vacunal.
Reactogenicidad
Reactogenicidad durante 7 días después de cada dosis; registro de efectos adversos durante 1 a 6 meses después de la segunda dosis.
Inmunogenicidad
Inmunogenicidad antes y un mes después de la 2.ª dosis, en un subconjunto aleatorio de partipantes, con el objetivo de establecer la no inferioridad con la población de 16-25 años.
Eficacia vacunal
Eficacia frente a covid confirmado desde 7 o más días después de la 2.ª dosis.
Otros informes de la EMA relativos a la seguridad de las vacunas de ARNm
El pasado 7 de mayo de 2021 el PRAC (Pharmacovigilance Risk Assessment Committee) de la EMA estudió las señales de seguridad relacionadas con las vacunas. En lo relativo a las vacunas de ARNm (Comirnaty y Moderna) destaca:
- El PRAC consideró que existe una posibilidad razonable de una asociación causal entre la vacuna Comirnaty y los casos notificados de hinchazón facial en personas con antecedentes de inyecciones con rellenos dérmicos. Por tanto, dicho efecto secundario aparecerá en la sección 4.8 de la ficha técnica y del prospecto de dicha vacuna. El balance beneficio-riesgo de la vacuna permanece sin cambios.
- El comité evaluó también la posible relación de algunos casos de miocarditis y pericarditis con las vacunas Comirnaty y COVID-19 Vaccine Moderna. Por el momento no hay indicios de que estos casos se deban a la vacuna. Sin embargo, el PRAC ha solicitado a los titulares de las vacunas citadas más información y mantiene abierta la evaluación continuada de esta cuestión.
[volver al inicio]
Adenda, 28 de noviembre de 2021. Pfizer & BioNTech, 22 de noviembre de 2021. Los datos de seguimiento a más largo plazo del ensayo de fase 3 de la vacuna Pfizer-Biontech frente a la covid respaldan la seguridad y alta eficacia en adolescentes de 12 a 15 años de edad. La vacuna Pfizer-BioNTech demostró una eficacia del 100% contra COVID-19 en un análisis a más largo plazo, sin que se identificaran problemas de seguridad graves.
[volver al inicio]
-oOo-
Más información
- Nota de prensa de BioNTech & Pfizer, 28 de mayo de 2021.
- Frenck RW, et al. Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents. N Engl J Med. 2021;385:239-50.
- Noticias sobre el uso de las vacunas de la covid en adolescentes en esta web: 6 de abril: Vacunas covid en niños: primeros datos en adolescentes; 14 de abril: Vacunación frente a la covid de niños y adolescentes; 4 de mayo: La EMA estudia la ampliación de uso de Comirnaty a adolescentes de 12 o más años; y 14 de mayo: El Ministerio de Sanidad adelanta detalles de la vacunación de adolescentes contra la covid.
- Otras noticias sobre el nuevo coronavirus y sus vacunas en esta web.
[volver al inicio]
Historial de actualizaciones
- 28 de noviembre de 2021. Pfizer & BioNTech anuncian datos de seguimiento a más largo plazo de su ensayo fase 3 en adolescentes.
[volver al inicio]