En marcha estudios que buscan vacunas frente a la variante Sudán del ébola
| Contenido |
|---|
| ● Brote de ébola (especie Sudán) en Uganda en 2022 ● La OMS impulsa la investigación de nuevas vacunas frente a la especie Sudán del virus ébola [ver] ● El ensayo “Solidaridad contra el ébola”: estudios Tokomeza y Tokomeza-Plus [ver] ● Preparando la respuesta en el próximo brote [ver] ● Más información en esta web y referencias bibliográficas [ver] |
| En pocas palabras |
|---|
| ● En 2022 Uganda vivió un brote de ébola producido por la especie Sudán del virus ébola. El brote finalizó en enero de 2023 con sólo 142 casos confirmados o probables. ● La OMS encargó a un grupo de expertos el diseño y puesta en marcha urgente de estudios de investigación con los productos candidatos a vacunas disponibles. ● El grupo de expertos ha seleccionado tres candidatos: una vacuna bivalente de adenovirus de simio, una vacuna monovalente de otro adenovirus de simio y una tercera monovalente con el virus de la estomatitis vesicular. ● Se llevarán a cabo estudios de fase 1 y 2 de forma inmediata, aprovechando el actual periodo interbrotes. ● Después, cuando aparezca un nuevo brote, los estudios de fase 3 se llevarán a cabo siguiendo la estrategia de vacunación en anillos, comparando la vacunación inmediata con la diferida, usando cada uno de los preparados seleccionados que hayan superado las fases 1 y 2. Se han diseñado dos protocolos de estudio (Tokomeza y Tokomeza-Plus) con objetivos específicos. ● Estos preparativos son la mejor garantía para poner en práctica la mejor respuesta posible ante nuevos brotes de esta enfermedad. |
-oOo-
Brote de ébola (especie Sudán) en Uganda en 2022
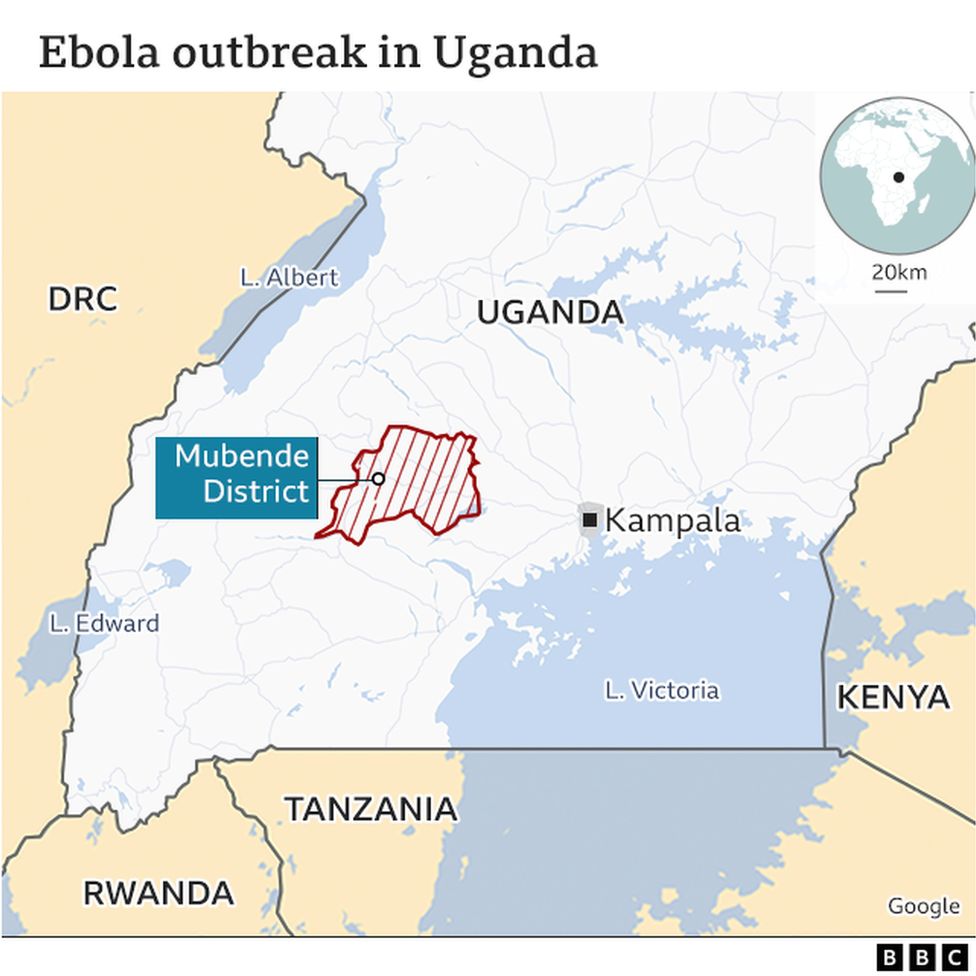 La especie Sudán del virus ébola (SUDV por sus siglas en inglés) se mantiene en la naturaleza en reservorios animales salvajes y los humanos se infectan a través de la exposición directa a ellos o sus fluidos. El SUDV tiene una tasa de mortalidad algo inferior a la especie Zaire, y es la infección más frecuente en el rango de edad de los 20 a los 39 años.
La especie Sudán del virus ébola (SUDV por sus siglas en inglés) se mantiene en la naturaleza en reservorios animales salvajes y los humanos se infectan a través de la exposición directa a ellos o sus fluidos. El SUDV tiene una tasa de mortalidad algo inferior a la especie Zaire, y es la infección más frecuente en el rango de edad de los 20 a los 39 años.
El reciente brote de SUDV en Uganda comenzó el 20 de septiembre de 2022, se expandió a partir de dos focos principales, afectó a 142 personas (con 55 fallecimientos) y finalizó oficialmente el 11 de enero de 2023.
La OMS, reconociendo que la integración de la investigación en la respuesta a emergencias es una parte esencial de su misión, y debido a la urgencia de la situación del brote de ébola especie Sudán (SUDV) en Uganda, pidió en octubre de 2022 al grupo de trabajo de priorización de vacunas creado para la COVID-19 (WHO Vaccine Prioritation Working Group) que evaluara de forma rápida la puesta en marcha de un ensayo clínico con las vacunas candidatas contra SUDV en ese país.
Las estrategias no farmacológicas llevadas a cabo por los servicios de salud pública del país lograron controlar el avance del virus, pero tan solo 79 días después de la declaración del primer caso ya se había diseñado y aprobado el primer ensayo con vacunas, un equipo de investigadores estaba ya listo para ponerlo en marcha y el primero de los tres preparados seleccionados se encontraba ya disponible en el país para su uso. Afortunadamente, el brote se controló en tiempo récord (nunca antes se había controlado un brote de enfermedad por virus ébola en una zona no endémica en menos de 120 días) y el ensayo no llegó a iniciarse.
[volver al principio]
La OMS impulsa la investigación de nuevas vacunas frente a la especie Sudán del virus ébola
 En las reuniones celebradas por el grupo de trabajo mencionado entre en octubre y noviembre de 2022 se eligieron tres vacunas candidatas (ver imagen adjunta):
En las reuniones celebradas por el grupo de trabajo mencionado entre en octubre y noviembre de 2022 se eligieron tres vacunas candidatas (ver imagen adjunta):
- Una bivalente (biEBOV) que utiliza un adenovirus de simio de replicación deficiente (ChAdOx1) como vector y que codifica dos antígenos (las glicoproteínas del virus ébola Zaire y de SUDV), desarrollada por la Universidad de Oxford y el Instituto Jenner del Reino Unido. Hasta la fecha, se han realizado estudios que mostraron protección hasta los 12 meses, se han completado los ensayos en fase 1 en EE.UU. y Uganda y está previsto un ensayo en fase 2 en África.
- Otra monovalente con un vector adenovirus de simio diferente al anterior (ChAd3) que codifica la glicoproteína de SUDV (ChAd3-SUDV), generada por el Sabin Vaccine Institute de Estados Unidos. Se basa en la misma plataforma utilizada para la vacuna COVID-19. Tiene ensayos en fase 1 completos y estudios en fase 1 adicionales en curso. La respuesta inmunitaria dura al menos 6 meses. La vacuna será fabricada por Serum Institute de India.
- Y una tercera también monovalente que cuenta con el virus de la estomatitis vesicular (VSV) como columna vertebral, donde se sustituye el gen VSV-G por el Ebola-GP de SUDV, de la Iniciativa Internacional para la Vacuna contra el Sida (IAVI). Se han completado los estudios de eficacia en primates, pero aún no se dispone de datos de seguridad en humanos. El desarrollador planea un estudio en fase 1/2 en Uganda en personal sanitario.
[volver al principio]
El ensayo “Solidaridad contra el ébola”: estudios Tokomeza y Tokomeza-Plus
 El diseño del ensayo, siguiendo la estrategia de “vacunación en anillos”, es similar a los que fueron realizados con éxito durante el gran brote acaecido en Guinea y Sierra Leona con la especie Zaire del virus ébola entre los años 2014 y 2016 (Ebola ça suffit ring vaccination trial consortium, BMJ 2015) y antes frente a la viruela (Henderson DA, Bull World Health Organ 1987).
El diseño del ensayo, siguiendo la estrategia de “vacunación en anillos”, es similar a los que fueron realizados con éxito durante el gran brote acaecido en Guinea y Sierra Leona con la especie Zaire del virus ébola entre los años 2014 y 2016 (Ebola ça suffit ring vaccination trial consortium, BMJ 2015) y antes frente a la viruela (Henderson DA, Bull World Health Organ 1987).
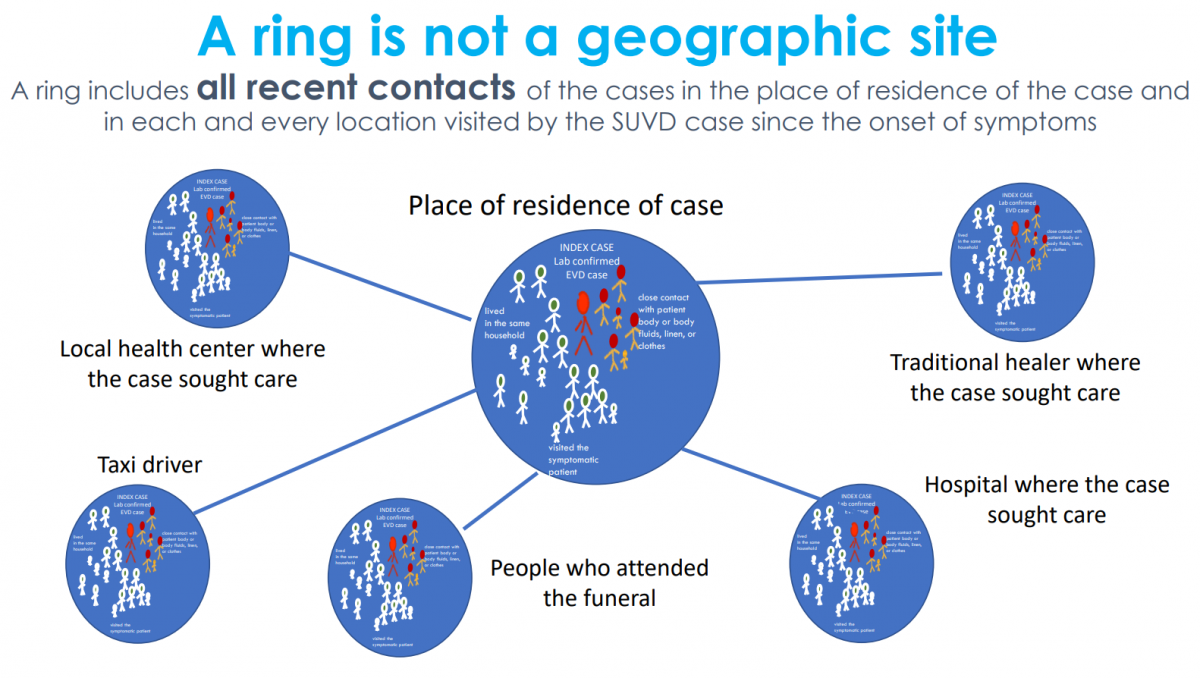
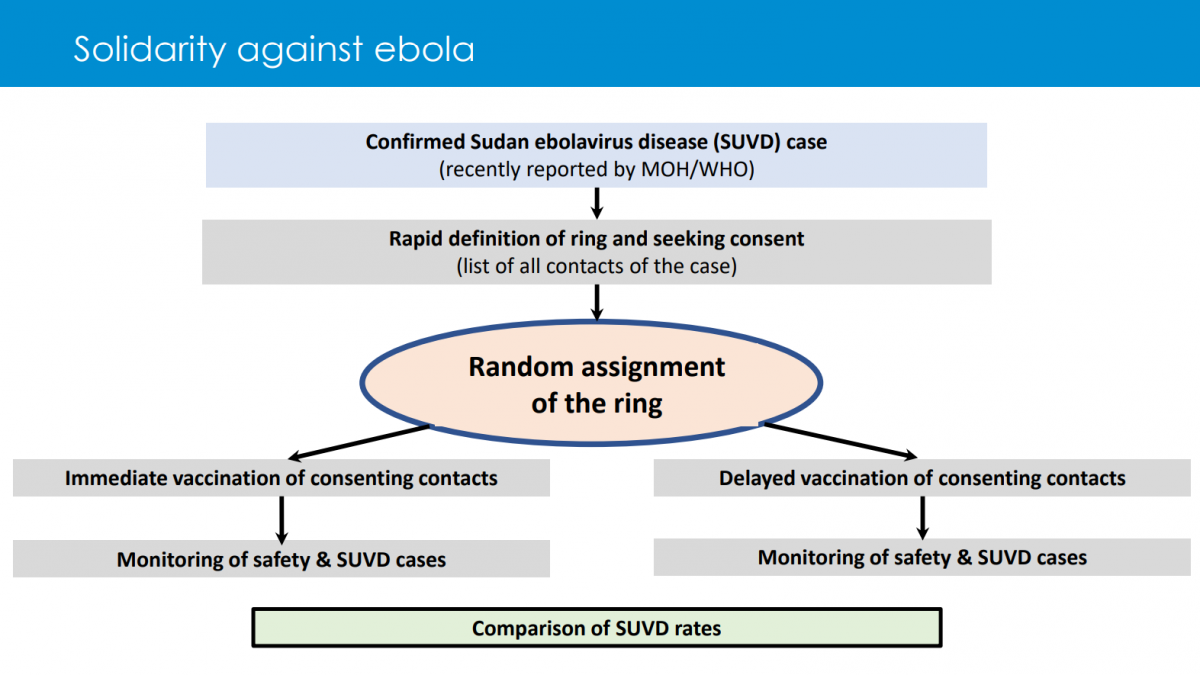
En este ensayo se procederá a localizar rápidamente a todos los contactos (y a los contactos de estos) de un caso índice de ébola y se aleatorizarán en dos grupos, en uno se ofrecerá inmediatamente la vacuna y en el otro de una forma diferida, 21 días después (ver dos imágenes adjuntas).
El propósito es comprobar si el uso de vacunas mediante una estrategia de administración no sistemática puede servir para el control de la expansión del virus SUDV en Uganda. El objetivo principal consiste en evaluar la eficacia para prevenir enfermedad por virus ébola en los contactos recientes del caso índice mediante la administración precoz de una única dosis de vacuna frente a controles (también contactos recientes del caso) que la recibirán de forma diferida. Como objetivos secundarios se proponen evaluar la seguridad de las vacunas SUDV empleadas en el ensayo hasta 21 días después de la inoculación, estudiar su inmunogenicidad, determinar la duración de la protección clínica, describir los factores asociados a un uso óptimo de las vacunas y explorar la posible reactividad cruzada para distintas especies de virus ébola generada por las vacunas.
Los criterios de inclusión son: haber mantenido contacto reciente con un caso confirmado de enfermedad por SUDV (ampliable a contactos de contactos), tener más de 6 años y firmar el consentimiento informado para participar en el ensayo (tutores legales en el caso de menores). Se excluirán a los que, siendo contactos de un caso, hayan pasado la enfermedad, los que estén recibiendo algún tratamiento experimental, los alérgicos a algún componente de la vacuna y los que se encuentren padeciendo una enfermedad aguda o crónica de gravedad (que requiera encamamiento u hospitalización). El tamaño de la muestra será definido según la dinámica de aparición de nuevos casos de enfermedad.
Se presentaron dos protocolos de estudio: Tokomeza y Tokomeza-Plus. En este último se estudiarán aspectos más específicos relacionados con la inmunidad generada por los vacunados (humoral y celular), si la vacuna resulta ser eficaz puede proteger a los individuos vacunados y ayudar a crear un “grupo tampón” de personas inmunizadas que podría limitar la propagación de la infección. Los estudios de simulación y de campo han demostrado que la vacunación “en anillo” alrededor de los nuevos casos puede ser eficaz en algunas circunstancias y ayudar a contener los brotes de enfermedades infecciosas con tasas de reproducción relativamente bajas. Así ocurrió con la viruela y en brotes previos de enfermedad por el virus ébola especie Zaire.
[volver al principio]
Preparando la respuesta en el próximo brote
 Durante el brote de Uganda se cimentaron los pasos necesarios para acelerar la respuesta en un brote posterior. La preparación de las dosis fue lo que más tiempo llevó, pero la experiencia ha ayudado a los implicados a identificar otras oportunidades para acelerar el inicio de la investigación integrada en una fase temprana de la respuesta al brote, entre las que se incluyen:
Durante el brote de Uganda se cimentaron los pasos necesarios para acelerar la respuesta en un brote posterior. La preparación de las dosis fue lo que más tiempo llevó, pero la experiencia ha ayudado a los implicados a identificar otras oportunidades para acelerar el inicio de la investigación integrada en una fase temprana de la respuesta al brote, entre las que se incluyen:
- Priorización rápida de vacunas candidatas.
- Diseño de protocolos de ensayo sencillos, con un proceso de aprobación regulatoria y ética más rápido.
- Preparación anticipada de equipos para el ensayo y la logística.
- Tener las vacunas candidatas disponibles y listas para la exportación internacional.
- Abordar el marco legal y las cuestiones de responsabilidad y seguros.
- Identificar fuentes flexibles de financiación para apoyar el inicio rápido de las actividades del ensayo como parte de la respuesta al brote.
Dada la escasez de datos disponibles, ninguna de las vacunas existentes es actualmente adecuada para su uso fuera de un ensayo clínico. Las fases de los ensayos clínicos pueden ser continuas, especialmente en una epidemia, pero las actividades tradicionales en fase 1 y fase 2 pueden y deben realizarse durante el periodo entre brotes (ver imagen adjunta). La supervisión de los ensayos clínicos para garantizar la calidad de los datos es importante para asegurar que sean realmente útiles. En el periodo entre brotes es cuando debe aprovecharse para poner en marcha estudios sobre inmunogenicidad y seguridad de las vacunas candidatas, pudiendo encontrarse diferencias que hagan prevalecer unos preparados sobre otros. Otros factores que también influirán en la decisión de priorización son: el análisis profundo de los resultados de los estudios en primates, la rápida disponibilidad de dosis, los datos anteriores acumulados con la plataforma de la vacuna, las posibilidades de fabricación y riesgo de rotura de stock, etc.
Aunque no se ha definido un correlato inmunológico de protección y este puede variar de una vacuna a otra, la evaluación de la respuesta inmune (incluida la mediada por células) será importante para la toma de decisiones. Los datos de inmunogenicidad a largo plazo pueden informar sobre la necesidad de reforzar la vacuna, aunque la correlación entre los marcadores inmunitarios y la protección real que genere la vacuna contra esta mortífera enfermedad está todavía por demostrarse.
[volver al principio]
-oOo-
Más información en esta web
- CAV-AEP, 28 de septiembre de 2022. Ébola en África de nuevo, ahora en Uganda.
- CAV-AEP. Otras noticias sobre el virus ébola y sus vacunas.
- CAV-AEP. Vacunas del ébola. Manual de inmunización en línea de la AEP.
Referencias bibliográficas
- Ebola ça suffit ring vaccination trial consortium. The ring vaccination trial: a novel cluster randomised controlled trial design to evaluate vaccine efficacy and effectiveness during outbreaks, with special reference to Ebola. BMJ. 2015;351:h3740.
- Henderson DA. Principles and lessons from the smallpox eradication programme. Bull World Health Organ. 1987;65(4):535-46.
- Manno D. Developing a vaccine against Sudan virus disease. Lancet Infect Dis. 2023, 3/ago. DOI: 10.1016/S1473-3099(23)00360-2.
- OMS, 12 de enero de 2023. Sudan Ebolavirus Candidate Vaccines - What additional research should be conducted to advance the evaluation of these vaccines?
- OMS, 9 de diciembre de 2022. Ebola trial candidate vaccines arrive in Uganda in record 79 days after outbreak declared.
- OMS, 16 de noviembre de 2022. WHO Vaccine Prioritization Working Group. Summary of the evaluations and recommendations on the three Sudan ebolavirus vaccines that are candidates for inclusion in the planned ring vaccination trial in Uganda (Tokomeza Ebola).
Otras referencias
- Manno D. Developing a vaccine against Sudan virus disease. Lancet Infect Dis. 2023;23(12):1333-5.
- Manno D, et al. Safety and immunogenicity of an Ad26.ZEBOV booster dose in children previously vaccinated with the two-dose heterologous Ad26.ZEBOV and MVA-BN-Filo Ebola vaccine regimen: an open-label, non-randomised, phase 2 trial. Lancet Infect Dis. 2023;23(3):352-60.
- Merck, 7 de septiembre de 2023. European Commission Expands Merck’s ERVEBO® [Ebola Zaire Vaccine, (rVSVΔG-ZEBOV-GP) live] Indication to Include Children 1 Year of Age and Older.
- Mwesigwa B, et al. Safety, tolerability, and immunogenicity of the Ebola Sudan chimpanzee adenovirus vector vaccine (cAd3-EBO S) in healthy Ugandan adults: a phase 1, open-label, dose-escalation clinical trial. Lancet Infect Dis. 2023;23(12):1408-17.
[volver al principio]