Fecha de actualización 28 de agosto de 2023
| Contenido |
|---|
| ● Introducción. ● Vacunas frente al VRS en población pediátrica [ver [2]] ● Vacunación durante el embarazo [ver [3]]. ● Estudio Matisse [ver [4]]. ● Adenda 20 de mayo de 2023 [ver [5]]. ● Adenda 21 de julio de 2023 [ver [6]]. ● Adenda 23 de agosto de 2023 [ver [7]]. ● Adenda 28 de agosto de 2023 [ver [8]]. ● Más información en esta web y referencias bibliográficas [ver [9]]. ● Historial de actualizaciones [ver [10]]. |
| En pocas palabras |
|---|
| ● Esta nota sobre el VRS está centrada en el desarrollo de vacunas en el embarazo (la investigación de vacunas para lactantes y niños pequeños ha avanzado muy poco). ● Tras la suspensión de los estudios puestos en marcha por GSK, solo se mantiene activa la investigación del producto de Pfizer, RSVpreF (Abrysvo), una vacuna bivalente basada en la proteína F prefusión (estudio Matisse). ● El estudio Matisse es un ensayo de fase 3, cuyos primeros datos han sido expuestos en la reunión del ACIP-CDC (EE. UU.) del pasado 23 de febrero de 2023 y publicados hace pocos días (NEJM). ● Los resultados mostrados indican que el producto en estudio tiene un perfil de seguridad y eficacia favorables, por lo que tanto los CDC (EE. UU.) como la EMA (UE) están estudiando los datos acumulados de cara a una eventual futura autorización. ● Con los datos disponibles, en los próximos meses se tendrán que determinar las mejores estrategias de prevención de la infección por el VRS con las herramientas habilitadas, anticuerpos monoclonales (nirsevimab) y, probablemente, las vacunas en el embarazo y en personas de 60 o más años. |
| Ver también |
|---|
| ● CAV-AEP, 11 de abril de 2023. Se estrecha el cerco al virus respiratorio sincitial (VRS) (parte 1): vacunación de adultos mayores [11]. |
-oOo-
Introducción
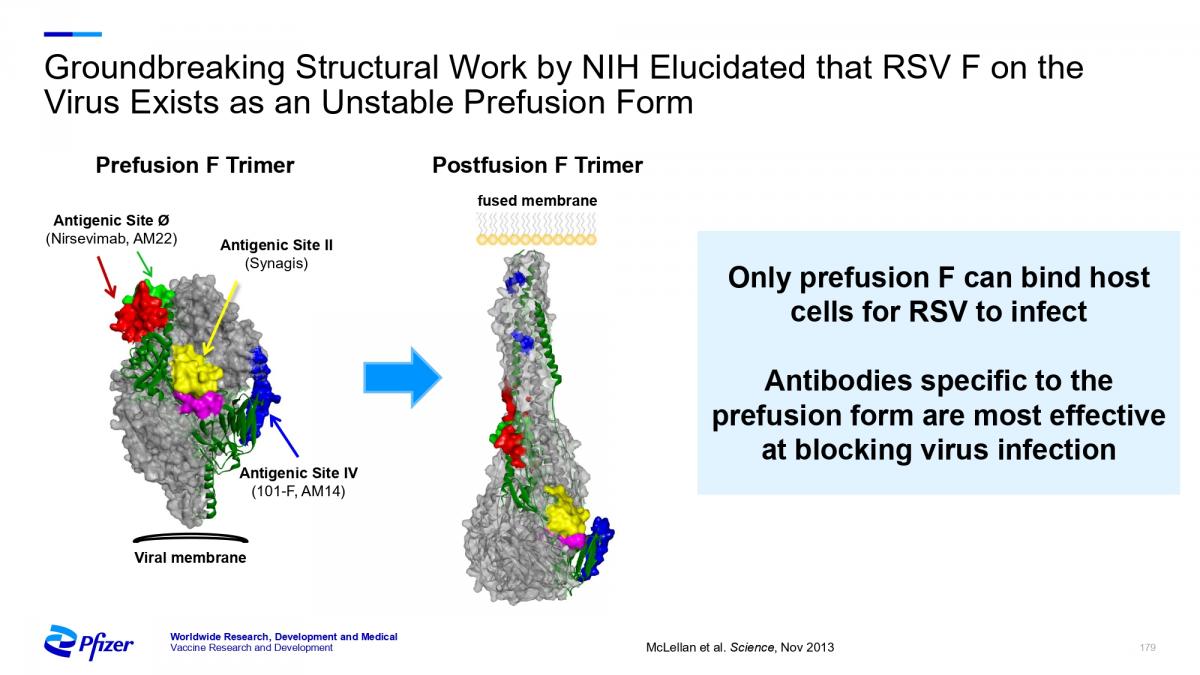
Como se ha comentado en una nota anterior [11], el objetivo principal de las vacunas del virus respiratorio sincitial (VRS) es la prevención de la enfermedad en los grupos con mayor incidencia y gravedad, que son los lactantes, niños pequeños y adultos mayores de 60 años. La investigación es, actualmente, intensa y se centra, principalmente, en las personas de más edad y durante el embarazo (ver la imagen que abre esta nota). En la citada nota previa [11] se ha expuesto una panorámica del estado de desarrollo de vacunas frente al VRS en personas de 60 o más años de edad, destacando que dos productos (uno de GSK y otro de Pfizer) han logrado, recientemente, la opinión favorable del grupo asesor de vacunas (VRBPAC) de la FDA estadounidense.
En esta nota se desarrolla brevemente el estado de las vacunas del VRS para niños pequeños (aún en fases iniciales de la investigación) y durante el embarazo (con estudios de fase 3) para la prevención de la infección en lactantes en sus primeros meses de vida.
[volver al principio [12]]
Vacunas frente al VRS en población pediátrica
El desarrollo de vacunas frente al virus respiratorio sincitial (VRS) en niños ha estado condicionado por los efectos de la vacuna administrada a lactantes en 1965, que condujo a una enfermedad más grave en los niños vacunados cuando se infectaban por el VRS. Por ello, y por la escasa respuesta inmune en lactantes pequeños, los menores de 6 meses han quedado por el momento excluidos en el desarrollo de las nuevas vacunas.
Actualmente hay ensayos clínicos en fases 1 y 2 para niños a partir de los 6-12 meses de edad (ClinicalTrials.gov [13]) en dos plataformas diferentes: 1) vacunas vivas atenuadas intranasales para niños entre 6 y 24 meses; y 2) vacunas recombinantes vectorizadas por virus, como el adenovirus 26, para niños entre 12 y 24 meses.
[volver al principio [12]]
Vacunación durante el embarazo
Por el momento, la estrategia más avanzada es la vacunación durante el embarazo para generar anticuerpos que crucen la placenta y protejan al lactante durante los primeros meses de vida, de forma similar a la desarrollada para la protección frente a tosferina.
El año pasado, 2022, GSK detuvo voluntariamente el desarrollo de su vacuna en mujeres embarazadas [14] (Dieussaert I, N Eng J Med 2024 [15]).
Por su parte, Pfizer ha continuado con los ensayos clínicos de vacunación en mujeres embarazadas (ver imagen adjunta):
- Estudio SAVVY (NCT04032093 [16]): se trata de un ensayo clínico en fase 2b para analizar la seguridad e inmunogenicidad de la vacuna RSVpreF en embarazadas de 18 a 49 años. Los resultados iniciales de este estudio muestran que la vacuna genera respuesta inmune en la embarazada y que la transmisión de anticuerpos al feto es eficiente con una persistencia mínima de 6 meses. Los resultados fueron publicados hace un año (Simoes EAF, N Engl J Med 2022 [17]).
- Estudio MATISSE (MATernal Inmunization Study for Safety and Efficacy) (NCT04424316 [18]), un ensayo de fase 3 del cual se han publicado los primeros datos hace pocos días (Kampmann B, N Engl J Med 2023 [19]) y que se comenta a continuación con datos basados en la información presentada en la reunión del ACIP-CDC (EE. UU.) del pasado 23 de febrero de 2023.
[volver al principio [12]]
Estudio Matisse
Es un ensayo clínico aleatorizado, doble ciego, controlado con placebo, fase 3 en el que se han incluido 18 países (NCT04424316 [18]). Se ha iniciado en junio 2020 y finalizará en el último trimestre de 2023 y, por tanto, cubre 4 estaciones de VRS, 2 en el hemisferio norte y 2 en hemisferio sur. El objetivo principal es evaluar la eficacia y seguridad de la vacuna RSVpreF (Abrysvo) en lactantes nacidos de madres vacunadas durante la gestación.
Los resultados de este estudio [24] se han presentado en la reunión del ACIP (Advisory Committee on Immunization Practices, CDC, EE. UU.) el 23 de febrero de 2023:
- Se han incluido 7392 gestantes de edad ≤49 años a las que se administró una única dosis de 120 microgramos de la vacuna o del placebo a una edad gestacional entre las 24 y las 36 semanas (el 44,7 % entre las 32 y las 36 semanas de edad gestacional).
- El seguimiento de los lactantes se mantiene durante 1 año para análisis de eficacia y 2 años para seguridad.
- Efectos neonatales:
- Prematuridad 5,6 % en el grupo vacuna vs. 4,7 % en el del placebo.
- Bajo peso 5,1 % grupo vacuna vs. 4,4 % grupo placebo.
- Muertes y pérdidas fetales (no relacionados con la vacuna):
- Muerte materna: 1 madre del grupo de vacuna falleció por shock hipovolémico tras sangrado posparto en parto domiciliario.
- Pérdidas fetales: 18 muertes fetales, 10 en el grupo vacuna vs. 8 en el de placebo, no significativo.
- Muerte infantil: 17 casos, 5 en vacunados vs. 12 en el grupo placebo.
- Eficacia (ver imagen adjunta).
En resumen:
- Eficacia frente a enfermedad grave:
- 90 días: 81,8 % (IC 99,5 %: 40,6-96,3 %).
- 6 meses: 69,4 % (IC 97,5 %: 44,3-84,1 %).
- Eficacia frente a enfermedad que precisa atención médica:
- 90 días: 57,1 % (IC 99,5 %: 14,7-79,8 %).
- 6 meses: 51,3 % (IC 97,5 %: 29,4-66,8 %).
Concluyen que la vacuna es bien tolerada y presenta un buen perfil riesgo/beneficio para las gestantes y sus hijos. Pfizer ha presentado la documentación a la EMA, que ha establecido un acuerdo de evaluación acelerada (accelerated assesment) y se espera que el CHMC emita su opinión en el próximo mes de julio.
Los resultados de este estudio acaban de ser publicados (Kampmann B, N Engl J Med 2023 [19]).
Tras la reunión del 23 de febrero, el ACIP-CDC ha expuesto las siguientes consideraciones (Fleming-Dutra K, ACIP-CDC feb/2023 [26]):
- ¿Debería recomendarse la vacuna RSVPreF bivalente a todas las embarazadas a las 24-36 semanas de edad gestacional?
- Esta recomendación debería ser considerada en el contexto actual de cuidado y prevención de la enfermedad por VRS en lactantes.
- Consideración acerca del período de administración de la vacuna. Por el momento no hay datos de eficacia estratificados según edad gestacional en el momento de la vacunación. La mayoría de las dosis se administraron con una edad gestacional ≥28 semanas (el 45 % ≥32 semanas).
- Todas las participantes en el estudio recibieron una única dosis. No hay datos acerca de la eficacia y seguridad de dosis adicionales en siguientes embarazos.
El 21 de marzo de 2023, la EMA ha concedido el estatus de evaluación acelerada a la solicitud de autorización de comercialización [27] de la vacuna bivalente frente al VRS de Pfizer (PF-06928316 RSVpreF) para adultos mayores y embarazadas. Se espera una decisión en el segundo semestre de 2023.
Además, la FDA ha aceptado la revisión de la solicitud de “licencia biológica” para su vacuna frente al VRS para la prevención de las infecciones respiratorias de vías bajas (IRVB) y IRVB graves que requieren atención médica, causadas por el VRS en lactantes desde el nacimiento hasta los seis meses de edad, mediante la inmunización activa de las embarazadas. Esta decisión ha sido tomada en base a los resultados del estudio MATISSE.
En resumen, y como ya se refería en una nota previa de esta web [28], quizás una estrategia mixta, integrada por el uso de anticuerpos monoclonales en lactantes menores de 6 meses y complementada con la vacunación de gestantes y otras poblaciones (adultos, niños mayores) constituya por el momento la mejor opción para disminuir la carga de enfermedad global por VRS.
[volver al principio [12]]
Adenda, 28 de agosto de 2023.- Según ha anunciado Pfizer [29], la Comisión Europea ha aprobado el uso de la vacuna Abrysvo para la prevención de las infecciones por VRS en personas de 60 o más años y en mujeres gestantes.
[volver al principio [12]]
Adenda, 23 de agosto de 2023.- La FDA estadounidense ha aprobado la vacuna Abrysvo (Pfizer) para la prevención de las infecciones graves por VRS en lactantes mediante la vacunación de las gestantes durante las semanas 32 a 36 de la gestación (CIDRAP, 22 de agosto de 2023 [30]).
[volver al principio [12]]
Adenda, 20 de mayo de 2023.- El comité asesor de la FDA estadounidense (VRBPAC) ha aprobado recomendar a la FDA la autorización de la vacuna Abrysvo (Pfizer) dirigida a mujeres gestantes. El dictamen del VRBPAC ha sido de 14 a favor y cero en contra en cuanto a eficacia, y 10 a favor y 4 en contra en cuanto a seguridad (por un aumento de partos prematuros: 5,6 % en grupo vacunadas frente a 4,7 % en grupo placebo [no significativo estadísticamente]). Ver: documentos debatidos por el VRBPAC (Vaccines and Related Biological Products Advisory Committee May 18, 2023 Meeting Announcement. Event Materials [31]); nota de prensa de Pfizer [32]; comentarios en CIDRAP [33]; y noticia en The New York Times [34]).
[volver al principio [12]]
Adenda, 21 de julio de 2023.- La EMA ha recomendado la autorización de Abrysvo (Pfizer) en mujeres gestantes y personas de 60 o más años de edad (nota de la EMA [35]).
[volver al principio [12]]
-oOo-
Más información en esta web
- CAV-AEP, 11 de abril de 2023. Se estrecha el cerco al virus respiratorio sincitial (VRS) (parte 1): vacunación de adultos mayores [11].
- CAV-AEP, 17 de noviembre de 2022. Avances en la prevención de la infección por VRS [36].
- CAV-AEP, 16 de marzo de 2023. Galicia aprueba la profilaxis frente al VRS y la vacunación frente a rotavirus [28].
- CAV-AEP. Manual de Inmunizaciones en línea de la AEP. Virus respiratorio sincitial [37].
Referencias bibliográficas
- Fleming-Dutra K. Work Group considerations regarding maternal RSV vaccine [26]. ACIP-CDC, 23 de febrero de 2023.
- Jewett C. F.D.A. Panel Recommends R.S.V. Vaccine to Protect Young Infants. A committee of experts voted in favor of a new shot administered to pregnant women, one in a series of new ways to arm the very young against a life-threatening virus [34]. The New York Times, 18 de mayo de 2023.
- Kampmann B, et al. Bivalent Prefusion F Vaccine in Pregnancy to Prevent RSV Illness in Infants. N Engl J Med. 2023;388:1451-64 [19]. ►Correspondence. Bivalent Prefusion F Vaccine in Pregnancy to Prevent RSV Illness in Infants. N Engl J Med. 2023;389:1052-5 [38].
- Munjal I. Safety and Efficacy of Bivalent RSV Prefusion F Vaccine in Vaccinated Mothers and their Infants [24]. ACIP-CDC, 23 de febrero de 2023.
- Pfizer, 18 de mayo de 2023. FDA Advisory Committee Votes in Support of Approval for Pfizer’s Vaccine Candidate to Help Prevent RSV in Infants Through Maternal Immunization [32].
- Schnirring L. FDA advisers recommend RSV vaccine for pregnant women to protect newborns [33]. CIDRAP, 19 de mayo de 2023.
- Simoes EAF, et al. Prefusion F Protein–Based Respiratory Syncytial Virus Immunization in Pregnancy. N Engl J Med. 2022;386:1615-26 [17].
- VRBPAC, Vaccines and Related Biological Products Advisory Committee May 18, 2023 Meeting Announcement. Event Materials [31].
Otras referencias (hasta junio de 2024)
2024
- Álvarez-Aldeán J, et al. Cost-effectiveness Analysis of Maternal Immunization with RSVpreF Vaccine for the Prevention of Respiratory Syncytial Virus Among Infants in Spain. Infect Dis Ther. 2024, 11/may. DOI: 10.1007/s40121-024-00975-6 [39].
- Dieussaert I, et al. RSV Prefusion F Protein–Based Maternal Vaccine — Preterm Birth and Other Outcomes. N Engl J Med. 2024;390:1009-21 [40].
- Rasmussen RA, et al. Maternal RSV Vaccine — Weighing Benefits and Risks. N Engl J Med. 2024;390:1050-1 [41].
- Son M, et al. Nonadjuvanted Bivalent Respiratory Syncytial Virus Vaccination and Perinatal Outcomes. JAMA Netw Open. 2024;7(7):e2419268 [42]. ►Comentado en: Regan AK. Perinatal Outcomes After RSV Vaccination During Pregnancy—Addressing Emerging Concerns. JAMA Netw Open. 2024;7(7):e2419229 [43]. ►Comentado en: CIDRAP, 8 de julio de 2024 [44]. ►Comentado en: EurekAlert, 8 de julio de 2024 [45].
2023
- Annenberg Public Policy Center, University of Pennsylvania, ahosto de 2023. Reducing Susceptibility to Misconceptions About Vaccination During Pregnancy: RSV [46]. ► Comentado en CIDRAP, 9 de agosto de 2023 [47].
- Boytchev H. Maternal RSV vaccine: Further analysis is urged on preterm births. BMJ. 2023;381:p1021 [48].
- Carbonell-Estrany X, et al. Prioritising respiratory syncytial virus prevention in low-income and middle-income countries. Lancet Global Health. 2023;11(5):655-7 [49].
- Dave The Knave, 9 de abril de 2023. Pfizer's RSV Vaccine in Pregnant Women. Critical Analysis [50].
- Graham BS. The Journey to RSV Vaccines - Heralding an Era of Structure-Based Design. N Engl J Med. 2023;38:579-81 [51].
- Karron RA. RSV Illness in the Young and the Old - The Beginning of the End? N Engl J Med. 2023;388:1522-4 [52].
- Mazur N, et al. Respiratory syncytial virus prevention within reach: the vaccine and monoclonal antibody landscape. Lancet Infect Dis. 2023;23:e2-21 [1].
- Robinson R, et al. Preventing respiratory syncytial virus bronchiolitis in infants. BMJ. 2023;381:p1023 [53].
- Topol E. Why the new RSV vaccines are a BFD [54]. Ground Truths, 8 de abril de 2023.
Otros
- Crank MC, et al. A proof of concept for structure-based vaccine design targeting RSV in humans. Science. 2019;365:505-9 [55].
- Li Y, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic análisis. Lancet. 2022;399:2047-64 [56].
- Walsh E, et al. A Randomized Phase 1/2 Study of a Respiratory Syncytial Virus Prefusion F Vaccine. J Infect Dis. 2022;225:1357-66 [57].
Historial de actualizaciones
- 28 de agosto de 2023. Se añade una adenda informando de que la Comisión Europea ha aprobado la vacuna Abrysvo en mayores y en mujeres embarazadas.
- 23 de agosto de 2023. Se añade adenda informando de la aprobación por parte de la FDA de la vacuna Abrysvo en gestantes.
- 21 de julio de 2023. Se añade adenda relativa a la recomendación de autorización de la EMA para Abrysvo en gestantes y personas de 60 o más años.
- 20 de mayo de 2023. Se añade la adenda relativa a la decisión favorable del VRBPAC sobre la vacuna Abrysvo dirigida a gestantes.
[volver al principio [12]]