Avances en la prevención de la infección por el VRS
| Contenido |
|---|
| ● Avances en la prevención de la infección por el VRS ● Vacunación de la embarazada [ver] ● Vacunas frente al VRS: un camino largo y tortuoso [ver] ● Nirsevimab, para la prevención en el lactante [ver] ● Comentario final [ver] ● Más información [ver] ● Otras referencias [ver] |
| En pocas palabras |
|---|
| ● Se comentan dos hechos importantes en la prevención de las infecciones por VRS. ● Las vacunas del VRS han recorrido ya un largo y tortuoso camino de, al menos, seis décadas. ● Ahora, el conocimiento de la estructura y conformación de la proteína F prefusión y el desarrollo de antígenos estables basados en ella han permitido avanzar en el desarrollo de un candidato de vacuna del VRS. ● Se han anunciado los resultados prometedores de un ensayo de fase 3 con un producto que, administrado a mujeres gestantes, ha logrado cifras importantes de eficacia en la prevención de la enfermedad grave en sus lactantes. ● Nirsevimab, aprobado por la EMA recientemente, es un anticuerpo monoclonal dirigido contra el epítopo θ de la configuración prefusión de la proteína F, que es 50 veces más potente que el palivizumab y que con una sola inyección mantiene niveles protectores, al menos, durante 150 días. |
-oOo-
Avances en la prevención de la infección por el VRS
Recientemente, se han producido dos noticias que constituyen un progreso significativo en la prevención por el virus respiratorio sincitial (VRS):
- La primera es el anuncio de Pfizer, el pasado 1 de noviembre, en el que comunica los resultados del estudio de fase 3, denominado estudio MATISSE, de su vacuna frente al VRS en la mujer embarazada. Esta vacuna contiene la subunidad F en su estado prefusión de los tipos A y B del VRS.
- La segunda es el anuncio de la Comisión Europea, el 4 de noviembre de 2022, informando de la autorización de nirsevimab, un anticuerpo monoclonal para la prevención de la infección del tracto respiratorio inferior causada por el VRS en recién nacidos y lactantes.
Se comentan estos anuncios y su importancia, de forma breve, a continuación.
[volver al principio]
Vacunación de la embarazada
MATISSE (MATernal Inmunization Study for Safety and Efficacy) es un estudio de fase 3, aleatorizado, doble ciego, controlado con placebo diseñado para evaluar la eficacia, la seguridad y la inmunogenicidad de la vacuna RSVpreF (una vacuna que contiene la proteína F en estado prefusión, estabilizada, frente a los subtipos A y B del virus) frente a la enfermedad de las vías respiratorias bajas que precisan atención médica (MA-LRTI, por sus siglas en inglés) y MA-LRTI grave en bebés nacidos de madres sanas vacunadas durante el embarazo (NCT04424316):
- El estudio reclutó aproximadamente 7400 mujeres sanas embarazadas ≤49 años de edad, que fueron aleatorizadas en una proporción de 1:1 para recibir una dosis única de 120 µg de la vacuna o un placebo durante el segundo o tercer trimestre de su embarazo.
- El ensayo también evaluó la seguridad y la inmunogenicidad de la vacuna en embarazadas y sus bebés.
- El estudio incluyó mujeres de 18 países y comenzó en junio de 2020, por lo que abarcó múltiples temporadas de VRS, tanto en el hemisferio norte como en el sur.
Según Pfizer, en un análisis preliminar prefijado de antemano por un Comité Independiente de Monitorización de Datos, se ha demostrado que la vacuna cumple el primer criterio principal de valoración (primary endpoint):
- La eficacia observada frente a la enfermedad grave de las vías respiratorias inferiores con necesidad de asistencia médica (MA-LRTI grave) fue del 81,8·% (IC·95·%: 40,6 a 96,3 %) en lactantes durante los primeros 90 días de vida.
- La eficacia durante el periodo de seguimiento de 6 meses fue del 69,4 % (IC 95 %: 44,3 a 84,1 %).
Aunque el segundo criterio principal de valoración (enfermedad de las vías respiratorias inferiores con necesidad de asistencia médica, -MA-LRTI-) no se cumplió, la vacuna también tuvo una eficacia significativa en este punto: 57,1·% (IC 95 %: 14,7 a 79,8%) en lactantes durante primeros 90 días de vida. Se observó una eficacia para MA-LRTI del 51,3·% (IC 95 %: 29,4 a 66,8 %) durante el período de seguimiento de seis meses.
[volver al principio]
Vacunas frente al VRS: un camino largo y tortuoso
El camino hasta la consecución de una vacuna frente el VRS ha sido un camino largo y tortuoso. Se vio súbitamente frenado por los hechos acaecidos en 1966, cuando se vacunó a 31 lactantes con una vacuna del virus inactivado con formol (Kim HW, Am J Epidemiol 1969). Aunque los lactantes desarrollaron anticuerpos frente al VRS, 23 de los vacunados se infectaron y en ellos la enfermedad fue más grave que en niños no vacunados, ya que 18 de ellos fueron hospitalizados y dos fallecieron. En el examen histopatológico de los pulmones se evidenció un infiltrado mononuclear y de eosinófilos característico de una respuesta inmune TH2. Hoy día, hay acuerdo en que el curso más grave de la infección en los niños vacunados se debió a una enfermedad potenciada por anticuerpos (Openshaw PJM, Annu Rev Immunol 2017). Todo esto, unido a la pobre respuesta inmunitaria frente al VRS en los lactantes menores de 6 meses, ha conducido a que, hasta este momento, esta franja de edad haya sido excluida para desarrollar vacunas frente a este virus.
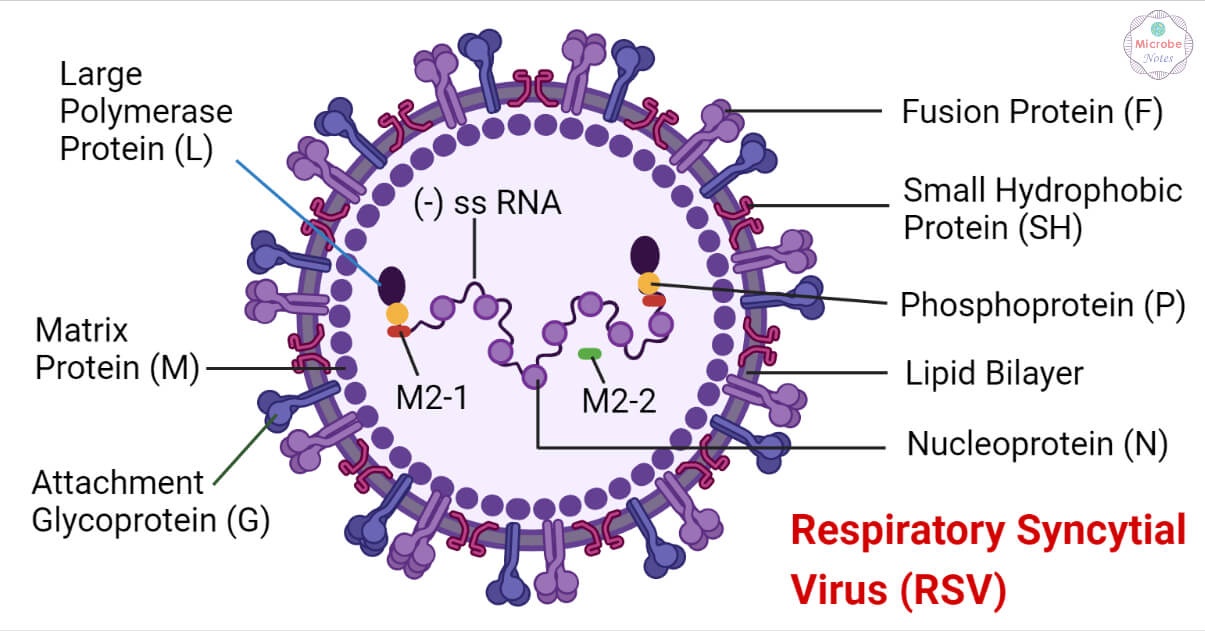
Otro obstáculo para la obtención de vacunas frente al VRS ha sido lograr el antígeno inmunizante adecuado. De las tres proteínas que existen en la superficie del virus (Ruckwardt TJ, Immunity 2019) (ver figura adjunta n.º 1) la proteína F es la que mejores propiedades reúne como antígeno vacunal, ya que contiene un número elevado de potentes epítopos neutralizantes, además de conservarse en los subtipos A y B del virus.
La proteína F puede encontrarse en dos estados de conformación: la proteína F prefusión, que es la forma en que se encuentra antes de que el virus infecte la célula, y la proteína F posfusión, que corresponde a la conformación de la proteína cuando ejerce su función de facilitar la fusión del virus con la célula. Los mejores epítopos inmunizantes se encuentran en la proteína F prefusión. El problema radica en que esta forma es altamente inestable y rápidamente cambia su conformación a la forma F posfusión (como se ha dicho, de forma ilustrativa, cambia desde una forma de "penacho de brócoli" a una forma de "palo de golf") (ver figura adjunta n.º 2), y este cambio de conformación acarrea una pérdida de los mejores epítopos inmunizantes (Ruckwardt TJ, Immunity 2019; Graham BS, Curr Opin Virol 2017). Solo los anticuerpos frente a la proteína F prefusión, pero no los anticuerpos frente a la forma posfusión, tienen capacidad neutralizante frente al virus y protegen frente a la infección y su gravedad (Ruckwardt TJ, Immunity 2019; Capella C, J Infect Dis 2017).
Los anticuerpos frente a la proteína F posfusión no solo carecerían de capacidad neutralizante, sino que podrían dar lugar a enfermedad más grave (enfermedad potenciada por anticuerpos). De hecho, un estudio reciente ha demostrado que la inactivación del VRS con formalina y alcohol hace que todas las moléculas de la proteína F prefusión de la superficie del virus cambien a la configuración posfusión (ver figura adjunta n.º 3), perdiendo la capacidad de generar anticuerpos neutralizantes (Killikelly AM, Sci Rep 2016).
Barney Grahan y Jason McLellan (Kolata G, NYT 2022), los investigadores que más tarde jugarían un papel primordial en el desarrollo de vacunas frente al SARS-CoV-2, al determinar la estructura y conformación espacial de la proteína S1 de este virus, lograron crear, introduciendo mutaciones, diferentes versiones estabilizadas de la proteína F prefusión, que inducían potentes anticuerpos neutralizantes. El trabajo fue publicado en Science (McLellan JS, Science 2013) y fue considerado como uno de los 10 mejores trabajos del año, lo que mereció un comentario de la prestigiosa revista (2013 Runners-Up, Science 2013; Cohen J, Science 2013).
Este hecho crucial supuso el pistoletazo de salida para la carrera de lograr una vacuna efectiva, y en la actualidad existen más de 30 ensayos clínicos de vacunas del VRS (PATH, 2022), en diferentes fases de desarrollo y con distintas plataformas. Pero, además, permitió identificar los epítopos inmunizantes más efectivos y desarrollar anticuerpos monoclonales de nueva generación frente a este virus (PATH, 2022). Estos anticuerpos exhiben una potencia varias decenas de veces superior al palivizumab, además de una vida media mucho más larga, que se logra mediante la introducción de mutaciones en la porción de Fc, que permite mantener, con una sola inyección, niveles protectores de anticuerpos en el lactante durante toda la estación del VRS.
[volver al principio]
Nirsevimab, para la prevención en el lactante
La segunda noticia de esta semana se refiere a unos de estos anticuerpos, el nirsevimab (Beyfortus, AstraZeneca) que, tras la recomendación favorable de la EMA para su autorización el 16 de septiembre de 2022, ha recibido, el 4 de noviembre de 2022, la autorización de la Comisión Europea para la prevención de la infección del tracto respiratorio inferior (ITRI) causada por el virus respiratorio sincitial (VRS) en recién nacidos y lactantes.
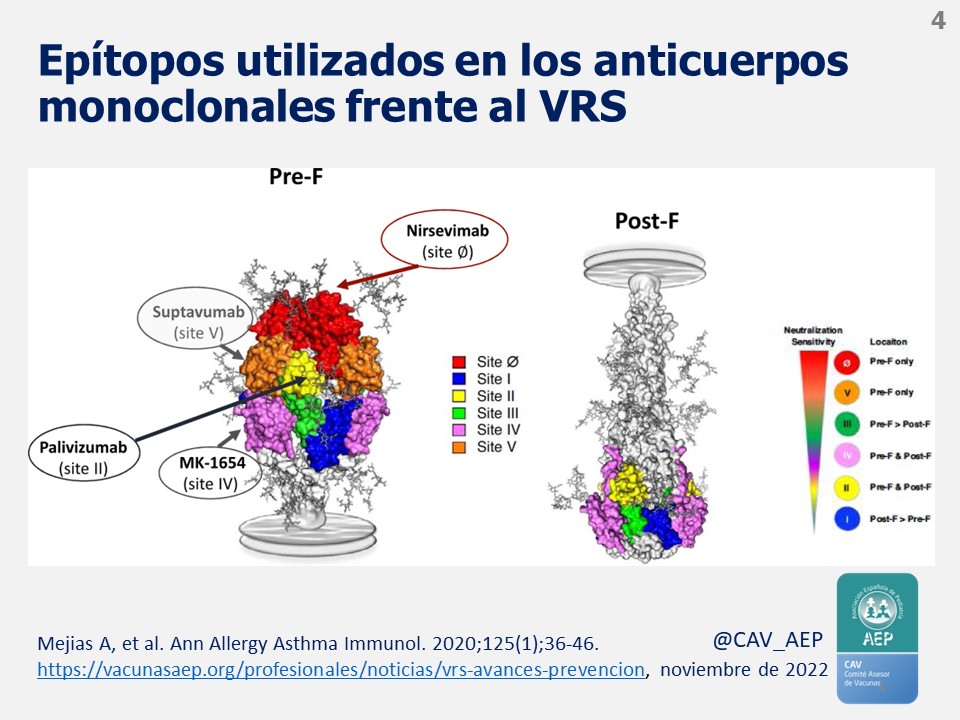
Nirsevimab es un anticuerpo monoclonal dirigido contra el epítopo Ø (ver figura adjunta n.º 4) de la configuración prefusión de la proteína F, que es 50 veces más potente que el palivizumab y que con una sola inyección mantiene niveles protectores, al menos, durante 150 días. En prematuros de 29 a 35 semanas de gestación, ha demostrado una eficacia del 70,1 % (IC 95 %: 52,3 a 81,2) en la prevención de la enfermedad de vías respiratorias bajas con necesidad de atención médica durante los 150 días siguientes a la inyección. Su eficacia frente a la fhospitalización fue del 78,4 % (IC 95 %: 51,9 a 90,3 %) (Griffin MP, N Engl J Med 2020). Posteriormente en un segundo ensayo en fase 3, realizado en lactantes a término y prematuros ≥35 semanas, niservimab tuvo una eficacia del 74,5 % (IC 95 %: 49,6 a 87,1 %) frente a enfermedad de vías respiratorias bajas con necesidad de atención médica (Hammitt LL, N Engl J Med 2022). La eficacia frente a la hospitalización no fue significativa debido al escaso número de casos. Sin embargo, en un análisis (prefijado de antemano) de los datos agrupados de ambos estudios la efectividad frente a hospitalización asociada al VRS fue 77,3 % (IC 95 %: 30,3 a 89,7 %).
[volver al principio]
Comentario final
Dada la experiencia previa con la vacuna inactivada y la inmadurez de la respuesta inmune del lactante menor de 6 meses (Openshaw PJM, Annu Rev Immunol 2017), la inmunización de la mujer embarazada y la administración de los anticuerpos monoclonales de nueva generación serán las únicas formas posibles -al menos a corto y medio plazo- de proteger a esta población, que representa el grupo más vulnerable frente a la infección por VRS (Havdal LB, Front Pediatr 2022). Ahora será necesario estudiar y definir las estrategias para que el uso de estas nuevas formas de prevención tenga el mayor impacto en la salud de los lactantes.
Para niños de mayor edad y adultos vulnerables, la vacunación con algunas de los diferentes productos en fase de desarrollo será una medida importante para mejorar la prevención de las infecciones por VRS. En definitiva, la estabilización de la proteína F prefusión por Barney Graham y Jason McLellan ha abierto una nueva era en la prevención de las infecciones por el VRS.
[volver al principio]
-oOo-
Más información
- CAV-AEP. Otras noticias sobre el VRS y sus vacunas en esta web.
- CAV-AEP, mayo de 2022. Vacunas frente al VRS. En: Vacunas del futuro. Manual de vacunas en línea de la AEP.
- Capella C, et al. Prefusion F, postfusion F, G antibodies, and disease severity in infants and young children with acute respiratory syncytial virus infection. J Infect Dis. 2017;216(11):1398-406.
- Cohen J. Structural Biology Triumph Offers Hope Against a Childhood Killer. Science. 2013;342(6258):546-7.
- EMA, 16 de septiembre de 2022. New medicine to protect babies and infants from respiratory syncytial virus (RSV) infection.
- Graham BS. Vaccine development for respiratory syncytial virus. Curr Opin Virol. 2017;23:107-12.
- Griffin MP, et al. Single-Dose Nirsevimab for Prevention of RSV in Preterm Infants. N Engl J Med. 2020;383(5):415-25.
- Hammitt LL, et al. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022;386(9):837-46. ►Comentado en: Ochoa Sangrador C, et al. Nirsevimab previene infecciones por virus respiratorio sincitial en lactantes a término, pero no están claros su beneficio clínico ni su eficiencia. Evid Pediatr. 2022;18:17.
- Havdal LB, et al. Risk factors associated with severe disease in respiratory syncytial virus infected children under 5 years of age. Front Pediatr. 2022, 30/ago. DOI: 10.3389/fped.2022.1004739.
- Killikelly AM, et al. Pre-fusion F is absent on the surface of formalin-inactivated respiratory syncytial virus. Sci Rep. 2016;6:34108.
- Kim HW, et al. Respiratory Syncytial Virus disease in infants despite prior administration of antigenic inactivated vaccine. Am J Epidemiol. 1969;89(4):422-34.
- Kolata G, et al. Halting Progress and Happy Accidents: How mRNA Vaccines Were Made. The stunning Covid vaccines manufactured by Pfizer-BioNTech and Moderna drew upon long-buried discoveries made in the hopes of ending past epidemics. The New York Times, 15 de enero de 2022.
- McLellan JS, et al. Structure-Based Design of a Fusion Glycoprotein Vaccine for Respiratory Syncytial Virus. Science. 2013;342:592-8.
- Mejías A, et al. The Journey to an RSV Vaccine. Ann Allergy Asthma Immunol. 2020;125(1);36-46.
- Openshaw PJM, et al. Protective and harmful immunity to RSV infection. Annu Rev Immunol. 2017;35:501-32.
- PATH, 1 de agosto de 2022. RSV Vaccine and mAb Snapshot.
- Pfizer, 1 de noviembre de 2022. Pfizer Announces Positive Top-Line Data of Phase 3 Global Maternal Immunization Trial for its Bivalent Respiratory Syncytial Virus (RSV) Vaccine Candidate.
- Ruckwardt TJ, et al. Immunological Lessons from Respiratory Syncytial Virus Vaccine Development. Immunity. 2019;51(3):429-42.
- Sanofi, 16 de septiembre de 2022. El CHMP recomienda la aprobación de nirsevimab (Beyfortus®) para la prevención de la enfermedad por VRS en lactantes.
- Sanofi, 4 de noviembre de 2022. Beyfortus® (nirsevimab) recibe de la Comisión Europea la primera aprobación mundial para la prevención de la enfermedad por VRS en lactantes.
- Science, 2013 Runners-Up. In Vaccine Design, Looks Do Matter. Science. 2013;342(6165):1442-3.
[volver al principio]
Otras referencias (hasta junio de 2023)
Aspectos generales
- Abbasi J. “This Is Our COVID” - What Physicians Need to Know About the Pediatric RSV Surge. JAMA. 2022;328(21):2096-8.
- Billard MN, et al. The link between respiratory syncytial virus infection during infancy and asthma during childhood. Lancet. 2023, 19/abr. DOI: 10.1016/S0140-6736(23)00672-4.
- Bradsley M, et al. Epidemiology of respiratory syncytial virus in children younger than 5 years in England during the COVID-19 pandemic, measured by laboratory, clinical, and syndromic surveillance: a retrospective observational study. Lancet Infect Dis. 2022, 2/sep. DOI: 10.1016/S1473-3099(22)00525-4.
- CDC. Respiratory Syncytial Virus Infection (RSV).
- Garcés Sánchez M, et al. Carga clínica y económica del virus respiratorio sincitial en el entorno ambulatorio. Rev Pediatr Aten Primaria. Supl. 2022;24(31):e83-e84.
- Griffin MR, et al. A Challenge to Respiratory Syncytial Virus Illness in Adults. N Engl J Med. 2022;386:2427-8.
- Li Y, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic analysis. Lancet. 2022;399(10340):2047-64.
- Martinón-Torres F, et al. The path towards effective respiratory syncytial virus immunization policies: recommended actions. Arch Bronconeumol. 2023, 20/jun. DOI: 10.1016/j.arbres.2023.06.006.
- Rao S, et al. Shifting Epidemiology and Severity of Respiratory Syncytial Virus in Children During the COVID-19 Pandemic. JAMA Pediatr. 2023, 15/may. DOI: 10.1001/jamapediatrics.2023.1088. ► Comentado en: Van Beusekom M. COVID public health measures may have led to RSV resurgence. CIDRAP, 16 de mayo de 2023.
- Reicherz F, et al. Waning Immunity Against Respiratory Syncytial Virus During the Coronavirus Disease 2019 Pandemic. J Infect Dis. 2022, 7/may. DOI: 10.1093/infdis/jiac192.
- Rosas-Salazar C, et al. Respiratory syncytial virus infection during infancy and asthma during childhood in the USA (INSPIRE): a population-based, prospective birth cohort study. Lancet. 2023, 19/abr. DOI: 10.1016/S0140-6736(23)00811-5.
- Wildenbeest JG, et al. The burden of respiratory syncytial virus in healthy term-born infants in Europe: a prospective birth cohort study. Lancet Respir Med. 2022, 10/nov. DOI: 10.1016/S2213-2600(22)00414-3.
Vacunas
- Abbasi J. RSV Vaccines, Finally Within Reach, Could Prevent Tens of Thousands of Yearly Deaths. JAMA. 2022;327(3):204-6.
- Díez-Domingo J, et al. Safety and immunogenicity of a ChAd155-vectored RSV vaccine (ChAd155-RSV) in healthy RSV-seropositive children 12–23 months of age. J Infect Dis. 2022, 9/dic. DOI: 10.1093/infdis/jiac481.
- Drew L. Will a new wave of RSV vaccines stop the dangerous virus? Pfizer, GSK and Moderna are ahead in the race to produce vaccines against respiratory syncytial virus — what will be their impact? Nature. 2023, 27/ene. DOI: 10.1038/d41586-023-00212-z.
- Fairbank R. RSV wave hammers hospitals - but vaccines and treatments are coming. As the respiratory illness helps to fuel a ‘tripledemic’, Pfizer and GSK race to get jabs approved. Nature. 2022, 15/dic. DOI: 10.1038/d41586-022-04434-5.
- Larkin H. Investigational RSV Vaccine Given During Pregnancy Protects Newborns. JAMA. 2022;328(22):2201.
- Nirenberg E. Respiratory Syncytial Virus (RSV): A pathogen that will hopefully soon be vaccine-preventable. Deplatform Disease, 11 de noviembre de 2022.
- Phijffer E. Are We Ready for Maternal Respiratory Syncytial Virus Vaccination? J Infect Dis. 2022;225(12):2053-5.
- Schmoele-Thoma B, et al. Vaccine Efficacy in Adults in a Respiratory Syncytial Virus Challenge Study. N Engl J Med. 2022;386:2377-86.
- Simoes EAF, et al. Prefusion F Protein–Based Respiratory Syncytial Virus Immunization in Pregnancy. N Engl J Med. 2022;386:1615-26. ►Comentado en: Larkin HD. Maternal RSV Vaccine Could Protect Infants, Interim Analysis Suggests. JAMA. 2022;327(22):2182.
Nirsevimab
- Mazur NI, et al. Respiratory syncytial virus prevention within reach: the vaccine and monoclonal antibody landscape. Lancet Infect Dis. 2023;23(1):2-21.
- Montesdeoca Melián A, et al. Comentario CAV-AEP a Evidencias en Pediatría sobre nirsevimab. Evid Pediatr. 2023;19:33.
- Ochoa Sangrador C, et al. Nirsevimab y prevención de bronquiolitis en lactantes nacidos a término. Evid Pediatr. 2023;19:35.
- Ochoa Sangrador C, et al. Nirsevimab previene infecciones por virus respiratorio sincitial en lactantes a término, pero no están claros su beneficio clínico ni su eficiencia. Evid Pediatr. 2022;18:17.
- Rodriguez-Fernandez R, et al. Monoclonal Antibodies for Prevention of Respiratory Syncytial Virus Infection. Pediatr Infect Dis. 2021;40(5S):S35-S39.
- Sanofi, 12 de mayo de 2023. Press Release: Nirsevimab delivers 83% reduction in RSV infant hospitalizations in a real-world clinical trial setting.
- Wilkins D, et al. Nirsevimab binding-site conservation in respiratory syncytial virus fusion glycoprotein worldwide between 1956 and 2021: an analysis of observational study sequencing data. Lancet Infect Dis. 2023;23(7):856-66.
- Wise J. RSV: UK to examine whether to offer monoclonal antibody routinely to all babies. BMJ. 2022;379:o2725.
[volver al principio]