#MedSafetyWeek: semana por la seguridad de los medicamentos

| Contenido |
|---|
| ● Introducción ● La seguridad de las vacunas [ver] ● La notificación de las sospechas de reacciones adversas [ver] ● El sistema de farmacovigilancia español [ver] ● ¿Qué es una reacción adversa a un medicamento (RAM)? [ver] ● ¿Cómo notificar las sospechas de reacciones adversas a medicamentos? [ver] ● ¿Quién puede notificar? [ver] ● Las notificaciones de sospechas de RAM no implican la presencia de relación causal [ver] ● Notificación por parte de los profesionales [ver] ● Notificación por parte de los ciudadanos [ver] ● ¿Cómo se utiliza la información proporcionada en las notificaciones? [ver] ● La importancia de notificar las sospechas de reacciones adversas a vacunas [ver] ● Más información en esta web, referencias bibliográficas y enlaces recomendados [ver] |
| En pocas palabras |
|---|
| ● #MedSafetyWeek es un proyecto del Uppsala Monitoring Centre (UMC), centro colaborador de la OMS para la vigilancia internacional de la seguridad de los medicamentos. ● La AEMPS participa, durante los días 6 al 12 de noviembre, en la octava edición de la iniciativa #MedSafetyWeek. ● La seguridad de las vacunas es un elemento clave de los programas de vacunación. Las vacunas en uso son seguras y mantienen un balance riesgo-beneficio favorable. ● Los sistemas de farmacovigilancia se nutren de información proveniente de diversas fuentes, entre ellas las notificaciones voluntarias de sospechas de reacciones adversas. ● ¿Qué es una reacción adversa a un medicamento (RAM)? ● Cómo, quien y qué notificar, por parte de los profesionales y ciudadanos. ● Las notificaciones de sospechas de RAM no implican la certeza de relación causal, son solo una señal de alerta a investigar. ● La información proporcionada en las notificaciones contribuye decisivamente a elevar el nivel de seguridad de los medicamentos. ● El CAV-AEP anima a los profesionales y ciudadanos a notificar todas las sospechas de reacciones adversas a las vacunas. |
-oOo-
Introducción
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) participa, durante los días 6 al 12 de noviembre, en la octava edición de la iniciativa #MedSafetyWeek, que es un proyecto del Uppsala Monitoring Centre (UMC), centro colaborador de la OMS en Suecia para la vigilancia internacional de la seguridad de los medicamentos.
 #MedSafetyWeek se propone la sensibilización sobre la farmacovigilancia en las redes sociales. Participarán autoridades reguladoras de medicamentos de 88 países, entre ellas la AEMPS y los centros de farmacovigilancia de las comunidades autónomas españolas, además de asociaciones de pacientes, sociedades científicas, centros sanitarios e instituciones públicas de todo el mundo.
#MedSafetyWeek se propone la sensibilización sobre la farmacovigilancia en las redes sociales. Participarán autoridades reguladoras de medicamentos de 88 países, entre ellas la AEMPS y los centros de farmacovigilancia de las comunidades autónomas españolas, además de asociaciones de pacientes, sociedades científicas, centros sanitarios e instituciones públicas de todo el mundo.
En esta nota se hace una reseña de algunos elementos centrales de la campaña #MedSafetyWeek, como es quién, qué y cómo notificar las sospechas de reacciones adversas a los fármacos.
[volver al principio]
La seguridad de las vacunas
Las vacunas tienen, en el ámbito regulatorio, la calificación de productos biológicos y deben ser aprobados, actualmente, por la Comisión Europea a través de la European Medicines Agency (EMA) mediante un procedimiento centralizado de evaluación.
La seguridad de las vacunas es un elemento clave de los programas de vacunación. Los niveles de seguridad exigidos para la autorización de las vacunas son muy elevados y superiores, en general, a los de otros fármacos. Las vacunas son productos con propósito preventivo destinados a amplios grupos de población (en muchos casos a cohortes completas), incluyendo a personas sanas, niños de corta edad y personas con circunstancias de vulnerabilidad especial. Se comprende, pues, que las vacunas deben ser productos sumamente seguros.
En efecto, las vacunas en uso son seguras y mantienen un balance riesgo-beneficio favorable, como así lo demuestran numerosos estudios. No obstante, como los demás fármacos, pueden presentar efectos adversos. Este es el objetivo de la farmacovigilancia, la monitorización y análisis de los datos de seguridad de, en este caso, las vacunas.
Las vacunas no solo deben demostrar un elevado nivel de seguridad en los estudios previos a la autorización, sino que una vez aprobadas y en uso siguen siendo objeto de vigilancia de forma permanente y de forma muy especial en los 5 años tras su autorización.
[volver al principio]
La notificación de las sospechas de reacciones adversas
Los sistemas de farmacovigilancia se nutren de información proveniente de diversas fuentes. En general manejan grandes cantidades de datos, cuya gestión requiere de una estrategia elaborada, recursos humanos y tecnológicos importantes. Una de las fuentes de información la constituye la notificación voluntaria por parte de profesionales, ciudadanos y la propia industria, de los eventos adversos ocurridos tras la administración de los fármacos, es decir de las sospechas de reacciones adversas a medicamentos (RAM).
Los sistemas de farmacovigilancia, en base a la información disponible, pueden detectar señales de seguridad o alarma (asociación, correlación), aunque, en general, no pueden establecer si existe una relación causal. A partir de las señales detectadas, se determinan las medidas de precaución necesarias y los estudios específicos destinados a evaluar si hay relación causal entre la señal detectada y las vacunas, u otros fármacos, implicados.
[volver al principio]
El sistema de farmacovigilancia español
El Sistema Español de Farmacovigilancia de medicamentos de Uso Humano (SEFV-H) está formado por 17 centros autonómicos y la propia AEMPS. FEDRA es la base de datos común a la que vierten los datos los centros autonómicos. A nivel de la Unión Europea, Eudravigilance es la entidad responsable de reunir y analizar la información de todos los sistemas de farmacovigilancia de los países miembros.
[volver al principio]
¿Qué es una reacción adversa a un medicamento (RAM)?
RAM es cualquier respuesta nociva y no intencionada a un medicamento. No solo incluye daños involuntarios derivados del uso autorizado de un medicamento en dosis recomendadas, sino también los relacionados con errores de medicación y usos al margen de los términos de la autorización de comercialización (ficha técnnica), incluidos el uso equivocado, la sobredosis y el abuso del medicamento. Términos como efecto secundario, efecto adverso, efecto indeseable, efecto colateral, etc., son sinónimos de RAM (aunque no el término evento adverso, que incluye otros hechos ocurridos en el contexto de la vacunación, aunque con una relación sólo circunstancial, como por ej., un accidente de tráfico en el camino hasta el centro de vacunación).
[volver al principio]
¿Cómo notificar las sospechas de reacciones adversas a medicamentos?
Como se ha dicho, la notificación voluntaria de las sospechas de RAM por parte de los profesionales y los ciudadanos es un elemento central del SEFV-H.
La notificación se puede hacer de dos formas:
- Tarjeta amarilla, enviada por correo postal sin coste o mediante un formulario en línea. Actualmente se usa menos, pues se prefiere el registro electrónico en línea.
- NotificaRAM es una aplicación informática en línea que permite la recogida de la información proporcionada por profesionales y ciudadanos y su envío al centro autonómico de farmacovigilancia y a la base de datos central, FEDRA, y a la AEMPS.
[volver al principio]
¿Quién puede notificar?
- Todos los profesionales implicados en la actividad sanitaria, con carácter general: médicos, enfermeras, odontólogos, farmacéuticos, etc.
- Los ciudadanos, en general.
[volver al principio]
Las notificaciones de sospechas de RAM no implican la presencia de relación causal
La notificación de una sospecha de RAM no implica una relación causal cierta entre el medicamente implicado y la reacción observada. La asociación temporal entre ambos eventos (la administración de un fármaco y la reacción observada) no es prueba de causalidad, pero sí una circunstancia a vigilar.
Es decir, las notificaciones de sospechas de RAM no son efectos secundarios de los medicamentos implicados, mientras que la investigación específica correspondiente así lo establezca, y sea, en consecuencia, reflejado oportunamente en las fichas técnicas y prospectos del medicamento.
[volver al principio]
Notificación por parte de los profesionales
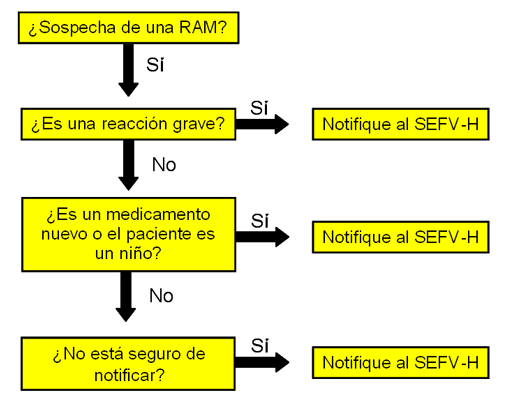 Ante la sospecha de que un medicamento ha causado una reacción adversa, la AEMPS recomienda no demorar la notificación, incluso si no se tiene la certeza de su causalidad.
Ante la sospecha de que un medicamento ha causado una reacción adversa, la AEMPS recomienda no demorar la notificación, incluso si no se tiene la certeza de su causalidad.
Principalmente debe notificar en los casos de:
- Cualquier RAM asociada a medicamentos y vacunas sujetos a seguimiento adicional (con triángulo negro en el envase).
- Sospechas de reacciones adversas graves identificadas con cualquier medicamento, aunque la reacción sea bien conocida. Se entiende como grave aquellas situaciones que: provoquen la muerte; amenacen la vida del paciente; provoquen su hospitalización, o la prolonguen; ocasionen incapacidad laboral o escolar; induzcan defectos congénitos; o sean clínicamente relevantes.
La notificación de las RAM relacionadas con los productos de reciente autorización, las vacunas y las que afectan a la población infantil son de especial importancia. En lo que se refiere a las vacunas, ya se han mencionada las razones. La vigilancia de la seguridad de los medicamentos después de su comercialización, en niños es especialmente importante por la limitada información originada por los ensayos previos a la autorización, por su menor participación en ellos. Y por el principio general de que la naturaleza y la evolución de las enfermedades y las RAM pueden diferir entre adultos y niños.
[volver al principio]
Notificación por parte de los ciudadanos
En ocasiones, los efectos secundarios pueden no ser descubiertos hasta que muchas personas hayan utilizado el medicamento durante un largo periodo. Es por eso que es importante que las personas informen a su médico, farmacéutico u otro profesional sanitario sobre estos efectos. También pueden notificarlos directamente a través de un formulario electrónico (NotificaRAM).
Los ciudadanos pueden notificar sospechas de reacciones adversas de cualquier medicamento, incluidos los medicamentos con receta, sin receta, fórmulas magistrales o medicamentos a base de plantas. Es especialmente útil recibir información de sospechas de reacción adversa que:
- No se mencione en el prospecto que acompaña al medicamento.
- Le ha causado problemas de consideración que interfieren en sus actividades habituales.
- Se asocia a medicamentos nuevos.
- Ocurre cuando se está tomando más de un medicamento, y puede ser causada por una interacción entre estos, o con algunos alimentos.
- Puede haber ocurrido como resultado de un error involuntario en la prescripción, dispensación, administración o toma de la medicación (por ejemplo, error en la dosificación de un medicamento o confusión del nombre).
[volver al principio]
¿Cómo se utiliza la información proporcionada en las notificaciones?
Las notificaciones se recogen y cargan en una base de datos especializada que permite analizarlas y evaluarlas rápidamente. Cada notificación será considerada en el contexto de todas las demás notificaciones recibidas y otras informaciones disponibles (estudios clínicos y otras fuentes).
La AEMPS en colaboración con los centros autonómicos puede usar su notificación de diferentes maneras:
- Llevar a cabo un análisis específico de notificaciones similares para identificar nueva información sobre la seguridad de los medicamentos.
- Trasladar información de interés a la ficha técnica (dirigida al profesional) y al prospecto (dirigido al paciente).
- Tener en cuenta la perspectiva del paciente, para entender mejor el impacto de las reacciones adversas en las personas que usan medicamentos.
- Solicitar información adicional a los fabricantes u otras fuentes.
- Plantear los hechos ante otros organismos reguladores de los medicamentos, dentro y fuera de la Unión Europea.
Y en cualquier caso, siempre, para adoptar las medidas que fueran necesarias (como modificar las recomendaciones y condiciones de uso, limitar la prescripción médica a ciertas circunstancias o especialistas, o al uso como segunda elección) para evitar o reducir los riesgos de los medicamentos y para mantener una relación favorable entre los beneficios y los riesgos de los medicamentos.
La AEMPS emite notas informativas de seguridad que se distribuyen a través de las comunidades autónomas, organizaciones colegiales, sociedades científicas, etc. Y actúa en estrecha colaboración con la EMA (Agencia Europea de Medicamentos) y las otras 26 agencias reguladoras de la Unión Europea. También existen los boletines de farmacovigilancia que emite cada centro autonómico del SEFV-H.
[volver al principio]
La importancia de notificar las sospechas de reacciones adversas a vacunas
Animamos a los profesionales y ciudadanos a notificar todas las sospechas de reacciones adversas a medicamentos (vacunas en este caso) en los casos y según las indicaciones mencionadas antes. Esto contribuirá a garantizar los más elevados niveles de seguridad de las vacunaciones, elemento clave en la salud de la población infantil, adolescentes y durante la gestación.
Esta web está acreditada por la red Vaccine Safety Net de la OMS, como una fuente fiable sobre la seguridad de las vacunas y los programas de vacunación.
[volver al principio]
-oOo-
Más información en esta web
- Noticias sobre efectos secundarios de las vacunas.
- Noticias sobre seguridad de las vacunas.
- Seguridad de las inmunizaciones; contraindicaciones y precauciones, en el Manual de inmunizaciones en línea de la AEP.
- Seguridad de las vacunas, en información para profesionales y familias.
- La web del CAV-AEP, acreditada por Vaccine Safety Net de la OMS.
Referencias bibliográficas y enlaces recomendados
- AEMPS, 6 de noviembre de 2023. La AEMPS participa en la #MedSafetyWeek para sensibilizar sobre la notificación de sospechas de reacciones adversas a medicamentos.
- AEMPS, 9 de mayo de 2023. Farmacovigilancia de Medicamentos de Uso Humano.
- AEMPS. Información para las notificaciones de sospechas de reacciones adversas a medicamentos por parte de profesionales sanitarios.
- AEMPS. Información para las notificaciones de sospechas de reacciones adversas a medicamentos por parte de ciudadanos.
- AEMPS. Directorio de centros autonómicos del Sistema español de Farmacovigilancia de medicamentos de uso humano (SEFV-H).
- AEMPS. Medicamentos sujetos a seguimiento adicional.
- AEMPS. CIMA, Centro de información online de medicamentos de la AEMPS.
- AEMPS. Notas infomativas de seguridad.
- AEMPS, 9 de mayo de 2023. La AEMPS publica el Informe de Actividad del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano de 2022.
- AEMPS. Farmacovigilancia de vacunas del COVID-19.
- AEMPS. Informes periódicos de farmacovigilancia de vacunas COVID-19.
- OMS, Uppsala Monitoring Centre. #MedSafetyWeek.
- Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H).
- Uppsala Monitoring Centre (UMC). UMCGlobalSafety
- Uppsala Monitoring Centre. #MedSafetyWeek. Raising pharmacovigilance awareness on social media.
Otras referencias
- Blau EF, et al. Progress in Immunization Safety Monitoring — Worldwide, 2020–2022. MMWR Morb Mortal Wkly Rep. 2023;72:1321-6.
[volver al principio]







