Una nueva vacuna se añade al arsenal contra al ébola
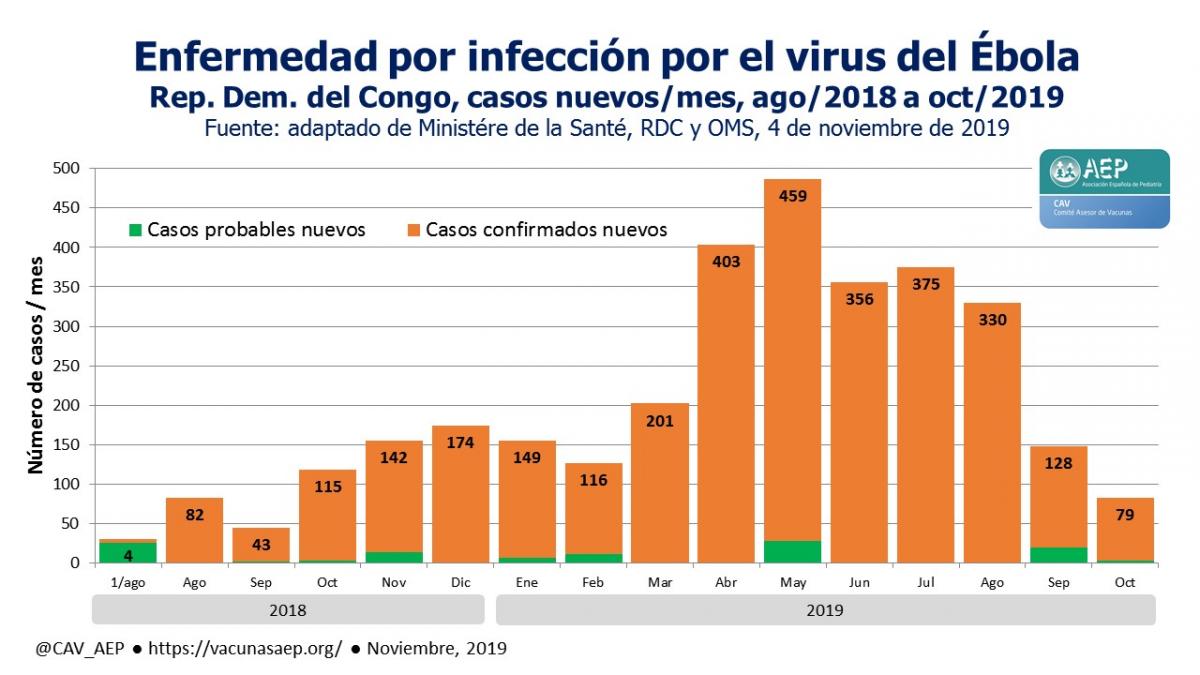
El actual brote de infección por el virus del Ébola en la Rep. Dem. del Congo (RDC), el décimo en este país desde 1976, comenzó en agosto de 2018. El balance global y evolución se muestran en la figura y la tabla adjuntas.
| Brote de ébola en la Rep. Dem. del Congo, balance global de agosto/2018 al 10 de noviembre de 2019 | ||||
|---|---|---|---|---|
| Casos | Fallecidos (%) | Curados | En curso | |
| Confirmados | 3169 | 2075 (65,5 %) | 1064 | 30 |
| Probables | 118 | 118 | ||
| Total casos | 3287 | 2193 (66,7 %) | 1064 | 30 |
Según datos de las autoridades de la RDC, la mortalidad ha sido, hasta el 10 de noviembre de 2019, del 66,7 %. Hasta la fecha indicada, de un total de 3169 confirmados, se han dado de alta por curación a 1064 personas, mientras que 30 confirmados siguen en tratamiento y 482 sospechosos más están en seguimiento.
Hasta ahora solo se ha utilizado una vacuna experimental, rVSV-ZEBOV, fabricada por Merck. A partir de este mes de noviembre, sin embargo, se proyecta utilizar una segunda vacuna, Ad26.ZEBOV/MVA-BN-Filo, fabricada por Janssen Vaccines. En ambos casos, las vacunas han sido donadas por los fabricantes, bajo acuerdos con la OMS y las autoridades locales.
La nueva vacuna se usará según una estrategia distinta a la usada en el caso de rVSV-ZEBOV, por lo que se plantean como herramientas complementarias en el intento de control de la difusión de la enfermedad.
Vacuna rVSV-ZEBOV
Hasta el 8 de noviembre de 2019 se ha vacunado a 249·855 personas. La vacuna rVSV-ZEBOV se está utilizando siguiendo la estrategia de vacunación en anillos, vacunando a los contactos de los casos confirmados o probables, a los contactos de los contactos y a los sanitarios y otras personas que participan en la respuesta al brote de ébola (técnicos, auxiliares, personal de seguridad, etc.). Como alternativa en las zonas donde la seguridad está comprometida, se han llevado a cabo actuaciones novedosas, como son los puntos de vacunación móviles y la vacunación geográfica (de una zona o localidad), en este caso para evitar el hostigamiento de las personas bajo seguimiento.

Esta vacuna, bajo el nombre comercial de Ervebo, ha recibido el pasado mes de octubre una recomendación de la European Medicines Agency (EMA) para autorizar de forma provisional su comercialización en la Unión Europea (ver adenda, al final).
Vacuna Ad26.ZEBOV + MVA-BN-Filo
La vacunación que se proyecta comenzar ahora, incluye en realidad dos productos usados secuencialmente, en niños a partir de un año de edad y adultos (incluyendo mujeres embarazadas y con lactancia materna); primero, Ad26.ZEBOV, un adenovirus no replicante, y dos meses después MVA-BN-Filo, un poxvirus también sin capacidad de replicación, en ambos casos manipulados para expresar antígenos de superficie del virus ébola, especies Zaire, Sudán y Tai Forest, y del virus Marburg.
- Vacuna atenuada con dos componentes administrados secuencialmente con 56 días de intervalo.
- Adenovirus tipo 26 (Ad26) que expresa la glicoproteina (GP) de un virus ébola especie Zaire (ZEBOV) variante Mayinga (Ad26.ZEBOV). Desarrollado por Janssen Pharmaceutical Co. (Johnson&Johnson).
- Poxvirus vaccinia Ankara modificado (MVA) con la GP de los virus ébola especies ZEBOV, Sudán (SEBOV) y Marburg, con una proteína nuclear del virus ébola especie Tai Forest (MVA-BN-Filo). Desarrollado por Bavarian Nordic.
El uso de la nueva vacuna en condiciones experimentales será dirigido en sus aspectos operativos por las autoridades de la RDC. El diseño científico y técnico corresponde al London School of Hygiene & Tropical Medicine (LSHTM). También colaboran otras entidades como el Institut National de Recherche Biomédicale (INRB, RDC), Coalition for Epidemic Preparedness Innovations (CEPI), Médecins Sans Frontières (MSF) y Wellcome Trust. La vacuna ha sido desarrollada con la colaboración de instituciones públicas de EE. UU., Reino Unido y la Comisión Europea, además de diversas entidades tecnológicas como Bavarian Nordic.
El fabricante, Janssen Vaccines & Prevention B.V. (del grupo Johnson&Johnson), aportará sin coste, al menos, medio millón de dosis del producto final a utilizar (de las cuales ya han llegado a la región las primeras unidades).
 La vacunación ya ha mostrado un perfil de reactogenicidad y seguridad aceptables, y se está utilizando en varios ensayos emplazados en la región. Se proyecta ahora usar ampliamente en zonas de menor riesgo de exposición, pero bajo estrictas condiciones de control con objeto de aclarar su potencial para evitar la difusión de la infección. La población diana sería la de zonas, colectivos o localidades que cumplan condiciones de elevado riesgo de extensión, pero sin circulación activa de virus, en individuos sin exposición directa conocida con enfermos o contactos de estos.
La vacunación ya ha mostrado un perfil de reactogenicidad y seguridad aceptables, y se está utilizando en varios ensayos emplazados en la región. Se proyecta ahora usar ampliamente en zonas de menor riesgo de exposición, pero bajo estrictas condiciones de control con objeto de aclarar su potencial para evitar la difusión de la infección. La población diana sería la de zonas, colectivos o localidades que cumplan condiciones de elevado riesgo de extensión, pero sin circulación activa de virus, en individuos sin exposición directa conocida con enfermos o contactos de estos.
Bavarian Nordic y Johnson&Johnson acaban de anunciar que han solicitado a la EMA la aprobación provisional para este producto, basados en los estudios con los que cuentan:
- Fase 1: JAMA. 2016;315(15):1610-23, JAMA. 2017;317(10):1075-7, J Infect Dis. 2019;220(1):46-56, J Infect Dis. 2019;220(1):57-67 y N. Goldstein et al. ECCMID Live 2019).
- Fase 2: R. Thiebaut et al. ECCMID Live 2019.
- Fase 3: B. Leigh et al. ECCMID Live 2019.
Adenda, 12 de noviembre de 2019. Sobre la vacuna rVSV-ZEBOV, añadir que el mismo 11 de noviembre la Comisión Europea, tras una rápida tramitación después de la recomendación de la EMA, ha autorizado la comercialización de la vacuna Ervebo en la Unión Europea. De la misma forma, el 12 de noviembre la OMS ha anunciado que ha precualificado la vacuna, lo que allana el camino para que las agencias de la ONU y GAVI adquieran la vacuna y puedan ponerla a disposición de los países afectados.
Adenda, 16 de enero de 2020. La FDA estadounidense ha aprobado (con fecha del 19 de diciembre de 2019) la vacuna Ervebo (rVSV-ZEBOV) para la prevención de la enfermedad causada por el virus ébola. Nota de prensa de Merck (20 de diciembre de 2019) informando de la autorización de la FDA.
Adenda, 1 de junio de 2020. El 29 de mayo de 2020. la EMA emite una opinión positiva recomendando la autorización de comercialización de la vacuna para su uso en niños mayores de 1 año y adultos. Esta vacuna incluye dos componentes: Zabdeno (Ad26.ZEBOV) y Mvabea (MVA-BN-Filo), administrados secuencialmente con un intervalo de 2 meses, y su indicación de uso abarca los individuos en riesgo de exposición, pero no para el control de brotes pues no serviría para la protección de inviduos ya expuestos.
-oOo-
Más información:
- Otras noticias anteriores sobre el ébola en esta web.
- Seguimiento del brote de ébola en CIDRAP.
- OMS, ébola en la RDC, actualización a 31 de octubre de 2019.
- OMS, informes (semanales) de situación del brote.
- OMS y Ministère de la Santé, RDC. Cuadro de mandos, evolución a tiempo real del brote.
- Ministère de la Santé, RDC. Informes periódicos.