Vacunación de la covid en niños de 5-11 años: primeros datos de seguridad
En EE. UU., la FDA autorizó el uso de emergencia de la vacuna Comirnaty 10 mcg para niños de 5 a 11 años de edad, a finales del mes de octubre de 2021 (dos dosis con un intervalo de 3 semanas entre ellas). Hasta la fecha se han vacunado cerca de 9 millones de niños. En esta nota se comentan los primeros datos de seguridad conocidos, a partir de estas fuentes:
 Estudio que examina los datos de seguridad referidos a 8,7 millones de niños de la edad señalada vacunados desde el 3 de noviembre al 19 de diciembre: Hause AM, et al. SCOVID-19 Vaccine Safety in Children Aged 5-11 Years - United States, November 3 December 19, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1755-60.
Estudio que examina los datos de seguridad referidos a 8,7 millones de niños de la edad señalada vacunados desde el 3 de noviembre al 19 de diciembre: Hause AM, et al. SCOVID-19 Vaccine Safety in Children Aged 5-11 Years - United States, November 3 December 19, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1755-60.- Los datos preliminares presentados en las reuniones del ACIP (CDC) del 16 de diciembre de 2021 y del 5 de enero de 2022.
En EE. UU. la única vacuna autorizada en menores de 18 años es Comirnaty (de Pfizer & BioNTech), en sus dos formulaciones: la de 10 mcg para los niños de 5-11 años y la de 30 mcg para los adolescentes de 12-17 años de edad.
[volver al inicio]
MMWR: seguridad de la vacunación frente a la covid de los niños de 5-11 años en EE. UU. hasta el 19 de diciembre de 2021
Entre el 3 de noviembre y el 19 de diciembre se han vacunado 8,7 millones de niños de 5-11 años de edad. En el presente estudio se presentan los datos de seguridad recogidos a través de los sistemas VAERS y v-Safe (Hause AM, MMWR, 2021):
 VAERS. Es un sistema de vigilancia de los efectos secundarios de los fármacos gestionado por la FDA y los CDC, de ámbito nacional y de carácter pasivo, que acepta notificaciones de cualquier origen (público en general, propfesionales, proveedores de atención sanitaria y fabricantes). El sistema clasifica como "graves" los informes que incluyen: hospitalización o prolongación de una hospitalización previa, riesgo vital, discapacidad permanente, anomalías congénitas o al nacer, y muerte. Todas las notificaciones consideradas graves son examinadas por los funcionarios de los CDC capacitados, incluyendo informes médicos, registros de historia clínica e informes de autopsias cuando corresponda.
VAERS. Es un sistema de vigilancia de los efectos secundarios de los fármacos gestionado por la FDA y los CDC, de ámbito nacional y de carácter pasivo, que acepta notificaciones de cualquier origen (público en general, propfesionales, proveedores de atención sanitaria y fabricantes). El sistema clasifica como "graves" los informes que incluyen: hospitalización o prolongación de una hospitalización previa, riesgo vital, discapacidad permanente, anomalías congénitas o al nacer, y muerte. Todas las notificaciones consideradas graves son examinadas por los funcionarios de los CDC capacitados, incluyendo informes médicos, registros de historia clínica e informes de autopsias cuando corresponda.El sistema v-Safe es un sistema voluntario de monitorización de efectos secundarios de la vacunación de la covid, gestionado por los CDC, basado en el uso de teléfonos de alto rendimiento, y que exige una inscripción gratuita previa. La aplicación envía mensajes al usuario solicitándole información a intervalos previamente determinados. En el periodo estudiado se inscribieron 42·504 niños (a través de sus padres o tutores). Los informes recibidos que cumplen los requisitos establecidos se vuelcan al sistema VAERS para su contabilización y evaluación a través de este.
El sistema VAERS tiene diversas limitaciones, una de ellas es que no permite establecer una relación causal entre los eventos notificados y los fármacos relacionados (pese a lo cual es frecuentemente utilizado por las personas y colectivos con interés en la desinformación sobre las vacunas), y su fortaleza reside en su ámbito, que alcanza a todo EE. UU., y que constituye un eficaz sistema de alerta sobre eventos y patrones inusuales que, cuando ocurren, dan lugar investigación específica a través del Vaccine Safety Datalink (VSD) de los CDC.
Datos proporcionados por el sistema VAERS
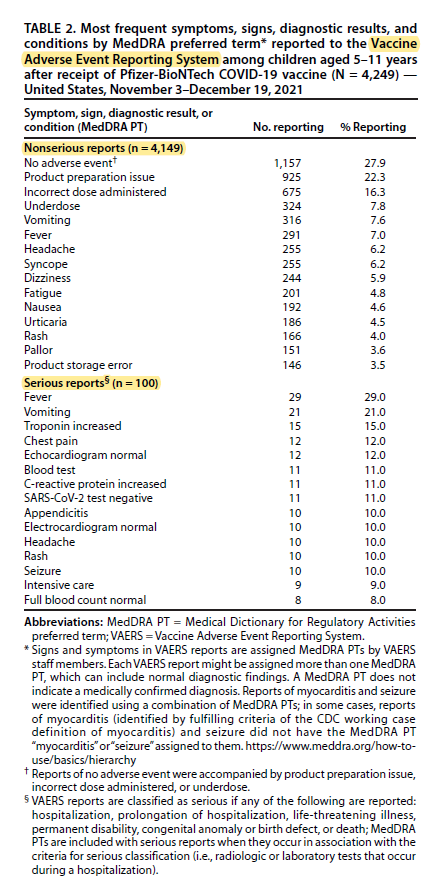 En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema VAERS:
En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema VAERS:
- Se recibieron y validaron 4249 notificaciones, la edad media fue de 8 años y el 44,2 % varones. En el 97,5·% de los casos los niños recibieron solo la vacuna de la covid (en los restantes, también otras como la de la gripe).
- El 97,6 % de las notificaciones fueron consideradas no graves. El perfil de reactogenicidad de la vacuna en los niños de 5-11 años fue similar al descrito en el estudio que permitió su autorización (Walter EB, N Engl J Med, 2021).
- Se registraron 100 notificaciones relativas a eventos clasificados como graves (con una edad media de 9 años y el 61 % varones). La mitad de ellos fueron causados por fiebre o vómitos. Entre los casos se notificaron dos muertes en niños con patología previa compleja y grave en los que se consideró que no estuvieron relacionadas con la vacunación.
- Se identificaron 11 casos confirmados de miocarditis tras la vacunación, de los cuales 7 ya se habían resuelto y los otros 4 con evolución favorable. La tasa de notificación fue de 0,13 casos por cada 100.000 vacunados (1,3/millón).
Datos proporcionados por el sistema v-Safe
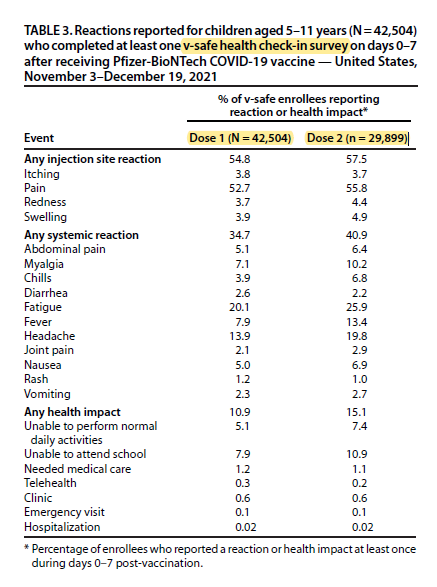 En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema v-Safe:
En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema v-Safe:
- Se inscribieron 42·504 niños en el programa v-Safe.
- De ellos informaron de reacciones locales el 57,5 % y sistémicas el 40,9 %.
- No se notificaron eventos de carácter grave.
- Se notificaron reacciones locales y sistémicas con mayor frecuencia tras la segunda dosis que con la primera: sistémicas 40,9 % vs. 34,7 %; fiebre 13,4 % vs. 7,9 %; interrupción de la actividad habitual 7,4 % vs. 5,1 %.
- Se registraron 14 hospitalizaciones; de 5 de estas se conoció la causa (de ellas, dos por apendicitis), que no se consideró relacionadas con la vacunación.
Limitaciones de los datos disponibles
- Los datos proporcionados por el VAERS se caracterizan por la infranotificación de efectos leves tras la vacunación y el sesgo de notificación. Otra limitación es la cantidad relativamente escasa de datos étnicos de los casos notificados.
- Los participantes del sistema v-Safe no son representativos de la población general (sesgo de selección).
- Número relativamente escaso de segundas dosis administradas.
Conclusiones
- El perfil de seguridad mostrado es similar al que se había descrito en el ensayo principal previo a la autorización (Walter EB, N Engl J Med, 2021), y destaca que los efectos secundarios de la vacunación fueron mayoritariamente leves y de breve duración.
- La frecuencia de las reacciones locales y sistémicas, sobre todo tras la segunda dosis, es algo menor que en los adolescentes de 12-17 años de edad (MMWR. 2021;70:1053-8).
- La miocarditis tras la vacunación es un evento notificado con muy baja frecuencia (aproximadamente 1,3/millón), sin que los sistemas de vigilancia utilizados permitan establecer si implican una relación causal.
- La vacunación sigue siendo la mejor forma de proteger a los niños de las complicaciones de la covid.
[volver al inicio]
Datos aportados en la reunión del ACIP del 5 de enero de 2022
El Comité Asesor sobre Prácticas de Inmunización (Advisory Committee on Immunization Practices, ACIP, CDC) se reune regularmente para revisar la información disponible y establecer recomendaciones sobre la vacunación en EE. UU. Después de la recomendación de vacunación frente a la covid de los niños de 5-11 años de edad a finales de octubre, ha revisado los datos de seguridad de dicha vacunación en sus reuniones del 16 de diciembre de 2021 y del 5 de enero de 2022. Los informes presentados en estas reuniones y comentados a continuación son provisionales y corresponden a posiciones consolidadas de los CDC.
En el primer informe (Su JR, ACIP, 5/ene de 2022) se examinan los registros del VAERS tras la vacunación de 8,7 millones de niños de 5-11 años y tras la dosis de refuerzo (3.ª dosis) en adolescentes y jóvenes de 16-24 años de edad. En el caso de los niños de 5-11 años, el 98 % de las notificaciones registradas corresponden a eventos clasificados como no graves.
En el caso de la miocarditis, se han registrado los siguientes casos:
- 12-15 años: 265 casos, presentados 1-3 días tras la vacunación, 83,4 % tras la 2.ª dosis, 90 % en varones, 92 % recuperados clínicamente en el momento del cierre del informe.
- 5-11 años: 12 casos, presentados 2-3 días tras la vacunación, edad media 10 años 75.% tras la 2.ª dosis, 67 % en varones.
- Las tasas por millón de vacunas administradas, según edad (5-11, 12-15 y 16-17 años), sexo y dosis se muestran en la siguiente imagen.
- La incidencia de miocarditis en los niños de 5-11 años es aproximadamente 10 veces menos que en los de 12-15 años y 16 veces menos que en los de 16-17 años.
- Globalmente, en los de 5-17 años de edad, la incidencia en varones después de la segunda dosis es aproximadamente 10 veces mayor que en la primera dosis de los propios varones, y que tras la segunda dosis de las mujeres.
En el segundo informe (Hause AM, ACIP, 5/ene de 2022) se examinan los datos del sistema v-Safe en los niños de 5-11 años y tras la dosis de refuerzo en los de 16-24 años. En lo que se refiere a los de 5-11 años, comprueban que la frecuencia de presentación de los síntomas y signos de reactogenicidad fue menor en los niños de esta edad que en los de 12-15 años.
En el tercer informe (Klein N, ACIP, 5/ene de 2022) se examinan los datos recolectados por el The Vaccine Safety Datalink (VSD), que es un proyecto colaborativo de los CDC y 9 organizaciones sanitarias para la vigilancia de la seguridad de las vacunaciones enfocada a los eventos graves e infrecuentes asociados. Encuentran que prácticamente la totalidad de los casos de peri/miocarditis se presentan en la primera semana tras la vacunación y que su distribución es:
- Edad 12-17 años, casi 1,2 millones de dosis de vacunas administradas: ambos sexos, segunda dosis 70,2 casos/millón; y ambos sexos y ambas dosis 34,6/millón.
- Edad 5-11 años: ningún caso detectado.
[volver al inicio]
Conclusiones
De los datos mostrados (que provienen de los sistemas VAERS, v-Safe y VSD) se pueden deducir las siguientes conclusiones referidas a casi 9 millones de vacunas Comirnaty 10 mcg administradas a niños de 5-11 años de edad (Hause AM, MMWR, 2021 y Su JR, ACIP, 5/ene de 2022):
- Más del 98 % de los efectos secundarios son leves, breves y ocurren en las primeras 48 horas. Estos se presentan con menor frecuencia que en los adolescentes y adultos, y el perfil de síntomas usuales es similar al mostrado por los ensayos previos a la autorización.
- Las miocarditis se presentan en la primera semana tras la vacunación con una frecuencia global de 1,3/millón de vacunas (0,13/100.000), una incidencia aproximadamente 10 veces menor que en los adolescentes de 12-15 años, y 16 veces menor que en los de 16-17 años. Los raros casos detectados han sido más frecuentes en los varones tras la segunda dosis (4,3/millón o 0,4/100.000).
- No se han detectado otros efectos secundarios graves ni otras señales de alarma.
De forma adicional, la FDA estadounidense, el 3 de enero de 2022, ha ampliado la autorización de emergencias de la dosis de refuerzo de Comirnaty 30 mcg en adolescentes de 12 o más años y la dosis adicional en niños de 5-11 años con inmunodepresión. En la nota de prensa en la que anuncia estas novedades, menciona que en los adolescentes que han recibido la dosis de refuerzo no se han detectado nuevos casos de miocarditis.
[volver al inicio]
-oOo-
Más información
- CAV-AEP. Otras noticias anteriores sobre el SARS-CoV-2 y sus vacunas en esta web.
- Hause AM, et al. SCOVID-19 Vaccine Safety in Children Aged 5-11 Years - United States, November 3 December 19, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1755-60. Comentado en Skeptical Raptor, 02/ene de 2022 y en CIDRAP, 3/ene de 2022.
- Hause AM, et al. COVID-19 vaccine safety in adolescents aged 12-17 years - United States, December 14, 2020 - July 16, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1053-8.
- Hause AM. Advisory Committee on Immunization Practices, January 5, 2022. Safety monitoring of COVID-19 vaccine among children and young adults in v-safe.
- Klein N. Advisory Committee on Immunization Practices, January 5, 2022. Vaccine Safety Datalink Rapid Cycle Analyses: Uptake and Safety of COVID-19 Vaccines in 5-11 and 12-17-Year-Olds.
- Mueller B, et al. Covid vaccines rarely lead to problems in younger children, according to two CDC reports. The New York Times, 30/dic de 2021.
- Su JR. Vaccine Safety Team, CDC COVID-19 Vaccine Task Force. Adverse events among children ages 5-11 years after COVID-19 vaccination: updates from v-safe and the Vaccine Adverse Event Reporting System (VAERS). ACIP, dec 13, 2021.
- Su JR. Advisory Committee on Immunization Practices, January 5, 2022. COVID-19 vaccine safety updates: Primary series in children and adolescents ages 5-11 and 12-15 years, and booster doses in adolescents ages 16–24 years.
- Twentyman E. Advisory Committee on Immunization Practices, January 5, 2022. Interim Clinical Considerations for Use of COVID-19 Vaccines: Latest Updates.
- Vaxopedia, 30/dic de 2021. COVID Vaccine Safety in Children.
- Walter EB, et al. Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 2021, 9/nov. DOI: 10.1056/NEJMoa2116298.
[volver al inicio]
Otras referencias
- Ammirati E, et al. Prevalence, Characteristics, and Outcomes of COVID-19–Associated Acute Myocarditis. Circulation. 2022;145:1123-39.
- Block JP, et al. Cardiac Complications After SARS-CoV-2 Infection and mRNA COVID-19 Vaccination — PCORnet, United States, January 2021–January. MMWR Morb Mortal Wkly Rep 2022;71:517-23.
- Chen L, et al. Safety of Global SARS-CoV-2 Vaccines, a Meta-Analysis. Vaccines (Basel). 2022;10(4):596.
- Fang S. BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 2022;386:604-6.
- Fernandez-Davila N, et al. Hypersensitivity Reactions to COVID-19 Vaccines - Identify High-risk Children and Vaccinate the Rest. JAMA Pediatr. 2022;176(5):443-4.
- Fronza M, et al. Myocardial Injury Pattern at MRI in COVID-19 Vaccine - associated Myocarditis. Radioloy. 2022, 15/feb. DOI: 10.1148/radiol.212559. Comentado en CIDRAP, 16/feb de 2022. Comentado en EurekAlert, 15/feb de 2022.
- Hause AM, et al. Safety Monitoring of COVID-19 Vaccine Booster Doses Among Adults — United States, September 22, 2021–February 6, 2022. MMWR Morb Mortal Wkly Rep. 2022, 11/feb. DOI: 10.15585/mmwr.mm7107.
- Kildegaard H, et al. Risk of Appendicitis After mRNA COVID-19 Vaccination in a Danish Population. JAMA Intern Med. 2022, 25/abr. doi:10.1001/jamainternmed.2022.1222.
- UK, Department of Health and Social Care, 16/feb de 2022. Independent report: JCVI statement on vaccination of children aged 5 to 11 years old.
- Watanabe A, et al. Assessment of Efficacy and Safety of mRNA COVID-19 Vaccines in Children Aged 5 to 11 Years. A Systematic Review and Meta-analysis. JAMA Pediatr. 2023, 23/ene. DOI: 10.1001/jamapediatrics.2022.6243. Comentado en: Offit PA. COVID-19 Vaccines in Young Children - Reassuring Evidence for Parents. JAMA Pediatr. 2023, 23/ene. DOI: 10.1001/jamapediatrics.2022.6251.
- Wise J. Covid-19: Vaccine will be offered to 5-11 year olds throughout UK. BMJ. 2022;376:o411.
- Xie J, et al. Long-term cardiovascular outcomes of COVID-19. Nature Med. 2022, 7/feb. DOI: 10.1038/s41591-022-01689-3. Comentado en Heart-disease risk soars after COVID — even with a mild case. Massive study shows a long-term, substantial rise in risk of cardiovascular disease, including heart attack and stroke, after a SARS-CoV-2 infection. Nature. 2022, 10/feb. DOI: 10.1038/d41586-022-00403-0.









