En EE. UU., la FDA autorizó el uso de emergencia de la vacuna Comirnaty 10 mcg para niños de 5 a 11 años de edad, a finales del mes de octubre de 2021 (dos dosis con un intervalo de 3 semanas entre ellas). Hasta la fecha se han vacunado cerca de 9 millones de niños. En esta nota se comentan los primeros datos de seguridad conocidos, a partir de estas fuentes:
 Estudio que examina los datos de seguridad referidos a 8,7 millones de niños de la edad señalada vacunados desde el 3 de noviembre al 19 de diciembre: Hause AM, et al. SCOVID-19 Vaccine Safety in Children Aged 5-11 Years - United States, November 3 December 19, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1755-60 [6].
Estudio que examina los datos de seguridad referidos a 8,7 millones de niños de la edad señalada vacunados desde el 3 de noviembre al 19 de diciembre: Hause AM, et al. SCOVID-19 Vaccine Safety in Children Aged 5-11 Years - United States, November 3 December 19, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1755-60 [6].- Los datos preliminares presentados en las reuniones del ACIP (CDC) del 16 de diciembre de 2021 [7] y del 5 de enero de 2022 [8].
En EE. UU. la única vacuna autorizada en menores de 18 años es Comirnaty (de Pfizer & BioNTech), en sus dos formulaciones: la de 10 mcg para los niños de 5-11 años y la de 30 mcg para los adolescentes de 12-17 años de edad.
[volver al inicio [9]]
MMWR: seguridad de la vacunación frente a la covid de los niños de 5-11 años en EE. UU. hasta el 19 de diciembre de 2021
Entre el 3 de noviembre y el 19 de diciembre se han vacunado 8,7 millones de niños de 5-11 años de edad. En el presente estudio se presentan los datos de seguridad recogidos a través de los sistemas VAERS y v-Safe (Hause AM, MMWR, 2021 [6]):
 [10]VAERS. Es un sistema de vigilancia de los efectos secundarios de los fármacos gestionado por la FDA y los CDC, de ámbito nacional y de carácter pasivo, que acepta notificaciones de cualquier origen (público en general, propfesionales, proveedores de atención sanitaria y fabricantes). El sistema clasifica como "graves" los informes que incluyen: hospitalización o prolongación de una hospitalización previa, riesgo vital, discapacidad permanente, anomalías congénitas o al nacer, y muerte. Todas las notificaciones consideradas graves son examinadas por los funcionarios de los CDC capacitados, incluyendo informes médicos, registros de historia clínica e informes de autopsias cuando corresponda.
[10]VAERS. Es un sistema de vigilancia de los efectos secundarios de los fármacos gestionado por la FDA y los CDC, de ámbito nacional y de carácter pasivo, que acepta notificaciones de cualquier origen (público en general, propfesionales, proveedores de atención sanitaria y fabricantes). El sistema clasifica como "graves" los informes que incluyen: hospitalización o prolongación de una hospitalización previa, riesgo vital, discapacidad permanente, anomalías congénitas o al nacer, y muerte. Todas las notificaciones consideradas graves son examinadas por los funcionarios de los CDC capacitados, incluyendo informes médicos, registros de historia clínica e informes de autopsias cuando corresponda.[11]El sistema v-Safe es un sistema voluntario de monitorización de efectos secundarios de la vacunación de la covid, gestionado por los CDC, basado en el uso de teléfonos de alto rendimiento, y que exige una inscripción gratuita previa. La aplicación envía mensajes al usuario solicitándole información a intervalos previamente determinados. En el periodo estudiado se inscribieron 42·504 niños (a través de sus padres o tutores). Los informes recibidos que cumplen los requisitos establecidos se vuelcan al sistema VAERS para su contabilización y evaluación a través de este.
El sistema VAERS tiene diversas limitaciones, una de ellas es que no permite establecer una relación causal entre los eventos notificados y los fármacos relacionados (pese a lo cual es frecuentemente utilizado por las personas y colectivos con interés en la desinformación sobre las vacunas [12]), y su fortaleza reside en su ámbito, que alcanza a todo EE. UU., y que constituye un eficaz sistema de alerta sobre eventos y patrones inusuales que, cuando ocurren, dan lugar investigación específica a través del Vaccine Safety Datalink (VSD) [13] de los CDC.
Datos proporcionados por el sistema VAERS
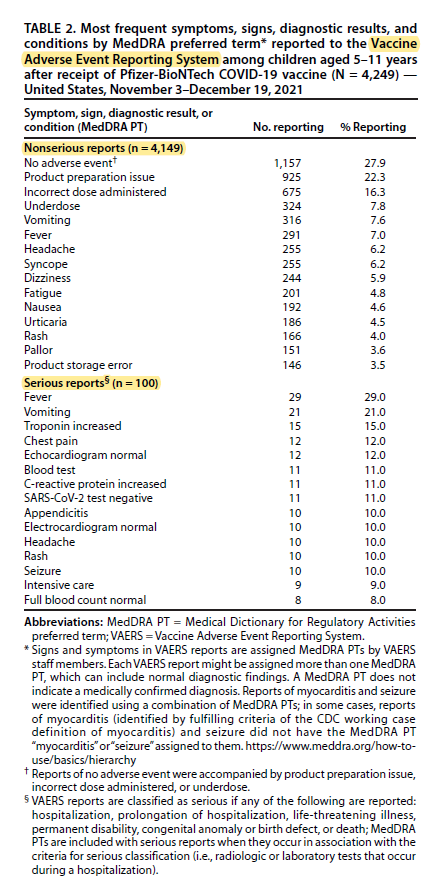 [14]En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema VAERS:
[14]En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema VAERS:
- Se recibieron y validaron 4249 notificaciones, la edad media fue de 8 años y el 44,2 % varones. En el 97,5·% de los casos los niños recibieron solo la vacuna de la covid (en los restantes, también otras como la de la gripe).
- El 97,6 % de las notificaciones fueron consideradas no graves. El perfil de reactogenicidad de la vacuna en los niños de 5-11 años fue similar al descrito en el estudio que permitió su autorización (Walter EB, N Engl J Med, 2021 [15]).
- Se registraron 100 notificaciones relativas a eventos clasificados como graves (con una edad media de 9 años y el 61 % varones). La mitad de ellos fueron causados por fiebre o vómitos. Entre los casos se notificaron dos muertes en niños con patología previa compleja y grave en los que se consideró que no estuvieron relacionadas con la vacunación.
- Se identificaron 11 casos confirmados de miocarditis tras la vacunación, de los cuales 7 ya se habían resuelto y los otros 4 con evolución favorable. La tasa de notificación fue de 0,13 casos por cada 100.000 vacunados (1,3/millón).
Datos proporcionados por el sistema v-Safe
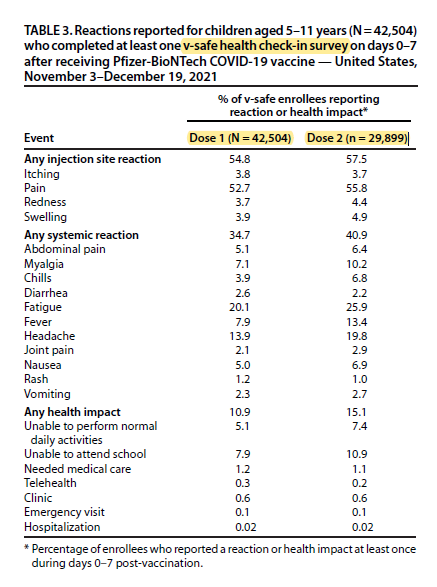 En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema v-Safe:
En la imagen adjunta se muestran los síntomas, signos y diagnósticos más frecuentes registrados en el sistema v-Safe:
- Se inscribieron 42·504 niños en el programa v-Safe.
- De ellos informaron de reacciones locales el 57,5 % y sistémicas el 40,9 %.
- No se notificaron eventos de carácter grave.
- Se notificaron reacciones locales y sistémicas con mayor frecuencia tras la segunda dosis que con la primera: sistémicas 40,9 % vs. 34,7 %; fiebre 13,4 % vs. 7,9 %; interrupción de la actividad habitual 7,4 % vs. 5,1 %.
- Se registraron 14 hospitalizaciones; de 5 de estas se conoció la causa (de ellas, dos por apendicitis), que no se consideró relacionadas con la vacunación.
Limitaciones de los datos disponibles
- Los datos proporcionados por el VAERS se caracterizan por la infranotificación de efectos leves tras la vacunación y el sesgo de notificación. Otra limitación es la cantidad relativamente escasa de datos étnicos de los casos notificados.
- Los participantes del sistema v-Safe no son representativos de la población general (sesgo de selección).
- Número relativamente escaso de segundas dosis administradas.
Conclusiones
- El perfil de seguridad mostrado es similar al que se había descrito en el ensayo principal previo a la autorización (Walter EB, N Engl J Med, 2021 [15]), y destaca que los efectos secundarios de la vacunación fueron mayoritariamente leves y de breve duración.
- La frecuencia de las reacciones locales y sistémicas, sobre todo tras la segunda dosis, es algo menor que en los adolescentes de 12-17 años de edad (MMWR. 2021;70:1053-8 [16]).
- La miocarditis tras la vacunación es un evento notificado con muy baja frecuencia (aproximadamente 1,3/millón), sin que los sistemas de vigilancia utilizados permitan establecer si implican una relación causal.
- La vacunación sigue siendo la mejor forma de proteger a los niños de las complicaciones de la covid.
[volver al inicio [9]]
Datos aportados en la reunión del ACIP del 5 de enero de 2022
El Comité Asesor sobre Prácticas de Inmunización (Advisory Committee on Immunization Practices, ACIP [17], CDC) se reune regularmente para revisar la información disponible y establecer recomendaciones sobre la vacunación en EE. UU. Después de la recomendación de vacunación frente a la covid de los niños de 5-11 años de edad a finales de octubre, ha revisado los datos de seguridad de dicha vacunación en sus reuniones del 16 de diciembre de 2021 [7] y del 5 de enero de 2022 [18]. Los informes presentados en estas reuniones y comentados a continuación son provisionales y corresponden a posiciones consolidadas de los CDC.
En el primer informe (Su JR, ACIP, 5/ene de 2022 [19]) se examinan los registros del VAERS tras la vacunación de 8,7 millones de niños de 5-11 años y tras la dosis de refuerzo (3.ª dosis) en adolescentes y jóvenes de 16-24 años de edad. En el caso de los niños de 5-11 años, el 98 % de las notificaciones registradas corresponden a eventos clasificados como no graves.
En el caso de la miocarditis, se han registrado los siguientes casos:
- 12-15 años: 265 casos, presentados 1-3 días tras la vacunación, 83,4 % tras la 2.ª dosis, 90 % en varones, 92 % recuperados clínicamente en el momento del cierre del informe.
- 5-11 años: 12 casos, presentados 2-3 días tras la vacunación, edad media 10 años 75.% tras la 2.ª dosis, 67 % en varones.
- Las tasas por millón de vacunas administradas, según edad (5-11, 12-15 y 16-17 años), sexo y dosis se muestran en la siguiente imagen.
- La incidencia de miocarditis en los niños de 5-11 años es aproximadamente 10 veces menos que en los de 12-15 años y 16 veces menos que en los de 16-17 años.
- Globalmente, en los de 5-17 años de edad, la incidencia en varones después de la segunda dosis es aproximadamente 10 veces mayor que en la primera dosis de los propios varones, y que tras la segunda dosis de las mujeres.
En el segundo informe (Hause AM, ACIP, 5/ene de 2022 [21]) se examinan los datos del sistema v-Safe en los niños de 5-11 años y tras la dosis de refuerzo en los de 16-24 años. En lo que se refiere a los de 5-11 años, comprueban que la frecuencia de presentación de los síntomas y signos de reactogenicidad fue menor en los niños de esta edad que en los de 12-15 años.
En el tercer informe (Klein N, ACIP, 5/ene de 2022 [22]) se examinan los datos recolectados por el The Vaccine Safety Datalink (VSD), que es un proyecto colaborativo de los CDC y 9 organizaciones sanitarias para la vigilancia de la seguridad de las vacunaciones enfocada a los eventos graves e infrecuentes asociados. Encuentran que prácticamente la totalidad de los casos de peri/miocarditis se presentan en la primera semana tras la vacunación y que su distribución es:
- Edad 12-17 años, casi 1,2 millones de dosis de vacunas administradas: ambos sexos, segunda dosis 70,2 casos/millón; y ambos sexos y ambas dosis 34,6/millón.
- Edad 5-11 años: ningún caso detectado.
[volver al inicio [9]]
Conclusiones
De los datos mostrados (que provienen de los sistemas VAERS, v-Safe y VSD) se pueden deducir las siguientes conclusiones referidas a casi 9 millones de vacunas Comirnaty 10 mcg administradas a niños de 5-11 años de edad (Hause AM, MMWR, 2021 [6] y Su JR, ACIP, 5/ene de 2022 [19]):
- Más del 98 % de los efectos secundarios son leves, breves y ocurren en las primeras 48 horas. Estos se presentan con menor frecuencia que en los adolescentes y adultos, y el perfil de síntomas usuales es similar al mostrado por los ensayos previos a la autorización.
- Las miocarditis se presentan en la primera semana tras la vacunación con una frecuencia global de 1,3/millón de vacunas (0,13/100.000), una incidencia aproximadamente 10 veces menor que en los adolescentes de 12-15 años, y 16 veces menor que en los de 16-17 años. Los raros casos detectados han sido más frecuentes en los varones tras la segunda dosis (4,3/millón o 0,4/100.000).
- No se han detectado otros efectos secundarios graves ni otras señales de alarma.
De forma adicional, la FDA estadounidense, el 3 de enero de 2022, ha ampliado la autorización de emergencias de la dosis de refuerzo de Comirnaty 30 mcg en adolescentes de 12 o más años y la dosis adicional en niños de 5-11 años con inmunodepresión. En la nota de prensa [23] en la que anuncia estas novedades, menciona que en los adolescentes que han recibido la dosis de refuerzo no se han detectado nuevos casos de miocarditis.
[volver al inicio [9]]
-oOo-
Más información
- CAV-AEP. Otras noticias anteriores sobre el SARS-CoV-2 y sus vacunas en esta web [24].
- Hause AM, et al. SCOVID-19 Vaccine Safety in Children Aged 5-11 Years - United States, November 3 December 19, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1755-60 [6]. Comentado en Skeptical Raptor, 02/ene de 2022 [25] y en CIDRAP, 3/ene de 2022 [26].
- Hause AM, et al. COVID-19 vaccine safety in adolescents aged 12-17 years - United States, December 14, 2020 - July 16, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:1053-8 [16].
- Hause AM. Advisory Committee on Immunization Practices, January 5, 2022. Safety monitoring of COVID-19 vaccine among children and young adults in v-safe [21].
- Klein N. Advisory Committee on Immunization Practices, January 5, 2022. Vaccine Safety Datalink Rapid Cycle Analyses: Uptake and Safety of COVID-19 Vaccines in 5-11 and 12-17-Year-Olds [22].
- Mueller B, et al. Covid vaccines rarely lead to problems in younger children, according to two CDC reports. The New York Times, 30/dic de 2021 [27].
- Su JR. Vaccine Safety Team, CDC COVID-19 Vaccine Task Force. Adverse events among children ages 5-11 years after COVID-19 vaccination: updates from v-safe and the Vaccine Adverse Event Reporting System (VAERS) [28]. ACIP, dec 13, 2021.
- Su JR. Advisory Committee on Immunization Practices, January 5, 2022. COVID-19 vaccine safety updates: Primary series in children and adolescents ages 5-11 and 12-15 years, and booster doses in adolescents ages 16–24 years. [19]
- Twentyman E. Advisory Committee on Immunization Practices, January 5, 2022. Interim Clinical Considerations for Use of COVID-19 Vaccines: Latest Updates [29].
- Vaxopedia, 30/dic de 2021. COVID Vaccine Safety in Children [30].
- Walter EB, et al. Evaluation of the BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 2021, 9/nov. DOI: 10.1056/NEJMoa2116298 [15].
[volver al inicio [9]]
Otras referencias
- Ammirati E, et al. Prevalence, Characteristics, and Outcomes of COVID-19–Associated Acute Myocarditis. Circulation. 2022;145:1123-39 [31].
- Block JP, et al. Cardiac Complications After SARS-CoV-2 Infection and mRNA COVID-19 Vaccination — PCORnet, United States, January 2021–January. MMWR Morb Mortal Wkly Rep 2022;71:517-23 [32].
- Chen L, et al. Safety of Global SARS-CoV-2 Vaccines, a Meta-Analysis. Vaccines (Basel). 2022;10(4):596 [33].
- Fang S. BNT162b2 Covid-19 Vaccine in Children 5 to 11 Years of Age. N Engl J Med. 2022;386:604-6 [34].
- Fernandez-Davila N, et al. Hypersensitivity Reactions to COVID-19 Vaccines - Identify High-risk Children and Vaccinate the Rest. JAMA Pediatr. 2022;176(5):443-4 [35].
- Fronza M, et al. Myocardial Injury Pattern at MRI in COVID-19 Vaccine - associated Myocarditis. Radioloy. 2022, 15/feb. DOI: 10.1148/radiol.212559 [36]. Comentado en CIDRAP, 16/feb de 2022 [37]. Comentado en EurekAlert, 15/feb de 2022 [38].
- Hause AM, et al. Safety Monitoring of COVID-19 Vaccine Booster Doses Among Adults — United States, September 22, 2021–February 6, 2022. MMWR Morb Mortal Wkly Rep. 2022, 11/feb. DOI: 10.15585/mmwr.mm7107 [39].
- Kildegaard H, et al. Risk of Appendicitis After mRNA COVID-19 Vaccination in a Danish Population. JAMA Intern Med. 2022, 25/abr. doi:10.1001/jamainternmed.2022.1222 [40].
- UK, Department of Health and Social Care, 16/feb de 2022. Independent report: JCVI statement on vaccination of children aged 5 to 11 years old [41].
- Watanabe A, et al. Assessment of Efficacy and Safety of mRNA COVID-19 Vaccines in Children Aged 5 to 11 Years. A Systematic Review and Meta-analysis. JAMA Pediatr. 2023, 23/ene. DOI: 10.1001/jamapediatrics.2022.6243 [42]. Comentado en: Offit PA. COVID-19 Vaccines in Young Children - Reassuring Evidence for Parents. JAMA Pediatr. 2023, 23/ene. DOI: 10.1001/jamapediatrics.2022.6251 [43].
- Wise J. Covid-19: Vaccine will be offered to 5-11 year olds throughout UK. BMJ. 2022;376:o411 [44].
- Xie J, et al. Long-term cardiovascular outcomes of COVID-19. Nature Med. 2022, 7/feb. DOI: 10.1038/s41591-022-01689-3 [45]. Comentado en Heart-disease risk soars after COVID — even with a mild case. Massive study shows a long-term, substantial rise in risk of cardiovascular disease, including heart attack and stroke, after a SARS-CoV-2 infection. Nature. 2022, 10/feb. DOI: 10.1038/d41586-022-00403-0 [46].


