La EMA estudia la ampliación de uso de Comirnaty a adolescentes de 12 o más años
Fecha de actualización: 26 de mayo de 2021
 La European Medicines Agency (EMA) ha informado ayer lunes 3 de mayo de 2021, a través de una escueta nota de prensa, de que se ha iniciado el estudio de la solicitud de Pfizer & BioNTech para ampliar la edad autorizada de uso de la vacuna de la covid Comirnaty, e incluir a los adolescentes de 12 a 15 años de edad.
La European Medicines Agency (EMA) ha informado ayer lunes 3 de mayo de 2021, a través de una escueta nota de prensa, de que se ha iniciado el estudio de la solicitud de Pfizer & BioNTech para ampliar la edad autorizada de uso de la vacuna de la covid Comirnaty, e incluir a los adolescentes de 12 a 15 años de edad.
La EMA es la entidad responsable de la autorización de uso de las vacunas en el ámbito de la Unión Europea (UE) y del Espacio Económico Europeo (en el cual se incluyen, además de la UE, Islandia, Liechtenstein y Noruega).
La investigación de las vacunas de la covid en niños y adolescentes está lanzada. Con el paso dado ahora por la EMA se acerca el momento en el que, si esta accede a la autorización, pueda contarse por primera vez con una vacuna de la covid disponible para la edad pediátrica.
Antecedentes
- La vacuna Comirnaty obtuvo una autorización condicional de uso en personas de 16 o más años de edad en la Unión Europea el pasado 21 de diciembre de 2020.
- El 31 de marzo de 2021, Pfizer & BioNTech anunciaron los primeros datos preliminares de un estudio en fase 3 sobre 2600 adolescentes, con una elevada eficacia y seguridad. También que habían solicitado a la FDA la autorización en el rango de edad de 12-15 años de edad.
- Ayer 3 de mayo de 2021, según medios de comunicación, se anunció que la FDA estadounidense preve aprobar en pocos días esta vacuna en los adolescentes, mediante una enmienda a la autorización previa, lo que acerca el momento de la incorporación de los adolescentes a la vacunación.
Declaraciones de responsables de BioNTech aseguran que se dispondrá de datos de niños de 5-11 años en el próximo mes de julio y de menores de esa edad en el tercer trimestre de este año.
Evolución de la vacunación de la covid en España
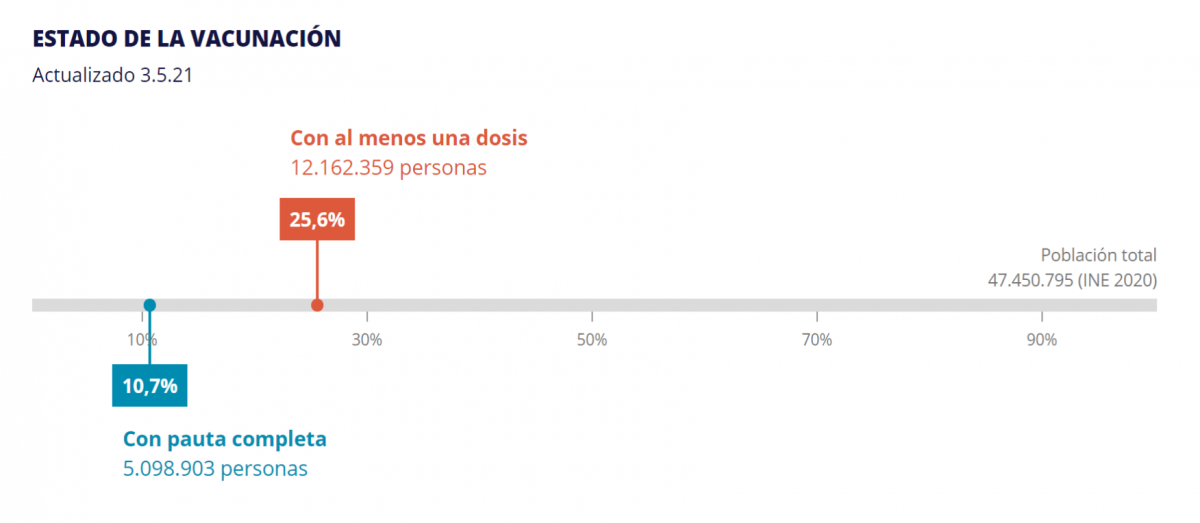
Con fecha 3 de mayo de 2021 y según datos de la Estrategia de vacunación COVID-19 en España un 25,6 % de la población española ha recibido, al menos, una dosis de alguna vacuna de las autorizadas, y el 10,7 % (casi 5,1 millones de personas) ha recibido la pauta completa (ver imagen adjunta).
Uso de la vacuna Comirnaty
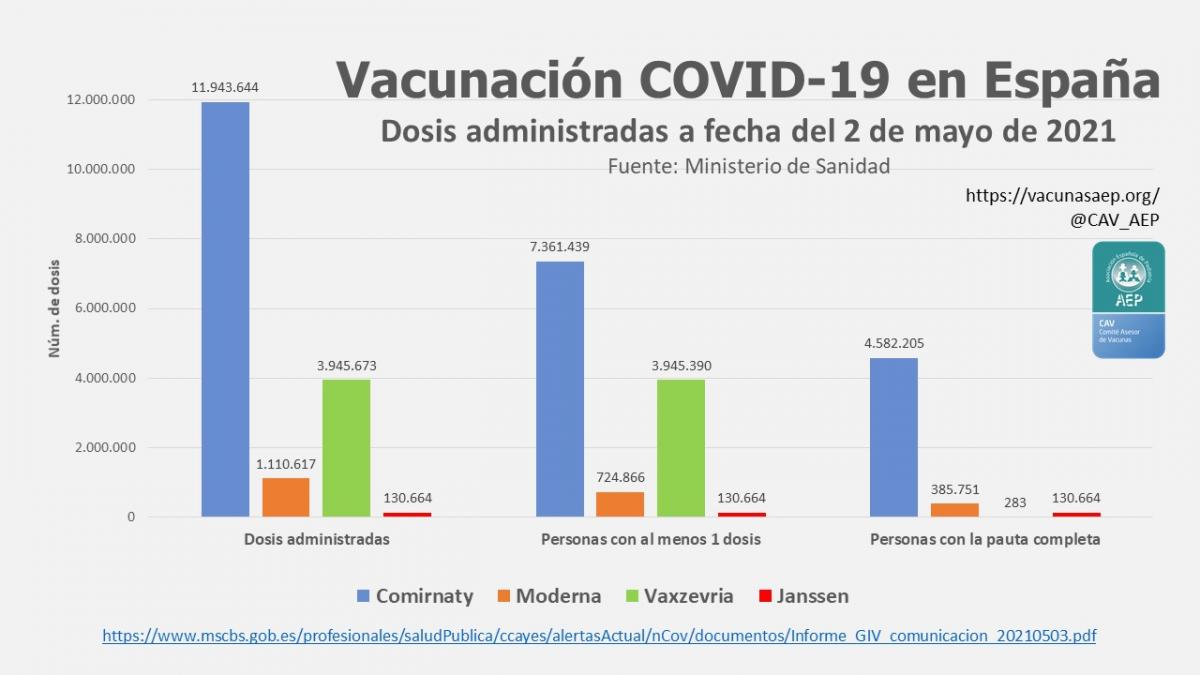
La vacuna Comirnaty es la más usada hasta el momento: el 60,5 % de las personas que han recibido, al menos, una dosis, y el 89,8 % de las que han recibido dos dosis (ver imagen adjunta).
Vacuna Comirnaty
Información general
En la web dedicada a la vacunación COVID-19 de la Consejería de Salud y Familias de la Junta de Andalucía se han publicado unas muy prácticas infografías sobre la cada una de las vacunas covid, además de otras informaciones prácticas. La infografía dedicada a la vacuna Comirnaty puede verse abajo.
Adenda, 5 de mayo de 2021. Health Canada ha ampliado la autorización de uso de la vacuna Comirnaty a los adolescentes de 12-15 años de edad, según aseguran sendos comunicados de Health Canada y de Pfizer & BioNTech, datados en esta fecha.
Adenda, 10 de mayo de 2021. En esta fecha, la FDA estadounidense ha autorizado la ampliación del uso de emergencias de la vacuna de Pfizer & BioNTech a los adolescentes de 12-15 años de edad, con la misma pauta vacunal. Según la nota de la FDA, la aprobación está basada en los datos aportados por Pfizer, de los cuales destacan:
- Participantes en el estudio 2260 adolescentes de 12-15 años; de ellos 1131 recibieron de forma ciega y aleatoria la vacuna y otros 1129 solo placebo (suero salino fisiológico). Seguimiento de al menos 2 meses tras acabar la pauta vacunal en al menos la mitad de los participantes.
- Inmunogenicidad. Se compararon 190 participantes con 170 de 16-25 años, encontrando pruebas de no inferioridad.
- Eficacia clínica en adolescentes sin antecedentes de infección previa: 7 días o más después de la segunda dosis, cero casos en 1005 vacunados frente a 16 casos en 978 del grupo placebo (EV: 100 %, IC 95 %: 75,3-100 %).
- Seguridad: solo manifestaciones leves-moderadas, 1-3 días tras la vacunación, de mayor intensidad tras la segunda dosis (excepto dolor en el lugar de inyección). Síntomas usuales: dolor en el brazo, cansancia, dolor de cabeza, escalofrios, mialgia y artralgia, fiebre. En general similar a los de 16-25 años, salvo la fiebre que fue algo más frecuente (20 % vs. 17 %).
- Contraindicación: alergia grave a una dosis previa de la misma vacuna o a algún componente.
- Tras la reunión del ACIP del 12 de mayo, se prevé que pueda comenzar la vacunación en pocos días, aunque se espera que las dudas y reticencias de las familias y los adolescentes pueda ser una barrera relevante.
Adenda, 15 de mayo de 2021. El ACIP de EE. UU. en su reunión del 12 de mayo de 2021 (documentos presentados) recomendó ampliar el uso de Comirnaty a los adolescentes de 12-15 años de edad. Otros documentos relacionados:
- Wallace M, et al. The Advisory Committee on Immunization Practices’ Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine in Adolescents Aged 12–15 Years — United States, May 2021. MMWR Morb Mortal Wkly Rep. 2021, 14/may. DOI: 10.15585/mmwr.mm7020e1.
- Pfizer-BioNTech COVID-19 Vaccine EUA Amendment Review Memorandum. Emergency Use Authorization (EUA) Amendment for an Unapproved Product. Review Memorandum, 9 de abril de 2021.
- FDA. Pfizer-BioNTech COVID-19 Vaccine.
Adenda, 26 de mayo de 2021. Moderna presenta los resultados preliminares en adolescentes de 12-17 años de edad:
- Estudio en fase 2/3 con 3732 participantes de 12-17 años de edad, distribuidos (2:1) en un grupo de vacunación (2 dosis) y placebo.
- Desde 14 días después de la segunda dosis hubo 4 casos frente a cero en el grupo de vacunación, lo que se traduce en un eficacia vacunal del 100 %.
- Usando los criterios del CDC (síntomas leves y confirmación microbiológica), la eficacia vacunal resultante es del 93 %.
- La compañía prevé solicitar la autorización de uso en este grupo de edad, en el mes de junio.
-oOo-
Más información
- Fichas técnicas de las vacunas de la covid. Ficha técnica de Comirnaty.
- Ministerio de Sanidad. Guía técnica de uso de la vacuna Comirnaty (versión vigente del 31 de marzo de 2021).
- Otras noticias sobre el SARS-CoV-2 y sus vacunas en esta web.
Historial de actualizaciones
- 26 de mayo de 2021. Moderna presenta resultados preliminares en adolescentes de 12-17 años de edad.
- 15 de mayo de 2021. Se añade información relacionada con la aprobación del uso de Comirnaty en adolescentes en EE. UU.
- 10 de mayo de 2021. Se añade la noticia de que la FDA de EE. UU. ha autorizado el uso de de Comirnaty en adolescentes de 12-15 años.
- 5 de mayo de 2021. Se añade la noticia de la autorización del uso de Comirnaty por parte de Canadá.