NVX-CoV2373, Novavax: nueva vacuna de la covid con elevada eficacia
Fecha de actualización: 27 de octubre de 2021
El 3 de febrero de 2021, la EMA informó de que iniciaba el procedimiento de evaluación continuada (rolling review) de la vacuna NVX-CoV2373 de Novavax. Actualmente esta es una de las cuatro que la EMA estudia mediante el procedimiento de rolling review, y una de las dos (junto con CVnCoV de CureVac) con mayor probabilidad de ser la quinta vacuna aprobada en la Unión Europea. La vacuna de Novavax se diferencia de las vacunas ya aprobadas en que está basada en una plataforma tecnológica distinta a las de ARNm y vectores virales, la tecnología de proteínas recombinantes que tan buenos resultados ha dado con otras vacunas, como las de la hepatitis B, la gripe y el virus del papiloma humano.
La vacuna NVX-CoV2373, de Novavax
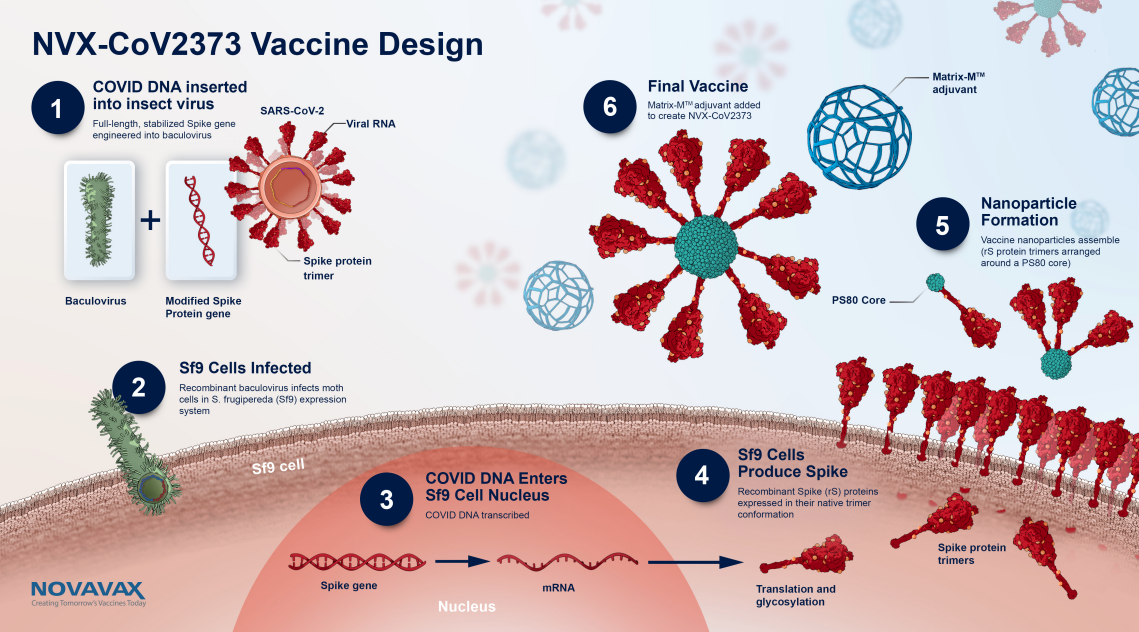
 La vacuna NVX-CoV2373 ha sido desarrollada por la empresa Novavax (Maryland, EE. UU.). Contiene nanopartículas con dos componentes principales:
La vacuna NVX-CoV2373 ha sido desarrollada por la empresa Novavax (Maryland, EE. UU.). Contiene nanopartículas con dos componentes principales:
- Proteína S recombinante del SARS-CoV-2 obtenida mediante técnicas genéticas: el gen (ADN) de la proteína S se inserta en el genoma de un baculovirus, con el que se infecta a células Sf9 (procedentes de tejido ovárico de la polilla del maiz, Spodoptera frugiperda). Estas producen proteína S que se expresa en la superficie de las células infectadas. Se recolecta y purifica la proteína S obtenida así.
- Adyuvante Matrix-M (que es el mismo que utiliza la vacuna del paludismo de este fabricante) compuesto por una saponina extraída de la corteza del árbol Quillaja saponaria Molina junto con colesterol y fosfolípidos.
- Los componentes citados se ensamblan conformando nanopartículas con estructura similar a la proteína S del SARS-CoV-2.
Más información en Novavax y The New York Times.
[►volver al inicio]
Cronología del desarrollo de NVX-CoV2373
En septiembre de 2020 se publicaron los primeros resultados de ensayos de fase 1-2 en los que se estudiaron la seguridad e inmunogenicidad del preparado con y sin el adyuvante (N Engl J Med. 2020;383:2320-32). En el mes de octubre se publicó el protocolo del ensayo de fase 3 que se iniciaba en esas fechas.
Resultados preliminares de un estudio de fase 3 en Reino Unido y otro de fase 2b en Suráfrica
El 28 de enero de 2021, Novavax publicó, mediante una nota de prensa, resultados preliminares de los estudios en Reino Unido y Suráfrica:
- Estudio de fase 3 en Reino Unido (más del 50 % de las cepas circulantes corresponden a la variante alfa, B.1.1.7, la llamada variante británica), con 15.000 participantes de 18-84 años de edad (27 % mayores de 65 años). Eficacia frente a covid sintomático confirmado a partir de 7 días después de la pauta vacunal (2 dosis, 21 días de intervalo): 62 casos, 56 de ellos en el grupo placebo y 6 en los vacunados (un caso grave en el grupo placebo), eficacia vacunal del 89,3 % (IC 95 %: 75,2-95,4 %). Los resultados de este estudio ya han sido publicados (ver adenda del 1/jul de 20219).
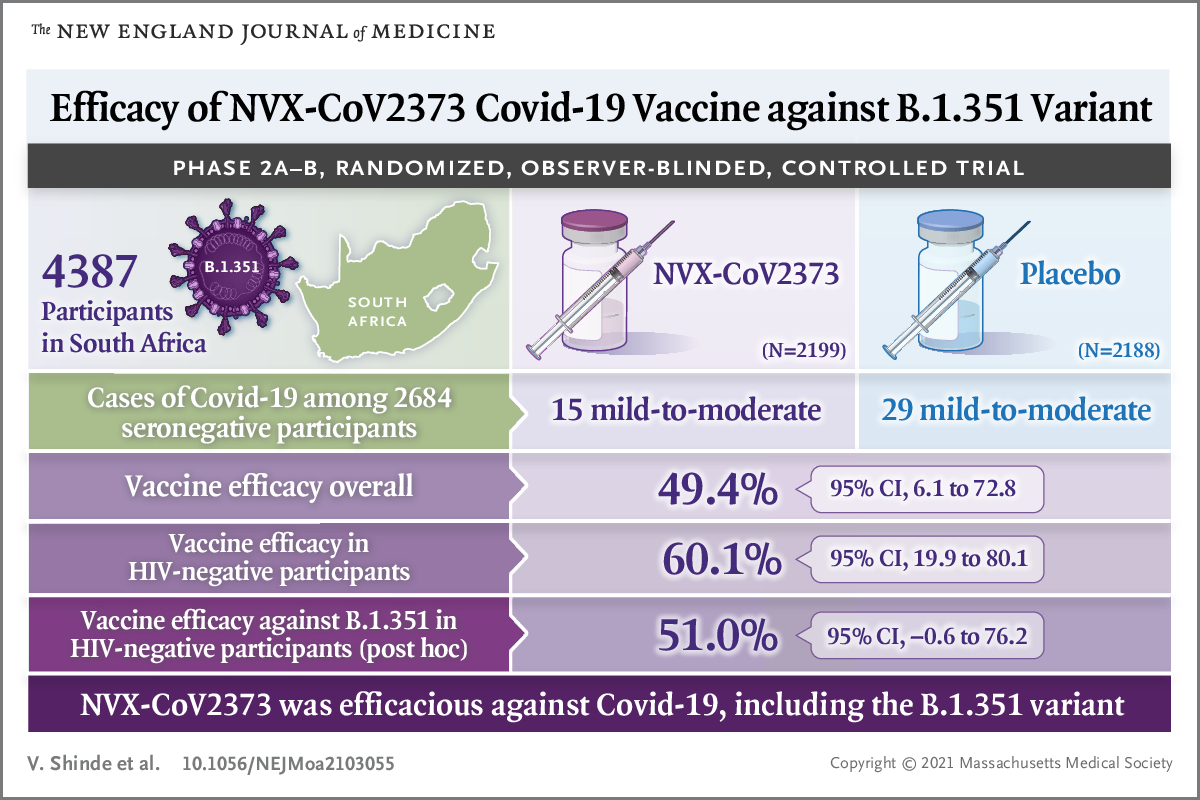
- Estudio de fase 2b en Suráfrica, donde más del 90 % de las cepas circulantes corresponden a la variante beta, B.1.351, con 4400 participantes de 18-84 años con y sin infección VIH. Eficacia frente a covid sintomático confirmado a partir de 7 días después de la pauta vacunal (2 dosis, 21 días de intervalo): 29 casos en el grupo placebo y 15 en el de vacunados, eficacia vacunal de 60 % (IC 95 %: 19,9-80,1 %) en personas VIH negativos, 49,4 % (IC 95 %: 6,1-72,8 %) sin tener en cuenta la infección por VIH.
Estos primeros resultados fueron calificados como esperanzadores pues suponian, en enero de 2021, la primera evidencia de actividad de una vacuna frente a la variante alfa, aunque en menor medida frente a la variante beta (Nature. 2021;590(7844):17; Florian Krammer, 29/ene de 2021).
El estudio surafricano fue finalmente publicado el 5 de mayo de 2021 en N Engl J Med. 2021;384:1899-909, y a él corresponde la infografía adjunta. También Novavax comentó la noticia en una nota de prensa.
Por su parte, el estudio del Reino Unido se ha publicado el 14 de mayo en formato preprint, con ligeros cambios en las cifras de eficacia vacunal (Heath PT, et al. medRxiv. 2021, 14/may. DOI:10.1101/2021.05.13.21256639): global 89,7 % (IC 95 %: 80,2-94,6 %) y 86,3 % (IC·95·%: 71,3-93,5 %) frente a la variante alfa. Los resultados de este estudio ya han sido publicados en formato estándar en una revista revisada por pares (ver adenda del 1/jul de 20219).
Novavax estudia versiones de la vacuna NVX-CoV2373 adaptadas a la variante beta
Novavax estudia versiones de NVX-CoV2373 (rS-B.1.351) adaptadas a la variante beta y ha presentado resultados preliminares esperanzadores en ratones, macacos y humanos (bioRxiv. 2021, 9/jun. DOI:10.1101/2021.06.08.447631 y nota de prensa de Novavax del 11 de junio de 2021).
Resultados preliminares del estudio PREVENT-19 de fase 3 en EE. UU.
Novavax acaba de presentar (14 de junio) mediante una nota de prensa los resultados preliminares del estudio de fase 3 en Estados Unidos, el estudio de esta vacuna más importante conocido hasta ahora, y que se comentan a continuación.
[►volver al inicio]
Estudio PREVENT-19 (fase 3)
 Es un estudio aleatorizado, controlado con placebo y ciego para el observador, que ha reunido a 29.960 participantes en EE. UU. y México, de los cuales dos tercios recibieron la vacuna y el tercio restante placebo:
Es un estudio aleatorizado, controlado con placebo y ciego para el observador, que ha reunido a 29.960 participantes en EE. UU. y México, de los cuales dos tercios recibieron la vacuna y el tercio restante placebo:
- 77 casos de covid sintomático y confirmado, de los cuales 63 ocurrieron en el grupo del placebo y los 14 restantes en el de los vacunados.
- En el grupo de la vacuna todos los casos fueron leves. En el grupo del placebo hubo 10 casos moderados y 4 graves.
- Eficacia vacunal frente a enfermedad moderada y grave 100 % (IC 95 %: 87-100 %), eficacia global 90,4 % (IC 95 %: 82,9-94,6 %).
- En el periodo del estudio la variante alfa B.1.1.7 era la predominante en EE. UU. Se completó la secuenciación de 54 de los 77 casos. La eficacia vacunal frente a variantes de interés o preocupación fue del 93,2 % (IC 95 %: 83,9-97,1 %) y frente a las demás 100 % (IC 95 %: 80,8-100 %).
- Considerando solo los participantes con >65 años, menores de esta edad con comorbilidad y los que tienen alto riesgo de exposición, la eficacia vacunal fue del 91 % (IC 95·%: 83,6-95 %).
- El perfil de reactogenicidad y seguridad ha sido favorable: la mayoría fueron síntomas y signos leves de duración limitada, y con una distribución de efectos secundarios moderados y graves similar en ambos grupos.
Como aspectos destacables del estudio se señala que más del 44 % de los participantes corresponden a colectivos especialmente vulnerables a la covid (por ej. los no blancos) y que tiene requisitos de conservación poco exigentes (refrigeración entre +2 y +8 ºC durante al menos 6 meses) (Science. 2021, 14/jun. DOI:doi:10.1126/science.abj7408).
Novavax ha declarado su interés en solicitar la aprobación por las agencias reguladores en el tercer trimestre del año y poder producir 100-150 millones de dosis cada mes. La compañía Serum Institute (India) también producirá esta vacuna.
[►volver al inicio]
Conclusiones
Los resultados preliminares presentados sitúan a esta vacuna a la par en eficacia vacunal comparada con las vacunas de ARNm (Comirnaty de Pfizer & BioNTech y Moderna), con las ventajas de los requisitos de conservación asequibles y de haber sido probada en un contexto con amplia circulación de distintas variantes virales (aunque la compañía ya prepara versiones adaptadas a la variante beta).
Es esperable que su autorización pueda ser evaluada en el tercer trimestre de este 2021, lo cual, de pasar el examen, contribuiría decisivamente en el control de la pandemia antes de acabar el año. Es especialmente esperanzador pues Novavax ya ha previsto destinar una cantidad importante de su producción a la iniciativa COVAX.
[►volver al inicio]
Adenda, 1 de julio de 2021. Se han publicado los resultados de un estudio de fase 3 sobre la seguridad y eficacia del producto NVX-CoV2373 llevado a cabo en Reino Unido (Heath PT, et al. N Engl J Med. 2021;385:1172-83). Los datos más destacables son:
- 15.187 aleatorizados (1:1), edad 18-84 años, sanos o con condiciones crónicas (incluidos VIH) estables. Finalmente 14.039 incluidos en el análisis de eficiacia por protocolo.
- Participantes: 27,9 % igual o >65 años, 44,6 % con comorbilidades, 94,5 % blancos.
- Recibieron 2 dosis de vacuna o placebo con un intervalo de 21 días.
- Resultados: 106 casos después de 7 días desde la segunda dosis: 10 en el grupo vacuna y 96 en el de placebo. Eficacia vacunal (EV): 89,7 % (IC 95 %: 80,2-94,6 %).
- No casos graves ni muertes entre los casos vacunados; 5 casos graves en el grupo placebo.
- Análisis post-hoc: EV frente a variante Alfa (B.1.1.7): 86,3 % (71,3-93,5 %) y frente a variantes no-Alfa: 96,4 % (73,8-99,5 %).
- Reactogenicidad aceptable, leve. EA graves frecuencia baja y similar en ambos grupos
Adenda, 16 de octubre de 2021. Novavax anuncia la publicación en formato prepublicación (preprint) los resultados finales del estudio pivotal PREVENT-19 (fase 3) llevado a cabo en EE. UU. y México:
- Nota de prensa de Novavax del 11 de octubre de 2021.
- Publicación: Dunkle LM, et al. Efficacy and Safety of NVX-CoV2373 in Adults in the United States and Mexico. medRxiv. 2021, 10/oct. DOI: 10.1101/2021.10.05.21264567.
Adenda, 30 de octubre de 2021. Novavax anuncia que ha solicitado la autorización de uso de emergencia en Reino Unido y Australia.
[►volver al inicio]
-oOo-
Más información
- Callaway E, et al. First evidence that COVID vaccines protect people against new variants. Novavax’s experimental shot is highly effective against the variant identified in Britain — but saw a worrying drop in efficacy against a lineage detected in South Africa. Nature. 2021;590(7844):17.
- Corum J, et al. How the Novavax Vaccine Works. The New York Times, 7 de mayo de 2021.
- EMA, 3/feb de 2021. EMA starts rolling review of Novavax’s COVID-19 vaccine (NVX-CoV2373).
- Heath PT, et al. Safety and Efficacy of NVX-CoV2373 Covid-19 Vaccine. N Engl J Med. 2021;385:1172-83 [medRxiv. 2021, 14/may. DOI:10.1101/2021.05.13.21256639].
- Keech C, et al. Phase 1-2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med. 2020;383:2320-32.
- Logue J, et al. Immunogenicity and In vivo protection of a variant nanoparticle vaccine that confers broad protection against emerging SARS-CoV-2 variants.
bioRxiv. 2021, 9/jun. DOI:10.1101/2021.06.08.447631. - Novavax, protocolos de los ensayos en curso.
- Novavax, 23/oct de 2020. A phase 3, randomised, oberrver-blinded, placebo-controlled trial to evaluate the efficacy and safety of a SARS-CoV-2 recomb inant spike protein nanoparticle vaccine (SARS-CoV-2 RS) with Matrix-M1 adyuvant in adult participant 18-84 years of age in the United Kingdom.
- Novavax, 28/ene de 2021. Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial.
- Novavax, 5/may de 2021. New England Journal of Medicine Publishes Phase 2b Clinical Trial Results Demonstrating Efficacy of Novavax COVID-19 Vaccine Against the B.1.351 Variant.
- Novavax, 11/jun de 2021. Novavax Announces Positive Data from Three Complementary Studies of COVID-19 Beta (B.1.351) Variant Strain Vaccine.
- Novavax, 14/jun de 2021. Novavax COVID-19 Vaccine Demonstrates 90% Overall Efficacy and 100% Protection Against Moderate and Severe Disease in PREVENT-19 Phase 3 Trial.
- Shinde V, et al. Efficacy of NVX-CoV2373 Covid-19 Vaccine against the B.1.351 Variant. N Engl J Med. 2021;384:1899-909.
- Wadman M, et al. Novavax vaccine delivers 89% efficacy against COVID-19 in U.K.—but is less potent in South Africa. Science. 2021, 28/ene. doi:10.1126/science.abg8101.
- Wadman M. Powerful new COVID-19 vaccine shows 90% efficacy, could boost world’s supply. Science. 2021, 14/jun. DOI:doi:10.1126/science.abj7408.
[►volver al inicio]
Sobre las variantes del SARS-CoV-2
- ECDC, 3/jun de 2021. SARS-CoV-2 variants of concern as of 3 June 2021.
- OMS, 31/may de 2021. Tracking SARS-CoV-2 variants.
- CDC, 15/jun de 2021. SARS-CoV-2 Variant Classifications and Definitions.
[►volver al inicio]
Otras referencias
- Novavax, 14/jun de 2021. Novavax Announces Positive Results from First Study of Influenza Vaccine and COVID-19 Vaccine Candidate Administered Simultaneously. COVID-19 vaccine candidate efficacy in those 18 to <65 years old was preserved in influenza vaccine recipients. Influenza vaccine immunogenicity preserved. Study demonstrated no early safety concerns. Data available ahead of publication via preprint server, medRxiv.
- Toback S, et al. Safety, Immunogenicity, and Efficacy of a COVID-19 Vaccine (NVX-CoV2373) Co-administered With Seasonal Influenza Vaccines. medRxiv. 2021, 13/jun. DOI:10.1101/2021.06.09.21258556.
[►volver al inicio]
Historial de actualizaciones
- 30 de octubre de 2021. Se añade el anuncio de solicitud de aprobación en Reino Unido y Australia.
- 16 de octubre de 2021. Novavax anuncia la publicación de los resultados finales del estudio pivotal PREVENT-19
- 1 de julio de 2021. Se auncia que se han publicado los resultados de un estudio de fase 3 sobre la seguridad y eficacia del producto NVX-CoV2373 llevado a cabo en Reino Unido.