Investigación en el Manual de Vacunas en línea de la AEP
El Manual de Vacunas en línea de la AEP (ver índice de contenidos aquí) ha incorporado un nuevo capítulo dedicado a la investigación en vacunas. Se presenta a continuación un breve resumen de algunos aspectos desarrollados en el capítulo.
Manual de vacunas en línea de la AEP
 El Manual de vacunas en línea de la AEP se creó en 2014 y desde entonces se mantiene permanentemente actualizado, con revisiones periódicas de cada uno de sus capítulos (a la cabecera de cada uno de ellos se señala la fecha de actualización). Los autores del Manual son los miembros, pasados y actuales, del Comité de Vacunas de la AEP (CAV-AEP), así como los expertos externos enumerados en el Anexo IV del Manual.
El Manual de vacunas en línea de la AEP se creó en 2014 y desde entonces se mantiene permanentemente actualizado, con revisiones periódicas de cada uno de sus capítulos (a la cabecera de cada uno de ellos se señala la fecha de actualización). Los autores del Manual son los miembros, pasados y actuales, del Comité de Vacunas de la AEP (CAV-AEP), así como los expertos externos enumerados en el Anexo IV del Manual.
El propósito del Manual es ser una fuente abierta de información y consulta sobre vacunaciones, dirigida particularmente a los pediatras españoles, pero también a otros profesionales sanitarios de habla hispana relacionados con la atención a la infancia y la adolescencia, la prevención o la vacunología. Al final de cada capítulo está disponible un formulario para recoger comentarios sobre su contenido; el CAV-AEP agradece todas las aportaciones recibidas.
Investigación científica
La investigación en el campo de las vacunaciones es intensa y extensa, y juega un papel crítico en el impacto de las mismas en el nivel de salud de la población. El conocimiento del sistema inmune y el desarrollo tecnológico ha permitido crear productos efectivos que potencian la respuesta inmune de los individuos frente a las infecciones.
La investigación no solo incluye los campos del desarrollo de nuevos productos, nuevas vacunas, sino también a los sistemas, procedimientos y dispositivos para su conservación, transporte y administración individual, los sistemas de seguridad y vigilancia de los eventuales efectos indeseados, así como a las condiciones que afectan a la percepción y aceptación por parte de la población a la que van dirigidas las vacunaciones.
Como dice la introducción al capítulo presentado aquí: “Investigar supone un proceso sistemático de descripción, recopilación y análisis de datos, con el objeto de responder a una pregunta o dar solución a un determinado problema, a través de la aplicación del método científico”. El planteamiento del capítulo es el de un texto básico de investigación.
Ensayos clínicos
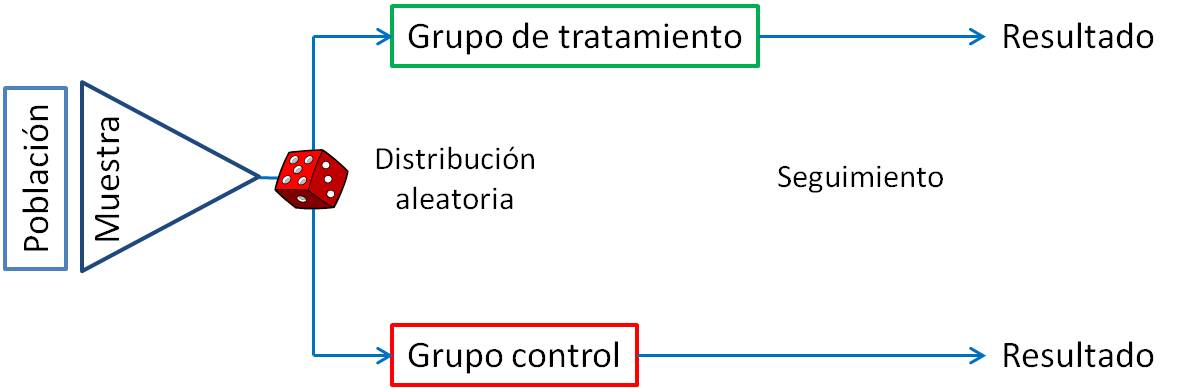 El ensayo clínico es un tipo de estudio experimental, de carácter prospectivo y controlado, que se considera la mejor prueba científica para apoyar la evidencia de eficacia de una intervención concreta. Está considerado como el diseño más idóneo para evaluar la eficacia de las intervenciones sanitarias. El ensayo clínico aleatorizado (ECA) como paradigma de la evidencia científica.
El ensayo clínico es un tipo de estudio experimental, de carácter prospectivo y controlado, que se considera la mejor prueba científica para apoyar la evidencia de eficacia de una intervención concreta. Está considerado como el diseño más idóneo para evaluar la eficacia de las intervenciones sanitarias. El ensayo clínico aleatorizado (ECA) como paradigma de la evidencia científica.
En general, los componentes de un ECA son: a) pregunta o hipótesis inicial; b) aleatorización; c) enmascaramiento; d) seguimiento; y e) análisis de los resultados. Se comentan brevemente, en el capítulo, las características de estos conceptos.
Ética de la investigación
La ética en la investigación es un campo de reciente desarrollo. Exige que la práctica de la ciencia se realice conforme a principios éticos que aseguren el avance del conocimiento, la comprensión y mejora de la condición humana y el progreso de la sociedad. Se focaliza el interés en la perspectiva moral de la ejecución de la investigación, en la consideración de sus aspectos éticos, en su naturaleza y fines. Aspectos concretos de especial importancia en la investigación y práctica de las vacunaciones son los del acceso a las mismas de todas las personas y grupos de la población diana, así como la seguridad de todo el proceso.
Investigar en vacunas
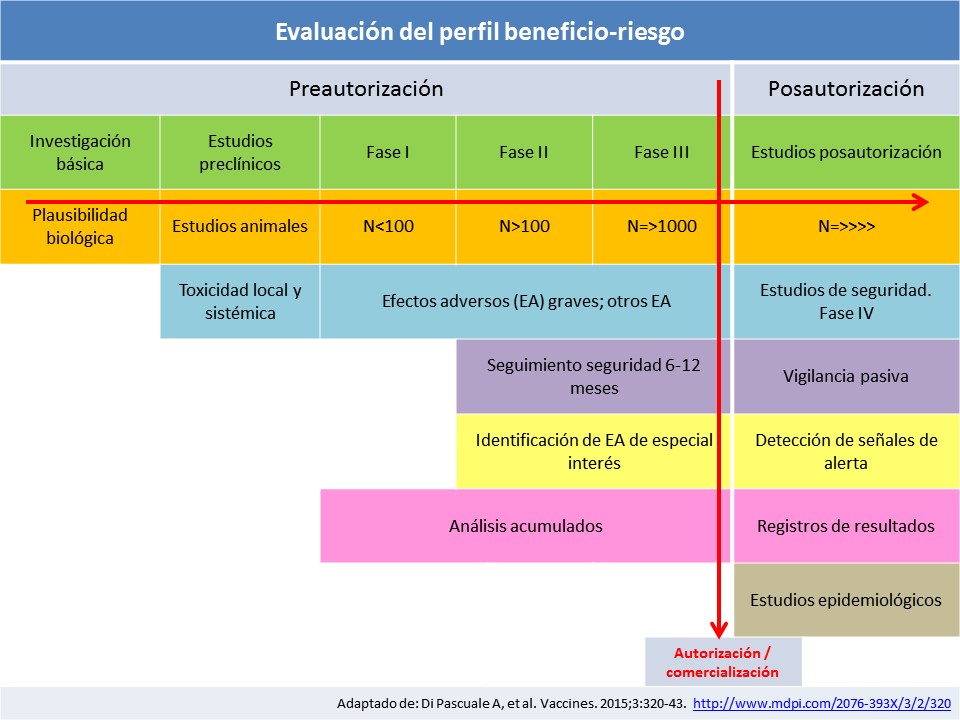 Los productos resultado de la investigación preclínica con fundadas expectativas de efectividad y seguridad pasan al proceso de investigación clínica, el cual se compone de tres fases (1, 2 y 3) antes de aspirar a su autorización por parte de las autoridades regulatorias (la European Medicines Agency [EMA] y la Agencia Española de Medicamentos y Productos Sanitarios [AEMPS] en Europa y España, respectivamente) y su posterior comercialización. La fase 4, una vez en pleno uso, realmente dura casi toda la vida útil del producto, persigue completar el conocimiento y límites, así como el riesgo de efectos adversos de baja frecuencia solo visibles con el uso en grandes poblaciones. Un largo proceso que puede llevar entre 10 y 15-20 años.
Los productos resultado de la investigación preclínica con fundadas expectativas de efectividad y seguridad pasan al proceso de investigación clínica, el cual se compone de tres fases (1, 2 y 3) antes de aspirar a su autorización por parte de las autoridades regulatorias (la European Medicines Agency [EMA] y la Agencia Española de Medicamentos y Productos Sanitarios [AEMPS] en Europa y España, respectivamente) y su posterior comercialización. La fase 4, una vez en pleno uso, realmente dura casi toda la vida útil del producto, persigue completar el conocimiento y límites, así como el riesgo de efectos adversos de baja frecuencia solo visibles con el uso en grandes poblaciones. Un largo proceso que puede llevar entre 10 y 15-20 años.
-oOo-
Más información:
- AEMPS, febrero de 2020. Ensayos clínicos con medicamentos de uso humano.
- Real Decreto 1090/2015, de 4 de diciembre, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos.
- Colección de artículos sobre los ECA en la revista Evidencias en Pediatría.
- Otras noticias anteriores sobre investigación en vacunas en esta web.
- Acceso índice de contenidos del Manual de vacunas en línea de la AEP.
- Últimas actualizaciones del Manual de vacunas en línea de la AEP: julio de 2019.
- Otras noticias anteriores sobre documentos del CAV en esta web.








