Los resultados preliminares del ensayo CombivacS no aclaran todas las dudas
Fecha de actualización: 26 de junio de 2021
El pasado 19 de abril de 2021 se presentó el estudio CombivacS, promovido por el Instituto de Salud Carlos III, una entidad dependiente de los ministerios de Ciencia e Innovación y Sanidad. Ahora, el martes 18 de mayo se presentan los resultados preliminares del mismo.
Antecedentes
El 7 de marzo de 2021 se dieron a conocer los primeros casos de trastornos tromboembólicos asociados a la vacuna Vaxzevria. Desde entonces, la EMA ha mantenido una estrecha vigilancia y estudio de estos fenómenos. El último pronunciamiento de esta está fechado el 23 de abril y mantiene su evaluación favorable del balance riesgo-beneficio.
Después de algunos vaivenes en las recomendaciones de uso de esta vacuna en España, el pasado 7 de abril de 2021, el Consejo Interterritorial del SNS (CISNS) acordó no administrar la vacuna Vaxzevria a los menores de 60 años. Un día después, el 8 de abril fue la Comisión de Salud Pública la que estableció el rango de 60-69 años como el destinatario de esta vacuna. Al mismo tiempo se demoraba la decisión de cómo completar la vacunación de las personas menores de esta edad que ya habían recibido una dosis de Vaxzevria. Son muchos los hechos y detalles ocurridos en estas semanas, y pueden consultarse los más relevantes es estas notas anteriores en esta web:
- 18 de marzo: La vacuna de AstraZeneca en investigación por posibles problemas de seguridad.
- 1 de abril: La EMA confirma la seguridad global de la vacuna de AstraZeneca, aunque no se puede descartar relación con raros trastornos de la coagulación.
- 19 de abril: Vacuna de AstraZeneca: la EMA mantiene su evaluación favorable pero el Ministerio limita su uso según la edad.
- 23 de abril: Vacuna de AstraZeneca: riesgos y beneficios comparados.
El 30 de abril, 17 sociedades científicas se posicionaron a favor de permitir completar la pauta de Vaxzevria con esta misma vacuna.
Se ha dicho que son 1,5 millones las personas de menos de 60 años que han recibido una primera dosis de Vaxzevria y permanecen a la espera de saber cómo y cuándo completarán su pauta vacunal. Las personas de 60-69 años que recibieron la primera dosis de Vaxzevria, completarán la pauta con esta misma vacuna.
Número y tipo de vacunas de la covid administradas
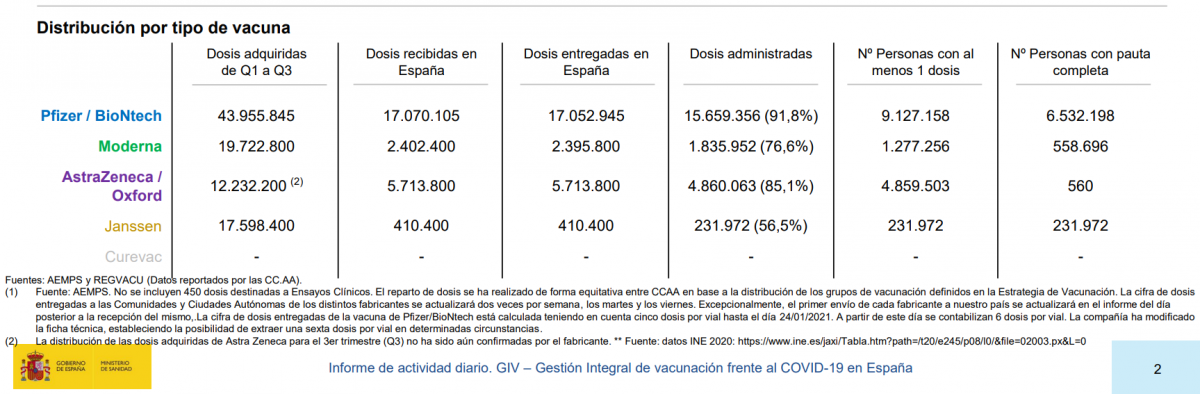
 Según los datos aportados por el Gobierno español, a fecha del 17 de mayo, más de 15 millones de ciudadanos han recibido, al menos, una dosis de alguna de las vacunas de la covid.
Según los datos aportados por el Gobierno español, a fecha del 17 de mayo, más de 15 millones de ciudadanos han recibido, al menos, una dosis de alguna de las vacunas de la covid.
En la misma fecha se informa de que unos 4,5 millones de personas han recibido una dosis de la vacuna Vaxzevria, pero solo 560 de ellas han completado la pauta de dos dosis.
[volver al inicio]
Características del ensayo CombivacS
Es un ensayo clínico en fase 2, comparativo, aleatorizado y adaptativo, para evaluar la inmunogenicidad (a los 14 días) de una dosis de la vacuna Comirnaty (Pfizer) en personas de menos de 60 años de edad que han recibido previamente (al menos 8 semanas antes) una dosis de la vacuna Vaxcevria (AstraZeneca).
Se seleccionan a 600 personas residentes en las áreas de influencia de los centros sanitarios que participan en el estudio (de Barcelona, Bilbao y Madrid), de los que, de forma aleatoria: 400 reciben una dosis de Comirnaty y otras 200 servirán de grupo control sin la nueva dosis de vacuna.
[volver al inicio]
Presentación de resultados preliminares
El martes 18 de mayo de 2021 se han presentado los resultados preliminares del estudio CombivacS (en la imagen adjunta, la rueda de prensa en la que se presentaron estos resultados). En la nota de prensa del ISCIII se destaca que "El uso combinado de las vacunas de AstraZeneca y Pfizer contra el SARS-CoV-2 ofrece una potente respuesta inmunitaria". Se presentan los primeros análisis serológicos de muestras tomadas a los 14 días de la dosis de Comirnaty administrada.
Los resultados muestran, de forma resumida, que "esta pauta de vacunación heteróloga es altamente inmunogénica y no presenta problemas de reactogenicidad postvacunación diferentes a los ya comunicados en el uso homólogo (en solitario) de esas mismas vacunas".
En el estudio se incluyeron finalmente 663 participantes con análisis serológicos. Se han utilizado tres técnicas en cada participantes. Los resultados a 14 días de la segunda dosis son:
- Identificación de RBD de la proteína S del SARS-CoV-2: aumento de 150 veces los niveles previos a la segunda dosis.
- Detección de anticuerpos basados en la proteína trimérica del virus: aumento de 42 veces los niveles previos a la segunda dosis.
- Eficacia para neutralizar un seudovirus portador de la proteína S del SARS-CoV-2: aumento de 7 veces.
Respecto a la reactogenicidad, se ha confirmado un perfil similar a lo ya señalado para la vacuna Comirnaty en regímenes homólogos.
El estudio ha estado coordinado por un equipo en el que han participado: (de izquierda a derecha en la imagen adjunta) Cristóbal Belda, José Alcamí, Alberto Borobia, Magdalena Campins, Raquel Yotti, Luis Castaño, Jesús Frías, María Teresa Pérez Olmedo y Antonio Carcas
[volver al inicio]
Comisión de Salud Pública y Consejo Interterritorial del SNS
El mismo martes 18 de mayo se ha celebrado una prolongada reunión de la Comisión de Salud Pública (CSP, con la participación de los directores generales de Salud Pública de las comunidadaes), y ayer miércoles 19 de mayo lo hizo lo propio el Consejo Interterritorial del SNS (CISNS, formado por los consejeros de sanidad de las comunidades y el Ministerio de Sanidad). Se esperaba que en estas reuniones quedara definitivamente aclarado cómo completarán la pauta vacunal las personas de menos de 60 años con una dosis inicial de la vacuna Vaxzevria, pero no ha sido así, se mantiene la incertidumbre y las dudas. Incluso varias comunidades han mostrado su desacuerdo por el desarrollo de la reunión del CISNS, en el que no se habría dado la oportunidad a las comunidades de evaluar la propuesta de la CSP del día previo.
El Ministerio de Sanidad, apoyándose en los resultados presentados del estudio CombivacS mantiene su decisión de ofrecer Comirnaty como segunda dosis. Sin embargo, varias comunidades (según algunos medios de comunicación, siete comunidades -Andalucía, Asturias, Cataluña, Galicia, Comunidad Valenciana, Madrid y Murcia-; según otros, también, Castilla y León) insisten en completar con la misma vacuna que la primera dosis, tal como indican las fichas técnicas de las vacunas y recomiendan la EMA y la AEMPS.
Hasta ahora no hay información oficial de ninguna de las dos reuniones citadas, pero según recogen algunos medios de comunicación de la rueda de prensa de la ministra Darias tras la reunión del CISNS del 19 de mayo, el Ministerio de Sanidad mantiene su decisión, pero abre la posibilidad de que las comunidades puedan ofrecer la alternativa de una segunda dosis de Vaxzevria previa firma de un documento de aceptación por parte de los usuarios, para lo cual ha remitido una consulta al Comité de Bioética de España, un organismo consultivo, que deberá opinar sobre las condiciones de las opciones de elección por parte de los usuarios.
[volver al inicio]
Críticas al estudio CombivacS y a la interpretación del Ministerio de Sanidad
Son importantes las limitaciones del estudio CombivacS. De los resultados mostrados solo se puede concluir que una segunda dosis de Comirnaty después de, al menos, 8 semanas de una primera dosis de Vaxzevria es inmunógena y con una reactogenicidad similar a lo ya conocido (Nature. 2021, 19/may. DOI:10.1038/d41586-021-01359-3). Pero no sirve para avalar la decisión previa del Ministerio de Sanidad. No aclara si es superior a la pauta de dos dosis de la vacuna de AstraZeneca ni la seguridad de la pauta heteróloga defendida por el Ministerio, pues el estudio no tiene potencia para detectar los eventuales efectos adversos de baja frecuencia (MicroBio, 19 de mayo de 2021). Los datos de inmunogenicidad de CombivacS no son comparables con los mostrados en los estudios de fase 3 de las vacunas implicadas, al ser variables, técnicas y contextos distintos. Tampoco informa sobre la protección y efectividad real de la pauta heteróloga.
Pocos días antes se han publicado datos preliminares sobre la reactogenicidad de las pautas heterólogas en el estudio Com-Cov de la Universidad de Oxford, que muestran ciertas desventajas a corto plazo de las pautas heterólogas al encontrar un incremento de los síntomas como fiebre en las 24-48 horas siguientes a la vacunación (34 % de la pauta Vaxzevria-Comirnaty frente al 10% de la pauta de dos dosis de Vaxzevria) (Lancet. 2021, 12/may. DOI: 10.1016/S0140-6736(21)01115-6).
En conclusión, se mantiene la incertidumbre y las dudas que llevan camino de arruinar la confianza en las autoridades sanitarias del país. Los profesionales, por su parte, muestran síntomas de hartazgo ante la falta de claridad y racionalidad de las cambiantes decisiones de las autoridades y la sensación de caminar sin norte.
[volver al inicio]
Adenda, 22 de mayo de 2021. El Ministerio de Sanidad ha publicado el dictamen del Comité de Bioética de España y un añadido a la actualización núm. 7 con una propuesta de consentimiento informado para las personas de menos de 60 años que elijen recibir la segunda dosis de Vaxzevria en vez de la vacuna Comirnaty, que es la opción recomendada por el propio Ministerio.
Adenda, 27 de mayo de 2021. Los resultados del estudio CombivacS se han publicado en formato preprint en: Borobia AM, et al. Reactogenicity and Immunogenicity of BNT162b2 in Subjects Having Received a First Dose of ChAdOx1s: Initial Results of a Randomised, Adaptive, Phase 2 Trial (CombiVacS). SSRN. 2021, 27/may.
Adenda, 26 de junio de 2021. Los resultados del estudio CombiVacS se han publicado en una revista revisada: Lancet. 2021, 25/jun. DOI:10.1016/S0140-6736(21)01420-3.
[volver al inicio]
-oOo-
Más información
- Borobia AM, et al. Immunogenicity and reactogenicity of BNT162b2 booster in ChAdOx1-S-primed participants (CombiVacS): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet. 2021, 25/jun. DOI:10.1016/S0140-6736(21)01420-3.
- Fernández Novo I. Pros y contras de poner una segunda dosis de Pfizer a quienes se vacunaron con AstraZeneca. Nius Diario, 20 de mayo de 2021.
- Estudio Com-Cov (Com-Cov2), de Oxford Vaccine Group.
- Shaw RH, et al. Heterologous prime-boost COVID-19 vaccination: initial reactogenicity data. Lancet. 2021, 12/may. DOI: 10.1016/S0140-6736(21)01115-6.
- Van Beusekom M. More side effects noted after using 2 different COVID vaccines. CIDRAP, 13/may de 2021.
- Iacobucci G. Covid-19: Fever, chills, and aches more common when AstraZeneca and Pfizer vaccines are mixed, early data show. BMJ. 2021;373:n1216.
- Callaway E. Mix-and-match COVID vaccines trigger potent immune response. Preliminary results from a trial of more than 600 people are the first to show the benefits of combining different vaccines. Nature. 2021, 19/may. DOI:10.1038/d41586-021-01359-3.
- Montoya M. Mezclar o no mezclar vacunas, ¿esa es la cuestión?. Estrategia de vacunación COVID-19. Voces expertas, 13 de mayo de 2021.
[volver al inicio]
Otras referencias
- Liu X, et al. Safety and Immunogenicity Report from the Com-COV Study – a Single-Blind Randomised Non-Inferiority Trial Comparing Heterologous And Homologous Prime-Boost Schedules with An Adenoviral Vectored and mRNA COVID-19 Vaccine. SSRN. 2021, 25/jun. doi:10.2139/ssrn.3871014.
- Yotti R. Combinación de vacunas contra el SARS-CoV-2: ¿por qué el ensayo CombivacS? SINC, 24/may de 2021.
- Lin A, et al. Heterologous vaccination strategy for containing COVID-19 pandemic. medRxiv. 2021, 23/may. DOI: 10.1101/2021.05.17.21257134.
- Quinn K. Why do we need booster shots, and could we mix and match different COVID vaccines? The Conversation, 16/mar de 2021.
Historial de actualizaciones
- 26 de junio de 2021. Se añade la referencia a la publicación del estudio ComviVacS en The Lancet.
- 28 de mayo de 2021. Se añade la referencia de la publicación en formato preprint del estudio CombivacS.
- 22 de mayo de 2021. Se añade una adenda con el dictamen del Comité de Bioética de España y el consentimiento informado propuesto por el Ministerio de Sanidad.