Vacuna de AstraZeneca: la EMA mantiene su evaluación favorable pero el Ministerio limita su uso según la edad
Fecha de actualización: 19 de abril de 2021
En los pasados días se ha asistido a nuevos cambios en la política de uso de la vacuna Vaxzevria (AstraZeneca), y la confusión y preocupación se ha instalado en la población.
A las 16,00 h del miércoles 7 de abril la EMA emitió un nuevo informe de evaluación de dicha vacuna, y a continuación se celebraron un consejo de ministros de sanidad europeos y, más tarde, otra del Consejo Interritorial del SNS español (CISNS, consejeros de sanidad de las comunidades y Ministerio de Sanidad). Al día siguiente, ayer 8 de abril, ha sido la Comisión de Salud Pública del CISNS ha que ha completado la serie de dos días frenéticos, que han dejado muchas dudas en el aire.
La EMA mantiene su evaluación favorable
 El pasado 7 de abril de 2021 la EMA concluyó una nueva evaluación de la seguridad de la vacuna Vaxzevria, e informó de sus conclusiones a través de una nota de prensa: "AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets".
El pasado 7 de abril de 2021 la EMA concluyó una nueva evaluación de la seguridad de la vacuna Vaxzevria, e informó de sus conclusiones a través de una nota de prensa: "AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets".
- EMA is reminding healthcare professionals and people receiving the vaccine to remain aware of the possibility of very rare cases of blood clots combined with low levels of blood platelets occurring within 2 weeks of vaccination. So far, most of the cases reported have occurred in women under 60 years of age within 2 weeks of vaccination. Based on the currently available evidence, specific risk factors have not been confirmed.
Respecto a los casos de trastornos de la coagulación estudiados:
- Hasta el 22/marzo se han notificado y estudiado en detalle, en la Unión Europea (UE) y Reino Unido (RU), 62 casos de trombosis de los senos venosos cerebrales (TSNC) y 24 de las venas esplácnicas, todos con trombopenia. Entre estos se han producido 18 fallecimientos. Estos datos corresponden a 25 millones de dosis administradas (1 caso por 290.000 vacunas).
- La mayoría de estos casos son mujeres menores de 60 años, pese a lo cual no puede establecerse que edad y sexo constituyan factores de riesgo, ya que las estrategias de vacunación han incidido especialmente en población menor de 65 años y las mujeres son mayoría entre los vacunados.
- Hasta el 4/abril se han registrado a través de EudraVigilance (notificaciones) otros casos hasta un total de 169 de TSVC y 53 de trombosis esplácnica (venas portal, esplénica y mesentérica). Estos casos corresponderían a un total de 34 millones de vacunas administradas (1 notificación por cada 158·000 vacunas).
De la nota ùblicada puede destacarse:
- La EMA insiste en que con los datos disponibles en la actualidad el balance riesgo/beneficio favorece a la vacuna aunque considera que los trastornos de la coagulación con trombocitopenia deben ser incluidos entre los afectos secundarios de la vacuna Vaxzevria.
- Como explicación más probable del fenómeno, se piensa que estos trastornos se deben a un mecanismo autoinmune similar al de la trombocitopenia trombótica asociada a la heparina (un autoanticuerpo contra el factor 4 plaquetario). No se han podido definir, hasta la actualidad, situaciones o enfermedades predisponentes (edad, sexo, etc.).
- La detección de estos casos extraordinariamente raros, demuestra la importancia de la fármaco-vigilancia, una vez que se aprueba una vacuna, para detectar los efectos secundarios de muy baja incidencia.
En la rueda de prensa celebrada a continuación, los máximos directivos de la EMA respondieron a las preguntas de los medios de comunicación (ver vídeo adjunto, de poco más de una hora de duración y las notas siguientes):
- ¿Se sabe por qué afecta más a mujeres jóvenes?: es posible que esto sea debido únicamente a las estrategias de vacunación seguida con esta vacuna en los diferentes países.
- ¿Se podría utilizar una vacuna diferente para la segunda dosis?: no hay datos que permitan llevar a cabo esta práctica, aunque en breve se dispondrá de ellos. Todos los casos aparecidos hasta ahora han sido tras la primera dosis (generalmente en las dos semanas siguientes) pero este puede ser un artefacto, ya que hay muy pocas personas que hayan recibido dos dosis, de las cuales apenas hay información.
- ¿Es menos frecuente en varones mayores de 60 años?: es difícil responder a esto ya que la exposición a la vacuna ha sido muy diferente. Aproximadamente, un 60 % de las personas que han recibido la vacuna han sido mujeres.
- ¿Puede poner un ejemplo de algún fármaco que dé lugar a trastornos parecidos y su frecuencia?: los anticonceptivos orales. Si 10·000 mujeres sanas toman estos fármacos durante un año aparecerán 4 episodios trombóticos en exceso.
- Dado que ocurren en mujeres jóvenes, ¿podría estar relacionado con los anticonceptivos orales o el embarazo?: aunque estas dos situaciones tienen un aumento de episodios trombóticos, no cursan con trombocitopenia.
- ¿Podrían informar de la incidencia con intervalos de confianza?: no es posible. Estos son datos de comunicación de acontecimientos adversos (reporting rate), que no permiten dar tasas de incidencia. La tasa de notificación varía entre 1 y 2 casos por 100·000 dosis. En Alemania, por ejemplo, informan de 1/100·000, pero en el Reino unido es de 1/600·000.
- ¿Cuál es el tratamiento adecuado?: no sabemos cuál es el mejor tratamiento. Algunas sociedades científicas, por la analogía de estos cuadros con la trombocitopenia asociada a la heparina, recomiendan inmunolobulinas IV y corticoesteroides.
- ¿Es posible que estos fenómenos puedan haberse producido porque la vacuna se haya administrado por vía intravenosa?: este hecho se ha investigado y parece que esta posibilidad es extremadamente remota.
- ¿Puede ocurrir esto mismo con otras vacunas fabricadas a base de vectores virales similares?: aunque lleven el mismo vector, son vacunas con una tecnología muy diferente. Los datos preliminares con la vacuna de Janssen han demostrado 3 casos de TSVC con 4,5 millones de dosis administradas. Con Comirnaty se han notificado 35 casos con 54 millones de dosis administradas. Con la vacuna de Moderna han sido 5 casos con 4 millones de dosis.
La AEMPS informa del dictamen de la EMA
 En la misma tarde del 7/abril, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) publicó una nota de prensa informando de las conclusiones de la EMA: Conclusiones del Comité para la Evaluación de Riesgos en Farmacovigilancia Europeo (PRAC). Tras la evaluación de los datos disponibles sobre los casos notificados de trombosis tras la vacunación con Vaxzevria (vacuna frente a la COVID-19 de AstraZeneca), el PRAC ha concluido lo siguiente:
En la misma tarde del 7/abril, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) publicó una nota de prensa informando de las conclusiones de la EMA: Conclusiones del Comité para la Evaluación de Riesgos en Farmacovigilancia Europeo (PRAC). Tras la evaluación de los datos disponibles sobre los casos notificados de trombosis tras la vacunación con Vaxzevria (vacuna frente a la COVID-19 de AstraZeneca), el PRAC ha concluido lo siguiente:
- Tras la administración de Vaxzevria pueden aparecer, muy raramente, trombosis en combinación con trombopenia, como trombosis de senos venosos cerebrales (TSVC), en abdomen (trombosis de venas esplácnicas) y trombosis arterial
- Los casos identificados se han presentado mayoritariamente en mujeres de menos de 60 años de edad en las dos semanas posteriores a la administración de la vacuna. No se han identificado factores de riesgo específicos para su aparición
- Se recomienda a profesionales sanitarios y ciudadanos vigilar la posible aparición de signos y síntomas de trombosis y trombocitopenia para su diagnóstico y tratamiento precoz.
La OMS apoya el dictamen de la EMA
El mismo día 7 de abril, la OMS publicó una nota de prensa apoyando las conclusiones de la EMA: "Interim statement of the COVID-19 subcommittee of the WHO Global Advisory Committee on Vaccine Safety on AstraZeneca COVID-19 vaccine".
Las autoridades británicas publican sus conclusiones
 Y también en la misma fecha, la entidad reguladora británica MHRA (Medicines and Healthcare products Regulatory Agency) también ha publicado su informe sobre la cuestión basados en su propia experiencia: "MHRA issues new advice, concluding a possible link between COVID-19 Vaccine AstraZeneca and extremely rare, unlikely to occur blood clots", y su conclusión:
Y también en la misma fecha, la entidad reguladora británica MHRA (Medicines and Healthcare products Regulatory Agency) también ha publicado su informe sobre la cuestión basados en su propia experiencia: "MHRA issues new advice, concluding a possible link between COVID-19 Vaccine AstraZeneca and extremely rare, unlikely to occur blood clots", y su conclusión:
- "The benefits of vaccination continue to outweigh any risks but the MHRA advises careful consideration be given to people who are at higher risk of specific types of blood clots because of their medical condition".
Consejo Interterritorial del SNS
 También el miércoles 7 de abril, ya al final del día, se reunió el CISNS que abordó las cuestiones relativas al uso de las mascarillas en espacios abiertos tras la confusión levantada unos días antes (artículo 6.2 segundo párrafo, de la ley 2/2021, de 29 de marzo) y las noticias sobre la vacuna Vaxzevria. Respecto a esta última cuestión, decidió limitar la administración de esta vacuna a personas de 60 o más años.
También el miércoles 7 de abril, ya al final del día, se reunió el CISNS que abordó las cuestiones relativas al uso de las mascarillas en espacios abiertos tras la confusión levantada unos días antes (artículo 6.2 segundo párrafo, de la ley 2/2021, de 29 de marzo) y las noticias sobre la vacuna Vaxzevria. Respecto a esta última cuestión, decidió limitar la administración de esta vacuna a personas de 60 o más años.
Comisión de Salud Pública del SNS
Ya el jueves 8 de abril, la Comisión de Salud Pública del SNS decidió fijar en el grupo de edad de 60 a 69 años el rango etario para el cual se destinará la vacuna de AstraZeneca.
Sin embargo dejó en el aire otras dudas como la de qué hacer con las personas (la mayoría menores de 55 años) que ya han recibido una dosis de esta vacuna y deberían recibir en las próximas semanas la segunda dosis. Con fecha del 19/abril de 2021, la AEMPS ha anunciado la autorización del primer ensayo que probará la eficacia y seguridad de una pauta vacunal mixta con una dosis de vacuna Comirnaty tras la primera de Vaxzevria.
Y llegó la confusión
Al final el resultado es el de gran confusión y temor por su impacto en el desarrollo de la vacunación de la covid y en la confianza de la población en las instituciones sanitarias.
La EMA ha respondido al reto de analizar la situación planteada con rigor y rapidez y ha emitido sus conclusiones que mantienen las iniciales tras examinar en detalle la información disponible, pero las autoridades de los países europeos optan por distanciarse de la EMA y tomar una amplia variedad de decisiones que ahondan la confusión.
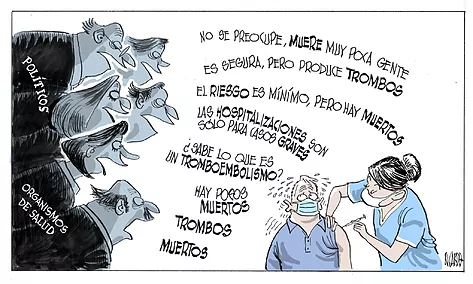 En España, tanto el gobierno central como los de las comunidades participan, también, del juego de la confusión y falta de cohesión, con mensajes contradictorios: la vacuna es segura pero se limita su uso a solo un pequeño grupo de personas distintas a las que ya la han recibido, y las comunidades tomando decisiones regionales variadas. Todo ello sin explicaciones convincentes. Otra vez la política de comunicación, que no existe (con la excepción de Andalucía, la única comunidad con una herramienta de información eficaz y rigurosa, Andavac).
En España, tanto el gobierno central como los de las comunidades participan, también, del juego de la confusión y falta de cohesión, con mensajes contradictorios: la vacuna es segura pero se limita su uso a solo un pequeño grupo de personas distintas a las que ya la han recibido, y las comunidades tomando decisiones regionales variadas. Todo ello sin explicaciones convincentes. Otra vez la política de comunicación, que no existe (con la excepción de Andalucía, la única comunidad con una herramienta de información eficaz y rigurosa, Andavac).
Las autoridades políticas y de salud pública de los países europeos y de las comunidades españolas tiene la capacidad legal para adaptar las recomendaciones de las entidades reguladoras (la EMA y la AEMPS) a las particularidades de sus territorios, pero ello debe hacerse de forma razonada y con las explicaciones necesarias. En todo caso, no parece razonable la amplia variedad de decisiones tomadas y la falta de cohesión mostradas.
Lamentablemente los acontecimientos descritos han eclipsado el logro de haber sido capaces de administrar casi medio millón de vacunas en un solo día en España, con lo que hacen unos 10 millones de vacunas puestas en total y tres millones los ciudadanos que han recibido la pauta completa de dos dosis.
-oOo-
Más información
- Noticias de la EMA en Twitter.
- CAV-AEP, 18/mar de 2021. La EMA confirma la seguridad global de la vacuna de AstraZeneca, aunque no se puede descartar relación con raros trastornos de la coagulación.
- Mouzo J. Sanidad y las comunidades acuerdan suspender la vacunación con AstraZeneca en menores de 60 años. El País, 7/abr de 2021.
- Castilla y León, Consejería de Sanidad, 7 de abril de 2021. Sanidad suspende cautelarmente la vacunación frente a la COVID-19 con AstraZeneca.
- Groups find possible link between AstraZeneca COVID vaccine, blood clots. CIDRAP, 7/abr de 2021.
- Branswell H, et al. In rare instances, AstraZeneca’s Covid-19 vaccine linked to blood clots, regulators say. STAT, 7/abr de 2021.
- Greinacher A. et al. A Prothrombotic Thrombocytopenic Disorder Resembling Heparin-Induced Thrombocytopenia Following Coronavirus-19 Vaccination. Res Square. 2021. 7/abr. DOI:10.21203/rs.3.rs-362354/v1.
- Vogel G, et al. Side effect worry grows for AstraZeneca vaccine. Science. 2021;372(6537):14-5.
- Kupferschmidt K, et al. A rare clotting disorder may cloud the world’s hopes for AstraZeneca’s COVID-19 vaccine. Science. 2021, 27/mar.
- Lee EJ, et al. Thrombocytopenia following Pfizer and Moderna SARS‐CoV‐2 vaccination. Hematology. 2021, 19/feb. DOI:10.1002/ajh.26132.
Otras referencias
- Cines DB, et al. SARS-CoV-2 Vaccine–Induced Immune Thrombotic Thrombocytopenia. N Eng J Med. 2021, 16/abr. DOI:10.1056/NEJMe2106315.
- Ostergaard SD, et al. Thromboembolism and the Oxford–AstraZeneca COVID-19 vaccine: side-effect or coincidence? Lancet. 2021;397(10283):1441-3.
- Scully M, et al. Pathologic Antibodies to Platelet Factor 4 after ChAdOx1 nCoV-19 Vaccination. N Eng J Med. 2021, 16/abr. DOI: 10.1056/NEJMoa2105385 (comentario de CIDRAP).
- Schultz NH, et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 2021, 9/abr. DOI: 10.1056/NEJMoa2104882.
- Greinacher A, et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med. 2021, 9/abr. DOI: 10.1056/NEJMoa2104840.
- Ledford H. How could a COVID vaccine cause blood clots? Scientists race to investigate. Researchers are searching for possible links between unusual clotting and the Oxford-AstraZeneca coronavirus vaccine. Nature News. 2021, 9/abr. DOI: 10.1038/d41586-021-00940-0.
- Remmel A. Why is it so hard to investigate the rare side effects of COVID vaccines? For the vast majority of people, COVID-19 vaccines are safe and effective. But further research is needed to understand the causes of rare adverse events. Nature News. 2021, 1/abr. DOI:10.1038/d41586-021-00880-9.
Historial de actualizaciones
- 19/abril de 2021. Se añade la noticia de que la AEMPS ha aprobado el primer ensayo que probará una pauta vacunal mixta, con una segunda dosis de vacuna de ARNm tras la primera de Vaxzevria.







