Vacunas de la covid: resumen de las recomendaciones de la EMA y del Ministerio de Sanidad
Fecha de actualización: 13 de noviembre de 2022
| Consultar también |
|---|
| CAV-AEP, 19 de diciembre de 2022. El Ministerio de Sanidad recomienda la vacunación de la covid en niños de 6-59 meses de edad con factores de riesgo. |
| Contenido |
|---|
| ● Vacunas de la covid: resumen recomendaciones de la EMA y del Ministerio de Sanidad ● Vacunas de la covid aprobadas por la EMA [ver] ● Recomendaciones del Ministerio de Sanidad ● Comirnaty (Pfizer & BioNTech) [ver] ● Spikevax (Moderna) [ver] ● Nuvaxovid (Novavax) [ver] ● Condiciones de alto riesgo (dosis adicionales en la primovacunación) [ver] ● Condiciones de riesgo para la aplicación de una dosis de refuerzo en el otoño de 2022 [ver] ● Fuentes de información del Ministerio de Sanidad y Andavac [ver] ● Más información [ver] ● Historial de actualizaciones [ver] |
| En pocas palabras |
|---|
| ● Se muestra un resumen de las disposiciones oficiales relativas a la vacunación de la covid, con especial interés en la población pediátrica. ● La EMA ha aprobado 11 vacunas, de las que solo tres tienen uso autorizado en los niños y adolescentes, tanto para la primovacunación, como para las dosis de refuerzo. ● Se resumen las recomendaciones del Ministerio de Sanidad sobre la vacunación de la población pediátrica en cinco tablas: Comirnaty, Spikevax, Nuvaxovid, grupos de riesgo para la dosis adicional de la primovacunación y, finalmente, los grupos de riesgo en los que se puede administrar una dosis de refuerzo con vacunas mono- o bivalentes en este otoño e invierno. |
-oOo-
Vacunas de la covid: resumen recomendaciones de la EMA y del Ministerio de Sanidad
A continuación, se presentan varias tablas que resumen la situación actual de las vacunas contra la covid. Por una parte, la relación de las vacunas aprobadas y en proceso de evaluación, con algunas de las características de cada una de ella. Y, por la otra, las recomendaciones actuales del Ministerio de Sanidad sobre el uso de estas vacunas en España.
Se muestran, por tanto, dos facetas de las disposiciones oficiales relativas a estos productos. El punto de vista de las agencias regulatorias, la EMA a nivel de la Unión Europea y la AEMPS a nivel español, y el de las autoridades de salud pública y sanitarias, representadas aquí por el Ministerio de Sanidad. Falta el punto de vista de las autoridades de salud pública de las comunidades autónomas, que son las que, en última instancia, determinan los detalles de la aplicación de los programas de vacunación en cada territorio, pero que por su complejidad y variabilidad (17 comunidades y dos ciudades autónomas con bajo grado de coordinación real) no puede ser contemplado en esta nota.
Las funciones de las agencias regulatorias (EMA y AEMPS) y de las autoridades de salud pública y sanitarias están delimitadas:
- Las agencias regulatorias establecen el marco general del uso de los productos sanitarios, basándose exclusivamente en los datos que les presentan sus promotores y fabricantes y los que proporcionan otros estudios independientes. Las fichas técnicas recogen las estipulaciones que cuentan con evidencias científicas suficientes. Por decirlo en un lenguaje informal: marcan qué productos pueden comercializarse y lo que puede hacerse con ellos en base a los datos objetivos disponibles.
- Las autoridades de salud pública y sanitarias, por el otro lado, determinan qué productos y cómo deben utilizarse en sus respectivos territorios, atendiendo a las necesidades propias. En lenguaje informal: señalan lo que debe hacerse y a quién aplicarlas. En determinadas circunstancias, y de forma debidamente justificada, pueden establecer formas de uso de los fármacos que desborden, en algún aspecto, los límites establecidos por las agencias regulatorias en las fichas técnicas. Y ello, atendiendo a circunstancias específicas relacionadas con la epidemiología de la enfermedad implicada, y los condicionantes concretos en un territorio y momento determinado.
Por último, hay que señalar que los resúmenes presentados están enfocados a los usos de estas vacunas en la población pediátrica, niños y adolescentes.
[volver al principio]
Vacunas de la covid aprobadas por la EMA
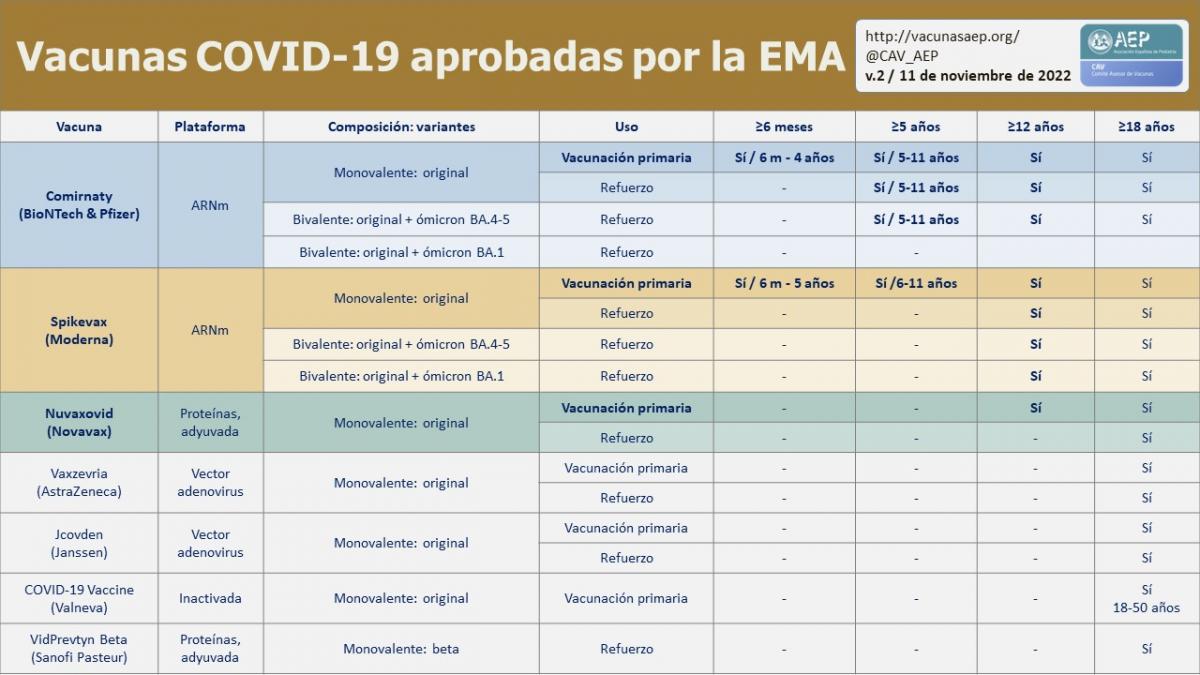
La European Medicines Agency (EMA) ha publicado un cuadro resumen que muestra todas las vacunas autorizadas en la Unión Europea y sus uso e indicaciones aprobadas (ver imagen de arriba, basaba en el resumen de la EMA).
Las vacunas aprobadas por la Comisión Europea son once (ver imagen de arriba): Comirnaty, Comirnaty Original/Omicron BA.1 y Comirnaty Original/Omicron BA.4-5 (BioNTech & Pfizer); Spikevax, Spikevax bivalent Original/Omicron BA.1 y Spikevax bivalent Original/Omicron BA.4-5 (Moderna); Vaxzevria (AstraZeneca); Jcovden (Janssen); Nuvaxovid (Novavax); COVID-19 Vaccine Valneva; y VidPrevTyn Beta (Sanofi Pasteur).
Además, otros productos se encuentran en fase de evaluación por parte de la EMA:
- El fabricante de otro producto ha presentado una solicitud de autorización, que actualmente está en espera de decisión: Skycovion (SK Chemicals GmbH) en agosto de 2022.
- Otras tres vacunas se encuentran en la fase de estudio y seguimiento previo ("rolling review") a la evaluación de una eventual solicitud de autorización: 1) Sputnik V, Gam-COVID-Vac (Gamaleya Institute); 2) COVID-19 Vaccine HIPRA (PHH-1V) (HIPRA Human Health S.L.U.); y 3) COVID-19 Vaccine (Vero Cell) Inactivated (Sinovac).
- Finalmente, un producto ha sido retirado cuando estaba siendo seguido mediante "rolling review": CVnCov (CureVac AG).
Estado regulatorio: de las once vacunas aprobadas, citadas antes, las de BioNTech & Pfizer, Moderna, AstraZeneca, Valneva y Sanofi Pasteur han recibido, en octubre y noviembre de 2022, una autorización de comercialización estándar, mientras que las de Janssen y Novavax aún mantienen el estatus de "autorización condicionada" con renovación anual.
[volver al principio]
Recomendaciones del Ministerio de Sanidad
Comirnaty (Pfizer & BioNTech)
[volver al principio]
Spikevax (Moderna)
[volver al principio]
Nuvaxovid (Novavax)
[volver al principio]
Condiciones de alto riesgo (dosis adicionales en la primovacunación)
[volver al principio]
Condiciones de riesgo para la aplicación de una dosis de refuerzo en el otoño de 2022
[volver al principio]
Fuentes de información del Ministerio de Sanidad y Andavac (Andalucía)
En la web del Ministerio de Sanidad dedicada a las vacunas y programas de vacunación, la parte que contiene los documentos técnicos dirigidos a los profesionales (Vacunación COVID-19, para profesionales):
- Guías técnicas de las vacunas (fechas de actualización consultadas: Comirnaty: 6 de septiembre de 2022; Spikevax: 6 de septiembre; Nuvaxovid 11 de julio).
- Guía para personal sanitario sobre vacunación frente a COVID-19 en otoño. Estrategia de Vacunación frente a COVID-19 (18 de octubre de 2022).
- Recomendaciones de vacunación frente a COVID-19 para el otoño en España (22 de septiembre de 2022).
- Guía sobre utilización de vacunas para personal sanitario. Estrategia de Vacunación frente a COVID-19 (26 de julio de 2022).
- Tabla resumen Vacunación COVID-19 (12 de julio de 2022).
En otra parte de la web se muestran, entre otros documentos, la evolución de la vacunación en España, con informes semanales.
Por parte de Andavac (proyecto del Plan Estratégico de Vacunaciones de la Consejería de Salud y Familias de Andalucía, apoyado por la Escuela Andaluza de Salud Pública), pueden consultarse:
- Vacunación covid, novedades.
- Vacunación frente a la covid de los niños de 5-11 años.
- Vacunación covid: información para profesionales.
[volver al principio]
-oOo-
Más información
- Fichas técnicas de las vacunas de la covid.
- CAV-AEP. Otras noticias sobre el SARS-CoV-2 y sus vacunas en esta web.
Otras referencias
- Burger L. German Panel Recommends COVID Shot Only for At-Risk Youngsters. Medscape, 18 de noviembre de 2022.
Historial de actualizaciones
- 13 de noviembre de 2022. Se ha actualizado la información referida a la EMA: aprobación de una nueva vacuna (VidPrevtyn, Sanofi Pasteur) y la ampliación de la indicación de Comirnaty (bivalente original + ómicron BA.4-5) como dosis de refuerzo en niños de 5-11 años. Estos cambios no han sido traspasados aún por el Ministerio de Sanidad a sus recomendaciones.
[volver al principio]