La FDA aprueba la vacuna de Janssen frente a la covid
Fecha de actualización: 2 de marzo de 2021
Ayer 27/feb de 2021, la FDA estadounidense ha aprobado la tercera vacuna frente a la covid, COVID-19 Janssen, después de las de Pfizer/BioNTech y Moderna. Es la primera vacuna basada en vector viral aprobada en EE. UU. La aprobación es de la modalidad de "aprobación de emergencia" (EUA, emergency use authorization).
La EMA recibió la solicitud de autorización de esta vacuna el pasado 16/feb de 2021, y tiene previsto examinar esta vacuna en el mes de marzo, por lo que podría ser la cuarta vacuna de la covid aprobada en el Unión Europea (UE). Sin embargo, según se ha publicado ayer en La Vanguardia, la compañía Johnson&Johnson ha anunciado que no suministrará los 200 millones de dosis en los plazos acordados con la UE (de los cuales corrrespondería un 10 % a España), con lo que el objetivo de vacunación antes del verano 70 % de la población en España queda comprometido.
A continuación se presenta una breve reseña del producto, a partir de la documentación de la FDA:
- Nota de prensa, 27/feb de 2021.
- VRBPAC. FDA Briefing Document. Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19 (PDF, 62 páginas).
- Información para profesionales (PDF, 23 páginas), información para la población (PDF, 6 páginas).
Vacuna COVID-19 Janssen
 Promotor / fabricante: Janssen (Johnson&Johnson). Este fabricante tiene ya una experiencia relevante en el campo de las vacunas de vectores virales (por ej. la vacuna del ébola Zabdeno, aprobada por la EMA en 2020).
Promotor / fabricante: Janssen (Johnson&Johnson). Este fabricante tiene ya una experiencia relevante en el campo de las vacunas de vectores virales (por ej. la vacuna del ébola Zabdeno, aprobada por la EMA en 2020).
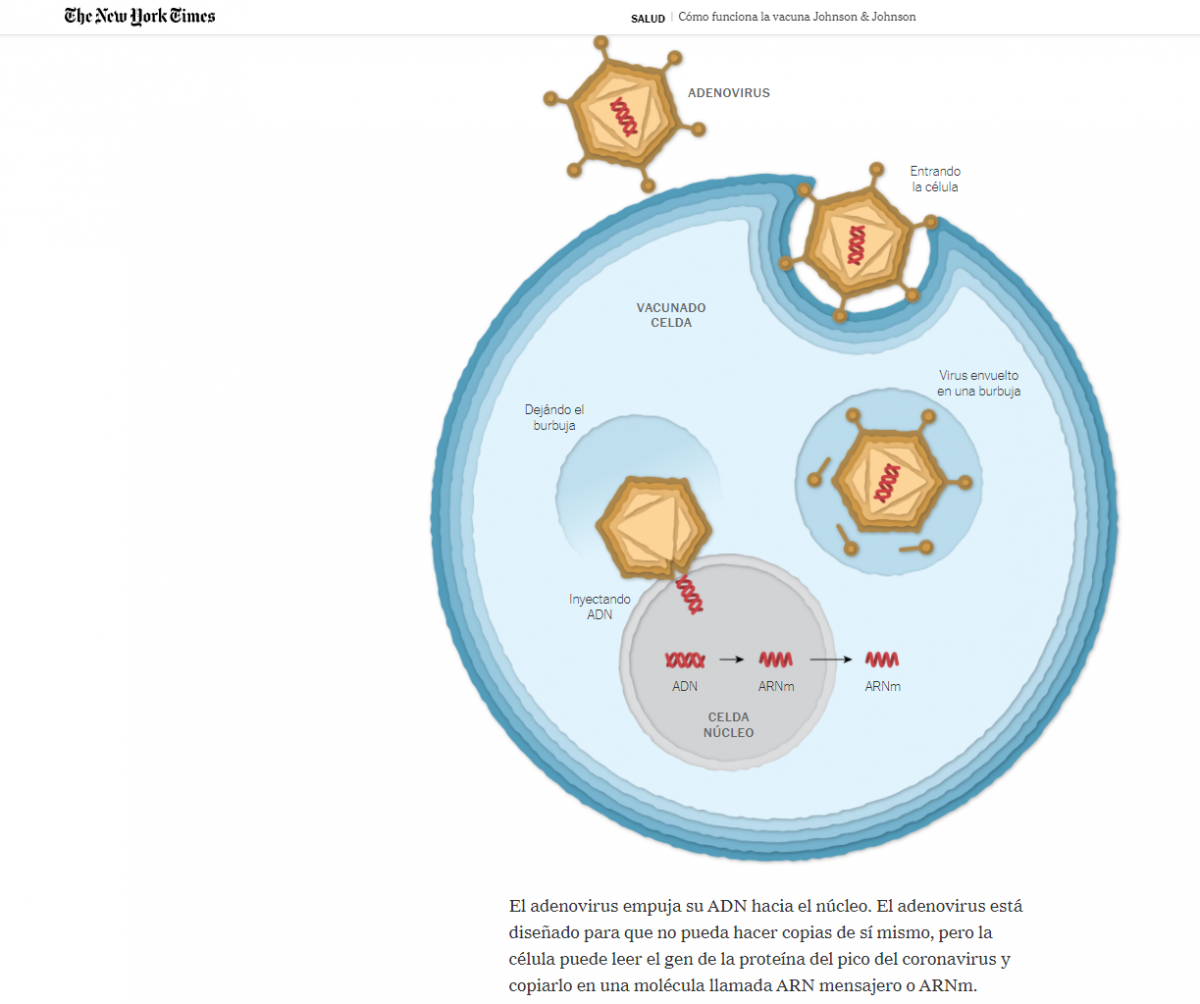
Mecanismo de acción: la vacuna Ad26.COV2.S contiene un adenovirus humano (Ad26) sin capacidad de replicación, en cuyo ADN se han insertado las instrucciones para codificar la proteína S del SARS-CoV-2 (ver la imagen adjunta extraída del New York Times, 27/feb de 2021).
Estudio en fase 3 (ENSEMBLE)
Los datos referidos a este estudio solo han sido publicados a través de una nota de prensa del propio fabricante (estudio ENSEMBLE, nota de prensa, 29/ene de 2021), y de la información utilizada por la FDA en el proceso de su evaluación previa a la autorización.
La FDA ha examinado la información proporcionada por el fabricante, de cuyos datos destacan, muy resumidamente:
- Localización: América del Sur, México, EE. UU. y Suráfrica.
- Participantes 43.783 (21.895 vacuna y 21.888 placebo con suero salino).
- Participantes finalmente evaluados: 19.630 vacuna y 19.691 placebo. De los vacunados: 19,5 % ≥65 años y 3,7 % ≥75 años.
- 8 semanas de seguimiento.
Resultados
| Eficacia clínica (casos en grupo de vacuna / casos en grupo de placebo) | ||
|---|---|---|
| A 14 días | A 28 días | |
| Enfermedad moderada-grave | 67 % (116/348) | 66,1 % (66/193) |
| 72 % en EE. UU., 66 % en América Latina, y 57 % en Suráfrica donde la variante B.1.351 es predominante | ||
| Enfermedad grave | 77 % (14/60) | 85 % (5/34) |
| Hospitalización | 93,1 % (2/29) (IC 95 %: 71,1-98,4 %) | 100 % (0/16) (74m3-100 %) |
| Muerte | 75 % (0/7) (33,4-90,6 %) | |
| Infección asintomática | 74,2 % (0,7% / 2,8 %) (IC 95 %: 47,1-88,6 %) a los 71 días de la vacunación | |
Pauta vacunal: una sola dosis de 0,5 ml (5x1010 partículas virales), IM.
Reactogenicidad
- Fiebre 9 % (grado 3: 0,2 %), mayor en el grupo de 18-59 años que en los mayores de 60 años.
- Ningún caso de anafilaxia.
- Eventos graves más frecuentes en el grupo placebo.
Conservación
- Congelado a -20 ºC estable.
- Vial sin abrir: +2 a +8 ºC hasta 3 meses (hasta 6 horas con 9-25 ºC).
- Vial abierto: +2 a +8 ºC hasta 6 horas (hasta 2 horas con 9-25 ºC).
Otros estudios en marcha
- Adolescentes 12-17 años de edad.
- 2.ª dosis (ENSEMBLE 2, 30 000 participantes).
Otros datos
Según datos de UNICEF:
- Coste estimado (dólares EE. UU.): UE 8,5, y en EE. UU y África 10.
- Aprobada ya en: Barein, 25/feb de 2021.
-oOo-
Más información
- Oliver SE, et al. The Advisory Committee on Immunization Practices’ Interim Recommendation for Use of Janssen COVID-19 Vaccine — United States, February 2021. MMWR Morb Mortal Wkly Rep. 2021, 2/mar. DOI:10.15585/mmwr.mm7009e4.
- Johnson&Johnson, nota de prensa del 27/feb de 2021.
- FDA, todas las vacunas de la covid.
- CIDRAP, 27/feb de 2021. FDA authorizes J&J 1-dose COVID vaccine.
- CIDRAP, 26/feb de 2021. FDA panel recommends J&J COVID vaccine for emergency use.
- Johnson&Johnson, nota de prensa del 26/feb de 2021. Single-Shot COVID-19 Vaccine Candidate Unanimously Recommended for Emergency Use Authorization by U.S. FDA Advisory Committee. Vote based on totality of scientific evidence provided by the Company including safety and efficacy data.
- The Medical Letter, 17/feb de 2021.
- EMA, 16/feb de 2021. EMA receives application for conditional marketing authorisation of COVID-19 Vaccine Janssen.
- Sadoff J, et al. Interim Results of a Phase 1-2a Trial of Ad26.COV2.S Covid-19 Vaccine. N Engl J Med. 2021, 13/jan. DOI: 10.1056/NEJMoa2034201.
Otras referencias
- Ledford H. J&J’s single-dose COVID vaccine raises hopes for faster rollout. US regulators have authorized Johnson & Johnson’s vaccine - which does not require a booster shot, and could simplify the logistics of mass vaccination. Nature News. 2021, 1/mar. DOI:10.1038/d41586-021-00526-w.
- Ledford H. J&J’s one-shot COVID vaccine offers hope for faster protection. But vaccine shows reduced protection against one fast-spreading coronavirus variant. Nature News. 2021, 29/ene: DOI:10.1038/d41586-021-00119-7.
- 2/mar de 2021. Se añade información contenida en la recomen daciones preliminares del ACIP (MMWR).