Vacunas de la COVID-19: hasta ahora resultados predecibles, lo cual es una buena noticia
Seguir y mantenerse al día de los pormenores del desarrollo de la investigación de las nuevas vacunas frente a la COVID-19 por el virus SARS-CoV-2 es ya una tarea imposible, un objetivo inabarcable por la extensión, variedad y velocidad de la investigación en curso. En este texto se pretende presentar un extracto de los resultados contrastados de la investigación clínica de los candidatos a vacuna, es decir, de los resultados publicados en medios científicos acreditados, acompañados de algunas pocas cifras seleccionadas para ubicarlo en un contexto general.
Situación general de la pandemia
Fuentes de información oficial:
- Mundo. Fuente: WHO Coronavirus Disease (COVID-19) Dashboard (fecha: 19/agosto de 2020). Casos confirmados 21.989.366, muertes 775.893.
- Europa. Fuente: ECDC. COVID-19 pandemic (fecha: 19/agosto de 2020). Casos confirmados 1.962.958, muertes 179.963.
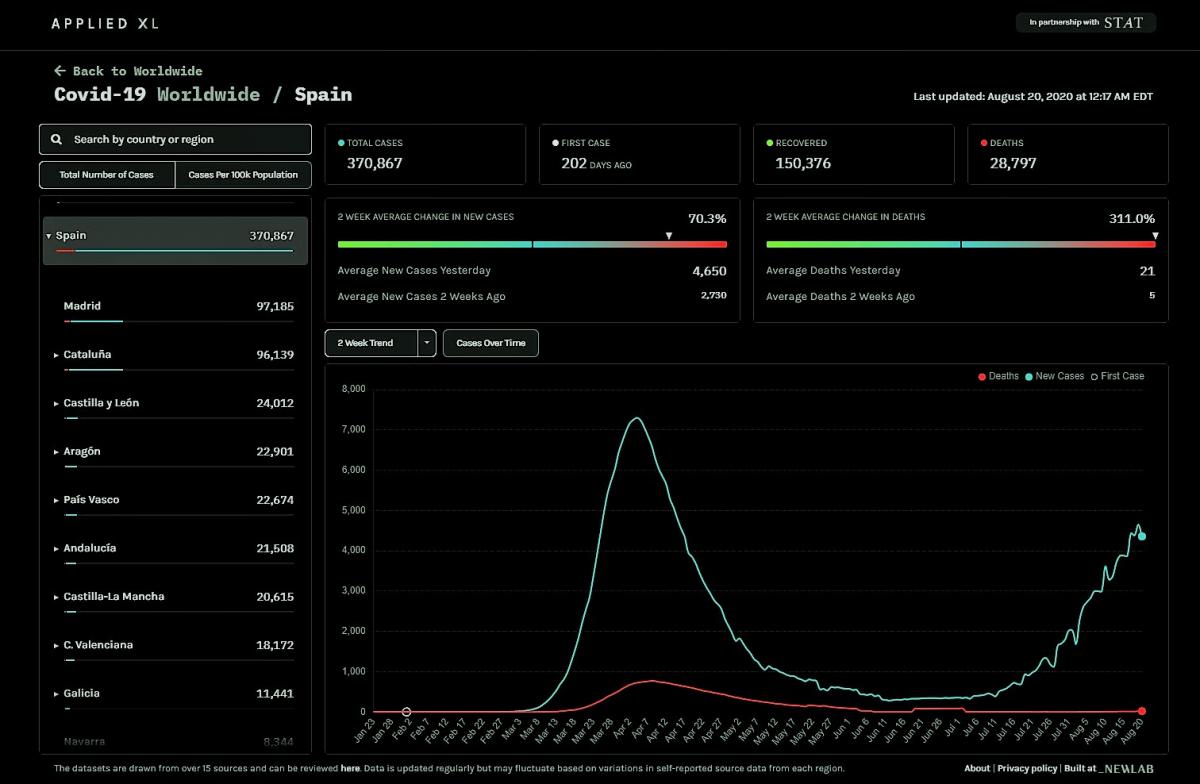 España. Fuente: Ministerio de Sanidad (fecha: 19/agosto de 2020). Casos confirmados 370.867, muertes 28.797.
España. Fuente: Ministerio de Sanidad (fecha: 19/agosto de 2020). Casos confirmados 370.867, muertes 28.797.
Otras fuentes:
- Johns Hopkins University of Medicine. Coronavirus Resource Center.
- Stat. The COVID-19 Tracker.
Panorama general de la investigación en vacunas del COVID-19 a fecha del 19 de agosto de 2020
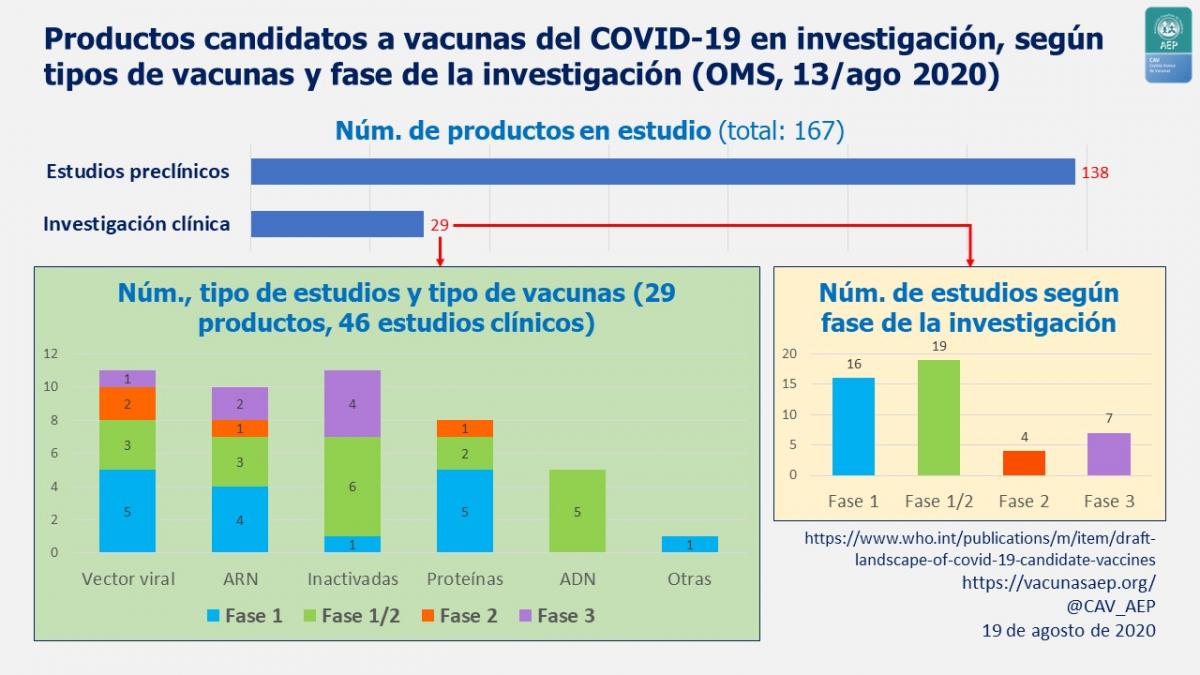
Productos candidatos a vacuna en investigación
Fuentes:
- OMS. WHO, Draft landscape of COVID-19 candidate vaccines (actualización: 13 de agosto de 2020).
- The New York Times. Coronavirus vaccines tracker.
Investigación española
En el listado de la OMS citado antes se encuentran 5 productos en investigación en España en fase de investigación preclínica.
Según el Ministerio de Ciencia e Innovación son 17 los proyectos de investigación españoles financiados por distintas fuentes públicas. De estos, todos en investigación preclínica, los 5 productos cuya investigación se encuentra más avanzada son (A. Hernando, Agencia Sinc, 27 de julio de 2020):
- Vector viral: variante atenuada de un virus vaccinia modificado Ankara (MVA) (Mariano Esteban, Centro Nacional de Biotecnología, CNB-CSIC).
- ADN recombinante (Vicente Larraga, Centro de Investigaciones Biológicas, CIB-CSIC).
- Replicones de ARN (Luis Enjuanes e Isabel Sola, Centro Nacional de Biotecnología, CNB-CSIC).
- Vector viral: virus vaccinia no replicante (Rafael Blasco, Instituto Nacional de Investigaciones Agronómicas, INIA, Ministerio de Ciencia e Innovación).
- Vector viral: lentivirus a partir del VIH (David Escors, Navarrabiomed).
Resultados publicados
Hasta la fecha se han publicado resultados de 7 estudios en fases 1, 1/2 y 2 (ver imagen de arriba), que, ordenados por tipos de vacunas, se muestran a continuación.
Vacunas basadas en un vector viral no replicante
- Fase 1. Adenovirus humano tipo 5 (Ad5). Zhu FC, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet. 2020;395:1845-54.
- Fase 1/2. Adenovirus de chimpancé ChAdOx1. Folegatti PM, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020;396(10249):467-78. (ver comentarios a este artículo en esta web).
- Fase 2. Adenovirus humano tipo 5 (Ad5). Zhu FC, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020;396(10249):479-88.
 Vacunas basadas en ARMm
Vacunas basadas en ARMm
- Fase 1. ARNm encapsulado en VLP (mRNA-1273). Jackson LA, et al. An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. NEJM. 2020, 14/jul. doi:10.1056/NEJMoa2022483.
- Fase 1/2. ARNm encapsulado en manoparatículas VLP (BNT162). Sahin U, et al. Concurrent human antibody and TH1 type T-cell responses elicited by a COVID-19 RNA vaccine. MedRxiv. 2020, 20/jul. doi:10.1101/2020.07.17.20140533 (publicación en formato preprint).
- Fase 1/2. ARNm encapsulado en manoparatículas VLP (BNT162b). Mulligan MJ, et al. Phase 1/2 study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 2020, 12/ago. doi:10.1038/s41586-020-2639
Vacuna inactivada
- Fase 1/2. Vacuna inactivada adyuvada con aluminio (WIV04). Xia S, et al. Effect of an inactivated vaccine against SARS-CoV-2 on safety and immunogenicity outcomes. Interim analysis of 2 randomized clinical trials. JAMA. 2020, 13/ago. doi:10.1001/jama.2020.15543.
La carrera por una vacuna de la COVID-19 ya no es solo una carrera por una vacuna
La carrera por una vacuna de la COVID-19 ya no es solo una carrera por una vacuna. Es también un reto industrial y económico, con empresas jugándose un puesto preferente en un escenario con elevada competitividad y riesgos económicos. Y también un nuevo escenario del complejo juego de las fuerzas geopolíticas que se disputan el papel de principal actor en el mundo (casos de EE. UU., China y Rusia, mientras la Unión Europea, con una propuesta política menos robusta, busca defenderse de los grandes y afianzar un puesto digno). Sin olvidar el impacto (interferencias) de las batallas políticas domésticas en la investigación (caso de D. Trump, presidente norteamericano, ante las elecciones presidenciales en el próximo noviembre).
 El pasado 11 de agosto el presidente ruso, V. Putin, anunció que la agencia reguladora de su país había aprobado una vacuna contra la COVID-19 (El Confidencial, Agencia Sinc y Science, 11 de agosto de 2020). El producto, desarrollado por el Instituto de Investigación de Epidemiología y Microbiología Gamaleya en Moscú, contiene dos componentes (ambos, vectores virales), administrados secuencialmente, uno con un adenovirus humano tipo 26 (Ad26) y el otro con otro adenovirus (Ad5). Apenas se conocen detalles técnicos más allá de los registros en ClinicalTrials.gov (NCT04437875 y NCT04436471); según declaraciones de las autoridades rusas, habrían superado los estudios en fase 1 y 2, pero no se han mostrado, y menos publicado, detalles de los resultados. También, según fuentes oficiales, la presunta vacuna aprobada está destinada inicialmente a solo determinados grupos de población más vulnerables. El anuncio y la aprobación de este producto (llamado, para más inri, Sputnik V, recordando la hazaña del lanzamiento espacial del Sputnik-1 en 1957), del que se supone que ha comenzado estudios en fase 3, se ha calificado de imprudente y temerario, pues no ha completado los estudios considerados imprescindibles, y si fracasa comprometerá no solo a la población rusa vacunada sino también la confianza global en las vacunaciones y la ciencia en general en el mundo entero (Nature. 2020;584:334-5).
El pasado 11 de agosto el presidente ruso, V. Putin, anunció que la agencia reguladora de su país había aprobado una vacuna contra la COVID-19 (El Confidencial, Agencia Sinc y Science, 11 de agosto de 2020). El producto, desarrollado por el Instituto de Investigación de Epidemiología y Microbiología Gamaleya en Moscú, contiene dos componentes (ambos, vectores virales), administrados secuencialmente, uno con un adenovirus humano tipo 26 (Ad26) y el otro con otro adenovirus (Ad5). Apenas se conocen detalles técnicos más allá de los registros en ClinicalTrials.gov (NCT04437875 y NCT04436471); según declaraciones de las autoridades rusas, habrían superado los estudios en fase 1 y 2, pero no se han mostrado, y menos publicado, detalles de los resultados. También, según fuentes oficiales, la presunta vacuna aprobada está destinada inicialmente a solo determinados grupos de población más vulnerables. El anuncio y la aprobación de este producto (llamado, para más inri, Sputnik V, recordando la hazaña del lanzamiento espacial del Sputnik-1 en 1957), del que se supone que ha comenzado estudios en fase 3, se ha calificado de imprudente y temerario, pues no ha completado los estudios considerados imprescindibles, y si fracasa comprometerá no solo a la población rusa vacunada sino también la confianza global en las vacunaciones y la ciencia en general en el mundo entero (Nature. 2020;584:334-5).
Separando el grano de la paja
Las perspectivas, según los resultados mostrados por las publicaciones mencionadas antes, son optimistas (Lancet. 2020;396(10249):448-9), pero en realidad lo único conseguido hasta ahora es demostrar que los candidatos en estudio tienen un perfil de seguridad aceptable y provocan una respuesta con anticuerpos neutralizantes de forma rápida, pero aún no se sabe si esta respuesta es suficiente y cuánto tiempo se mantendría, es decir, aún no se sabe si funcionarán (Nature. 2020;583:669-70).
Por lo sabido de la inmunología de los coronavirus en general y del SARS-CoV-2 en particular, los resultados publicados hasta ahora eran predecibles, lo cual es, en cierto modo, una buena noticia, pues podrían estar anticipando unos resultados finales favorables (Nature. 2020, 17 de agosto. doi:10.1038/d41586-020-02400-7).
Otro aspecto no cubierto por los estudios publicados hasta ahora es el uso de las vacunas en grupos poblacionales especiales, tradicionalmente apartados de los estudios iniciales de casi cualquier fármaco; son los niños, las embarazadas y mujeres lactantes, las personas de edad avanzada y las que padecen algunas condiciones crónicas. Estas poblaciones han estado expresamente excluidas en los estudios publicados. Otros estudios en fase 2 y 3 en curso incluyen a algunas de estas personas: por ej. con la vacuna AZD1222/ChAdOx1 de la Universidad de Oxford se estudia en niños de 5-12 años y personas con >56 años de edad (NCT04400838), personas con VIH (NCT04444674), etc. (H. Branswell. STAT, 19 de agosto de 2020).
-oOo-
Más información:
- Callaway E. The race for coronavirus vaccines: a graphical guide. Eight ways in which scientists hope to provide immunity to SARS-CoV-2. Nature. 2020;580:576-7.
- Iannelli V. About That Russian COVID-19 Vaccine... Vaxopedia, 12 de agosto de 2020.
- Quinn K, et al. COVID-19: Problemas y riesgos de la vacuna rusa ‘Sputnik V’. The Conversation, 14 de agosto de 2020.
- Otras noticias anteriores sobre el SARS-CoV-2 y la COVID-19 y sus vacunas en esta web.
Otras referencias:
- Logunov DY, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 2020, september 04. DOI:10.1016/S0140-6736(20)31866-3.
- Abbasi J. COVID-19 and mRNA Vaccines—First Large Test for a New Approach. JAMA. 2020, september 3. doi:10.1001/jama.2020.16866.
- Keech C, et al. Phase 1–2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. NEJM. 2020, 2 de septiembre. DOI:10.1056/NEJMoa2026920. Nota de prensa de Novavax, 4 de agosto de 2020 a propósito de MedRxiv. 2020, 6 de agosto. doi:/10.1101/2020.08.05.20168435
- Avorn J, et al. Regulatory Decision-making on COVID-19 Vaccines During a Public Health Emergency. JAMA. 2020, 31 de agosto:doi:10.1001/jama.2020.17101.
- Walsh EE, et al. RNA-Based COVID-19 Vaccine BNT162b2 Selected for a Pivotal Efficacy Study. MedRxiv. 2020, 20 de agosto. doi:/10.1101/2020.08.17.20176651. Comentario de D. Lowe en Sciencemag, 20 de agosto de 20202. Nota de prensa de Pfizer&BionTech, 20 de agosto de 2020.
- Krause P, et al. COVID-19 vaccine trials should seek worthwhile efficacy. Lancet. 2020, 27 de agosto. doi:10.1016/S0140-6736(20)31821-3.
- Dashraath P, et al. COVID-19 vaccines and neglected pregnancy. Lancet. 2020, 27 de agosto. doi:10.1016/S0140-6736(20)31822-5.
- Soriano V. ¿Funcionarán las vacunas contra la COVID-19 si hay reinfecciones? The Consersation, 27 de agosto de 2020.
- Heath PT, et al. Inclusion of pregnant women in COVID-19 vaccine development. Lancet Infect Dis. 2020;20(9(:1007-8.
- Thorp HH. A dangerous rush for vaccines. Science. 2020:369(6506):885.
- Reuters. Exclusive: Nearly a Fifth of Enrollees in Pfizer, BioNTech COVID-19 Vaccine Study Are Black or Latino. The New York Times, 22 de agosto de 2020.
- M. Ansede, A. Galocha. La vacuna: el único camino de regreso a la vida anterior. El País, Ciencia, 31 de mayo de 2020.
- A. Galocha, N. Domínguez. Así infecta el coronavirus. El País, Ciencia, 11 de marzo de 2020.