Actualizado el 2 de enero de 2021
 [5]
[5]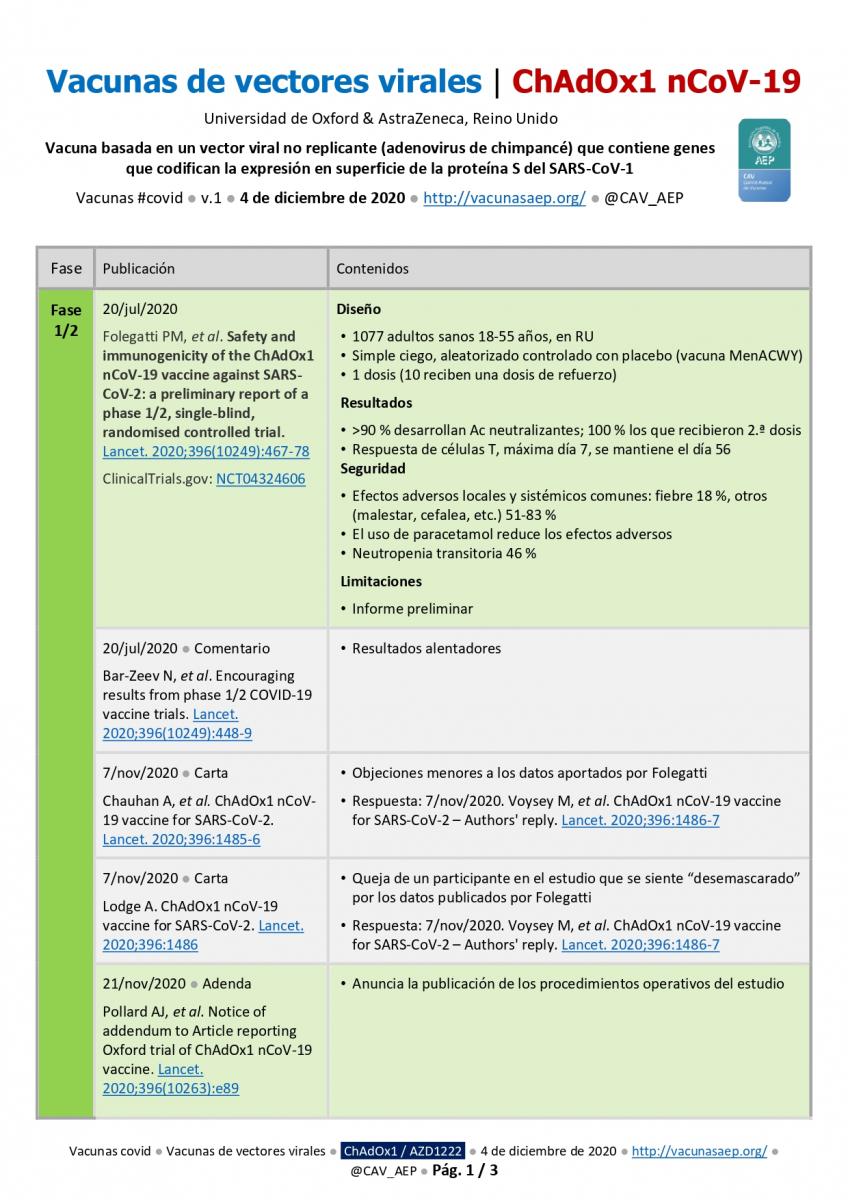 [6]Continuación del repaso a los datos más relevantes sobre el desarrollo y evaluación de las vacunas frente a la covid. Hace unos días ha sido la vacuna de Moderna [1] y la de BioNTech&Pfizer [2], ambas de ARN, y ahora es el caso la vacuna de vectores virales no replicantes de la Universidad de Oxford y AstraZeneca.
[6]Continuación del repaso a los datos más relevantes sobre el desarrollo y evaluación de las vacunas frente a la covid. Hace unos días ha sido la vacuna de Moderna [1] y la de BioNTech&Pfizer [2], ambas de ARN, y ahora es el caso la vacuna de vectores virales no replicantes de la Universidad de Oxford y AstraZeneca.
Vacunas de vectores virales: vacuna ChAdOx1 nCoV-19
- Desarrollada por la Universidad de Oxford y AstraZeneca, Reino Unido.
- Vacuna basada en un vector viral no replicante (adenovirus de chimpancé) que contiene genes que codifican la expresión en superficie de la proteína S del SARS-CoV-1.
Toda la información en una tabla (PDF, 3 páginas [6]).
Fase 1/2
 20 de julio de 2020 ● Folegatti PM, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020;396(10249):467-78 [7].
20 de julio de 2020 ● Folegatti PM, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020;396(10249):467-78 [7].
- Diseño: a) 1077 adultos sanos 18-55 años, en RU; b) Simple ciego, aleatorizado controlado con placebo (vacuna MenACWY); c) 1 dosis (10 reciben una dosis de refuerzo).
- Resultados: a) >90 % desarrollan Ac neutralizantes; 100 % los que recibieron 2.ª dosis; b) Respuesta de células T, máxima día 7, se mantiene el día 56.
- Seguridad: a) Efectos adversos locales y sistémicos comunes: fiebre 18 %, otros (malestar, cefalea, etc.) 51-83 %; b) El uso de paracetamol reduce los efectos adversos; c) Neutropenia transitoria 46 %.
- Limitaciones: a) Informe preliminar.
- ClinicalTrials.gov: NCT04324606 [8].
Comentarios y respuestas:
- 20 de julio de 2020 ● Comentarios ● Bar-Zeev N, et al. Encouraging results from phase 1/2 COVID-19 vaccine trials. Lancet. 2020;396(10249):448-9 [9]: resultados alentadores.
- 7 de noviembre de 2020 ● Carta ● Chauhan A, et al. ChAdOx1 nCoV-19 vaccine for SARS-CoV-2. Lancet. 2020;396:1485-6 [10]: objeciones menores a los datos aportados por Folegatti.
- 7 de noviembre de 2020 ● Carta ● Lodge A. ChAdOx1 nCoV-19 vaccine for SARS-CoV-2. Lancet. 2020;396:1486 [11]: queja de un participante en el estudio que se siente “desemascarado” por los datos publicados por Folegatti.
- 7 de noviembre de 2020 ● Respuesta ● Voysey M, et al. ChAdOx1 nCoV-19 vaccine for SARS-CoV-2 – Authors' reply. Lancet. 2020;396:1486-7 [12].
- 21 de noviembre de 2020 ● Adenda ● Pollard AJ, et al. Notice of addendum to Article reporting Oxford trial of ChAdOx1 nCoV-19 vaccine. Lancet. 2020;396(10263):e89 [13]: anuncia la publicación de los procedimientos operativos del estudio.
17 de diciembre de 2020 ● Ewer KJ, et al. T cell and antibody responses induced by a single dose of ChAdOx1 nCoV-19 (AZD1222) vaccine in a Phase 1/2 clinical trial. Nat Med. 2020, 17/dec. DOI: 10.1038/s41591-020-01194-5 [14].
- Explora la respuesta de participantes de 18-55 años hasta 8 semanas después de la 2.ª dosis.
- Comprueban respuesta celular CD4+ tipo Th1 y humoral a base de las subclases IgG1 e IgG3.
17 de diciembre de 2020 ● Barrett JR, et al. Phase 1/2 trial of SARS-CoV-2 vaccine ChAdOx1 nCoV-19 with a booster dose induces multifunctional antibody responses. Nat Med. 2020, 17/dec. DOI: 1038/s41591-020-01179-4 [15].
- Este estudio apoya el uso de una pauta de dos dosis.
Fase 2
 18 de noviembre de 2020 ● Ramasamy MN, et al. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial. Lancet. 2020;396/10267):1979-93 [16].
18 de noviembre de 2020 ● Ramasamy MN, et al. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial. Lancet. 2020;396/10267):1979-93 [16].
- Objetivo: a) Inmunogenicidad y tolerancia en las personas de más edad.
- Diseño: a) 560 participantes, edades 18-55, 56-69 y ≥70 años; b) Una o dos dosis, doble ciego, aleatorizado, placebo (vacuna MenACWY).
- Resultados: a) Inmunogenicidad similar; b) Los participantes de ≥70 años presentan mejor tolerancia.
Comentarios y respuestas:
- 18 de noviembre de 2020 ● Comentario ● Andrew MK, et al. Age and frailty in COVID-19 vaccine development. Lancet. 2020;396(10267):1942-4 [17]: se congratula de que se estudie específicamente la eficacia y seguridad en el sector de la población de mayor vulnerabilidad, la de mayor edad.
Fase 2/3
9 de septiembre de 2020 ● Noticia ● Phillips N, et al. A leading coronavirus vaccine trial is on hold: scientists react. Nature. 2020, 9 de septiembre [18] (sobre una noticia previa de STAT [19]). Suspensión temporal del estudio el 06/sep para revisar datos de seguridad por incidentes en un participante.
- Se ha notificado un caso de mielitis transversa en un participante.
- Los efectos adversos durante los ensayos son eventos relativamente frecuentes.
- Los científicos piden precaución en el análisis de l.os datos y en la interpretación de los mismos.
 12 de septiembre de 2020 ● Nota de prensa ● AstraZeneca [20] y Universidad de Oxford [21]. COVID-19 vaccine AZD1222 clinical trials resumed in the UK. Reanudación del estudio: la MHRA del RU ha comprobado que el incidente registrado no tiene relación con el estudio.
12 de septiembre de 2020 ● Nota de prensa ● AstraZeneca [20] y Universidad de Oxford [21]. COVID-19 vaccine AZD1222 clinical trials resumed in the UK. Reanudación del estudio: la MHRA del RU ha comprobado que el incidente registrado no tiene relación con el estudio.
17 de septiembre de 2020 ● Protocolo del estudio [22] en fase 3 en EE. UU.
21 de octubre de 2020 ● Noticia ● Reuters [23]. AstraZeneca COVID-19 vaccine trial Brazil volunteer dies, trial to continue. Un participante en Brasil fallece, pero estaba asignado al grupo placebo.
 23 de noviembre de 2020 ● Nota de prensa ● AstraZeneca [24]: AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19. Universidad de Oxford [25]: Oxford University breakthrough on global COVID-19 vaccine.
23 de noviembre de 2020 ● Nota de prensa ● AstraZeneca [24]: AZD1222 vaccine met primary efficacy endpoint in preventing COVID-19. Universidad de Oxford [25]: Oxford University breakthrough on global COVID-19 vaccine.
Análisis intermedio:
- Diseño: a) Más de 24 000 adultos sanos ≥18 años de edad, en RU, Brasil y Suráfrica; b) Pautas: 1.ª dosis con cantidad reducida (solo en RU), 2.ª dosis completa (n=2741); 2 dosis completas (n=8895); intervalo 1 mes; c) Placebo comparador: vacuna MenACWY o SSF; d) Conservación: entre +2 y +8 ºC.
- Resultados: a) 131 casos en ambos estudios; b) Eficacia vacunal: 62 % con 2 dosis completas, 90 % con media dosis inicial y segunda completa; EV combinada 70 % (p<0,0001).
- Seguridad: a) No efectos adversos graves.
- Limitaciones: a) Uso de media dosis por error de fabricación.
Comentarios y respuestas:
- 23 de noviembre de 2020 ● Opinión ● Calaway E. Why Oxford’s positive COVID vaccine results are puzzling scientists. Nature. 2020;588:16-8 [26]: a) Necesidad de explicaciones a los hallazgos del análisis intermedio; b) Hipótesis: la dosis baja estimularía más eficazmente la inmunidad celular; la dosis baja promovería menos inmunidad frente al virus vector.
- 25 de noviembre de 2020 ● Opinión ● Wired [27]. The AstraZeneca Covid Vaccine Data Isn't Up to Snuff: a) Comentarios y críticas; b) Objeciones a la metodología del estudio, a la información parcial ofrecida por AstraZeneca y a la gestión del error de fabricación que afectó a casi 3000 participantes en Brasil.
- 27 de noviembre de 2020 ● Opinión ● The New York Times [28]. Dudas y respuestas sobre la vacuna de AstraZeneca. Coste de la vacuna: 3-4 dólares/dosis.
 8 de diciembre de 2020 ● Voysey M, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2020, 8 de diciembre. DOI:10.1016/S0140-6736(20)32661-1 [29].
8 de diciembre de 2020 ● Voysey M, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2020, 8 de diciembre. DOI:10.1016/S0140-6736(20)32661-1 [29].
Publicación de los datos completos del primer análisis intermedio (publicado por AstraZeneca en 23/noviembre):
- Reune resultados de eficacia clínica procedentes de ECA en fase 3 en el Reino Unido y Brasil (11·636 personas), junto con datos de seguridad de un total de 23·745 participantes en 4 ensayos en el Reino Unido, Brasil y Sudáfrica.
- Eficacia, 14 días después de la 2.ª dosis:
- Datos combinados: 70,4 % (IC 95 %: 54,8-80,6 %). Casos 131, de ellos 30 en 5807 vacunados y 101 en 5829 participantes del grupo control.
- Participantes que recibieron dos dosis completas: 62,1 % (41-75,7 %). Casos 98, de ellos 27 en 4440 vacunados y 71 en el grupo control. Los datos procedentes de Brasil y RU fueron similares, lo que da fuerza a este hallago.
- Participantes que recibieron una 1.ª media dosis, seguido de una 2.ª dosis estándar completa: 90,0 % (67,4-97 %). Casos 33, de ellos 3 en 1367 vacunados y 30 en el grupo control. Estos participantes tenían todos menos de 55 años.
- Total casos: 131, de ellos 30 en vacunados y 101 en el grupo control.
- Del conjunto de participantes, el 82 % tenían una edad de 18-55 años.
- Datos de eficacia similar evaluados a 21 días después de la primera dosis, lo que sugiere que una única dosis proporciona alguna protección.
- Datos de seguridad en 23·745 participantes en las tres ubicaciones, con 3,4 meses de observación: 168 participantes notificaron 175 eventos graves, de los que solo 3 se estimaron como relacionados con el ECA (una anemia hemolítica en el grupo control y una mielitis transversa) y un caso más de fiebre elevada, pero aun no se sabe en qué grupo se encuentra). Todos se han recuperado.
- Datos de eficacia contra la transmisión de la infección, infección asintomática (6638 participantes en RU): en conjunto 69 casos, 29 en el grupo vacuna y 40 en el grupo control (eficacia 27 %). En el grupo de dosis baja / dosis estándar, hubo 7 casos en el grupo de vacuna y 17 en el grupo de control (eficacia del 59 %); en las personas que recibieron dos dosis estándar, hubo 22 casos en el grupo de la vacuna y 23 en el grupo de control (eficacia del 4 %).
Comentarios:
- Knoll MD, et al. Oxford–AstraZeneca COVID-19 vaccine efficacy. Lancet. 2020, 8 de diciembre. DOI:10.1016/S0140-6736(20)32623-4 [30].
- Ledford H. Oxford COVID-vaccine paper highlights lingering unknowns about results. Nature News. 8/dic, 2020 [31].
- La noticia en CIDRAP, 8 de diciembre de 2020 [32].
- Nota de prensa de Lancet en EurekAlert, 8 de diciembre de 2020 [33].
- Hilo en Twitter [34] de Lancet comentando los resultados publicados.
Aprobación de la vacuna
30 de diciembre de 2020 ● La Medicines and Healthcare products Regulatory Agency (MHRA) británica ha aprobado el 30/dic de 2020 la vacuna de Oxford y AstraZeneca [35], para su uso en personas de 18 o más años de edad en una pauta de 2 dosis, con un intervalo de 4-12 semanas entre ellas (ficha técnica [36]).
2 de enero de 2021 ● India aprueba la vacuna [37] de Oxford y AstraZeneca.
-oOo-
Más información
- CAV-AEP, 21 de julio de 2020 [38]. Las vacunas contra el SARS-CoV-2 (covid-19) basadas en vectores de adenovirus son seguras, bien toleradas e inmunógenas.
- CAV-AEP, 30 de noviembre de 2020. Vacunas contra la covid de ARN: mRNA-1273 de Moderna.
- CAV-AEP, 2 de diciembre de 2020. Vacunas contra la covid de ARN: BNT162b2 de BioNTech y Pfizer.
- Draft landscape of COVID-19 candidate vaccines. OMS, 2 de diciembre de 2020 [39].
- The Treatments and Vaccines Considered for COVID-19. The Medical Letter, 1 de diciembre de 2020 [40].
- CAV-AEP. Otras noticias sobre las vacunas de la covid en esta web [41].
- CAV-AEP, 18 de octubre de 2020 [42]. ¿Cómo seguir la evolución del desarrollo de las vacunas de la covid?
- Goodman JL, et al. Answering Key Questions About COVID-19 Vaccines. JAMA. 2020;324(20):2027-8 [43]. Traducción al español [44] por el Grupo de Trabajo COVID-19 de la Región de Murcia en APS.
