Capítulo 39 - Tosferina
- Puntos clave [1]
- Introducción [2]
- Epidemiología de la enfermedad [3]
- Tipos de vacunas, composición y presentación [4]
- Inmunogenicidad, eficacia y efectividad [5]
- Vías de administración [6]
- Indicaciones y esquemas de vacunación [7]
- Administración con otras vacunas y otros productos [8]
- Efectos adversos [9]
- Precauciones y contraindicaciones [10]
- Profilaxis posexposición [11]
11.1. Quimioprofilaxis posexposición de los contactos estrechos [12]
11.2. Vacunación posexposición de los contactos estrechos [13]
- Otras pautas de prevención [14]
- Bibliografía [15]
- Enlaces de interés [16]
- Historial de actualizaciones [17]
- Tablas y figuras incluidas en el capítulo:
Tabla 39.1. Características y composición de las vacunas con componente tosferina [18]
Tabla 39.2. Condiciones de conservación, reconstitución y aspecto de las vacunas con componente de la tosferina [19]
Figura 39.1. Progresión de las fases clínicas de la tosferina y momento óptimo para las pruebas diagnósticas [20]
Figura 39.2. Número de casos y tasas de tosferina en España desde 2009 hasta febrero de 2024 [21]
Figura 39.3. Incidencia y hospitalizaciones por 100 000 habitantes y cobertura vacunal de primovacunación (1998-2020) [22]
Figura 39.4. Hospitalizaciones por tosferina en menores de un año, por meses de edad y sexo. España 2005-2020 [23]
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Tosferina. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-39
⌂ [24]
1. Puntos clave
- La tosferina o pertussis es una infección respiratoria aguda altamente contagiosa, causada por Bordetella pertussis, que afecta a todos los grupos de edad.
- Actualmente, en los países occidentales, hay dos picos de edad bien definidos en los que se padece esta enfermedad: lactantes menores de 3-4 meses y adolescentes, con importante morbimortalidad en el primer grupo. También existe transmisión endémica en adultos
- El diagnóstico ha de sospecharse por la clínica. En todo paciente con tos en accesos, de predominio nocturno (no asma), de más de 14 días de duración debe incluirse la tosferina en el diagnóstico diferencial.
- En lactantes, sobre todo aquellos no vacunados o que solo han recibido alguna dosis de vacuna, el diagnóstico debe sospecharse antes. En esta edad puede incluso debutar con pausas de apnea con tos escasa o nula.
- La detección en exudado nasofaríngeo por PCR es la técnica más rápida, eficiente y útil para el diagnóstico de la enfermedad.
- Las vacunas frente a la tosferina utilizadas actualmente en España son vacunas inactivadas acelulares.
- La eficacia de las actuales vacunas acelulares de 2 o más componentes frente a tosferina se estima en el 85 % para prevenir cuadros típicos de tosferina.
- La efectividad vacunal a largo plazo ha sido menor de la esperada,debido en gran parte a que la duración de la protección de las vacunas acelulares no dura más de 10 años, y que aunque protegen frente a la enfermedad clínica, no interrumpen la circulación de Bordetella pertussis.
- La vacuna frente a la tosferina forma parte del calendario de vacunaciones sistemáticas de todas las comunidades autónomas de España. En España desde 2017, se administran 2 dosis en la primovacunación a los 2 y 4 meses, con un primer refuerzo a los 11 meses, aplicando vacunas hexavalentes (DTPa-HB-Hib-VPI), y otro refuerzo a los 6 años, preferiblemente con preparado de carga estándar de difteria, tétanos y tosferina combinado con componente de polio inactivada (DTPa-VPI). Asturias desde 2018 usa Tdpa-VPI. En la adolescencia, 12-14 años, el CAV de la AEP recomienda administrar una 5.ª dosis de refuerzo con Tdpa, en lugar de Td, con el fin de aumentar la protección del adulto joven susceptible que actúa como transmisor
- La dosis de los 6 años debería administrarse preferiblemente con preparados de carga antigénica estándar, en especial si no está prevista la administración de una dosis a los 12-14 años, además de contener componente de polio inactivada (DTPa-VPI).
- La mejor estrategia para proteger a los lactantes menores de 3 meses, grupo que padece la enfermedad más grave y el mayor número de hospitalizaciones y muertes, es la vacunación de la mujer embarazada a partir de la semana 27 de gestación, tal y como estableció el Ministerio de Sanidad en 2015. Se necesita desarrollar nuevas vacunas más efectivas, capaces de reducir la circulación de B. pertussis en la población.
⌂ [24]
2. Introducción
La tosferina o pertussis es una infección respiratoria aguda muy contagiosa, causada por Bordetella pertussis, que afecta a todos los grupos de edad, pero es especialmente grave en los 3 primeros meses de la vida, cuando el lactante no ha iniciado la vacunación frente a la enfermedad, o ha recibido solo una dosis de la vacuna. Bordetella parapertussis produce un cuadro similar, pero más leve. Otros microorganismos pueden dar lugar a cuadros de tos paroxística prolongada indistinguibles clínicamente de la tosferina.
La tosferina es endémica a nivel mundial y, a pesar de las altas tasas de vacunación, continúan produciéndose casos, generalmente a partir de adolescentes y adultos jóvenes cuya inmunidad, natural o adquirida, ha ido disminuyendo con el tiempo.
La fase catarral dura de 1 a 2 semanas. La fase de estado o paroxística, caracterizada por accesos de tos paroxística que pueden o no ir acompañados de estridor inspiratorio o "gallo", suele durar de 4 a 6 semanas. En recién nacidos y prematuros, la clínica puede caracterizarse por episodios de apnea y cianosis. En el lactante pequeño, las crisis de tos son más intensas. El 90 % de las hospitalizaciones se dan en niños menores de 1 año por presentar complicaciones como imposibilidad para realizar las tomas, apneas, sobreinfecciones respiratorias bacterianas, encefalopatía con convulsiones e incluso muerte súbita.
La letalidad se concentra sobre todo en los menores de 3 meses, en lactantes menores de 2 meses es de alrededor del 1 % y en los lactantes mayores del 0,5 %, ocurre por un cuadro conocido como tosferina maligna, en el que se produce un fallo cardiorrespiratorio con hipertensión pulmonar refractaria, asociada a shock cardiogénico y fallo multiorgánico.
El diagnóstico ha de sospecharse por la clínica. Toda tos, en accesos, de predominio nocturno (no asma), de más de 14 días de duración debe ser investigada por si se tratara de una tosferina. En los lactantes pequeños, el diagnóstico de sospecha debe realizarse antes, en cuanto se produzcan los típicos accesos de tos. En ocasiones, el cuadro se presenta con pausas de apnea.
Es necesario realizar un diagnóstico microbiológico rápido que permita la instauración precoz de un tratamiento antibiótico adecuado y de las medidas necesarias para evitar la transmisión. La confirmación diagnóstica puede hacerse mediante el aislamiento de B. pertussis a partir del cultivo de material obtenido por aspirado o frotis nasofaríngeo, técnica que, a pesar de su baja sensibilidad, sigue siendo considerada por la OMS de referencia para el diagnóstico.
Las técnicas de amplificación de ácidos nucleicos como la reacción en cadena de la polimerasa (PCR) o la amplificación isotérmica se han convertido en las herramientas diagnósticas más utilizadas debido a su rapidez y excelente sensibilidad, además, el resultado no depende de la viabilidad bacteriana, por lo que las bacterias pueden detectarse incluso en casos de tos persistente que dure más de tres semanas o después de que los pacientes hayan sido tratados con antibióticos. Actualmente hay pruebas disponibles pueden detectar no solo B. pertussis sino también diferenciar especies de Bordetella que causan una enfermedad similar, como B. parapertussis, B. bronchiseptica o la B. holmesii, que se ha asociado a grandes brotes.
La serología tiene sus limitaciones y su uso no se ha generalizado en nuestro medio, está indicada en estadios avanzados de la enfermedad donde tanto la PCR como los cultivos ofrecen menor sensibilidad. Ver figura 39.1 [20].
Figura 39.1. Progresión de las fases clínicas de la tosferina y momento óptimo para las pruebas diagnósticas.
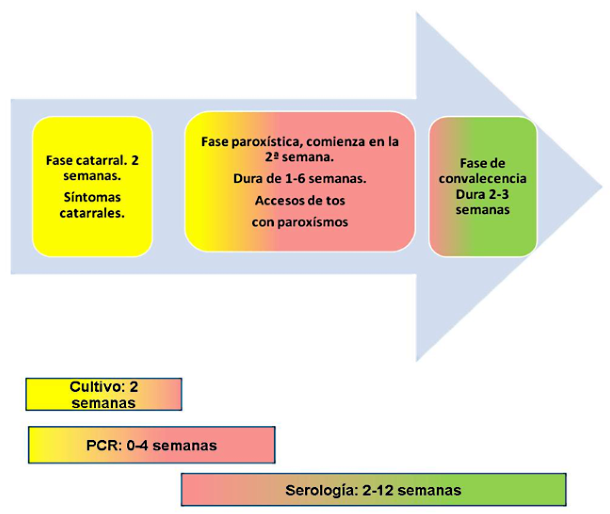
Modificado de CDC 2024.
⌂ [24]
3. Epidemiología de la enfermedad
La tosferina es una infección endémica con brotes epidémicos que ocurren cada 3-4 o más años. Los brotes afectan a todos los grupos de edad, siendo adolescentes y adultos los que actúan como principal fuente de transmisión de la enfermedad.
El reservorio de B. pertussis es exclusivamente humano. La tosferina es muy contagiosa con un número de reproducción básico (Ro) de 12-17 y una tasa de ataque de hasta el 90 % de los contactos domiciliarios no inmunes. La transmisión de la infección se produce por contacto estrecho con una persona infectada a través de gotitas aerosolizadas por la tos o contacto con las secreciones respiratorias. La máxima contagiosidad se produce durante el período catarral y las primeras 2 semanas de la fase paroxística, con un período de incubación de 7 a 20 días. La enfermedad es más frecuente en invierno y en primavera.
Aunque se considera que se diagnostican menos de la mitad de los casos, la disponibilidad de pruebas diagnósticas sencillas y rápidas, como la PCR, junto a la mejora de los sistemas de notificación de los casos, son factores que contribuyen a un mayor conocimiento de la epidemiología de esta enfermedad en la que destaca el incremento de casos en adolescentes y adultos jóvenes que han perdido la inmunidad y en los lactantes que no han iniciado o completado la vacunación. Un análisis realizado para conocer la carga de tosferina en adultos mayores de 50 años en Europa entre 2010-2020 muestra como la enfermedad sigue tendencias similares a las de los niños de 0 a 4 años, los datos muestran como las estrategias de vacunación actuales son insuficientes para disminuir la carga de la enfermedad en todos los grupos de edad y como a pesar de disponer de vacunas con una efectividad aceptable y de haber alcanzado elevadas coberturas vacunales, cada 2-5 años, de forma cíclica, se producen brotes en países de alto índice de desarrollo humano (IDH).
En las dos últimas décadas la incidencia de la tosferina se ha incrementado en todo el mundo, hasta el advenimiento de la pandemia COVID 19, siendo una de las enfermedades prevenibles por vacunación más prevalentes. Diferentes estudios han evidenciado la gran circulación de B. pertussis en todo el mundo, independientemente de los calendarios y de las coberturas de vacunación. Entre las razones que explican esta reemergencia están la evanescencia de la inmunidad que confieren tanto la enfermedad natural como la vacunación, la sustitución de las vacunas de células enteras por vacunas acelulares, menos reactógenas, pero que conllevan una protección de menor duración y que no aportan protección frente a la colonización y transmisión de la enfermedad. A todo ello se suma la aparición de cepas de Bordetella pertussis que escapan a la inmunidad conferida por la vacuna acelular, sobre todo las denominadas cepas pertactin-deficientes.
En España, la tipificación antigénica de las cepas de B. pertussis aisladas en los últimos 30 años ha confirmado que, tras la transición de las vacunas de células enteras a las acelulares, han surgido linajes bacterianos que producen antígenos vacunales diferentes a los contenidos en las vacunas actuales, como también se ha confirmado en los países vecinos. Por lo tanto, el control de la tosferina requiere nuevas vacunas que no solo protejan contra la enfermedad, sino que prevengan la infección y la transmisión. Se contemplan varios enfoques, incluidas vías de administración alternativas como la inmunización nasal, la mejora de las vacunas acelulares mediante la adición de más antígenos y adyuvantes, y el desarrollo de vacunas novedosas, como vacunas vivas atenuadas y vacunas de vesículas de membrana externa.
A partir de los primeros años del presente siglo se comenzó a constatar, en países con altas coberturas de vacunación un incremento de los casos de tosferina, en los lactantes menores de 1 año y, sobre todo, en los menores de 3 meses. En estos lactantes, aumentaron las hospitalizaciones por enfermedad grave y las muertes por la enfermedad. El análisis epidemiológico demostró que el reservorio de la enfermedad lo constituían sobre todo los adolescentes y adultos jóvenes, como consecuencia del debilitamiento progresivo de la inmunidad inducida por las vacunas acelulares (que en el mejor de los casos duraba 7-10 años). Estos adultos jóvenes no inmunes, adquirían la enfermedad a veces subclínica o con sintomatología difícil de reconocer y la transmitían a lactantes menores de 3 meses antes de que iniciaran la vacunación frente al la enfermedad o cuando en el mejor de los casos habían recibido sólo una dosis de la vacunas. Esto condujo al desarrollo de la estrategia de vacunación frente a tosferina en la mujer embarazada, práctica actualmente vigente en miuchos países.
La introducción de las vacunas de células enteras de Bordetella pertussis en la década de los 50 del siglo anterior, supuso una disminución marcada de los casos de tosferina en todo el mundo, aunque se ha mantenido las ondas epidémicas típicas de la enfermedad cada 3-5 años. Recientemente, en el segundo semestre 2023 y primeros meses de 2024, se ha producido un incremento de casos mundiales de tosferina. En Europa, se han registrado más de 25 000 casos de tosferina en 2023 y más de 32.000 de enero a marzo de 2024, cifras similares a las de 2016 y 2019. La mayor incidencia ha ocurrido en los menores de un año y en los adolescentes de 10-19 años. Desde enero de 2023 hasta abril de 2024, se ha producido 19 muertes, 11 en niños y 8 en mayores de 60 años. Las posibles causas de este rebrote son la falta de circulación de B. pertussis (con la pérdida concomitante del efecto refuerzo) y la caída de coberturas vacunales en los niños, como consecuencia de la pandemia COVID-19, así como la vacunación subóptima de la embarazada en algunos países.
En España, la tosferina es una enfermedad de declaración obligatoria numérica desde 1982 y de declaración individualizada a partir de 1996. Desde el año 2010 la tosferina se encuentra en una epidemia/pandemia sostenida (figura 39.2 [21]). En el informe publicado por el Centro Nacional de Epidemiología analizando el periodo 2005-2020, se recogen un total de 43 534 casos de tosferina, en este intervalo se han registrado 10 281 hospitalizaciones por tosferina, el 82, 7% en menores de 3 meses de vida, con 56 defunciones, todas en lactantes menores de tres meses. En el año 2015, el Ministerio de Sanidad, instó a las CC. AA. a iniciar la vacunación de la embrazada, a la 26-27 semana de gestación, con la vacuna Tdpa. Desde entonces, los casos de tosferina y las hospitalizaciones asociadas en niños menores de 3 meses de edad, han disminuido de forma marcada.
Figura 39.2. Número de casos y tasas de tosferina en España desde 2009 hasta febrero de 2024
En la figura 39.3 [22] se muestra la morbilidad declarada por tosferina en España durante el período 1998-2020 con las coberturas de vacunación y en la figura 39.4 [23] se muestran las hospitalizaciones de menores de 1 año de 2005 a 2020. Como en otros países, tras el paréntesis de los años de la pandemia de la COVID-19, también en España se ha producido en los últimos meses un incremento de la tosferina, hasta alcanzar unas tasas superiores a las del pico registrado en 2015. El grupo en el que más ha aumentado han sido el de los 10-14 años. En 2023 se registraron 2780 casos y desde enero al 11 de abril de 2024, 9785. Casi el 70 % de los casos se han producido en menores de 15 años, sobre todo en niños de 10-14 años, seguidos por los niños de 5-9 años. También se ha producido un acúmulo de casos entre 35-45 años. Se han producido 1 y 4 muertes en 2023 y 2024, respectivamente. Dos de las defunciones de 2024, han ocurrido en lactantes: uno de ellos de 3 meses de edad cuya madre no había sido vacunada en el embarazo; el otro ha sido un lactante de 2 meses hijo de una madre que recibió la vacuna de la tosferina 5 días antes del parto. Las otras dos defunciones ocurrieron en adultos de más de 70 años. Por ello, las acciones preventivas deben dirigirse fundamentalmente a proteger al grupo de los lactantes menores de 6 meses -el más vulnerable-, sobre todo con la vacunación de la embarazada, y a tratar de disminuir la incidencia en los adolescentes /adultos que actúan como reservorio y fuente de infección, siendo necesaria la dosis de tosferina en la adolescencia como promueve la AEP desde hace años.
Figura 39.3. Incidencia y hospitalizaciones por 100 000 habitantes y cobertura vacunal de primovacunación (1998-2020).
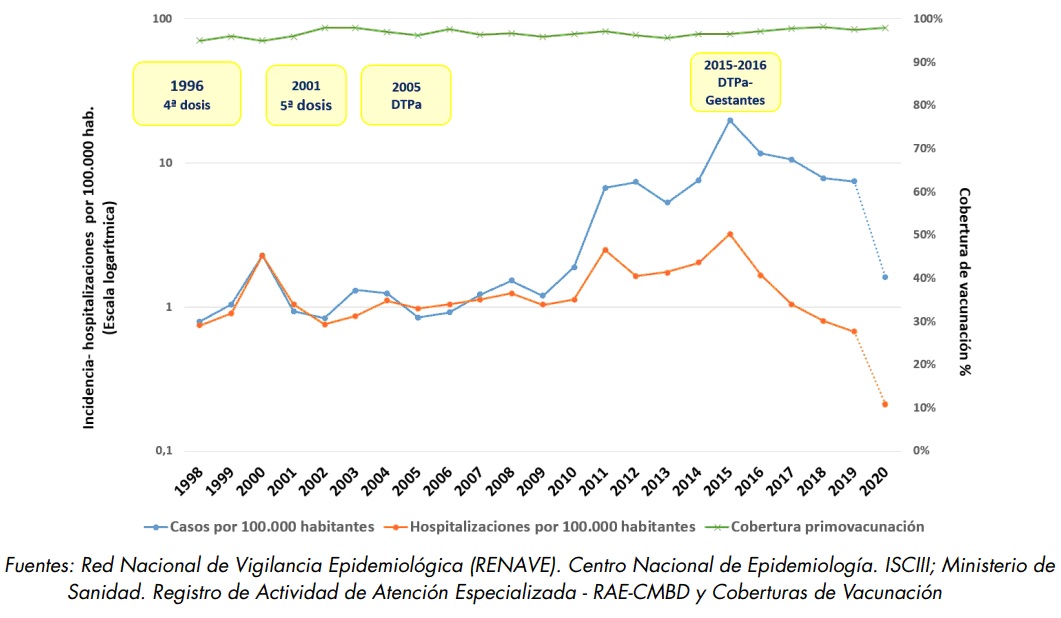
Figura. 39.4. Hospitalizaciones por tosferina en menores de un año, por meses de edad y sexo. España 2005-2020.

El bajo grado de sospecha clínica determina que la tosferina en adultos quede frecuentemente sin diagnosticar siendo la carga real de la enfermedad mayor de lo que indican los datos de vigilancia epidemiológica.
La persistencia de la tosferina, incluso en sociedades con coberturas muy altas de vacunación, se debe a múltiples factores. La duración de la inmunidad y la efectividad de las vacunas acelulares frente a la tosferina, son menores que las de las vacunas de células enteras. De hecho, una revisión sistemática ha demostrado que solo un 10 % de los sujetos es inmune a la enfermedad, a los 8,5 años de recibir la última dosis de una vacuna acelular. Este hecho se debe, en gran medida, a que la detoxificación de la toxina pertúsica se lleva a cabo, en la mayoría de las vacunas acelulares por métodos químicos, lo que conduce una pérdida de hasta un 80 % de sus epítopos. Por otra parte, desde hace varios años, han aparecido cepas de Bordetella pertussis deficientes en pertactina, probablemente por la presión selectiva de las vacunas acelulares, lo que ha resultado en una disminución de su efectividad. Por último, las vacunas acelulares, aunque protegen frente a la enfermedad, no influyen en la colonización nasofaríngea por B. pertussis, que se podría transmitir por infecciones asintomáticas.
A la luz de estos hechos, es evidente que se necesitan nuevas vacunas que induzcan una protección más duradera frente a la enfermedad y que además sean capaces de interrumpir la transmisión y circulación de B. pertussis.
En vías de desarrollo se encuentra una vacuna acelular monovalente –sin los toxoides diftérico y tetánico–, lo que permitiría administrar refuerzos periódicos frente a la tosferina, en la que la toxina pertúsica y la hemaglutinina filamentosa se han modificado mediante procedimientos genéticos: Esta vacuna induce respuestas inmunes significativamente más altas que las vacunas acelulares actuales. Otra vacuna de tosferina, la BPZE1, compuesta por B. pertussis viva a la que se ha atenuado por inactivación genética o retirada de sus toxinas, y que se administra por vía intranasal, ha demostrado que es capaz de evitar tanto la infección como la enfermedad en primates no humanos. En humanos, y a diferencia de las vacunas acelulares actuales, induce respuestas IgA específicas potentes.
⌂ [24]
4. Tipos de vacunas, composición y presentación
En España, las vacunas acelulares inactivadas (DTPa) se comercializan desde 1998, y han ido sustituyendo progresivamente a las vacunas de células enteras combinadas con los toxoides tetánico y diftérico (vacunas DTPw o DTPe) que presentaban alta reactognicidad. Según la preparación, las DTPa pueden contener de 1 a 5 antígenos de B. pertussis: toxoide pertúsico (TP) (presente en todas), hemaglutinina filamentosa (HAF), pertactina (PRN) y uno o dos tipos de proteínas fimbriales (FIM-2 y FIM-3). Múltiples estudios muestran que ninguno de estos factores por sí solo es determinante de la eficacia vacunal, aunque la mayoría de los trabajos coinciden en que el componente fundamental es el TP que induce directamente la generación de anticuerpos protectores en respuesta a la inmunización.
Las vacunas frente a la tosferina utilizadas actualmente en España son vacunas inactivadas acelulares (Pa o pa) y forman parte de vacunas combinadas. Se dispone de 8 preparados que incluyen el componente de la tosferina (tablas 39.1 [18] y 39.2 [19]).
Las vacunas utilizadas en la primovacunación, con carga antigénica estándar, se conocen con el acrónimo "Pa" mientras que las utilizadas como refuerzo y que tienen menor carga antigénica de tosferina se denominan "pa". Estas últimas se utilizan como vacunas de refuerzo tras la primovacunación y son las únicas que pueden administrarse a adolescentes y adultos. No se han comercializado vacunas monocomponentes frente a la tosferina, actualmente están en estudio para evaluar su inmunogenicidad y seguridad para su posible aplicación en los recién nacidos.
Las vacunas combinadas que incluyen el componente tosferina utilizan sales de aluminio como adyuvante. Las vacunas Pentavac (no comercializada), Hexyon y Vaxelis pueden contener trazas indetectables de formaldehído, glutaraldehído, neomicina, estreptomicina y polimixina B. Hexyon contiene aminoácidos esenciales incluyendo L-fenilalanina. Infanrix-IPV+Hib (no comercializada) contiene neomicina y polimixina B e Infanrix Hexa contiene trazas de neomicina y polimixina B. Infanrix-IPV continene formaldehído, fenilalanina, neomicina y polimixina B y Tetraxim contiene etanol, estreptomicina, fenilalanina, fenoxietanol, formaldehído, glutaraldehído, neomicina y polimixina B. Boostrix formaldehído, Boostrix polio contiene formaldehído, fenilalanina, trazas de neomicina y polimixina B y Triaxis fenoxieetanol, formaldehído, glutaraldehído y latex (ver anexo II [26]).
El uso de vacunas combinadas en el calendario infantil es recomendado por el Comité Asesor de Vacunas de la AEP. Por tanto, se recomienda que la vacunación frente a la tosferina en el calendario se realice con vacuna combinada hexavalente (DTPa-Hib-HB-VPI) en primovacunación de 2 y 4 meses y refuerzo a los 11 meses, posteriormente a los 6 años se aplicará DTPa-VPI, preferentemente, o Tdpa-VPI, si el niño es mayor de 7 años, y a los 12-18 años Tdpa. Para su aplicación en las dosis de refuerzo, las vacunas disponibles con componente frente a la tosferina son la DTPa y la Tdpa.
Tabla 39.1. Características y composición de las vacunas con componente tosferina.
|
Nombre comercial |
Indicación |
Rango de edad recomendado |
Composición: Antígenos de la tosferina |
|---|---|---|---|
|
Hexyon |
Primovacunación y refuerzo |
≥6 semanas No hay estudios de inmunogenicidad y seguridad a partir de 24 meses de edad, pero probablemente segura en <7 años (off label) |
Toxoide pertúsico: 25 µg |
|
Infanrix Hexa (GlaxoSmithKline) |
Primovacunación y refuerzo |
≥6 semanas No hay estudios de inmunogenicidad y seguridad a partir de 36 meses de edad, pero probablemente segura en <7 años (off label) |
Toxoide pertúsico: 25 µg |
|
Vaxelis |
Primovacunación y refuerzo | ≥6 semanas No hay estudios de inmunogenicidad y seguridad a partir de 15 meses de edad, pero probablemente segura en <7 años (off label) |
Toxoide pertúsico 20 µg |
|
Infanrix -IPV+Hib (GlaxoSmithKline) |
Primovacunación y refuerzo |
A partir de 2 meses a 5 años |
Toxoide pertúsico: 25 µg |
|
Pentavac |
Primovacunación y refuerzo |
A partir de 2 meses. La ficha técnica no especifica edad máxima |
Toxoide pertúsico: 25 µg |
|
Infanrix-IPV |
Refuerzo | A partir de 16 meses a 13 años. Hay que tener en cuenta que a partir de 7 años no se aconsejan los componentes estándar de difteria y tosferina | Toxoide pertúsico: 25 µg Hemaglutinina filamentosa: 25 µg Pertactina: 8 µg |
|
Tetraxim |
Primovacunación y refuerzo | A partir de 2 meses a 13 años. Hay que tener en cuenta que a partir de 7 años no se aconsejan los componentes estándar de difteria y tosferina |
Toxoide pertúsico: 25 µg Hemaglutinina filamentosa: 25 µg |
|
Boostrix Polio |
Refuerzo | A partir de los 3 años |
Toxoide pertúsico: 8 µg Hemaglutinina filamentosa: 8 µg Virus de la polio inactivado propagado en células Vero |
|
Infanrix |
Primovacunación y refuerzo. |
A partir de 2 meses a 7 años. |
Toxoide pertúsico: 25 µg |
|
Boostrix |
Refuerzo |
A partir de los 4 años |
Toxoide pertúsico: 8 µg |
|
Triaxis |
Refuerzo |
A partir de los 4 años |
Toxoide pertúsico: 2,5 µg |
En color rojo las vacunas que ya no están comercializadas en España
Presentación y reconstitución
Todas las vacunas incluidas en este capítulo presentan las mismas condiciones de conservación. Los aspectos particulares relativos a reconstitución, aspecto y estabilidad se muestran en la tabla 39.2 [19].
Tabla 39.2. Condiciones de conservación, reconstitución y aspecto de las vacunas con componente de la tosferina
|
Nombre comercial |
Condiciones de conservación |
Reconstitución del producto |
Aspecto |
Observaciones |
|---|---|---|---|---|
|
Infanrix Hexa (GlaxoSmithKline) |
+2 ºC a +8 ºC |
Agitar jeringa precargada y añadir la suspensión al vial del liofilizado. Agitar hasta que el liofilizado esté completamente disuelto |
Suspensión blanquecina turbia |
Usar inmediatamente tras la reconstitución. Se ha demostrado estabilidad durante 8 horas a 21 ºC |
|
Hexyon |
+2 ºC a +8 ºC |
No precisa. |
Suspensión blanquecina turbia |
Agitar antes de la inyección para obtener una suspensión turbia blanquecina homogénea |
| Vaxelis (MSD) | +2 ºC a +8 ºC No congelar Proteger de la luz |
No precisa. Suspensión inyectable en jeringa precargada |
Suspensión turbia blanquecina homogénea | Agitar antes del uso para obtener una suspensión turbia blanquecina homogénea |
|
Infanrix -IPV+Hib (GlaxoSmithKline) |
+2 ºC a +8 ºC |
Agitar jeringa precargada y añadir la suspensión al vial del liofilizado. Agitar hasta que el liofilizado esté completamente disuelto |
Suspensión blanquecina turbia |
Inyectar inmediatamente tras la reconstitución |
|
Pentavac |
+2 ºC a +8 ºC |
Agitar jeringa precargada y añadir la suspensión al vial del liofilizado. Agitar hasta que el liofilizado esté completamente disuelto |
Suspensión de aspecto blanquecino turbio |
Inyectar inmediatamente tras la reconstitución |
| Tetraxim (Sanofi Pasteur) |
+2 ºC a +8 ºC No congelar Proteger de la luz |
No precisa. 0,5 ml en suspensión inyectable en jeringa precargada |
Suspensión blanca turbia | Agitar antes de la inyección para obtener una suspensión homogénea |
| Boostrix Polio (GlaxoSmithKline) |
+2 ºC a +8 ºC No congelar Proteger de la luz |
No precisa. 0,5 ml en suspensión inyectable en jeringa precargada |
Suspensión blanca turbia | Agitar antes de la inyección para obtener una suspensión homogénea |
|
Infanrix (GlaxoSmithKline) |
+2 ºC a +8 ºC |
No precisa. |
Liquido blanco ligeramente lechoso |
Agitar antes de la inyección para obtener una suspensión homogénea |
|
Boostrix (GlaxoSmithKline) |
+2 ºC a +8 ºC |
No precisa. |
Suspensión blanca turbia |
Agitar antes de la inyección para obtener una suspensión homogénea |
|
Triaxis |
+2 ºC a +8 ºC |
No precisa. |
Suspensión blanca turbia |
Agitar antes de la inyección para obtener una suspensión homogénea |
En color rojo las vacunas que ya no están comercializadas en España
⌂ [24]
5. Inmunogenicidad, eficacia y efectividad
Las vacunas acelulares han demostrado una buena inmunogenicidad que unida a su menor reactogenicidad han aconsejado el cambio de las vacunas de células enteras a las vacunas acelulares.
La eficacia de las actuales vacunas acelulares de 2 o más componentes frente a la tosferina (DTPa) se estima en el 85 % para prevenir cuadros típicos de tosferina y en el 71-78 % para prevenir formas leves de la enfermedad.
Tanto la infección natural como la vacunación frente a la tosferina confieren una protección limitada, se estima en 4-20 años para la infección natural y en 4-7 años para la adquirida mediante vacunación. Los brotes epidémicos acontecidos en California en 2010-11 y en Washington en 2012, han aportado importantes datos sobre la efectividad de estas vacunas. También se ha documentado una mayor protección en aquellos niños que recibieron la serie primaria de vacunación con vacunas de célula entera, frente a los que recibieron la serie con preparados acelulares, opción que no es aceptable, al menos, hasta que se disponga de vacunas de célula entera modificadas para disminuir su reactogenicidad.
La pérdida de la inmunidad adquirida mediante la vacunación con el paso del tiempo, ha sido una de las posibles causas, aunque no la única, de la reemergencia de la tosferina. Algunos autores, para clarificar este punto, han realizado una revisión sistemática y un metaanálisis para determinar la duración de la inmunidad tras la vacunación, con esquemas de vacunación de 3 o bien 5 dosis de DTPa, encontrándo que no existen diferencias con estos distintos esquemas de vacunación y que se podría estimar que la duración media de la protección con DTPa es de unos 3 años y que sólo el 10 % de los niños estarían protegidos a los 8,5 años después de la última dosis.
La efectividad vacunal ha sido menor de lo esperado. En niños de 4-10 años que habían recibido 5 dosis de vacuna con preparados acelulares de carga estándar, la estimación de la efectividad vacunal global durante el brote de California fue del 88,7·%, con cifras más elevadas inicialmente y con descensos conforme pasa el tiempo tras la vacunación. En un estudio similar en niños de 11 o más años, durante este mismo brote, se estimó la efectividad vacunal para los adolescentes que habían recibido Tdpa, en un 60 %. A pesar de que muchos casos de tosferina ocurren en sujetos vacunados, en estudios de vigilancia en Estados Unidos se ha podido constatar que los niños de más de 3 meses con un esquema vacunal adecuado para su edad frente a la tosferina, presentaban cuadros más leves y menos complicaciones.
Estos hechos justifican que para conseguir una adecuada protección en todos los grupos de edad sea necesario administrar una dosis de refuerzo también en adolescentes y adultos jóvenes, en los que los estudios documentan una efectividad del 88,89 %.
Recientemente se están estudiando nuevas vacunas con nuevos componentes antigénicos, de células enteras con reducción de endotoxina, con adyuvantes más potentes que incrementen las respuestas Th1 y Th17, con adenilato-ciclasa o con nuevas vías de administración, como el uso de vacunas vivas atenuadas intranasales.
En cuanto a la efectividad de la vacunación de la gestante para prevenir la enfermedad en el lactante, los datos del registro PERTINENT de la UE/EEE muestran que la vacunación durante el embarazo reduce el riesgo de hospitalización por tosferina en un 75-88 % en lactantes de menos de 2 meses. El último informe publicado por el National Health Service de Reino Unido, notifica una efectividad del 95 % y en España, un trabajo publicado en 2020 muestra una eficacia para evitar la enfermedad leve en menores de 3 meses del 65 % y del 71 % para el riesgo de enfermedad grave con hospitalización.
Existe la duda de si el elevado nivel de anticuerpos de transferencia materna en el lactante, previos al inicio de su vacunación, puede tener un efecto de bloqueo de la respuesta (blunting) a la primovacunación frente a la tosferina. Hay varias publicaciones con resultados heterogéneos y aunque puede afirmarse que, si bien inicialmente puede haber una menor respuesta de anticuerpos en hijos de mujeres vacunadas, un mes después de la dosis de refuerzo de los 11 meses, la concentración de anticuerpos frente a todos los antígenos de la tosferina no es significativamente inferior en los grupos de hijos de vacunadas que en los de no vacunadas. En el registro PERTINENT entre los lactantes que tienen entre 2 y 11 meses de edad, hijos de madres vacunadas y no vacunadas, que han recibido alguna dosis de vacuna, no se evidencian diferencias significativas.
⌂ [24]
6. Vías de administración
Todas las vacunas con componente de la tosferina comentadas en este capítulo deben administrarse por vía intramuscular profunda, en el tercio medio del vasto externo en menores de 1-2 años y en el deltoides en mayores de esta edad. Sin embargo, en pacientes con alteraciones de la coagulación se podría aplicar por vía subcutánea profunda para reducir el riesgo de sangrado.
⌂ [24]
7. Indicaciones y esquemas de vacunación
La vacuna frente a la tosferina forma parte del calendario de vacunaciones sistemáticas de todas las CC. AA. de España. En todas ellas se administran, al menos, 4 dosis (primovacunación 2 y 4 meses y refuerzos a los 11 meses y a los 6 años), con excepción de Asturias que incluye una dosis a los 13 años con Tdpa y en 2024 también Cataluña a los 11-12 años, Andalucía y Madrid a los 14 años. En 2025 se sumó Canarias con Tdpa a los 14 años. El calendario de vacunaciones de la AEP también contempla como vacuna sistemática una dosis, con Tdpa a los 10-12 años, rebajando a esta edad su aplicación dado que en los brotes de tosferina los adolescentes de 10 a 14 años son los más afectados.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) recomienda desde 2016 el uso de vacunas combinadas en el calendario infantil , indicando que la vacunación frente a la tosferina en el calendario se realice con vacuna combinada hexavalente (DTPa-Hib-HB-VPI) en primovacunación a los 2 y 4 meses; el refuerzo a los 11 meses, también con vacuna hexavalente (esquema 2 + 1), con un refuerzo posterior con DTPa-VPI, preferentemente, o Tdpa-VPI a los 6 años y la dosis final de Tdpa a los 10-12 años. Esta pauta 2+1 se aplica en todas las comunidades desde enero de 2017.
Además, se recomienda vacunar con Tdpa a las embarazadas en cada embarazo entre las 27-32 semanas de gestación, lo más precozmente posible en este rango. Si se sospecha que el parto pueda ser prematuro, dado que la vacuna puede administrarse partir de las 16 semanas, se recomienda aplicarla tras el control ecográfico de la semana 20.
Las vacunas de carga antigénica estándar (Pa) (DTPa) están indicadas para las dosis de primovacunación y para los refuerzos hasta los 7 años. Las vacunas hexavalentes han sido autorizadas por la AEMPS para ser administradas en menores de 7 años de edad en el caso que no hayan recibido la pauta de vacunación en tiempo (2, 4, 11 meses de edad) o la tengan incompleta de acuerdo con las recomendaciones oficiales. El Comité Asesor de Vacunas de la AEP recomienda aplicar una dosis con Tdpa en la adolescencia, tal como ya habían hecho en España las comunidades de Asturias, Madrid y la ciudad autónoma de Melilla, pero por el desabastecimiento pasaron a vacunar provisionalmente con Td, y actualmente solo la ha recuperado Asturias a los 13 años. La DTPa-VPI lo está desde los 2 meses (Tetraxim) y 16 meses (Infanrix-IPV) hasta los 13 años. La AEMPS ha autorizado el uso de los dos preparados disponibles de DTPa-VPI (Tetraxim, Infarnrix-IPV) tanto para primovacunación a partir de los 2 meses de edad, como para dosis de recuerdo hasta los 13 años, aunque, a partir de los 7 años es preferible la Tdpa para evitar mayor riesgo de reactogenicidad.
Diversos países en los continentes americano y oceánico y 18 países europeos administran Tdpa en la adolescencia. La edad óptima de aplicación de esta dosis es a los 12-14 años. Los preparados de baja carga antigénica no están autorizados en Estados Unidos hasta los 10-11 años, la 5.ª dosis de vacunación frente a la tosferina se realiza con preparados DTPa. Alemania utiliza Tdpa como 5.ª dosis, pero con una dosis de recuerdo o 6.ª dosis en la adolescencia con Tdpa. El Reino Unido utiliza desde junio de 2003, como dosis de refuerzo a los 3 años y 4 meses, como 4.ª dosis, preparados DTPa o Tdpa indistintamente junto con VPI. Algunos autores encuentran menor duración de la protección cuando la 5.ª dosis se administra con preparados de baja carga antigénica (Tdpa), media de duración 2,1 ±1,1 años, mientras que con DTPa es de 5,1 ±1,5 años, por lo que en España se recomienda para la 4.ª dosis de refuerzo de los 6 años.
En algunos países se recomienda una vez completado el calendario infantil con 5 o 6 dosis, poner un refuerzo de vacunación frente al tétanos, preferentemente Tdpa para reforzar la protección frente a la tosferina en la edad adulta. El Ministerio de Sanidad de España considera que los niños que completan su calendario en la adolescencia con 5 dosis están correctamente vacunados y no precisan un refuerzo de tétanos hasta los 60-65 años, y en relación con la vacunación de adultos frente a la tosferina, limitan su recomendación a mujeres embarazadas, profesionales sanitarios que trabajan en pediatría, obstetricia y sus respectivas áreas de urgencias, y profesionales que trabajan en estrecho contacto con casos y en el control de brotes epidémicos de tosferina. En la Unión Europea, varios países recomiendan un refuerzo de la vacuna contra la tosferina en adultos cada 10 años.
Las vacunas de baja carga antigénica (pa) (Tdpa) están indicadas en la revacunación de adolescentes y adultos, pero los CDC autorizan desde 2020 el uso de Td o Tdpa indistintamente para la vacunación frente al tétanos, difteria y tosferina en niños mayores de 7 años no vacunados o que precisan dosis de refuerzo..
En situaciones en las que no se sigue la pauta sistemática del calendario de vacunaciones (inmigrantes, calendarios incompletos, etc.) se deben administrar las dosis en función de la edad y de las vacunas previamente recibidas (ver capítulo 11 [27] sobre calendarios acelerados). Como norma general se administrarán las 2 dosis de primovacunación con, al menos, 8 semanas de intervalo entre las mismas y las 2 dosis de refuerzo con 6 meses de intervalo respecto de la primovacunación y primer refuerzo, respectivamente, a menos que el niño tenga menos de 4-6 años en cuyo caso el último refuerzo se administrará a esta edad.
La edad mínima de administración de la vacuna hexavalente son las 6 semanas de vida, las restantes vacunas combinadas con componente tosferina se administran a partir de los 2 meses, tal como consta en sus correspondientes fichas técnicas. Aunque habitualmente se ha venido recomendando iniciar la vacunación con DTPa a partir de los 2 meses de edad, organismos internacionales como la American Academy of Pediatrics (AAP) y su comité de vacunas, el Advisory Committee on Immunization Practices (ACIP), consideran que se pueda adelantar a las 6 semanas de edad, estrategia encaminada a reducir hasta un 9 % los casos de tosferina grave en lactantes pequeños no inmunizados. También se ha estimado que esta estrategia podría evitar el 6 % de las muertes. La vacunación del recién nacido es aún controvertida y de momento no es recomendada por los organismos oficiales correspondientes.
En Europa la edad mínima de administración de las vacunas de baja carga antigénica (pa) son los 4 años de edad. Actualmente, estas vacunas pueden utilizarse como dosis de primovacunación y como dosis de refuerzo en pacientes primovacunados. Está autorizada su utilización como dosis de refuerzo en la profilaxis de heridas tetanígenas.
En los casos documentados de tosferina, y como quiera que se desconoce la duración de la inmunidad natural, se recomienda que los niños completen la serie primaria de vacunación con DTPa si son menores de 7 años y con Tdpa a partir de 7 años.
⌂ [24]
8. Administración con otras vacunas y otros productos
Las vacunas frente a la tosferina pueden administrarse con cualquier intervalo respecto de otras vacunas inactivadas o atenuadas, siempre que se administren en lugares anatómicos diferentes y con jeringas y agujas distintas.
Las vacunas combinadas hexavalentes y pentavalentes pueden administrarse concomitantemente con otras vacunas sistemáticas y con la vacuna antirrotavirus.
Aunque en su momento en la ficha técnica se habían visto interferencias en un ensayo clínico entre la dosis de refuerzo de la vacuna hexavalente Hexyon y la vacunación frente a la varicela y se había aconsejado separarlas por 4 semanas; en mayo la EMA y la AEMPS tras conocer nuevos datos han determinado que se pueden administrar simultáneamente sin ningún problema al haber desaparecido dicha interferencia.
Las vacunas Tdpa (Boostrix, Boostrix polio y Triaxis) pueden también administrarse de forma simultánea con otras vacunas o inmunoglobulinas en lugares anatómicos diferentes.
En algunos estudios se ha observado resultados inferiores en la respuesta inmunológica frente al antígeno pertactina de la vacuna frente a tosferina en la administración simultánea con la vacuna frente al meningococo B, si bien no sugiere tener significación clínica.
Posibles interferencias con otros fármacos o productos biológicos
No han de observarse precauciones especiales por riesgo de interferencia con otros productos biológicos (inmunoglobulinas, sangre, etc.) o fármacos, con la excepción de los tratamientos inmunosupresores que pueden impedir alcanzar una respuesta adecuada.
⌂ [24]
9. Efectos adversos
La utilización generalizada de vacunas acelulares de la tosferina ha comportado una disminución en la incidencia de reacciones adversas, tanto locales como generales. Las reacciones adversas locales más frecuentes son: dolor, eritema y tumefacción en el lugar de inyección y son más frecuentes conforme aumenta el número de dosis administradas. Hasta un 2 % de pacientes pueden presentar reacciones locales significativas, lo que no constituye una contraindicación para la administración de dosis posteriores.
Las reacciones adversas generales más frecuentes son: fiebre, irritabilidad e inapetencia en niños pequeños, y cefaleas en adolescentes y adultos.
Las reacciones infrecuentes, tales como el llanto y los episodios de hipotonía-hiporrespuesta son menos frecuentes desde la introducción de las vacunas acelulares. La aparición de convulsiones es muy infrecuente.
⌂ [24]
10. Precauciones y contraindicaciones
Las vacunas con componente de la tosferina están contraindicadas en las siguientes situaciones:
- Reacción anafiláctica a una dosis previa de la misma vacuna o a cualquiera de los componentes presentes en la vacuna. Si un estudio de alergia permite determinar el antígeno responsable de la reacción anafiláctica sería posible continuar la vacunación si existen vacunas sin dicho componente.
- Antecedente de encefalopatía o encefalitis en los 7 días posteriores a la recepción de una dosis de cualquier vacuna con un componente antipertúsico, no atribuibles a otra causa, de las que el niño no se hubiera recuperado completamente en una semana. Si lo hizo, o se identificó otra causa, no se debe interrumpir ni demorar la aplicación de la pauta de vacunación frente a la tosferina correspondiente a su edad.
Algunas situaciones consideradas contraindicaciones de las vacunas de células enteras ya no lo son para las vacunas acelulares, y simplemente se consideran situaciones de precaución que no contraindican dosis posteriores de la vacuna:
- Encefalopatía progresiva, epilepsia refractaria al tratamiento farmacológico u otro trastorno neurológico no estacionario de causa desconocida. En estos casos se recomienda retrasar la vacunación frente a la tosferina hasta la estabilización del proceso. Si a juicio del médico responsable no es esperable una evolución hacia su estabilización en un período de tiempo razonable, dada la ausencia de evidencias que apoyen la relación entre la vacuna de la tosferina acelular y la generación de un daño neurológico añadido, debería plantearse la opción de vacunar con preparados que contengan antígenos de B. pertussis, por presentar un balance riesgo/beneficio favorable.
En este sentido, ante encefalopatías epilépticas inestables del lactante no vinculadas patológicamente a la vacunación, como los síndromes de West y de Dravet, debe abogarse por no interrumpir ni demorar la recepción de las vacunas acelulares de la tosferina de acuerdo con sus indicaciones sistemáticas. - Enfermedad moderada o grave, con o sin fiebre.
- Historia de síndrome de Guillain-Barré en las 6 semanas posteriores a la administración de una vacuna. En este caso deberá valorarse con precaución la conveniencia o no de administrar una dosis posterior de dicha vacuna. Teniendo en cuenta que todas las vacunas de la tosferina están combinadas con toxoide tetánico, esta precaución es válida para todas ellas.
La vacuna Td también está autorizada por la AEMPS en menores de 7 años cuando haya contraindicación para la vacuna de la tosferina.
El llanto inconsolable de más de 3 horas de duración, la historia de fiebre de ≥40,5 °C durante las 48 horas siguientes después de la vacunación con una dosis previa de DTP/DTPa/Tdpa y el episodio hipotónico-hiporreactivo (colapso o estado similar al shock) en las 48 horas siguientes, así como la convulsión en los 3 días posteriores a la administración de una dosis previa de DTP/DTPa/Tdpa se consideran falsas contraindicaciones y no precauciones desde 2018.
⌂ [24]
11. Profilaxis posexposición
Según el protocolo de vigilancia de tosferina [28]de la Red Nacional de Vigilancia Epidemiología (RENAVE), actualizado en julio de 2024, se consideran contactos estrechos de un caso de tosferina a:
- Las personas que viven en la misma casa (convivientes)
- Los recién nacidos hijos de mujeres con tosferina que sean infecciosas en el momento del parto
- Las personas que han tenido contacto directo cara a cara con un caso sintomático; contacto directo con secreciones respiratorias (tos explosiva o estornudo en la cara, compartir alimentos o cubiertos, besos, resucitación boca a boca o realizar exploraciones clínicas de nariz y garganta) de un caso sintomático
Hay que tener en cuenta que los enfermos de tosferina son contagiosos hasta cinco días después del inicio del tratamiento con un antibiótico eficaz o hasta 21 días desde el inicio de síntomas si no se ha completado el tratamiento.
Otros contactos, como los contactos en el trabajo o asistir al mismo colegio, generalmente no se consideran contactos estrechos, aunque se debería evaluar cada situación particular, sobre todo cuando entre ellos haya contactos de alto riesgo.
El protocolo también define un grupo prioritario de actuación con el objetivo de evitar la transmisión a personas que están en riesgo de sufrir tosferina grave:
- Personas en riesgo de sufrir tosferina grave (grupo de alto riesgo): aunque la vacunación de tosferina en las embarazadas tiene una alta efectividad para prevenir la enfermedad en los lactantes menores de 2 meses de vida, este grupo de edad presenta alto riesgo de complicaciones graves por tosferina. Se definen como personas de alto riesgo a:
- Lactantes con <2 meses de edad prematuros (nacidos <32 semanas) o nacidos a término, independientemente del estado de vacunación de la madre
- Lactantes de 2 a 11 meses de edad que no hayan recibido tres dosis de vacuna, (independientemente del estado de vacunación de la madre), teniendo en cuenta que una dosis administrada sólo se considerará válida si han trascurrido, al menos, dos semanas entre la administración de la vacuna y la exposición
- En este grupo de alto riesgo, el CAV-AEP incluye, además, a embarazadas en las últimas 3 semanas de gestación, los niños no vacunados o incompletamente vacunados, y personas con inmunodepresión o con enfermedades crónicas, como asma, fibrosis quística o cardiopatía congénita
- Personas que pueden trasmitir la infección a personas de alto riesgo: embarazadas en el último trimestre de gestación (>32s) y personas en contacto estrecho con población en el primer año de vida:
- Mujeres embarazadas en el último trimestre de gestación (>32s) o antes si la embarazada tiene riesgo de parto prematuro. Aunque la tosferina en las mujeres embarazadas no es más grave que en otros adultos y no se han descrito efectos sobre el feto, sí se ha descrito la transmisión desde la madre al recién nacido en el parto o justo después del nacimiento y se ha asociado con enfermedad neonatal grave
- Personas que están en contacto estrecho con personas de alto riesgo:
- Convivientes
- Trabajadores sanitarios de las unidades de neonatología y obstetricia y de sus áreas de urgencias
- Personas que de manera regular estén en contacto estrecho o prolongado con niños en el primer año de vida (como guarderías o establecimientos donde concurren menores de un año y otras personas cuidadoras de bebés)
PROFILAXIS POSEXPOSICIÓN DE LOS CONTACTOS ESTRECHOS
La medida más importante posexposición es la quimioprofilaxis. Como medida adicional, se revisará y actualizará, si procede, la vacunación en los contactos a quienes se les ha recomendado profilaxis con antibióticos.
11.1. QUIMIOPROFILAXIS POSEXPOSICIÓN DE LOS CONTACTOS ESTRECHOS
Dado su limitado impacto, la profilaxis con macrólidos sólo está recomendada en los contactos estrechos que pertenecen a uno de los grupos prioritarios de actuación. Las pautas y dosis son las mismas que las del tratamiento de la enfermedad. La recomendación de profilaxis antibiótica debe hacerse independientemente del estado de vacunación del contacto, con la salvedad de la embarazada de >32 semanas de gestación que ha recibido vacunación, al menos, una semana antes de la exposición. El objetivo de la profilaxis con antibióticos es limitar la transmisión al recién nacido.
La dosificación de los macrólidos recogida en el protocolo de RENAVE es la siguiente:
- Azitromicina: 10 mg/kg una vez al día, 3 días, incluido los menores de 1 mes (el riesgo de estenosis hipertrófica de píloro es menor que el beneficio de proteger frente a tosferina) (CDC [29]). Máximo 500 mg/día
- Claritromicina: 7,5 mg/kg dos veces al día, 7 días. Máximo 1 g/día
- Eritromicina: niños entre 1 mes y 23 meses: 125 mg cuatro veces al día durante 7 días; 2-7 años: 250 mg cuatro veces al día durante 7 días; 8-17 años: 500 mg cuatro veces al día durante 7 días. No se recomienda en lactantes menores de un mes de vida, por su asociación con la estenosis hipertrófica del píloro. Sin embargo, es el único macrólido recomendado en embarazadas
El CAV-AEP, en consonancia con SEIP [30], recomienda para azitromicina una pauta de 5 días (10 mg/kg el 1.er día y 5 mg/kg, entre el 2.º y el 5.º día), salvo en menores de 6 meses: 10 mg/kg/día los 5 días; en todos los casos, administrar, al menos, una hora antes de ingerir alimentos. La dosis recomendada de eritromicina es de 40 mg/kg/día, cada 8 horas, durante 14 días en menores de 6 meses, y entre 7 y 14 días en mayores de esa edad. La dosificación recomendada de claritromicina es igual a la referida por la RENAVE.
11.2. VACUNACIÓN POSEXPOSICIÓN DE LOS CONTACTOS ESTRECHOS
Como se ha comentado, se revisará y actualizará, si procede, la vacunación en los contactos a quienes se les ha recomendado profilaxis con antibióticosse como viene reflejado en el Cap. 9. Vacunación profiláctica posexposición en niños sanos [31] y también a continuación:
- Contactos menores de 7 años:
- Lactantes <2 meses: se podrá administrar la primera dosis a partir de las 6 semanas de vida
- Lactantes de 2 a 11 meses de edad: se recomienda adelantar la pauta de vacunación cuando solo hayan recibido una o dos dosis; esta dosis se administrará a las 4 semanas de la última dosis de vacuna administrada. El CAV-AEP añade que, posteriormente debe recibir la dosis de refuerzo de la vacuna hexavalente 6 meses después de esta administrada
- Niños de 12 meses a 7 años: si tienen vacunación incompleta para su edad, se recomienda completar la pauta siguiendo las recomendaciones del calendario de vacunación
- En los niños entre 1 y 7 años, el CAV-AEP recomienda que a aquellos que hayan recibido la cuarta dosis de una pauta 3+1 o la tercera dosis de una pauta 2+1 hace más de 3 años, y que por edad no hayan recibido todavía la dosis de los 6 años, se les debe administrar una dosis de refuerzo con Tdpa si la pauta fue 3+1, o con DTPa-VPI si fue 2+1. Esta dosis, si se administra por encima de los 4 años, hace innecesaria administrar posteriormente la dosis correspondiente a los 6 años
- Contactos mayores de 7 años: solo se recomienda completar la pauta de vacunación en caso de que esté incompleta
- En niños mayores de 7 años y adolescentes, en los que hayan pasado más de 5 años desde la última dosis de recuerdo (habitualmente la Tdpa o DTPa-VPI de los 6 años), el CAV-AEP recomienda administrar una dosis de refuerzo con Tdpa. Esta dosis, si se administra con 10 o más años, hace innecesaria la dosis habitual de Td a los 14-16 años (o en el caso de Asturias, la Tdpa de los 13 años)
- Adultos que puedan transmitir la tosferina a personas de alto riesgo; si no han recibido 1 dosis de vacuna frente a la tosferina o si ya ha pasado más de 5 años de la misma, se recomienda una dosis de Tdpa con un intervalo de, al menos, un mes desde la última dosis de Td
- En embarazadas de más de 32 semanas de gestación que sean contacto estrecho de un caso de tosferina y que no se hubieran vacunado en la semana 27 o 28 de gestación se les administrará una dosis de vacuna Tdpa tan pronto como sea posible. Si la embarazada es contacto estrecho y tiene amenaza de parto prematuro, y no está vacunada, se vacunará cuanto antes. Si la dosis de vacuna frente a la tosferina se administra a partir de la semana 20 de gestación se considera que proporciona protección al recién nacido y no será necesario administrar otra dosis en las semanas 27 o 28
⌂ [24]
12. Otras pautas de prevención
En lactantes o niños que hayan padecido una tosferina sospechada clínicamente o incluso confirmada por laboratorio, la vacunación es segura y se recomienda continuar administrando las vacunas con componente de la misma.
En niños mayores de 7 años, adolescentes o adultos que no hayan recibido ninguna dosis de vacuna frente a la tosferina, de acuerdo a las fichas técnicas actuales en España, están autorizadas las vacunas DTPa-VPI hasta los 13 años, aunque es preferible el uso de Tdpa para evitar reactogenicidad. La primovacunación de estos individuos se realizará administrando 3 dosis de Td o Tdpa con 2 refuerzos posteriores (se puede consultar el capítulo 11 [32]).
Dado que los primeros 3 meses de vida son el periodo de mayor riesgo de mortalidad por tosferina y de desarrollar el síndrome de tosferina maligna, en algunos países se recomienda la vacunación con Tdpa a los futuros padres antes del embarazo o en su defecto inmediatamente después del parto, así como a todos los convivientes familiares (estrategia "cocoon" o "del nido") con la finalidad de aumentar su protección frente a esta enfermedad y proteger así al recién nacido. Actualmente la estrategia del nido ha demostrado ser poco eficiente y sus estudios controvertidos, por lo que ha dejado de recomendarse.
Desde 2011 en EE. UU. y en Argentina, se recomienda la vacunación de la madre durante la gestación a partir de las 20 semanas. Desde octubre de 2012, Reino Unido recomienda vacunar a todas las embarazadas contra la tosferina, entre las semanas 28 y 38 de gestación, alcanzándose coberturas del 50-60 %, con notable descenso de los casos en lactantes, siendo la efectividad vacunal superior al 90 %. La vacunación de la mujer embarazada es segura y efectiva. Es la forma más eficiente de controlar la tosferina en el lactante. El momento más adecuado de vacunar a la mujer embarazada es motivo de controversia, algunos países efectúan la administración entre las 27 y las 36 semanas de gestación; Reino Unido la ha adelantado al segundo trimestre (16 semanas) tras publicarse mejores niveles de anticuerpos en el recién nacido, cuando se vacuna a las madres en ese momento.
EE. UU., Reino Unido y la AEP recomiendan actualmente aplicar 1 dosis de Tdpa en cada embarazo independientemente del tiempo que haya pasado con la aplicación de la dosis anterior de Tdpa o Td. Esta estrategia permite el paso transplacentario de anticuerpos protectores al recién nacido y se considera como el modo más efectivo de protección, sin suponer un riesgo adicional para la madre ni para el niño.
En España la Comisión de Salud Pública aprobó la recomendación de vacunar frente a la tosferina en el embarazo, en junio de 2015, entre las semanas 27-28 y 36, en cada embarazo. El CAV-AEP recomienda la vacunación de la embarazada a partir de la 27.ª semana, pero se puede adelantar a la 20 si hay amenaza de parto prematuro..
Existen muchas publicaciones y una revisión sistemática constatando la seguridad de la vacuna de la tosferina en la mujer gestante, así como la efectividad frente a tosferina en el lactante de mujeres vacunadas, que es de un 90 %.
Otras medidas adicionales de protección infantil indirecta, es mediante la vacunación de todos los profesionales de la salud, especialmente aquellos en contacto directo con niños (deberían vacunarse: ginecólogos, pediatras, matronas, neonatólogos y personal sanitario de las unidades de cuidados intensivos pediátricas, de las de pediatría y de las de obstetricia), así como de los cuidadores de guarderías. Estos adultos deberían recibir una dosis de refuerzo de vacuna Tdpa, incluidos los mayores de 65 años. Una buena estrategia para aumentar las coberturas es que en el caso de ser necesaria la profilaxis antitetánica en una herida, esta se realice con la vacuna que lleva componente de tosferina (Tdpa, en lugar de Td).
⌂ [24]
13. Bibliografía
- Abu Raya B, et al. Immunization of pregnant women against pertussis: The effect of timing on antibody avidity. Vaccine. 2015;33:1948-52.
- Advisory Committee on Immunization Practices (ACIP). Recommended Immunization Schedule for Children and Adolescents Aged 18 Years or Younger, United States [33].
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de la AEMPS sobre el uso de vacunas hexavalentes para la inmunización activa en menores de 7 años [34].
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de la AEMPS sobre el uso las vacunas DTPa-IPV en primovacunación [35]. 22 de marzo de 2023.
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Vacunación de niños en los que no está indicada la vacuna frente a la tosferina. [36]3 de abril de 2009.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. [37] An Pediatr (Barc). 2026;104:504051.
- American Academy of Pediatrics. Pertussis (Whooping Cough). En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 589-91.
- Amirthalingam G, et al. Effectiveness of maternal pertussis vaccination in England: an observational study. Lancet. 2014;384:1521-8.
- Bahar E, et al. Descriptive Overview of Pertussis Epidemiology Among Older Adults in Europe During 2010-2020. Infect Dis Ther. 2022;11:1821-38.
- Baxter R, et al. Effectiveness of vaccination during pregnancy to prevent infant pertussis. Pediatrics. 2017;139. pii:e20164091.
- Berbers, G., et al. Circulation of pertussis and poor protection against diphtheria among middle-aged adults in 18 European countries. Nat Commun. 2021;12:2871.
- Campins M, et al. Tos ferina en España. Situación epidemiológica y estrategias de prevención y control. Recomendaciones del Grupo de Trabajo de Tos ferina. Enferm Infecc Microbiol Clin. 2013;31:240-53.
- Centers for Diseases Control and Prevention. Chapter 10. Pertussis [38]. Manual for the Surveillance of Vaccine-Preventable Diseases. October 2024.
- Centers for Diseases Control and Prevention. Pertussis [39]. In: Pink Book: Epidemiology and Prevention of Vaccine-Preventable Diseases. 14th ed.CDC website.. Published August 2021. Updated April, 2024.
- Centers for Diseases Control and Prevention. Treatment of Pertussis [29]. November 2024.
- Centers for Diseases Control and Prevention. Vaccine Information Statements (VISs). Tdap (Tetanus, Diphtheria, Pertussis) [40] VIS.
- Centro Nacional de Epidemiología. CIBERESP. ISCIII. Informe epidemiológico sobre la evolución de la tosferina en España 2005-2020. Impacto de la vacunación en gestastes sobre la epidemiología de la tosferina. Tosferina 2005-2020 [41].
- Centro Nacional de Epidemiología. Boletín semanal en red [42].
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026 [43]. [Internet]. Madrid: AEP; 2026.
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. La tosferina en alza: en dos meses de 2024 un 85 % más que en todo 2023 [44].
- Donegan K, et al. Safety of pertussis vaccination in pregnant women in UK: observational study. BMJ. 2014;349:g4219.
- European Centre for Disease Prevention and Control. Increase of pertussis cases in the EU/EEA, 8 May 2024 [45]. Stockholm: ECDC; 2024.
- European Centre for Disease Prevention and Control. Pertussis. Informe epidemiológico anual de 2022 [46]; Apr 2024.
- Gkentzi D, et al. Maternal vaccination against pertussis: a systematic review of the recent literature. Arch Dis Child Fetal Neonatal Ed. 2017;102:F456-63.
- González-López JJ, et al. Epidemiology, prevention and control of pertussis in Spain: New vaccination strategies for lifelong protection. Enferm Infecc Microbiol Clin (Engl Ed). 2022;40:195-203.
- Instituto de Salud Carlos III. Red Nacional de Vigilancia Epidemiológica. Actualización de la situación de la tosferina en España. Datos provisionales 8 de julio 2024 [47].
- Instituto de Salud Carlos III. Resultados de la vigilancia Epidemiológica de las enfermedades transmisibles. Informe anual. Años 2017-2018 [48]. Madrid, 2020.
- Locht C, et al. Live Attenuated Pertussis Vaccine BPZE1 Protects Baboons Against Bordetella pertussis Disease and Infection. J Infect Dis. 2017;216:117-24.
- Locht C. The Path to New Pediatric Vaccines against Pertussis. Vaccines (Basel). 2021;9:228.
- Macina D, et al. Bordetella pertussis in School-Age Children, Adolescents and Adults: A Systematic Review of Epidemiology and Mortality in Europe. Infect Dis Ther. 2021;10:2071-118.
- Merdrignac L, et al, PERTINENT Group. Effectiveness of pertussis vaccination in pregnancy to prevent hospitalisation in infants aged <2 months and effectiveness of both primary vaccination and mother's vaccination in pregnancy in infants aged 2-11 months. Vaccine. 2022;40:6374-82.
- Ministerio de Sanidad, Servicios Sociales e Igualdad, Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Grupo de Trabajo tos ferina 2015 de la Ponencia de Programa y Registro de Vacunaciones. Adenda al programa de vacunación frente a tos ferina en España: vacunación en el embarazo [49]. Junio 2015.
- Ministerio de Sanidad, Política Social e Igualdad. Ponencia de Programa y Registro de Vacunaciones. Revisión del programa de vacunación frente a tos ferina en España. Enero 2013 [50] Grupo de trabajo tos ferina 2012.
- Mir-Cros A, et al.Dinámica poblacional y deriva antigénica de Bordetella pertussis luego del reemplazo de la vacuna de células enteras, Barcelona, España, 1986–2015. Emerg Microbes Infect. 2019;8:1711-20.
- McGirr A, et al. Duration of pertussis immunity after DTaP immunization: a meta-analysis. Pediatrics. 2015;135:331-43.
- McNamara LA, et al. Reduced severity of pertussis in persons with age-appropriate pertussis vaccination-United States, 2010-2012. Clin Infect Dis. 2017;65:811-8.
- Nguyen HS, et al. The optimal strategy for pertussis vaccination: a systematic review and meta-analysis of randomized control trials and real-world data. Am J Obstet Gynecol. 2022;226:52-67.
- Nordholm AZ, et al. Pertussis epidemic in Denmark, August 2023 to February 2024 [51]. Euro Surveill. 2024;29:2400160.
- Ponencia de Programa y Registro de Vacunaciones. Calendario acelerado de vacunaciones. [52] Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Consumo y Bienestar Social, julio 2023.
- Red Nacional de Vigilancia Epidemiológica (RENAVE). Protocolo de vigilancia de tosferina [53]. Julio 2024.
- Smout Z, et al. Whooping cough rises sharply in UK and Europe. Increasing vaccine uptake is critical to controlling pertussis outbreaks. BMJ 2024;385:q736.
- Sociedad Española de Infectología Pediátrica. Vázquez Pérez A, et al. Tosferina-pertussis (whooping cough) [30]. Protoc diagn ter pediatr. 2023;2:167-79.
- Szwejser-Zawislak E, et al. Evaluation of Whole-Cell and Acellular Pertussis Vaccines in the Context of Long-Term Herd Immunity. Vaccines (Basel). 2022;11:1.
- UK Security Health Agency. Confirmed cases of pertussis in England by month [54]. 14 may 2024.
- WHO. Pertussis vaccines: WHO position paper – August 2015 [55]. Wkly Epidemiol Rec. 2015;90:433-58.
- Wood N, et al. Immunogenicity and Safety of Monovalent Acellular Pertussis Vaccine at Birth: A Randomized Clinical Trial. JAMA Pediatr. 2018;172:1045-52.
⌂ [24]
14. Enlaces de interés
- American Academy of Pediatrics. Healthy children. Whooping Cough [56]
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026 [43]
- CDC. Pertussis (Whooping Cough) [57]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles [58]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Tosferina [59]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente a tosferina [60]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna de la tosferina [61]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la tosferina [62]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la tosferina [63]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada [64]
- ECDC. Pertussis (Whooping Cough) [65]
- ECDC. Laboratory diagnosis and molecular surveillance of Bordetella pertussis [66]
- Epidemiología, prevención y control de la tosferina en España: Nuevas estrategias vacunales para la protección de por vida [67]
- Health Protection Agency, United Kingdom. Pertussis. Guidance, data and analysis [68]
- The Australian Immunisation Handbook. Pertussis (Whooping Cough) [69]
- WHO. Pertussis [70]
⌂ [24]
15. Historial de actualizaciones
| 6 de julio de 2018 | Actualización de todos los apartados, excepto vías de administración; efectos adversos; precauciones y contraindicaciones y quimioprofilaxis posexposición. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2019 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2020 | Nuevas citas bibliográficas y enlaces de interés |
| 12 de febrero de 2020 | Cambios sobre Tdpa cada 10 años en el apartado "Indicaciones y esquemas de vacunación". Nueva cita bibliográfica |
| 1 de enero de 2021 | Nuevas citas bibliográficas y enlaces de interés |
| 22 de febrero de 2021 | Actualización del apartado "Precauciones y contraindicaciones". |
| 12 de noviembre de 2021 | Se añade Tetraxim a las tablas 39.1 y 39.2 |
| 1 de enero de 2022 | Actualización del apartado "Epidemiología". Nuevas citas bibliográficas y enlaces de interés |
| 1 de julio de 2022 | Actualización del apartado 8 sobre Hexyon y la vacuna de la varicela |
| 25 de enero de 2023 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés. Cambio de nombre a Manual de Inmunizaciones |
| 7 de agosto de 2023 | Actualización del apartado "Indicaciones y esquemas de vacunación" con la reomendación AEMPS de DTPa-VPI. Nueva cita bibliográfica |
| 1 de enero de 2024 | Actualización del apartado "Quimioprofilaxis posexposición". Nuevas citas bibliográficas y enlaces de interés |
| 27 de mayo de 2024 | Actualización de los apartados "Puntos clave", "Introducción" y "Epidemiología de la enfermedad". Creación figura 39.2. Nuevas citas bibliográficas |
| 21 de noviembre de 2024 | Actualización del apartado "Profilaxis posexposición". Nuevas citas bibliográficas |
| 1 de enero de 2025 | Disminución de la edad de aplicación de Tdpa en la adolescencia a los 10-12 años. Nuevas citas bibliográficas y enlaces de interés |
| 1 de abril de 2025 | Modificación enlace de interés de "Vacunación acelerada" |
| 1 denero de 2026 | Nuevas citas bibliográficas y enlaces de interés |
-oOo-

