Actualizado en noviembre de 2025
Capítulo 24 - Fiebre amarilla
- Puntos clave [1]
- Introducción [2]
- Epidemiología de la enfermedad [3]
- Tipos de vacunas, composición y presentación [4]
- Inmunogenicidad, eficacia y efectividad [5]
- Vías de administración [6]
- Indicaciones y esquemas de vacunación [7]
- Administración con otras vacunas y otros productos [8]
- Efectos adversos [9]
- Precauciones y contraindicaciones [10]
- Observaciones [11]
- Bibliografía [12]
- Enlaces de interés [13]
- Historial de actualizaciones [14]
- Tablas y figura incluidas en el capítulo:
Tabla 24.1. Vacuna frente a la fiebre amarilla disponible en España [15]
Tabla 24.2. Pautas de vacunación frente a la fiebre amarilla [16]
Tabla 24.3. Criterios mayores y menores para la definición de caso de enfermedad viscerotrópica. [17]
Tabla 24.4. Contraindicaciones y precauciones de la vacunación contra la fiebre amarilla [18]
Figura 24.1. Países endémicos para la fiebre amarilla en África [19]
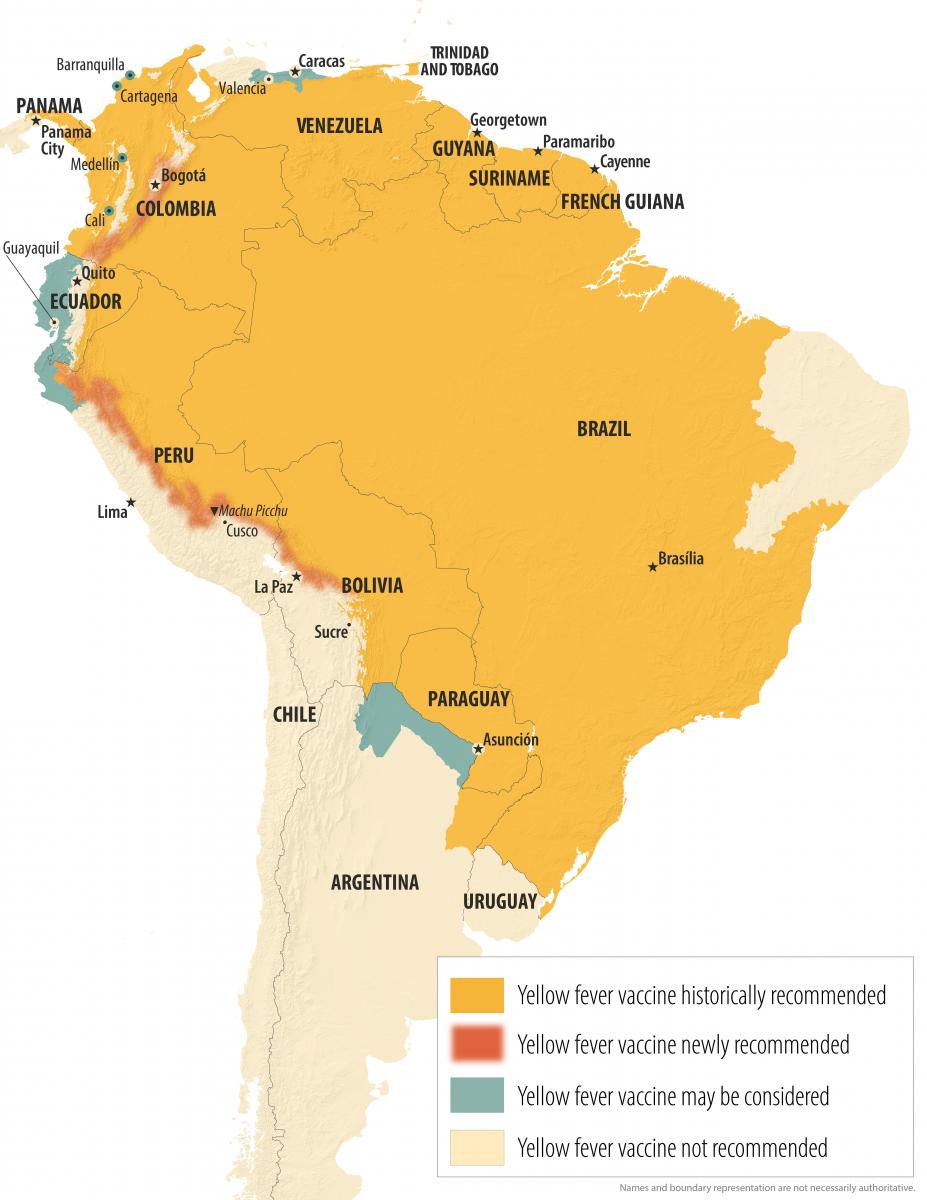
Figura 24.2. Países endémicos para la fiebre amarilla en Ámerica [20]
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Fiebre amarilla. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; nov/2025. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-24
⌂ [21]
1. Puntos clave
- La fiebre amarilla es una enfermedad hemorrágica viral aguda transmitida por mosquitos hembra de los géneros Aedes y Haemogogus. El nombre de "amarilla" lo recibe por la ictericia que presentan algunos pacientes. No existe un tratamiento específico para esta enfermedad y hasta el 50 % de las personas que presentan la forma grave de la enfermedad morirán a causa de la misma.
- El virus es endémico en las zonas tropicales de África y de Centro y Sudamérica y se estima que en 2018 se produjeron unos 109 000 casos graves y 51 000 muertes, la mayor parte de ellas en África.
- El número de brotes de fiebre amarilla, especialmente en medio urbano, se ha incrementado en las últimas dos décadas debido a la disminución de la inmunidad de la población a la infección, la deforestación, la superpoblación de las urbes, los movimientos migratorios de la población, el desarrollo de vías de comunicación entre grandes ciudades y el cambio climático.
- Desde 2017, OMS, UNICEF y Gavi se han unido para desarrollar una estrategia mundial integral para eliminar las epidemias de fiebre amarilla (EYE) teniendo a la vacunación masiva como pilar básico.
- La vacunación es la medida preventiva más importante contra la fiebre amarilla. Es una vacuna atenuada obtenida en huevo embrionado de pollo y de administración inyectable por vía subcutánea.
- Una sola dosis es suficiente para conferir inmunidad y protección de por vida, sin necesidad de dosis de recuerdo como recomendó la OMS en mayo de 2013 y quedando recogido en el Reglamento Sanitario Internacional (RSI) [22], en su tercera edición de 2016.
- Todos los países endémicos deben introducir la vacuna contra la fiebre amarilla en los programas nacionales de inmunización. En España, únicamente está indicada para viajeros a zonas endémicas o cuando lo exija el RSI. La vacunación solo es aplicable en las dependencias de Sanidad Exterior en las distintas provincias y en los Centros de Vacunación Internacional autorizados específicamente por el Ministerio de Sanidad (ver sección de enlaces de interés [23]).
⌂ [21]
2. Introducción
La fiebre amarilla (FA) está producida por un virus de tipo ARN, de cadena única que codifica 3 proteínas estructurales y 7 no estructurales, con simetría cúbica esférica, cubierto con una envoltura de lípidos y con proteínas de superficie que incluyen las glucoproteínas M y E. Pertenece a la familia Flaviviridae, que debe su nombre al virus de la fiebre amarilla ya que Flavus significa amarillo en latín. Tiene cuatro géneros, siendo uno de ellos el de los flavovirus. Se transmiten por artrópodos (por eso son parte del grupo de los arbovirus, del inglés arthropod-borne viruses) principalmente por garrapatas (grupo A) y mosquitos (grupo B, al que pertenece entre otros el virus de la fiebre amarilla). Se han descrito siete genotipos del virus de la FA, cinco de África y dos de las Américas.
Al igual que otros arbovirus, la mayoría de las personas con la infección son asintomáticas. La relación de infección sintomática a asintomática varía de 1:7 a 1:12. El número de personas con la infección es cuatro veces mayor en África occidental que en las Américas. El 85 % de los casos presentan una forma leve de la enfermedad. En América del Sur, entre las infecciones sintomáticas graves, la tasa de mortalidad alcanza el 40-60 % en comparación con el 20 % en África occidental.
Es una enfermedad viral que tiene tres formas epidemiológicas de presentación: a) forma urbana, en áreas geográficas endémicas, por picadura del artrópodo vector mosquito hembra Aedes aegypti u otro género y especie (tras alimentarse de los seres humanos en la fase virémica); b) forma selvática, donde suele ser enfermedad enzoótica mantenida entre primates no humanos y desde los que pasa, por varios vectores (mosquitos arbóreos Haemagogus spp o Aedes spp), al ser humano, y c) forma intermedia entre las dos anteriores; en este tipo de transmisión, los mosquitos semidomésticos (que viven en la selva y cerca de las casas) infectan a los primates y al hombre indistintamente. Este es el ciclo de transmisión más frecuente en algunos países de África.
En España, donde no hay casos en seres humanos descritos desde hace muchas décadas, ha sido recientemente descrita la presencia de mosquitos Aedes aegypti en las Islas Canarias, concretamente en Gran Canaria, donde parece haberse establecido. En la mayor parte de la Península Ibérica una especie del género Aedes, el Aedes albopictus, ha ido colonizando poco a poco distintas regiones y, aunque no es un vector eficaz de FA, sí lo es de otras arbovirosis (dengue, zika o chikunguña).
Tras los devastadores brotes en Angola y la República Democrática del Congo en 2016 que vieron la exportación de casos a China, se lanzó la Estrategia para Eliminar las Epidemias de Fiebre Amarilla (EYE), una acción liderada por la OMS, UNICEF y Gavi, en coalición con más de 50 socios en 40 países para hacer frente a la cambiante epidemiología de la enfermedad, la reaparición de mosquitos y el mayor riesgo de brotes urbanos y propagación internacional. Las epidemias de FA son complejas, por su naturaleza multifactorial y sus numerosas incógnitas. La amenaza de brotes de FA sigue afectando a países de África y las Américas pese a los esfuerzos hechos en los últimos años por evitarlo. Los brotes urbanos sin precedentes de 2016 demostraron que, a pesar de los avances en las actividades de inmunización, siguen existiendo desafíos para poner fin a las epidemias de FA en distintos países del mundo.
La estrategia fue respaldada por todos los Estados Miembros africanos durante la 67.ª Reunión del Comité Regional de la OMS para África y por el Grupo Regional de Asesoramiento Técnico sobre Inmunización (RITAG) de la OPS en 2017. EYE es una estrategia integral y a largo plazo basada en las lecciones aprendidas y que pretende poner fin a las epidemias de FA para 2026.
Consta de tres objetivos estratégicos:
- Proteger a las poblaciones de riesgo
- Prevenir la propagación internacional
- Contener rápidamente los brotes
Para la consecución de estos objetivos debe asegurarse: que haya vacunas asequibles y un mercado de vacunas sostenido (evitando roturas de stock); un fuerte compromiso político a nivel mundial, regional y nacional; una gobernanza de alto nivel con asociaciones a largo plazo; sinergias con otros programas y sectores sanitarios de forma transversal; e investigación y desarrollo de mejores herramientas y prácticas.
El Euro Health Group, con la orientación de la OMS, UNICEF y las oficinas de evaluación de Gavi, llevó a cabo una evaluación intermedia independiente de la Estrategia EYE (que abarca de 2017 a 2021), como una oportunidad para hacer balance de los progresos de la estrategia hasta la fecha y determinar la mejor manera de acercarse a la protección de casi mil millones de personas en África y en las Américas contra la FA para 2026. Desde 2017, según datos de la Estrategia EYE, 226 millones de personas más en África han sido protegidas contra la FA mediante una vacuna de dosis única que proporciona protección de por vida. Con la anterior iniciativa contra la fiebre amarilla, se protegió a 108 millones de personas en un periodo de 8 años. La coalición mundial de la Estrategia EYE ha contribuido a acelerar la vacunación durante este periodo.
⌂ [21]
3. Epidemiología de la enfermedad
La epidemiología de la FA ha sido muy cambiante en los últimos 25 años, objetivándose un pico en la incidencia de 2016 a 2018, año este último en el que se estimaron 109 000 casos graves y 51 000 muertes en todo el mundo. Aunque la declaración de los casos de enfermedad es obligatoria en la mayor parte de los países, existen evidencias de una infranotificación en la mayoría de los países endémicos. Se calcula que la incidencia es de 10 a 250 veces mayor que el número de casos notificados anualmente en la actualidad. La OMS clasifica las áreas geográficas según su nivel de riesgo en cuatro categorías: 1) “zona endémica” (recomendada la vacunación); 2) “zona transicional” (recomendada la vacunación); 3) “zona de bajo potencial de exposición” (vacunación solo si existiese larga estancia o intensa exposición con circunstancias específicas), y 4) “zona sin riesgo” (no recomendada la vacunación). El listado de países es actualizado por la OMS anualmente en el anexo I [24] de su publicación International Travel and Health (ITH). También se pueden ver en las figuras 24.1 [19] y 24.2 [20].
Figura 24.1. Países endémicos para la fiebre amarilla en África.
Tomado de Centers for Disease Control and Prevention. Yellow Book. Actualizado a diciembre de 2024. Este mapa es una versión actualizada del mapa de 2010 creado por el Grupo de Trabajo Informal de la OMS sobre el Riesgo Geográfico de la Fiebre Amarilla.
Figura 24.2. Países endémicos para la fiebre amarilla en América.
Tomado de Centers for Disease Control and Prevention. Yellow Book. Actualizado a diciembre de 2024. Este mapa es una versión actualizada del mapa de 2010 creado por el Grupo de Trabajo Informal de la OMS sobre el Riesgo Geográfico de la Fiebre Amarilla.
En 2024, según la OMS, hay 40 países (27 africanos y 13 de América Central y Sudamérica) en los que la enfermedad es endémica en todo el país o en algunas regiones, siendo 20 los países que comunicaron casos de fiebre amarilla (15 en la región africana, 5 en la región de las Américas). Ocasionalmente, los viajeros a países endémicos pueden importarla a países donde no existe. Para evitar estos casos importados, muchos países exigen un certificado de vacunación frente a la FA antes de expedir visados, sobre todo cuando los viajeros proceden de zonas endémicas. Basándose en ello, la OMS y los CDC han elaborado el mapa de recomendaciones vacunales que se actualiza cada año. En África, se produjo un brote masivo en Angola durante 2015-16 notificando 1132 casos y 168 muertes por FA y más de la mitad se produjeron en la capital, Luanda, que se extendió a la República Democrática del Congo y Uganda y causó más de 4000 casos, con 375 muertes. En Nigeria, en 2019, se notificaron 4189 casos sospechosos, pudiendo confirmarse mediante analítica solo 404 de ellos. En 2020 y 2021 se han producido casos en varios países africanos, siendo el más numeroso el brote de Ghana con 202 casos sospechosos del 15 de octubre al 27 de noviembre de 2021, incluidos 70 casos confirmados y 35 muertes (letalidad: 17 %). En 2022, se identificaron 65 casos confirmados y 8 muertes en 14 países (letalidad 12,3 %). Los países con mayor número de casos fueron República Centroafricana (14) y Camerún (11). La FA en África está clasificada como un evento de nivel 2 en la lista de la OMS en el sistema interno de calificación de emergencias sanitarias. En 2023 hubo en la Región de África de la OMS 86 casos confirmados de FA, incluidas 8 muertes (tasa de letalidad del 9,3 %), en 15 países: Camerún, Chad, Costa de Marfil, Gabón, Guinea, Guinea Ecuatorial, Níger, Nigeria, República Centroafricana, República del Congo, República Democrática del Congo (RDC), Senegal, Sudán del Sur, Togo y Uganda. En 2024 se notificaron un total de 142 casos confirmados en 15 países africanos, con brotes y situaciones propensas a epidemias, incluso en países sin antecedentes recientes de transmisión activa, como Angola, Burkina Faso y Malí. Los países que notificaron más de 5 casos confirmados fueron Burkina Faso, Camerún, Gabón, Ghana, Guinea, Nigeria y Uganda. Si bien solo se documentaron 4 fallecimientos entre los casos confirmados, la evolución de los pacientes no se notificó de manera sistemática, lo que limita la evaluación de la tasa de letalidad. Los patrones de transmisión ponen de relieve el riesgo continuo debido a la transmisión selvática, la propagación y la amplificación, tanto en poblaciones susceptibles, como en aquellas con factores de riesgo ocupacionales. A pesar de las campañas de vacunación masivas llevadas a cabo en varios de estos países, hubo muchas personas pertenecientes a poblaciones vulnerables, migrantes o aisladas que no accedieron a la vacunación.
En América del Sur hubo un brote en Perú y Bolivia de 2016 a 2017, que produjo más de 85 casos con 32 muertes. Brasil ha padecido dos grandes brotes de FA, durante los períodos estacionales (diciembre a mayo), en 2016-2017, con 778 casos humanos, incluidas 262 muertes y en 2017-2018, con 1376 casos y 483 muertes. Los estados de Rio de Janeiro y Sao Paulo, zonas turísticas libres de FA durante décadas, fueron los más afectados. En 2020 se notificaron algunos casos en Brasil y Perú, y en 2021 en estos mismos países además de en Venezuela, mientras que en 2022 se declararon 17 casos entre Bolivia, Brasil (5 casos cada uno, con 4 fallecidos en cada país, tasa de letalidad 80 %) y Perú (7, con 5 fallecidos, tasa de letalidad 71,4 %). En 2023, hubo 40 casos confirmados de FA en las Américas, con el resultado de 24 muertes (letalidad del 60 %). Los casos se notificaron en Bolivia, Brasil, Colombia y Perú. La mayoría tenían antecedentes de exposición a zonas silvestres o boscosas debido a actividades laborales o recreativas. Durante el mismo periodo, se confirmaron 9 muertes por fiebre amarilla en primates no humanos (monos) en Brasil. En 2024, se confirmaron 61 casos de fiebre amarilla en humanos en la región de las Américas, de los cuales 30 fueron mortales. Estos casos se distribuyeron en cinco países: el Estado Plurinacional de Bolivia, Brasil, Colombia, Guyana y Perú. Bolivia y Brasil notificaron ocho casos y cuatro muertes cada uno de ellos; Colombia notificó 23 casos, trece de ellos mortales; Guyana notificó tres casos; y Perú notificó 19 casos, nueve de ellos mortales. La mayoría de los casos estuvieron relacionados con la exposición silvestre y ocupacional en zonas boscosas dedicadas a la agricultura, la tala, la extracción de piedra y el ecoturismo. Los afectados fueron predominantemente hombres adultos en edad laboral.
La vacuna contra la FA debe administrarse durante la infancia en áreas endémicas como parte de los programas de vacunación de rutina y las actividades de inmunización suplementarias, incluida la respuesta de emergencia durante brotes y campañas de recuperación en áreas endémicas. Once de los 40 países de alto riesgo a nivel mundial han alcanzado el umbral de inmunidad del 80 %, necesario para limitar la amplificación del virus de la fiebre amarilla en las comunidades, lo que subraya la urgencia de ampliar la vacunación. Entre los ejemplos recientes de éxito se incluyen las campañas de vacunación dirigidas a trabajadores de alto riesgo, realizadas entre 2024 y mediados de 2025 como parte del control de brotes. La cobertura mundial mejoró ligeramente, pasando del 58 % en 2022 al 62 % en 2023 y al 64 % en 2024. En total, aproximadamente 20,7 millones de niños fueron protegidos mediante la vacunación sistemática: 17,3 millones en África y 3,4 millones en América Latina y el Caribe. En África, 22 de 27 países con riesgo de transmisión la habían introducido ya en su programa de inmunización infantil en 2017. En la actualidad son 25 (en Kenia, limitada a 4 regiones) y, en ellos, la cobertura global pasó del 57 % en 2022 al 62 % en 2023 y al 64 % en 2024. Cinco (20 %) países alcanzaron una cobertura ≥80 %, en comparación con 3 países en 2022; Liberia y Sierra Leona se han unido a Burkina Faso, Ghana y Níger en la consecución de este objetivo. Senegal, con una cobertura del 76 %, no ha podido alcanzar la tasa de cobertura del 80 % desde 2020. Etiopía y Sudán del Sur aún no han introducido la vacuna contra la fiebre amarilla en sus calendarios de inmunización sistemática, aunque la primera ha solicitado a Gavi, la Alianza para la Vacunación, su inclusión para 2026. Desde 2017, más de 336 millones de personas en África han sido protegidas contra la fiebre amarilla mediante la vacunación y campañas de recuperación, con 71,9 millones de vacunados solo en 2024, incluidos 5,1 millones en campañas reactivas. Solo en 2023, más de 60 millones de personas fueron vacunadas en Nigeria, Uganda, RDC y Sudán, y en 2024, más de 66 millones en Chad, Nigeria, RDC y Uganda, acercándose o logrando la protección nacional. Este programa ofrece una oportunidad sin precedentes para poner fin a las devastadoras epidemias de FA que se suceden sin cesar en el continente africano. Los brotes urbanos son más frecuentes en África y su desaparición es uno de los objetivos de la estrategia EYE.
En las Américas, todos los países con transmisión de la FA han introducido esta vacuna en sus programas de vacunación de rutina desde al año 2000, pero debido a una cobertura insuficiente, al menos, 11 de estos países están llevando a cabo campañas de recuperación para llegar a los focos de poblaciones no vacunadas. Entre 2019 y 2024, la cobertura de vacunación contra la fiebre amarilla en América Latina y el Caribe fluctuó notablemente debido a la pandemia de COVID-19 y a las decisiones operativas sobre la administración simultánea de la vacuna. Antes de la pandemia, la cobertura regional era del 61 %, por debajo del umbral ≥95 % recomendado en las Américas para prevenir brotes en entornos de transmisión selvática. La pandemia interrumpió los servicios de inmunización en toda la región, lo que provocó una disminución significativa de la cobertura entre 2020 y 2022. Esta disminución incrementó el número de personas susceptibles en todos los países endémicos, aumentando el riesgo de brotes. En 2023 se inició una recuperación lenta pero constante, con una cobertura regional que aumentó al 63 % y posteriormente al 67 % en 2024. Si bien esta tendencia refleja un renovado esfuerzo por restablecer los servicios de rutina, sigue siendo insuficiente, ya que una cobertura de entre el 80 % y el 94 % deja lagunas de inmunidad, y una cobertura inferior al 80 % representa un riesgo muy alto de un brote a gran escala. El 3 de febrero de 2025, la OPS/OMS emitió una alerta epidemiológica tras un aumento de casos de fiebre amarilla en países de Sudamérica. El 17 de abril, Colombia declaró una emergencia de salud pública debido al incremento de casos de fiebre amarilla. Entre el 1 de enero y el 13 de abril de 2025, se notificaron 189 casos confirmados y 74 defunciones asociadas a la fiebre amarilla en cuatro países: Bolivia, Brasil, Colombia y Perú. Según medios de comunicación que citan fuentes oficiales, recientemente también se han notificado casos de fiebre amarilla en Ecuador, incluyendo dos defunciones.
A pesar de la disponibilidad de una vacuna altamente efectiva, los brotes de FA han continuado y se han expandido a nuevas áreas en los últimos años. Muchas poblaciones siguen siendo vulnerables a los brotes. El aumento de los viajes mundiales y los movimientos de población plantean riesgos de introducción en grandes áreas urbanas en áreas tropicales y subtropicales que están infestadas de mosquitos capaces de trasmitir esta arbovirosis. Para prevenir la transmisión en los brotes de FA es importante que se vacune de forma rápida a la mayoría de la población en riesgo (80 % o más). Las deficiencias en la inmunización sistemática, la investigación tardía de casos y la insuficiencia de recursos en los sistemas de salud siguen obstaculizando el control de la epidemia. Además, la demora en la recepción de muestras en los laboratorios de referencia limita la investigación oportuna y la evaluación de la relevancia epidemiológica en tiempo real.
El riesgo para los viajeros es muy variable dependiendo de la zona visitada, la estación del año, la duración y el tipo de viaje, además de las condiciones individuales del propio viajero. Una estimación en viajeros no vacunados sitúa el riesgo en viajes de 2 semanas a áreas endémicas de África en 50 casos por cada 100 000, siendo 10 veces menor en las de América. La transmisión del virus de la FA en las zonas rurales de África occidental es estacional (al final de la estación lluviosa y al principio de la estación seca), normalmente entre julio y octubre es el periodo de mayor riesgo. En África oriental la transmisión del virus de la FA suele ser menos predecible porque a menudo transcurren largos periodos (años) entre la actividad del virus en esta región. Cuando se produce la transmisión del virus de la FA en África oriental, la estacionalidad es similar a la de África occidental.
El riesgo de infección por vectores selváticos en Sudamérica es mayor durante la estación de lluvias (enero-mayo, con un pico de incidencia durante febrero y marzo). Sin embargo, Ae. aegypti puede transmitir el virus de la fiebre amarilla de forma episódica, incluso durante la estación seca, tanto en zonas rurales como en zonas urbanas densamente pobladas.
El ECDC publicó el 8 de febrero de 2021 el registro de casos importados en Europa en 2019, donde no se comunicó ningún caso. En 2018: hubo 13 (el mayor número de casos comunicados en la Unión Europea en un solo año), de ellos 12 provenían de Brasil y uno de Senegal o Gambia. Los pacientes fueron detectados y notificados en Francia (7 casos), Alemania (2) y uno en Chequia, Holanda, Rumanía y Reino Unido. En los cuatro años anteriores, el ECDC solo había publicado un caso en Holanda procedente de Surinam. En 2020 se diagnosticaron dos casos importados en Francia y ninguno en 2021, 2022 y 2023 en toda Europa.
Una vez inoculado el virus por el vector, tras un periodo de incubación de 3-6 días aparecen los síntomas agudos, habitualmente de breve duración y variada expresión clínica. Los síntomas más frecuentes de la FA son: fiebre, cansancio, cefaleas, ictericia, dolores musculares, náuseas y vómitos. En la mayoría de los casos los síntomas desaparecen en 3 o 4 días, aunque en algunas personas la astenia puede durar varios meses. La viremia dura desde poco antes de iniciar la fiebre hasta el quinto día del cuadro clínico de media. Una pequeña proporción de pacientes (uno de cada 7, aproximadamente) presentan síntomas graves, y aproximadamente la mitad de estos casos fallecen en un plazo de 7 a 10 días. Estos pacientes entran a las 24 horas de la remisión inicial en una segunda fase, más tóxica, donde reaparece la fiebre elevada y se ven afectados varios órganos (el hígado y los riñones frecuentemente). En esta fase son frecuentes la ictericia (signo que da nombre a la enfermedad), la coluria, el dolor abdominal y la aparición de vómitos. Puede haber hemorragias orales, nasales, oculares o gástricas que son consecuencia del fallo hepático.
Ante la sospecha clínica, debe notificarse urgentemente a la Autoridad Sanitaria, a los efectos de notificación al Ministerio, para cumplir con el Reglamento Sanitario Internacional (2005). Es de declaración obligatoria (EDO) y urgente con datos epidemiológicos básicos (DEB). En nuestro medio, el diagnóstico definitivo solo puede efectuarse, con el diagnóstico directo (en muestras de sangre), mediante el aislamiento del virus o con mayor frecuencia de su material genético (RT-PCR). El diagnóstico indirecto (en muestras de suero) se establece por: a) demostración de un alto título de anticuerpos específicos IgM (los posvacunales pueden persistir durante años) y b) aumento de cuatro veces el título de anticuerpos específicos IgG-neutralizantes entre dos muestras de suero tomadas de la fase aguda y de la convaleciente (seroconversión). La serología debe completarse con el test de neutralización por reducción de placas (PNRT) y así disminuir la probabilidad de falsos positivos. En el estudio, conviene descartar otros flavivirus en la misma muestra. No hay tratamiento antiviral específico (pese a los estudios con ribavirina), por lo que hay que manejar a los pacientes con tratamiento de soporte, frecuentemente en una unidad de cuidados intensivos.
Debido al alto nivel de viremia, la transmisión sanguínea puede producirse teóricamente a través de transfusiones o pinchazos con agujas. Se ha documentado un caso de transmisión perinatal del virus FA de tipo salvaje a partir de una mujer que desarrolló síntomas de 3 días antes del parto; posteriormente, el bebé dio positivo en las pruebas de ARN viral de FA y murió el duodécimo día de vida.
⌂ [21]
4. Tipos de vacunas, composición y presentación
La vacuna utilizada en España frente la fiebre amarilla, se encuentra comercializada con el nombre de Stamaril, del laboratorio Sanofi-Pasteur. Es una vacuna atenuada, termoestable y liofilizada. Se obtiene por cultivo de la cepa 17 D exenta del virus de la leucosis aviar (Fundación Rockefeller), con un único serotipo antigénico que es válido para ambos continentes. La atenuación se realiza mediante múltiples pases en huevo embrionado de pollo. La dosis (0,5 ml) usual no debe contener menos de 1000 unidades DL50 (dosis letal determinada estadísticamente en el 50 % de los ratones analizados). En 2016 la OMS estableció que, de forma excepcional, en el caso de que hubiera escasez de vacunas para controlar un brote, podría utilizarse la vacuna antiamarílica (como también se la conoce) fraccionada en cantidades de 1/5 del volumen total (0,1 ml). De esta forma se han combatido brotes en Angola, Uganda, República Democrática del Congo (RDC) y Brasil. Los resultados obtenidos en la RDC demostraron seroconversión en el 98 % de los receptores de dosis fraccionadas a los 28 días, y que el 85 % era seropositivo 8 años después de la vacunación. En otro estudio de seguimiento de un pequeño subgrupo de vacunados, a los 10 años el 98 % tenía anticuerpos protectores neutralizantes. Las dosis fraccionadas de Stamaril pueden ser administradas también por vía intradérmica (ID), vía que ofrece la ventaja potencial de imitar la inoculación natural de FA por un mosquito infectado y promover que las células dendríticas infectadas de la dermis y epidermis viajen a los ganglios linfáticos regionales, lo que acabará en viremia e infección sistémica. Dos estudios realizados en los Países Bajos han demostrado la no inferioridad de la dosis fraccionada de la vacuna de FA en comparación con la dosis completa amarilla en términos de inmunogenicidad y duración de la seroconversión.
Los expertos (SAGE) han concluido que las pruebas disponibles son suficientes para determinar que la administración de una fracción de la dosis de la vacuna contra la FA (0,1 ml en lugar de 0,5 ml), administrada por la vía habitual SC/IM, aunque también se ha utilizado la ID, podría ser una opción segura y eficaz para las campañas de vacunación colectiva destinadas a controlar los brotes urbanos en situaciones de escasez aguda de vacunas. No se ha establecido aún la duración de esta protección. En menores de 2 años se recomienda la administración de la dosis completa preferentemente.
Presentación y reconstitución
Se presenta en vial con vacuna, junto con una jeringuilla que contiene 0,5 ml de diluyente. Debe almacenarse entre +2 °C y +8 °C, protegerse de la luz en su envase externo antes de su uso. No se debe congelar. Su validez tras la reconstitución es tan solo para uso inmediato porque el preparado vacunal es muy termolábil, por lo que debe ser administrada de forma inmediata.
Actualmente hay seis productores de vacunas contra la fiebre amarilla, de los cuales solo cuatro son considerados como precalificados por la OMS: Bio-Manguinhos (Río de Janeiro, Brasil), Sanofi Pasteur (Lyon, Francia), el Instituto Pasteur (Dakar, Senegal) y el Instituto de Poliomielitis y Encefalitis viral (Moscú, Rusia).
Tabla 24.1. Vacuna frente a la fiebre amarilla disponible en España.
| Vacuna (Laboratorio) |
Composición | Presentación (dosis) |
Conservación (validez) |
| STAMARIL (Sanofi Pasteur) |
- Polvo con virus atenuados cepa 17D-204, que se cultivaron en embriones de pollo, exentos de leucosis aviar. Concentración como mínimo DL50 de 1000 UI en medio estabilizante. - Excipientes a) polvo: lactosa, sorbitol E420, clorhidrato de L-histidina, L-alanina, ClNa, ClK, fosfato disódico, fosfato monopotásico, cloruro cálcico y sulfato magnésico. b) disolvente: ClNa y agua para inyectables |
- 1 vial con vacuna en polvo (beis-anaranjado) con tapón (clorobutilo) - 1 jeringa con diluyente (0,5 ml) transparente-incoloro; (émbolo de clorobromobutilo). Inyectar en el vial y agitar, antes de aplicar |
1 dosis = 0,5 ml Conservar (+2 ºC/ +8 ºC). No congelar. Validez (3 años) |
⌂ [21]
5. Inmunogenicidad, eficacia y efectividad
En personas inmunocompetentes la inmunogenicidad, como ocurre en casi todos los preparados vacunales de virus atenuados, es excelente. Se cree que una dosis de la vacuna proporciona inmunidad protectora de por vida (más de 35 años) y los anticuerpos neutralizantes son el correlato de la protección. Las tasas de seroconversión son elevadas 30 días después de la vacunación (97-99 %), y estas tasas no varían en función de la edad. A los 10 días de la administración de la vacuna, cuando el certificado se considera válido, se estima un nivel de protección del 95 %.
A efectos del Certificado Internacional de Vacunación (CIV) la validez de la protección de la vacuna se prolonga a lo largo de toda la vida.
⌂ [21]
6. Vías de administración
La vacuna reconstituida, se aplica por vía subcutánea (preferible) o intramuscular (en brazo o muslo, según la edad). La vacuna es facilitada y aplicada por los Centros de Vacunación Internacional [27] autorizados por el Ministerio de Sanidad (Dirección General de Salud Pública). Tal y como se ha comentado anteriormente, la administración por vía ID de 1/5 del volumen total (0,1 ml) está avalada por la OMS en el contexto de brotes y problemas de disponibilidad de dosis (en mayores de 2 años). Sin embargo, la misma OMS considera que la dosis fraccionada no cumple los requisitos de vacunación contra la fiebre amarilla establecidos en el Reglamento Sanitario Internacional (RSI), por lo que no se puede expedir una certificación de vacunación para viajes internacionales a una persona que sólo haya recibido una dosis fraccionada.
⌂ [21]
7. Indicaciones y esquemas de vacunación
- En los países endémicos se recomienda la vacunación en los programas nacionales a todos los niños a la edad de 9-12 meses al mismo tiempo que la vacuna contra el sarampión. Además, se recomiendan campañas preventivas de vacunación masiva para los habitantes de zonas endémicas de fiebre amarilla en las que existe una baja cobertura de vacunación.
- La vacunación está indicada en todos los viajeros mayores de 9 meses de edad no vacunados que viajen hacia y desde las zonas de riesgo (tabla 24.2 [16]), a menos que pertenezcan a un grupo de personas para las que la vacunación contra la fiebre amarilla esté contraindicada (tabla 24.4 [18]).
- La vacuna debe administrarse, al menos, 10 días antes de entrar en un área endémica ya que la inmunidad protectora puede no alcanzarse hasta que, al menos, haya transcurrido este tiempo.
- No debe administrarse a niños menores de 6 meses edad. Podría utilizarse excepcionalmente entre 6 y 9 meses de edad en situaciones concretas, donde el riesgo de exposición sea muy elevado. La dosis también sería de 0,5 ml. Las dosis fraccionadas se utilizan, en casos excepcionales, y siempre por encima de los 2 años. A no ser que se trate de circunstancias inaplazables, ningún niño menor de 9 meses debería viajar a zonas donde la fiebre amarilla sea endémica.
- A partir de los 60 años de edad (debido al aumento del riesgo de efectos adversos graves asociados a la vacunación) solo debe aplicarse, si existiese riesgo considerable e inevitable para la transmisión del virus.
- Desde mayo de 2013 la OMS considera que una sola dosis de la vacuna contra la fiebre amarilla es suficiente para conferir inmunidad protectora sostenida durante toda la vida contra la enfermedad por lo que no sería necesario la administración de dosis de refuerzo. El Reglamento Sanitario Internacional (RSI) (tercera edición, 2016) así lo recoge.
Las pautas de vacunación se muestran en la tabla 24.2 [16].
Tabla 24.2. Pautas de vacunación frente a la fiebre amarilla.
| Vacuna (Laboratorio) |
Edad de administración (vía) | N.º dosis | Dosis refuerzo |
| STAMARIL (Sanofi Pasteur) |
Edad ≥9 meses Vía subcutánea preferible. Si se utiliza IM, en región anterolateral externa del muslo para las edades 9 meses a 2 años. Niños mayores y adultos, en deltoides |
1_dosis | No necesaria |
Aunque no existe acuerdo generalizado y no se establece en el RSI, algunos autores consideran que puede valorarse la revacunación frente a la fiebre amarilla en los siguientes casos:
- Mujeres que recibieron la dosis anterior estando embarazadas: deben recibir una nueva dosis antes de su siguiente viaje o exposición.
- Personas que recibieron un trasplante de células hematopoyéticas después de la vacunación anterior y que han recuperado la inmunocompetencia (al menos, 2 años después del transplante y sin evidencia de enfermedad inherto contra huésped).
- Personas con infección por VIH (recuento de CD4 200-499/µl) u otras formas de inmunodeficiencias o con tratamientos inmunosupresores, deben recibir refuerzos cada 10 años mientras se mantengan o vuelvan a zonas endémicas.
- Otras condiciones que presuntamente comportan cierta inmunodepresión como la malnutrición intensa.
- Profesionales de laboratorios que manipulan virus de la fiebre amarilla, previa comprobación serológica.
- Personas que fueron vacunadas con dosis fraccionada; aunque actualmente no hay ninguna recomendación, podría ser necesaria en el futuro.
- Los niños que recibieron la vacuna contra la fiebre amarilla a una edad temprana, particularmente para aquellos que recibieron la vacuna a los 9 meses de edad.
- En la Guyana francesa recomiendan que los que recibieron la primera dosis con menos de 24 meses de edad, recibirán una segunda dosis cuando cumplan 6 años.
- El JCVI en junio de 2019 considera que cuando la fiebre amarilla y la triple vírica se administran juntas o dentro de un mes de diferencia, se debe administrar una dosis adicional de la vacuna contra la fiebre amarilla a los 10 años de su aplicación.
⌂ [21]
8. Administración con otras vacunas y otros productos
Respecto de la administración en el mismo acto de otras vacunas junto a la de FA, cabe matizar determinados aspectos:
- Las vacunas inactivadas pueden ser administradas al mismo tiempo, antes o después
- La administración simultánea de las vacunas triple vírica (SRP) y antiamarílica condiciona, sobre todo en menores de 2 años, una reducción en la magnitud de la respuesta humoral frente a la fiebre amarilla, rubeola y parotiditis, lo que se evita separándola por un intervalo mínimo de 4 semanas. La OMS, sin embargo, encarece su aplicación al mismo tiempo cuando la perentoriedad de su indicación no permita respetar este intervalo ideal, dado que la respuesta que induce frente a estos antígenos es suficientemente robusta. Sin embargo, alerta sobre la posibilidad de que genere una inmunogenicidad menos duradera y facilite fallos secundarios de la inmunización. Por ello, si se procede a su administración simultánea, debería considerarse la aplicación de una dosis adicional de las vacunas SR, SRP o SRPV a partir de las 4 semanas siguientes, para asegurar su efectividad en el contexto de su indicación sistemática, así como una revacunación frente a la fiebre amarilla a los 10 años en caso de persistencia del riesgo de exposición a la enfermedad, como indica el JCVI del Reino Unido. Las mismas consideraciones pueden extenderse a vacunaciones practicadas con la vírica bicomponente (SR) o la tetracomponente (SRPV)
- Entre la administración de vacunas vivas parenterales monocomponentes o la antigripal intranasal y la antiamarílica, no es preciso guardar ninguna separación temporal predeterminada, pudiéndose aplicar concomitantemente o con cualquier intervalo de tiempo. Como ya se comentó, conviene en cambio respetar el preceptivo intervalo de 4 semanas entre la de SRP (o SR, o SRPV) y la antiamarílica; sin embargo, cuando se necesite una protección rápida o para no perder la oportunidad de su recepción, se acepta y recomienda su administración simultánea o con cualquier intervalo menor, puesto que no impide la inducción de suficientes niveles de anticuerpos protectores específicos
- Se puede administrar a la vez o separada por cualquier intervalo de las vacunas atenuadas orales (fiebre tifoidea, rotavirus, poliomielitis). No hay datos sobre la respuesta inmune a la vacuna viva atenuada contra el cólera oral administrada simultáneamente con Stamaril
⌂ [21]
9. Efectos adversos
En general son poco frecuentes y banales, y se producen en los 10-12 días tras la vacunación (más frecuentes entre los días tercero y séptimo). La viremia por la cepa vacunal está presente entre sanos después de la primovacunación, para ir desapareciendo tras una semana.
Las reacciones adversas conocidas están derivadas de datos obtenidos de estudios clínicos y de la experiencia poscomercialización. En los ensayos clínicos, las reacciones locales registradas, con clínica leve en el 12-18 % de vacunados, son dolor, enrojecimiento, hinchazón, induración o hematoma. En los niños pequeños, las reacciones notificadas con mayor frecuencia (entre el 32 % y el 35 %) fueron irritabilidad, llanto, somnolencia y pérdida de apetito. Las reacciones muy frecuentes (≥10 %) fueron cefaleas; las frecuentes (≥1 % y ≤10 %), náuseas, vómitos, diarreas, mialgias, fiebre y astenia, y las poco frecuentes (≥1 por 1000 y ≤1 %), dolor abdominal y artralgias.
Como reacciones adversas graves MAPI (manifestaciones posvacunales indeseables) o AEFI (adverse events following immunization), se han descrito, de forma esporádica, tres cuadros clínicos:
- Hipersensibilidad grave o anafilaxia, citándose como posibles alérgenos: huevos y proteínas de pollo o gelatina; esta última no está presente en Stamaril. La tasa de anafilaxia es de 0,76 casos por 100 000 dosis administradas.
- Enfermedad neurotrópica asociada a vacuna (ENA-VFA o YEL-AND), que engloba la “enfermedad neurotrópica” y también las “neurológicas autoinmunes” que afectan al sistema nervioso central (SNC) o periférico (SNP). El riesgo estimado es de 0,8/100 000 vacunas en menores de 60 años, y 2,2/100 000 en mayores de esta edad, con muy baja letalidad. Se puede manifestar como fiebre alta con cefalea que puede evolucionar hasta incluir uno o más de los siguientes síntomas: confusión, letargo, encefalitis, encefalopatía y meningitis, habitualmente en los 30 días siguientes a la primovacunación, no habiéndose comunicado casos tras las revacunaciones. Se han notificado otros signos y síntomas neurológicos que incluyen convulsión, síndrome de Guillain-Barré y déficits neurológicos focales.
- Enfermedad viscerotrópica asociada a vacuna (EVA-VFA o YEL-AVD). La incidencia registrada en VAERS es de 0,3-0,4 casos/100 000 dosis distribuidas, con un riesgo estimado de 0,3/100 000 vacunas en menores de 60 años y 1,2/100 000 en mayores de esta edad, y una letalidad del 30-63 %. Los signos y síntomas iniciales son inespecíficos y pueden incluir fiebre, mialgia, fatiga, cefalea e hipotensión, lo que podría progresar rápidamente a una disfunción hepática con ictericia, citolisis muscular, trombocitopenia, insuficiencia respiratoria aguda e insuficiencia renal. Habitualmente suceden en los 10 días siguientes a la primovacunación, no habiéndose comunicado casos tras las revacunaciones. La definición de caso de EVA-VFA en la infancia se basa en los siguientes criterios (Brighton Collaboration) (tabla 24.3 [17]), valorables tras su asociación temporal con la vacunación y en ausencia de otra alternativa diagnóstica:
Tabla 24.3. Criterios mayores y menores para la definición de caso de enfermedad viscerotrópica.
| Criterios mayores | |
| Hepáticos |
Bilirrubina total >1,5 veces del LNS (o >1,5 veces el valor basal del paciente, si se conoce) o ALT o AST >3 veces del LNS (o >3 veces del valor basal del paciente si se conoce) |
| Renales |
Creatinina >1,5 veces del LNS (o >1,5 veces del valor basal del paciente si se conoce) |
| Musculoesqueléticos |
CPK >5 veces del LNS |
| Respiratorios |
Saturación de oxígeno <88 % con aire ambiental o requerimiento de ventilación mecánica |
| Trastornos plaquetas |
Plaquetas <100 000/µl |
| Hipotensión |
Requerimiento de fármacos vasopresores para mantener la TA sistólica |
| Coagulopatía |
INR >1,5 o TP >1,5 veces del LNS o TTPA >1,5 veces del LNS o PDF elevados o hemorragia en más de una localización |
| Criterios menores | |
| Hepáticos |
Ictericia |
| Renales |
Diuresis <500 ml orina/24 h (adultos) o <0,5 ml/kg/hora para niños |
| Musculoesqueléticos |
Hematuria en tira de orina con un examen de microscopía de orina negativa para glóbulos rojos |
| Respiratorios |
Aumento de la frecuencia respiratoria para la edad |
| Trastornos plaquetas |
Presencia de petequias o púrpura |
| Hipotensión |
TA sistólica <90 mm Hg (adultos) o <percentil 5 para la edad (niños) |
| Coagulopatía |
Hemorragia clínicamente evidente (una de las siguientes): epistaxis, hematemesis, melena, hematoquecia, hemoptisis, metrorragia o menorragia, hemorragia gingival o sangrado persistente de sitios de punción con aguja |
LNS: límite normal superior para el rango de referencia de valores normales. TA: Tensión arterial. TP: tiempo de protrombina. TTPA: tiempo de tromboplastina parcial activada. PDF: productos de degradación del fibrinógeno.
Tomado de: Thomas RE. Yellow fever vaccine-associated viscerotropic disease: current perspectives [28]. Drug Des Devel Ther. 2016;10:3345-53.
Cuando se usa ≥1 criterio mayor o un criterio mayor y uno menor para cumplir con la definición de caso, cada criterio debe referirse a un sistema orgánico diferente (por ejemplo, hepático o renal).
Los niveles de certeza diagnóstica son: nivel 1: ≥3 criterios mayores; nivel 2: dos mayores; o uno mayor y ≥2 menores; nivel 3: ictericia y ≥2 criterios menores; o ≥3 menores; o uno mayor y uno menor.
El nivel 1 es más específico, mientras que los niveles 2 y 3 son menos específicos pero de mayor sensibilidad.
⌂ [21]
10. Precauciones y contraindicaciones
La vacuna está contraindicada en los siguientes casos (tabla 24.4 [18]):
- Hipersensibilidad con anafilaxia confirmada a proteínas de huevo, ovoderivados o proteína de pollo. Alergia grave a otro componente del preparado.
- Niños con edad inferior a los 6 meses.
- Enfermedad febril aguda intercurrente.
- Alteraciones de la inmunidad
- Inmunodeficiencias primarias.
- Historia de disfunción del timo (timoma, timectomía, miastenia gravis).
- Infección por el VIH sintomática
- Infectados por el VIH asintomáticos, pero inmunodeprimidos: linfocitos T CD4+ <200/mm3(o <15 % del total de linfocitos para niños menores de 6 años de edad), basado en el aumento de riesgo de encefalitis.
- Neoplasias malignas.
- Trasplantados de órgano sólido o receptores de progenitores de células hematopoyéticas en los dos primeros años del trasplante; o que siguen con fármacos inmunosupresores pasados dos años, ya que estos deben ser considerados inmunosuprimidos.
- Personas en tratamiento inmunomodulador o inmunosupresor, como corticoides sistémicos según dosis y si es tratamiento ≥2 semanas, antineoplásicos, citotóxicos, inhibidores de α-TNF, agentes bloqueantes de IL-1, otros anticuerpos monoclonales o radioterapia.
La legislación de la Unión Europea ha establecido una concentración de 2 μg/ml como la concentración máxima permitida de proteína del huevo que se considera segura en pacientes con anafilaxia previa al huevo. En las vacunas contra la FA, las concentraciones de ovoalbúmina varían de 2,43 μg/ml a 4,42 μg/ml, según el lote.
Debido a la epidemia de FA en Brasil en 2017-2018, la mayor desde 1980, la vacunación se hizo indispensable. Se realizó un estudio con 132 pacientes con antecedentes de alergia al huevo, a los que se les hicieron pruebas cutáneas con la vacuna Bio-Manguinhos contra la FA (prick test, prueba cutánea intradérmica o ambas). Aquellos con una prueba de punción cutánea negativa y prueba cutánea intradérmica negativa (92, 70 %) fueron vacunados bajo supervisión médica con la dosis estándar. A 40 pacientes (30 %) que tenían prueba cutánea positiva (17) o prueba cutánea intradérmica (23, después de una prueba de punción cutánea negativa) se les sometió a desensibilización con cuatro aplicaciones sucesivas cada 30 minutos, la primera a concentración 1:10 (0,05 ml) y las 3 siguientes sin dilución (0,5 ml, 0,15 ml y 0,3 ml), sin ocurrir eventos adversos, demostrando que este protocolo es seguro. En un reciente estudio australiano, se administró la vacuna contra la fiebre amarilla a 11 niños alérgicos al huevo, incluidos 3 con anafilaxia, en 2 hospitales pediátricos terciarios australianos, sin que ocurrieran eventos adversos graves.
En los casos en los que la vacuna se encuentre contraindicada, debe expedirse en un CVI oficial un certificado, al menos, en dos iodiomas (inglés y francés) justificativo donde se detalle la causa de la exención vacunal, tanto para niños como para adultos que requieran el Certificado Internacional de Vacunación. Pese a esta certificación, el viajero debe saber que las Autoridades Sanitarias del país receptor podrían aceptar o no dicha certificación.
Respecto a las precauciones, ha de prestarse especial atención a los puntos siguientes (tabla 24.4 [18]):
- Podría aplicarse a niños de 6-8 meses, en situaciones de muy alto riesgo, pero valorando el que se ha descrito mayor susceptibilidad a encefalitis (enfermedad neurotrópica asociada a la vacuna con incidencia 50-400 casos/105 niños vacunados).
- Personas ≥60 años edad, por el riesgo de enfermedad asociada a la vacunación (en forma neurotrópica o viscerotrópica).
- Personas infectadas por el VIH que potencialmente necesiten protección, deben realizar consulta en una unidad de enfermedades infecciosas pediátricas, para valorar la recomendación según el seguimiento clínico al que estén sometidos:
- Infectados sin evidencia de inmunodeficiencia con CD4+ ≥500 cel/mm3 (o ≥25 % del total de linfocitos en niños menores de 6 años), la vacuna pudiera administrarse según el área endémica a visitar/residir.
- Personas que son tratadas con el antirretroviral antagonista del correceptor CCR-5 (Maraviroc), tienen riesgo incrementado para reacción adversa grave viscerotrópica.
- En la infección asintomática y con moderado inmunocompromiso (CD4+ = 200-499 cel/mm3 en ≥6 años de edad o con 15-24 % del total de linfocitos en <6 años de edad), se ha valorado la respuesta que se puede producir con anticuerpos específicos, registrándose en solo 17 % a los diez meses de la vacunación contra la FA valorados por test de neutralización (PNRT de reducción de placas) en países en desarrollo. Parece estar condicionada la respuesta por la carga viral y el recuento de CD4+.
- Gestantes, que prevean un viaje inminente e imposible de diferir en el tiempo a áreas endémicas, o ser contacto próximo y no vacunado de un caso confirmado y siempre con justificación epidemiológica.
- Aunque no hay datos específicos, se recomienda evitar el embarazo en las 4 semanas siguientes a la administración de la vacuna a una mujer en edad fértil.
- La vacunación de una mujer lactante puede causar la excreción de algunas partículas virales a través de la leche, por lo que debe valorarse las implicaciones de este hecho para el lactante, aunque la información disponible sobre ello es escasa:
- Si el lactante es menor de 9 meses o padece una inmunodeficiencia (primaria o secundaria a un tratamiento inmunosupresor), deberá tenerse en cuenta el riesgo de FA en la madre, priorizando su vacunación en caso de ser elevado y recomendando la interrupción temporal de la lactancia materna, desechando la leche durante las 2 semanas que sigan a la vacunación.
- Si el lactante es mayor de 9 meses y sano, la vacunación de la madre es compatible con mantener la lactancia materna y además habría que valorar, si estuviera indicada, la vacunación del propio lactante. Esta opción es también aceptable en lactantes de 6 a 9 meses en situaciones de muy alto riesgo (grandes epidemias de fiebre amarilla).
- Paciente con problema hereditario de intolerancia a la fructosa (casos raros hereditarios) por el sorbitol que lleva como excipiente.
- No hay datos sobre posibles eventos adversos aumentados o una disminución de la eficacia de la vacuna después de la administración de la vacuna de la fiebre amarilla a pacientes con afecciones crónicas como enfermedad renal, enfermedad hepática o diabetes mellitus. Los datos limitados sugieren que la enfermedad autoinmune, ya sea sola o junto con otros factores de riesgo, incluida la medicación inmunosupresora, podría aumentar el riesgo de YEL-AVD.
- No debe ser donante de sangre aquel adulto vacunado, hasta pasados 15 días tras recibir la vacunación, pues se ha descrito transmisión de la cepa vacunal entre donante y receptor.
Tabla 24.4. Contraindicaciones y precauciones de la vacunación contra la fiebre amarilla.
| Contraindicaciones | Precauciones |
|
|
⌂ [21]
11. Observaciones
En el consejo de viajeros internacionales, conviene incidir que la vacunación contra la FA no exime del cumplimiento exquisito de las precauciones contra las picaduras de mosquitos. No hay que olvidar que las hembras de Aedes aegypti pican especialmente durante el día. Algunas de esas medidas son: el uso de telas mosquiteras en ventanas o a modo de dosel para la cama, uso de ventiladores o aparatos de aire acondicionado en estancias cerradas, uso de ropa de manga larga (también pantalones) y color claro, evitar el uso de perfumes y, sobre todo, el empleo periódico (varias veces al día) de repelentes homologados con DEET o icaridina sobre la piel expuesta.
La capacidad limitada de fabricación de vacunas utilizando huevos de gallina embrionados, el cambio climático que empuja los hábitats de los mosquitos a nuevas regiones, el desplazamiento forzoso de grandes grupos poblacionales que huyen de la guerra o la sequía, viviendo clandestinamente en zonas rurales-selváticas y las dificultades para mejorar las coberturas vacunales en áreas muy aisladas acrecienta la necesidad de desarrollar nuevas vacunas candidatas contra la FA que sean más estables. Las vacunas candidatas contra la FA en desarrollo incluyen diversas plataformas de vacunas: inactivadas, con vector viral replicante recombinante, ADN vectorizado por plásmido, partículas similares a virus (VLP), ARNm, vacunas vivas atenuadas con mutaciones en codones del genoma y vacunas de subunidades producidas por plantas.
⌂ [21]
12. Bibliografía
- American Academy of Pediatrics. Arboviruses. En: Kimberlin DW, Brady MT, Jackson MA, Long SS, eds. Red Book: 2021-2024. Report of the Committee on Infectious Diseases. 32st ed, Itasca, IL.: American Academy of Pediatrics; 2021. pp. 202-9.
- Brazil Ministry of Health. Yellow Fever Reports [29].
- Calbo Torrecillas F, et al. Fiebre amarilla. En: Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Vacunas en Pediatría. Manual de la AEP 2012, 5.ª ed. Madrid: Exlibris ediciones SL; 2012. p. 313-26.
- Cancado B, et al. Yellow fever vaccine and egg allergy. Lancet Infect Dis. 2019;19:812.
- Centers for Disease Control and Prevention. Yellow Fever Vaccine. Recommendations of the ACIP [30]. MMWR. 2010;59(RR07):1-27.
- Centers for Disease Control and Prevention. Yellow Fever Vaccine Booster Doses: Recommendations of the Advisory Committee on Immunization Practices, 2015 [31]. MMWR. 2015;64:647-50.
- Chen LH, et al. Yellow fever control: current epidemiology and vaccination strategies. Trop Dis Travel Med Vaccines. 2020;6:1.
- Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Inmunizaciones del niño viajero [32]. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; may/2024. [consultado el dd/mmm/aaaa].
- Gaythorpe KA, et al. The global burden of yellow fever. Elife. 2021;10:e64670.
- Gershman M, et al. Yellow Fever [33]. In Travel-associated infections and diseases. CDC Yellow book 2024.
- Gershman MD, et al. The Brighton Collaboration Viscerotropic Disease Working Group. Viscerotropic disease: Case definition and guideliness for Collection, analysis, and presentation of immunization safety data [34]. Vaccine. 2012;30:5038-88.
- Hansen CA, et al. The Present and Future of Yellow Fever Vaccines. Pharmaceuticals (Basel). 2021;14:891.
- JCVI. Yellow fever [35]: the green book, chapter 35.
- Kuhn S, et al. Case report: probable transmission of vaccine strain of yellow fever virus to an infant via breast milk. CMAJ. 2011;183:E243-5.
- Michel R, et al. Observational study on immune response to yellow fever and measles vaccines in 9 to 15-month old children. Is it necessary to wait 4 weeks between two live attenuated vaccines? Vaccine. 2015;33:2301-6.
- Nascimento Silva JR, et al. Mutual interference on the immune response to yellow fever vaccine and a combined vaccine against measles, mumps and rubella. Vaccine. 2011;29:6327-34.
- Porudominsky R, et al. Yellow fever vaccine and risk of developing serious adverse events: a systematic review [36]. Rev Panam Salud Publica. 2018;42:e75.
- Reno E, et al. Prevention of yellow fever in travellers: an update [published online ahead of print, 2020 May 7]. Lancet Infect Dis. 2020;S1473-3099(20)30170-5.
- Sharma K, et al. Yellow Fever Vaccination In EGG-Allergic Children. Pediatr Infect Dis J. 2020;39:e76-8.
- Sicre de Fontbrune F, et al. Immunogenicity and Safety of Yellow Fever Vaccine in Allogeneic Hematopoietic Stem Cell Transplant Recipients After Withdrawal of Immunosuppressive Therapy. J Infect Dis. 2018;217:494-97.
- Stefano I, et al. Recent immunization against measles does not interfere with the sero-response to yellow fever vaccine. Vaccine. 1999;17:1042-6.
- Thomas RE. Yellow fever vaccine-associated viscerotropic disease: current perspectives [28]. Drug Des Devel Ther. 2016;10:3345-53.
- WHO. Fractional dose yellow fever vaccine as a dose-sparing option for outbreak response [37]WHO Secretariat information paper. 20 JULY 2016.
- WHO. Global yellow fever update 2024 [38]. Wkly Epidemiol rec. 2025;100:499-534.
- WHO. Meeting of the Global Advisory Committee on Vaccine Safety, December 2010. Yellow fever vaccine and HIV infection. Wkly Epidemiol Rec. 2011;86:41-2.
- WHO. Revised recommendations for yellow fever vaccination for international travellers, 2011 [39]. WER 2011;86:401-11.
- WHO. Vaccines and vaccination against yellow fever. WHO Position Paper-June 2013 [40]. Wkly Epidemiol Rec. 2013;88:269-84.
- WHO. WHO issues addendum to the yellow fever vaccine position paper [41]. Banluta. 23 June 2017.
- WHO, Unicef y Gavi. A global strategy to Eliminate Yellow fever Epidemics 2017–2026 [42]. Geneva: World Health Organization; 2018. Licence: CC BY-NCSA 3.0 IGO.
⌂ [21]
13. Enlaces de Interés
- ANDAVAC. Viajes internacionales: fiebre amarilla [43]
- Asociación de Médicos de Sanidad Exterior [44]
- Centers for Disease Control and Prevention (CDC). Yellow fever. Yellow Book, 2024. Section 5 [45]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Fiebre amarilla [46]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente a la fiebre amarilla [47]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna de la fiebre amarilla [48]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la fiebre amarilla [49]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la fiebre amarilla [50]
- European Centre for Disease Prevention and Control (ECDC). Yellow fever [51]
- European Centre for Disease Prevention and Control (ECDC). Yellow fever - Annual epidemiological report [52]
- National Travel Health Network and Centre (NaTHNac). Countries with risk of yellow fever transmission and countries requiring yellow fever vaccination [53]
- Ministerio de Sanidad. Información para el viajero: fiebre amarilla [54]
- Ministerio de Sanidad. Listado de Centros de Vacunación Internacional. Sanidad Exterior. [27]
- Ministerio de Sanidad. Información sobre vacunas de interés para viajes internacionales Sanidad Exterior [55]
- PAHO/WHO. PAHO Health Emergencies Interactive Atlas and Maps [56]
- The Australian Immunization Handbook. Australian Government Department of Health, Canberra. Yellow Fever [57]
- World Health Organization (WHO). International travel and health. Countries with risk of yellow fever transmission and countries requiring proof of vaccination against yellow fever [24]
- World Health Organization (WHO). Disease outbreak news. Yellow fever [58]
- World Health Organization (WHO). Yellow fever [59]
⌂ [21]
14. Historial de actualizaciones
| 28 de septiembre de 2018 | Actualización de todos los apartados, excepto administración con otras vacunas y otros productos; precauciones y contraindicaciones y observaciones. Nuevas citas bibliográficas y enlaces de interés |
| 28 de mayo de 2020 | Actualización de todos los apartados, excepto inmunogenicidad, eficacia y efectividad; vías de administración y observaciones. Nuevas citas bibliográficas y enlaces de interés |
| 11 de agosto de 2020 | Actualización del apartado "Administración con otras vacunas y otros productos" (interacción con triple vírica) |
| 20 de diciembre de 2021 | Actualización de todo el capítulo. Nuevas citas bibliográficas y enlaces de interés |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 6 de septiembre de 2023 | Actualización del apartado "Epidemiología de la enfermedad". Nueva cita bibliográfica |
| 11 de septiembre de 2024 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 10 de noviembre de 2025 | Actualización del apartado "Epidemiología de la enfermedad". Nueva cita bibliográfica. Nuevo enlace de interés |
-oOo-