Capítulo 21 - Difteria
- Puntos clave [1]
- Introducción [2]
- Epidemiología de la enfermedad [3]
- Tipos de vacunas, composición y presentación [4]
- Inmunogenicidad, eficacia y efectividad [5]
- Vías de administración [6]
- Indicaciones y esquemas de vacunación [7]
- Administración con otras vacunas y otros productos [8]
- Efectos adversos [9]
- Precauciones y contraindicaciones [10]
- Bibliografía [11]
- Enlaces de interés [12]
- Historial de actualizaciones [13]
- Tablas y figura incluidas en el capítulo:
Tabla 21.1. Vacunas combinadas de tétanos y difteria de carga antigénica estándar (DTPa) disponibles en España [14]
Tabla 21.2. Vacunas de difteria trivalentes de carga antigénica reducida (Tdpa) disponibles en España [15]
Tabla 21.3. Vacunas de difteria bivalentes de carga antigénica reducida (Td) disponibles en España [16]
Tabla 21.4. Resumen de la vacunación frente a la difteria y el tétanos en niños y en adultos [17]
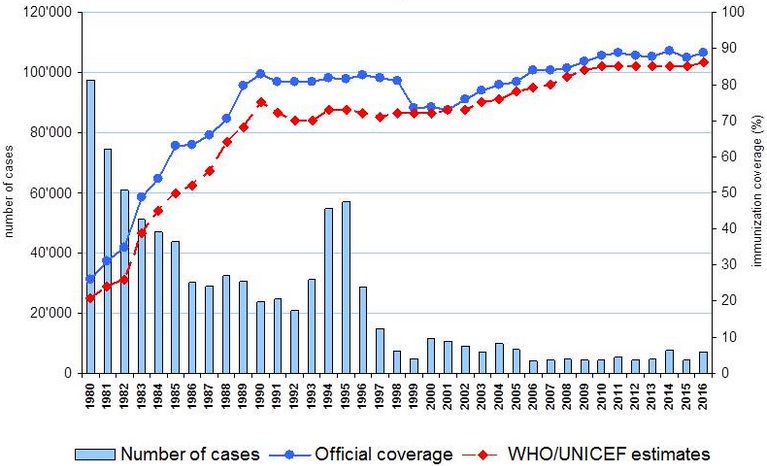
Figura 21.1. Cobertura de vacunación (estimada y real) con tres dosis de toxoide diftérico (DTP3) y casos comunicados de 1980 a 2016 en el mundo [18]
Sugerencia para la citación: Comité Asesor de Vacunas e Inmunizaciones (CAV-AEP). Difteria. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; ene/2026. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-21
⌂ [19]
1. Puntos clave
- Es una enfermedad infecciosa endémica en algunas regiones de África, Asia, Caribe y Sudamérica en las que las coberturas vacunales son subóptimas. Actualmente está controlada en países occidentales, aunque en Europa se ha producido un incremento de casos en los últimos años.
- Las manifestaciones clínicas se deben a la acción de una potente toxina que inhibe la síntesis proteica, no sólo en las células nasofaríngeas sino en otros órganos como corazón, tejido nervioso y riñón.
- La mortalidad de la enfermedad no tratada, en la actualidad, oscila generalmente entre el 5 y el 10 %, pero puede alcanzar hasta casi el 30 %, siendo más alta en los niños menores de 5 años.
- Su sospecha clínica debe seguirse de un diagnóstico microbiológico preciso y de una notificación a las autoridades de Salud Pública (enfermedad de declaración urgente, obligatoria e individualizada).
- Los casos han de tratarse precozmente con antitoxina diftérica y antibióticos. Los contactos recibirán quimioprofilaxis y se garantizará que tengan una adecuada protección con toxoide diftérico (completando o reforzando la vacunación).
- En la actualidad, la enfermedad es endémica de algunos países de índice de desarrollo humano (IDH) bajo, que además experimentan brotes con gran numero de casos. En la Unión Europea/Área Económica Europeo (UE/EEA) se produjo un aumento de casos (320 casos) con respecto a los años anteriores.
- El toxoide usado en las vacunas se obtiene mediante la inactivación de la toxina diftérica, siendo preciso la administración de varias dosis para generar una protección duradera. No existe una vacuna monocomponente frente a difteria, ya que el toxoide diftérico se asocia a otros componentes vacunales frente al tétanos y la tosferina.
- Hay dos tipos de presentaciones de la vacuna: infantil o de carga antigénica estándar (D) y adulto o de carga antigénica reducida/baja (d). El componente D no debe administrarse a partir de los 7 años de edad (elevada reactogenicidad), aunque las vacunas actuales DTPa-VPI están autorizadas hasta los 13 años incluidos.
- Debe conservarse a 2-8 ºC, protegerla de la luz, agitar antes de usarla y no congelarla.
- Se administra por vía intramuscular.
- La vacunación frente a difteria no evita ni reduce la colonización nasofaríngea por Corynebacterium diphtheriae, ni impide la transmisión de la enfermedad.
- Las personas que padecen difteria deben ser vacunadas frente a la enfermedad, una vez superada la misma.
- En el calendario infantil actual de nuestro país se administran 5 dosis.
- Dado que aún existen países endémicos de difteria, existe la posibilidad de importación de casos, por lo que los viajeros deben asegurarse de haber cumplimentado la serie de vacunación correspondiente a su edad, recibiendo, si fuera necesario, pautas aceleradas de vacunación.
- Es una vacuna segura, con escasos efectos adversos (a destacar la reacción tipo Arthus cuando se administran dosis repetidas).
- Las contraindicaciones son las generales de las vacunas. Se puede aplicar a inmunodeprimidos, embarazadas, mujeres que lactan y prematuros.
⌂ [19]
2. Introducción
La difteria es una enfermedad infecciosa que ha producido grandes epidemias en la historia. En los países con un IDH alto con tasas altas de vacunación es una enfermedad que está bien controlada, aunque ocasionalmente aparecen casos, casi siempre importados. En los países con un IDH bajo con insuficiente cobertura vacunal, la enfermedad es endémica con brotes esporádicos que afectan a cientos o miles de personas. La enfermedad está causada por cepas toxigénicas (portan el gen tox) del bacilo aerobio grampositivo Corynebacterium diphtheriae. Otras especies como C. ulcerans y esporádicamente C. pseudotuberculosis, son también responsables de casos en humanos. El control de la difteria es un objetivo prioritario en la mayoría de los países del mundo y la vacuna que protege de esta enfermedad forma parte de las seis con las que se inició el Programa Ampliado de Inmunizaciones de la OMS (EPI, por sus siglas en inglés).
⌂ [19]
3. Epidemiología de la enfermedad
Aunque siempre se ha considerado que el reservorio de C. diphtheriae lo constituye exclusivamente el ser humano, algunos autores citan el aislamiento ocasional en algunos animales domésticos. La transmisión de humano a humano es la más importante, la cual se da por medio de secreciones respiratorias (gotitas al toser o estornudar) provenientes de enfermos o en menor grado portadores asintomáticos. Se ha estimado que el número de reproducción básico (R0) oscila entre 1,7 y 4,3. Tras el tratamiento antibiótico, los enfermos dejan de ser contagiosos a los 2-4 días, pero en ausencia de un tratamiento correcto la contagiosidad se prolonga de 2 a 4 semanas. Los portadores crónicos pueden excretar bacilos durante 6 meses o más. La transmisión de la difteria respiratoria ocurre a través de gotitas respiratorias. Es mucho más frecuente que ocurra desde individuos que padecen la enfermedad que desde portadores asintomáticos.
La difteria cutánea está causada por Corynebacterium diphtheriae o por Corynebacterium ulcerans se transmite por contacto con las lesiones cutáneas o con objetos contaminados. En el caso de la difteria cutánea producida por Corynebacterium ulcerans, el contagio puede producirse a través de las secreciones de animales infectados o por consumo de productos lácteos no pasteurizados.
Durante las décadas de los años 20 y 30 del siglo anterior, hubo varias epidemias de la enfermedad en todo el mundo, incluidos los países de IDH alto. A partir de 1923, tras iniciarse y extenderse la vacunación el número de casos disminuyó de forma drástica. En España, la incidencia era de 1000 casos por 100 000 habitantes en 1941. Tras introducirse la vacunación en 1945, la tasa de incidencia cayó rápidamente a 0,1/100 000 habitantes.
Con el inicio del Programa de Vacunación Ampliada (EPI en 1974), la incidencia de la enfermedad disminuyó de forma ostensible: >90 % desde 1980 a 2000 (OMS).
En la época prevacunal y vacunal temprana, la difteria afectaba, sobre todo, a niños menores de 5 años. La letalidad de la enfermedad oscila entre el 5 y el 10 %, pero a veces alcanza hasta el 30 %.
En la última gran epidemia, acaecida en países pertenecientes a la antigua Unión de Repúblicas Socialistas Soviéticas (URSS) debido al acúmulo de grandes bolsas poblacionales de individuos susceptibles (la mayoría adultos insuficientemente inmunizados), se contabilizaron más de 157 000 casos con más de 5000 muertes de 1990 a 1998. Las causas fueron: el derrumbe de la URSS y el caos social suscitado, la gran circulación de personas en ambientes de hacinamiento, la pérdida de protección contra la enfermedad en población adulta que no había recibido refuerzo vacunal y la falta de planificación sanitaria. Las acciones posteriores, apoyadas por la OMS, consiguieron finalmente mitigar la situación de epidemia mantenida.
En la actualidad, la difteria es endémica en países con IDH bajo y medio, que además presentan brotes que afectan a cientos o miles de casos. Desde mediados de 2023, acontecieron brotes en varios países africanos, como Nigeria, Guinea, Niger, Mauritania y Sudáfrica. En total, hasta el 25 de febrero de 2024, se han producido 37 704 casos (más de 23 833 confirmados por laboratorio) con 926 muertes. El 78 % y el 7% de los casos y de las muertes, respectivamente, ocurrieron en Nigeria. Sólo un 24 % estaba totalmente vacunado y un 70 % afectó a menores de 15 años. Tras la puesta en marcha de campañas de vacunación, la aparición de nuevos casos se ha ralentizado. En 2024, solo Nigeria, Guinea y Níger han comunicado casos. Además de la baja cobertura vacunal, otros factores que han contribuido a este brote y su mortalidad han sido: ruptura de las cadena del frío en el almacenamiento y transporte de la las vacunas, retraso diagnóstico, analfabetismo y falta de información, dificultad de acceso a las vacunas (agravada por las restricciones y el confinamiento durante la pandemia COVID-19) y retraso en el diagnóstico y tratamiento de la enfermedad.
En la región europea, con una cobertura vacunal con tercera dosis del 95 %, la difteria es muy poco frecuente, aunque en los últimos años se ha registrado un aumento de casos. Mientras que, entre 2016 y 2021, se notificaron al ECDC una media anual de 27 casos, en 2022 se notificaron 320 casos (la mayoría de difteria cutánea) y en 2023 se registraron 169 casos de infección con cepas portadoras del gen tox, el 62% en personas migrantes de países como Afganistán, Bulgaria, Chequia, Serbia, Siria y Turquía. La presentación generalmente fue cutánea y el 67% de los casos había recibido alguna dosis de vacuna. El estudio genético demostró que estos casos estaban producidos por una cepa que se había extendido a través de las rutas migratorias. Al final de ese mismo año, las medidas que se llevaron a cabo, mitigaron el brote. Sin embargo, en 2025 la cepa ha sido detectada nuevamente en casos que afectan sobre todo a personas sin techo. Entre 2022 y 2025, 10 personas, casi todas ellas con la forma respiratoria, han fallecido.
En España, la difteria es una enfermedad de declaración obligatoria (BOE núm 65, del 17 de marzo de 2015. Orden SSI/445/2015, de 9 de marzo). Desde el año 2013 el protocolo de difteria de la Red Nacional de Vigilancia Epidemiológica (RENAVE) incluye la vigilancia y notificación de casos de difteria respiratoria, cutánea y de otras localizaciones. Un caso de difteria confirmado por laboratorio requiere el aislamiento en una muestra clínica de una cepa de Corynebacterium diphtheriae, C. ulcerans o C. pseudotuberculosis productores de toxina.
Según datos de la Red Nacional de Vigilancia Epidemiológica, entre 2014 y 2024 se notificaron 15 casos de difteria toxigénica, de ellos, 10 tuvieron clínica cutánea y 5 faríngea, el 33,3 % fueron casos importados y el 53,3 % de los casos precisaron hospitalizaron. En 2015, tras casi 30 años sin casos de difteria respiratoria (dos últimos en 1986), falleció un niño de 6 años que no había sido vacunado. De 2019 a 2022 se notificó cada año un caso de difteria respiratoria en adultos entre 50-85 años, mientras que en 2023 no se notificó ninguno.
El control de esta enfermedad es un objetivo prioritario en la mayoría de los países del mundo y la vacuna se incluye entre las seis con las que se inició el Programa Ampliado de Inmunizaciones de la OMS. .Es esencial mantener altas coberturas de vacunación, protocolos y sistemas de vigilancia actualizados, incluidos los planes de acogida a personas migrantes actualizando los calendarios y recordando que las personas que padezcan la enfermedad deben recibir la inmunización completa con toxoide diftérico porque el padecimiento de la difteria no confiere inmunidad.
La primovacunación con tres o más dosis induce títulos protectores de anticuerpos en el 95,5 % de los vacunados y después de la administración de las cinco dosis en el 98,4 %, siendo muy efectiva en la prevención de la enfermedad grave y de la mortalidad, pero no protege frente a la colonización nasofaríngea, por lo que se estima que su efectividad total frente a la enfermedad clínica es de un 70-90 %.
Para garantizar el control de la enfermedad se precisa, al menos, el 90 % de cobertura con 3 dosis de DTP en el primer año de vida. Sólo la cobertura de vacunación mantiene la difteria bajo control. Ver figura 21.1 [18]. En 2024 las coberturas mundiales fueron del 85 % (109 millones), un nivel inferior al 86 % de 2019, antes de la pandemia de la covid. La disminución (hasta 7 puntos porcentuales) ocurrió sobre todo en los países de IDH bao. En 2024, 14,3 millones de lactantes no recibieron la dosis inicial de la vacuna DTP debido a las carencias de los servicios de inmunización y de otros servicios de atención de salud, y otros 5,6 millones solo estaban parcialmente vacunados. En conjunto, suman 19,9 millones de lactantes, de los cuales alrededor del 55 % viven en 10 países: Afganistán, Etiopía, Filipinas, India, Indonesia, Nigeria, Pakistán, República Democrática del Congo, Sudán y Yemen.
A pesar de que en España más de un 95 % de los niños han recibido 3 o más dosis de difteria, el segundo estudio de seroprevalencia de 2020, demuestra que a partir de los 30 años de edad el porcentaje de individuos con títulos protectores comienza a disminuir, de forma que entre los 40 y 70 años de edad solo un 30-40 % de los individuos son seropositivos.
Figura 21.1. Cobertura de vacunación (estimada y real) con tres dosis de toxoide diftérico (DTP3) y casos comunicados de 1980 a 2016 en el mundo.
Fuente: Organización Mundial de la Salud, 2017.
En España disponemos de coberturas vacunales ofrecidas por el Ministerio de Sanidad [21], cuyos datos más recientes se refieren a las coberturas de 2024. Con el 97,93 % en la hexavalentes de los 4 meses, con el 94,04 % en la hexavalente de los 11 meses y con el 89,16 % a los 6 años con DTPa.
Manifestaciones clínicas
En la forma faríngea, la enfermedad comienza, tras un periodo de incubación de 1-10 días, con malestar general, fiebre de bajo grado y dolor faríngeo y en el cuello. Tras 1 o 2 días aparacen unas membranas blanco-grisáceas (seudomembranas) muy adherentes en faringe y amígdalas, las cuales sangran con facilidad al intentar desprenderlas. Pueden extenderse por contigüidad al paladar blando, úvula, laringe y tráquea, agravando el cuadro clínico. La difteria cutánea es muy contagiosa (contacto) y actualmente representa el mayor porcentaje de casos en Europa. La mortalidad de la enfermedad se relaciona con asfixia por obstrucción de las vías aéreas o por la acción de la toxina a distancia en órganos como: el corazón, el sistema nervioso y el riñón.
El pronto reconocimiento del cuadro clínico (difícil en nuestro medio, dada su extrema rareza) y la notificación a las autoridades de Salud Pública son esenciales para la instauración de un tratamiento precoz y la puesta en marcha de las pertinentes medidas preventivas en posibles contactos. El diagnóstico de sospecha es clínico, pero es esencial la confirmación microbiológica desde muestras obtenidas de zonas adyacentes a las seudomembranas. La observación directa del bacilo o su aislamiento desde cultivos en medios especiales debe seguirse del estudio de su poder toxigénico. La PCR (reacción en cadena de la polimerasa) es útil para establecer un diagnóstico (detección del gen tox), cuando un tratamiento antibiótico previo ha podido reducir la viabilidad del Corynebacterium spp.
Las complicaciones de la difteria derivan de la diseminación de la toxina desde el punto de infección local. Afectan precozmente al miocardio (miocarditis) y, tras un período de latencia, al sistema nervioso (parálisis del velo del paladar u óculomotora, polineuritis periféricas), al riñón (necrosis tubular) y, menos frecuentemente, al hígado y glándulas suprarrenales. La letalidad de la difteria no tratada es del 5-10 %, pero puede alcanzar hasta el 30 % en menores de 5 años.
El tratamiento se basa en el aislamiento del paciente, uso precoz de antitoxina diftérica equina parenteral y antibióticos. La antibioterapia es necesaria para eliminar el bacilo diftérico y detener la producción de toxina. Se recomienda la utilización de penicilina (G intravenosa o procaínica intramuscular), eritromicina oral o una combinación de ambos durante 14 días. Al término del tratamiento, debe verificarse la eliminación del microorganismo en 2 cultivos realizados con un intervalo de 24 horas y si es necesario, volver a tratar. Los portadores identificados deben ser aislados y manejados como los casos. Todos los contactos recibirán profilaxis antibiótica y una dosis de toxoide diftérico, a menos que hubieran sido vacunados en los 12 meses previos, completando, si procede, la pauta de vacunación siguiendo el calendario vacunal vigente. Las personas que padezcan o hayan padecido la difteria deben recibir la vacunación antidiftérica como si no la hubieran padecido, puesto que la enfermedad no confiere inmunidad duradera.
La difteria cutánea, no está mediada por la toxina, y aparece sobre todo, en las zonas descubiertas de la piel, sobre todo las piernas. Las lesiones comienzan como vesículas o pústulas, que evolucionan a úlceras dolorosas de bordes bien delimitados, algo elevadas, de un diámetro que oscila desde algunos milímetros hasta algún centímetro. A medida que evolucionan, las lesiones se cubran de una membrana, similar a una escara, que puede simular un impétigo. Finalmente las lesiones se desprenden dejando una base hemorrágica.
⌂ [19]
4. Tipos de vacunas, composición y presentación
La vacunación frente a la difteria forma parte del calendario sistemático infantil de nuestro país. Pero, además, el toxoide diftérico tiene un papel primordial en la protección de las personas que tengan contacto con un caso sospechoso o demostrado de la enfermedad. Todos los contactos deberían completar (o iniciar) la vacunación frente a difteria, incluso aunque su calendario esté completo; también deberían recibir una dosis de la vacuna si han transcurrido más de 5 años de la última dosis. Aunque protege frente a la enfermedad, la vacunación no influye en la colonización nasofaríngea por C. diphteriae y, por tanto, no interrumpe la transmisión de la enfermedad.
La importancia de mantener el estado vacunal al día es que, para la protección frente a la enfermedad, se necesitan títulos de antitoxina en suero suficientes para neutralizar muy rápidamente a la toxina.
No existe vacuna monocomponente y se presenta siempre en forma de vacuna combinada con el toxoide tetánico u otros componentes vacunales como tosferina, Haemophilus influenzae tipo b, poliomielitis inactivada (VPI) o hepatitis B. El toxoide se produce tras eliminar la capacidad patógena de la toxina mediante el uso de formaldehído o glutraldehido y posteriormente se adsorbe en sales de aluminio para aumentar su capacidad inmunogénica. La concentración del toxoide se expresa en unidades de floculación (Lf), estando establecido que 1 Lf es la cantidad necesaria para aglutinar una unidad de antitoxina (estándar de referencia internacional). La potencia del toxoide se mide en unidades internacionales (UI), con patrones extraídos de ensayos realizados en cobayas o ratones.
Hay 2 tipos de presentaciones de los preparados vacunales que contienen toxoide diftérico:
- La de carga antigénica estándar que se puede aplicar hasta los 6 años y 11 meses y que contiene no menos de 30 UI o entre 10 y 25 Lf. Se expresa en las vacunas con la letra “D”. Esta concentración de toxoide diftérico la encontramos formando parte de, entre otros, los preparados pentavalentes o hexavalentes. Actualmente las vacunas DTPa-VPI están autorizadas hasta los 13 años inclusive.
- La de carga antigénica reducida, autorizada a partir de los 4 años de edad, contiene no menos de 4 UI o de 2 Lf de toxoide diftérico, y se nombra con la letra “d”. Las más usadas son Td y Tdpa.
En el momento actual en España están comercializadas las vacunas que se destacan en las tablas 21.1 [14], 21.2 [15] y 21.3 [16].
Tabla 21.1. Vacunas combinadas de tétanos y difteria-tosferina de carga antigénica estándar (DTPa) disponibles en España.
|
Nombre comercial y laboratorio |
Composición y producción |
Volumen y edad de administración |
Presentación |
Excipientes y trazas |
|---|---|---|---|---|
|
Hexyon |
Toxoide tetánico |
0,5 ml |
Jeringa precargada |
- Hidróxido de aluminio (0,6 mg Al) |
|
Infanrix Hexa |
Toxoide tetánico |
0,5 ml |
Jeringa precargada para reconstituir con Hib liofilizado |
- Hidróxido de aluminio, (equivalente a 0,5 mg Al) |
|
Vaxelis |
Toxoide tetánico |
0,5 ml |
Jeringa precargada |
- Fosfato (0,17 mg Al) e hidrofosfato de aluminio (0,15 mg Al) |
|
Infanrix-IPV+Hib No comercializada |
Toxoide tetánico |
0,5 ml |
Jeringa precargada para reconstituir con Hib liofilizado |
- Hidróxido de aluminio (0,5 mg Al) |
|
Pentavac No comercializada |
Toxoide tetánico |
0,5 ml |
Jeringa precargada |
- Hidróxido de aluminio (0,3 mg Al) |
|
Infanrix-IPV |
Toxoide tetánico |
0,5 ml. |
Jeringa precargada |
- Hidróxido de aluminio (0,5 mg Al) |
|
Tetraxim |
Toxoide tetánico |
0,5 ml |
Jeringa precargada |
- Hidróxido de aluminio (0,3 mg Al) |
|
Infanrix |
Toxoide tetánico |
0,5 ml. |
Jeringa precargada |
- Hidróxido de aluminio (0,5 mg Al) |
DTPa: difteria, tétanos, tosferina acelular de carga estándar
VPI: Virus de la poliomielitis inactivado
Hib: Haemophilus influenzae tipo b
HB: Hepatitis B
En color rojo las vacunas que ya no están comercializadas en España
Tabla 21.2. Vacunas de difteria trivalentes de carga antigénica reducida (Tdpa) disponibles en España.
|
Nombre comercial y laboratorio |
Composición y producción |
Volumen y edad de administración |
Presentación |
Excipientes y trazas |
|---|---|---|---|---|
|
Boostrix Polio |
Toxoide tetánico |
0,5ml. |
Jeringa precargada |
- Hidróxido de aluminio hidratado (0,3 mg Al) |
|
Boostrix |
Toxoide tetánico |
0,5ml. |
Jeringa precargada |
- Hidróxido de aluminio hidratado (0,3 mg Al) |
|
Triaxis |
Toxoide tetánico |
0,5ml. |
Vial con suspensión inyectable
|
- Fosfato de aluminio (0,33 mg Al) |
Tdpa: Tétanos, difteria y tosferina acelular de carga reducida
VPI: Virus de la poliomielitis inactivado
Tabla 21.3. Vacunas de difteria bivalentes de carga antigénica reducida (Td) disponibles en España.
|
Nombre comercial y laboratorio |
Composición y producción |
Volumen y edad de administración |
Presentación |
Excipientes y trazas |
|---|---|---|---|---|
|
Anatoxal Tedi |
Toxoide tetánico |
0,5 ml |
Jeringa precargada |
- Hidróxido de aluminio hidratado (0,5 mg Al) |
|
Diftavax |
Toxoide tetánico |
0,5ml. |
Jeringa precargada |
- Hidróxido de aluminio (expresado en Al) máximo 0,625 mg |
|
Ditanrix adulto |
Toxoide tetánico |
0,5ml. |
Jeringa precargada |
- Hidróxido de aluminio (0,5 mg Al) |
|
DiTeBooster* |
Toxoide tetánico |
0,5ml. |
Jeringa precargada |
- Hidróxido de aluminio hidratado (0,5 mg Al). |
* Solo para revacunación, aunque autorizada por Salud Pública para primovacunación
Td: Tétanos y difteria de carga antigénica reducida
En color rojo las vacunas que ya no están comercializadas en España
Presentación y reconstitución
Todas las vacunas con componente diftérico deben conservarse entre +2 y +8 ºC, evitando la congelación y debiendo estar protegidas de la luz solar. Si por accidente la vacuna se congela, no se podrá utilizar. En condiciones adecuadas de conservación la vida media es de unos 3-4 años aproximadamente, aunque hay que consultar la fecha de caducidad. Algunos preparados como la vacuna Infanrix Hexa o la vacuna Infanrix-IPV+Hib deben ser reconstituidas. En el caso de Infanrix Hexa se ha demostrado estabilidad durante 8 horas a +21 ºC tras la reconstitución. En el caso de la vacuna Infanrix-IPV+Hib, la vacuna debe inyectarse inmediatamente tras la reconstitución. Las vacunas Hexyon, Vaxelis, Infanrix, Pentavac, Infanrix-IPV y Tetraxim ya vienen preparadas para administrar y no precisan manipulación para la reconstitución.
⌂ [19]
5. Inmunogenicidad, eficacia y efectividad
Se considera que una concentración de anticuerpos antitoxoide de 0,01 UI/ml es el límite inferior a partir del cual existe cierto grado de protección contra la enfermedad. Concentraciones iguales o superiores a 0,1 UI/ml se consideran plenamente protectoras y las superiores a 1,0 UI/ml se asocian con una inmunidad duradera contra la difteria.
Entre el 95 y el 100 % de los adultos vacunados con 3 dosis y de los niños vacunados con 4 dosis de DTP alcanzan concentraciones séricas de anticuerpos superiores a 0,01 UI/ml, con cifras medias entre 0,1 y 1 UI/ml. Esta inmunidad adquirida disminuye de forma progresiva hasta los 10 años. En ensayos clínicos de inmunogenicidad de la vacuna diftérica, se observó en niños preescolares que recibieron un refuerzo entre los 4-6 años de edad que el 98 % alcanzaban cifras de inmunoprotección (≥0,1 UI/ml) y el 86 % niveles de protección duradera (>1,0 UI/ml). Estudios de casos y controles muestran cifras de eficacia superiores al 85 %. No se han realizado ensayos clínicos controlados de efectividad de la vacunación contra difteria, pero sí existen numerosos estudios observacionales que avalan su capacidad para prevenir las formas respiratorias de la enfermedad.
La casi completa desaparición de la enfermedad en los países con elevada cobertura de vacunación y la experiencia adquirida en el control de brotes mediante campañas de vacunación son pruebas evidentes de su efectividad. Sin embargo, la vacuna es ineficaz a la hora de prevenir infecciones por cepas no toxigénicas de C. diphtheriae y tampoco evita el estado de portador nasofaríngeo asintomático.
⌂ [19]
6. Vías de administración
Cada dosis consta de 0,5 ml y se aplica por vía intramuscular. Sin embargo, en pacientes con alteraciones de la coagulación se podría aplicar por vía subcutánea profunda para reducir el riesgo de sangrado, aunque lo ideal es administrarla intramuscular con las medidas apropiadas [22].
⌂ [19]
7. Indicaciones y esquemas de vacunación
En España desde 2017, se administran 5 dosis de toxoide diftérico en la infancia: a los 2, 4 y 11 meses con vacuna hexavalente (DTPa-HB-Hib-VPI), a los 6 años con vacuna, también, combinada (DTPa-VPI, Tdpa-VPI) y a los 13-14 años con Td o Tdpa. Las mujeres gestantes reciben una dosis de vacuna Tdpa (para la prevención de la tosferina). Todas las personas deben recibir, una última dosis de vacuna Td alrededor de los 65 años de edad.
El cambio en el calendario a partir del 2017 consistió en adoptar un esquema 2+1, con una separación mínima entre la primera y la segunda de 8 semanas y entre la segunda y la tercera dosis de 6 meses. Se ha demostrado que, tras el refuerzo, no hay diferencia entre pautas 3+1 y 2+1 en cuanto a concentración de anticuerpos antitoxoide diftérico se refiere. Se usan preparados hexavalentes (DTPa [difteria de carga estándar, tétanos, tosferina acelular de carga estándar], HB [hepatitis B], Haemophilus influenzae tipo b y VPI [polio inactivada o inyectable]). La edad mínima de aplicación de la 1.ª dosis de la vacuna es las 6 semanas.
En la actualidad 15 países de Europa usan, con algunas variaciones, esquemas similares a España (Alemania, Austria, Dinamarca, Eslovaquia, Eslovenia, Finlandia, Francia, Islandia, Italia, Liechtenstein, Luxemburgo, Noruega, República Checa, Rumanía y Suecia) en primovacunación y primer refuerzo (2+1).
En la pauta 2+1, el intervalo mínimo entre la 1.ª y la 2.ª dosis de DTPa es de 8 semanas y entre la 2.ª y la 3.ª de 6 meses, pero un intervalo de, al menos, 4 meses tras la 2.ª puede considerase válido (si fue por error) si la 3.ª se administró a los 11 meses de edad o más, aunque no podría aplicársele el periodo de gracia de 4 días a este intervalo reducido. Para completar la pauta vacunal, se necesitan otras 2 dosis de refuerzo: una 4.ª dosis que se pauta a los 6 años de edad en forma de vacuna DTPa o Tdpa junto a VPI y una 5.ª dosis que se aplica entre los 13 y los 16 años de edad en forma de vacuna Td, excepto Asturias, que aplica la vacuna Tdpa (esta última recomendada por el Comité Asesor de Vacunas de la Asociación Española de Pediatría en la dosis de refuerzo de los 12-14 años) (tabla 21.4 [17]).
Para que un adulto esté bien vacunado de difteria tiene que tener 3 dosis de primovacunación con una dosis de refuerzo cada 10 años. Sin embargo, al ir unida esta vacuna en las presentaciones comerciales con el toxoide tetánico, esta pauta se cambió en España (asimilándola a la recomendada para la vacunación antitetánica, basándose en recomendaciones de la OMS, que considera que un adulto está bien vacunado frente al tétanos si ha recibido a lo largo de su vida 5 dosis).
Esta última variación en los protocolos de vacunación puede acarrear cierta desprotección frente a la difteria en adultos. Diversos estudios alertan de los bajos niveles de anticuerpos antitoxina diftérica en adultos, debido a una pérdida de protección que se acentúa con la edad. En caso de aparición de casos de difteria se debería proteger a la población que haya recibido la última dosis de toxoide diftérico hace más de 10 años con una nueva dosis de Td o Tdpa. Asimismo, se debería recibir una dosis de refuerzo ante viajes internacionales a países endémicos o epidémicos y en el manejo de contactos de un caso de difteria.
Por tanto, en España si no ha recibido nunca esta vacuna se le pondrán 3 dosis de primoinmunización: 0, 1 y 12 meses (con una separación mínima de 1 mes entre la 1.ª y la 2.ª, y de 6 meses entre la 2.ª y la 3.ª) y 2 dosis de refuerzo que se aplicarán idealmente cada 10 años (el intervalo mínimo de separación entre la 3.ª dosis y el 1.er refuerzo es de 1 año e igualmente de 1 año entre el 1.er y 2.º refuerzo) (tabla 21.4 [17]).
Tabla 21.4. Resumen de la vacunación frente a la difteria y el tétanos en niños y en adultos.
| Pauta de calendario | 2 meses | 4 meses | 11 meses | 6 años | 12-14 años | 60-65 años |
| Pauta si otra edad de inicio | Primovacunación | Refuerzos | ||||
| 1.ª | 2.ª | 3.ª | 1.º | 2.º | 3.º | |
|
<4 años |
En el momento |
+ 2 meses |
+ 6-12 meses |
6 años |
12-14 años |
60-65 años |
|
4-6 años |
En el momento |
+ 2 meses |
+ 6-12 meses |
12-14 años |
+ 1-10 años |
60-65 años |
|
>6 años y adultos |
En el momento |
+ 1 mes |
+ 6-12 meses |
+ 1-10 años |
+ 1-10 años |
60-65 años |
| ---- | Edad cronológica |
| ---- | Intervalo con dosis previa |
Desde el año 2016, la vacuna Tdpa se administra en nuestro país a todas las embarazadas (en cada gestación), idealmente entre las semanas 27 y 32, de preferencia 27o 28 semanas.
Los CDC autorizan desde 2020 el uso de Td o Tdpa indistintamente para la vacunación frente tétanos, difteria y tosferina en niños mayores de 7 años no vacunados o que precisan dosis de refuerzo.
Las vacunas hexavalentes han sido autorizadas por la AEMPS para ser administradas en menores de 7 años de edad en el caso que no hayan recibido la pauta de vacunación en tiempo (2, 4, 11 meses de edad) o la tengan incompleta de acuerdo con las recomendaciones oficiales.
La DTPa-VPI lo está desde los 2 meses (Tetraxim) y 16 meses (Infanrix-IPV) hasta los 13 años incluidos. La AEMPS ha autorizado el uso de los dos preparados disponibles de DTPa-VPI (Tetraxim, Infarnrix-IPV) tanto para primovacunación a partir de los 2 meses de edad, como para dosis de recuerdo hasta los 13 años incluidos, aunque, a partir de los 7 años es preferible la Tdpa para evitar mayor riesgo de reactogenicidad.
Los niños con calendario incompleto o desconocido deben recibir, al menos, 4 dosis de difteria en menores de 7 años (idealmente de carga antigénica estándar) y 3 dosis en mayores de esta edad. Si la 3.ª dosis se administra con 4 o más años de edad, la 4.ª dosis del calendario sistemático que habitualmente se aplica a los 6 años de edad no sería necesaria, pero debe recordarse que tiene que recibir 5 dosis de tétanos cuando llegue a la edad adulta. Las dosis puestas serán consideradas válidas si han respetado las edades e intervalos mínimos entre dosis, siguiendo el axioma de “dosis puesta, dosis que cuenta” (ver capítulo 11. Calendarios acelerados [23]).
En el caso de viajeros internacionales a zonas endémicas de difteria (India, Indonesia, Madagascar, Pakistán, Nigeria, Haití, República Dominicana y países de la antigua Unión Soviética como Ucrania), se recomienda:
- En niños completar la vacunación utilizando un calendario acelerado que respete los intervalos mínimos entre dosis.
- En adultos una dosis de refuerzo si han transcurrido más de 10 años desde la última dosis de Td o Tdpa recibida.
En los contactos de pacientes con difteria se actuará como sigue:
Los contactos estrechos con un caso de difteria o con un portador asintomático deben recibir inmediatamente tratamiento con un macrólido y una dosis de toxoide diftérico, salvo si han sido vacunados en los 12 meses previos. Los portadores identificados deben ser aislados y manejados como los casos.
Conviene recordar que las personas que padezcan la difteria deben recibir la inmunización completa con toxoide diftérico porque el padecimiento de la enfermedad no confiere inmunidad.
⌂ [19]
8. Administración con otras vacunas y otros productos
Al tratarse de una vacuna inactivada puede administrarse a la vez, o con cualquier intervalo de separación, con otras vacunas inactivadas y con otras vacunas atenuadas.
Aunque en su momento en la ficha técnica se habían visto interferencias en un ensayo clínico entre la dosis de refuerzo de la vacuna hexavalente Hexyon y la vacunación frente a la varicela y se había aconsejado separarlas por 4 semanas; en mayo de 2022 la EMA y la AEMPS, tras conocer nuevos datos, han determinado que se pueden administrar simultáneamente sin ningún problema al haber desaparecido dicha interferencia.
Posibles interferencias con otros fármacos o productos biológicos
No se han descrito interacciones, ni incompatibilidades con otros fármacos o productos biológicos.
⌂ [19]
9. Efectos adversos
Debido a la administración de esta vacuna en forma combinada con otros componentes, en ocasiones, es difícil conocer el agente responsable de las reacciones adversas. La reactogenicidad local es frecuente, en forma de dolor, tumefacción y eritema en el punto de la inyección (40-73 % de los vacunados). Estas manifestaciones clínicas son leves y transitorias. La administración de dosis no muy distanciadas entre sí o la inoculación del preparado en un plano más superficial de lo recomendado (debe ser intramuscular profunda), suelen inducir reacciones locales más floridas. Igualmente, es posible la aparición de un nódulo cutáneo doloroso de unas semanas de duración en el lugar de administración de la vacuna.
Las reacciones generales son menos frecuentes e incluyen fiebre, malestar general, cefalea, mialgias, somnolencia, irritabilidad, astenia y anorexia. Las reacciones anafilácticas de tipo inmediato son excepcionales (0,65 a 3 casos por millón de dosis administradas).
Se ha descrito de forma muy infrecuente la aparición de un fenómeno tipo Arthus, el cual consiste en una reacción de hipersensibilidad de tipo III localizada, en la que los complejos antígeno-anticuerpo que fijan el complemento se depositan en las paredes de los vasos sanguíneos pequeños, causando una inflamación aguda, infiltración de neutrófilos, hemorragia y necrosis localizada de la piel. Las reacciones de Arthus se describieron inicialmente en animales de laboratorio hiperinmunizados. Si apareciera no se podría administrar otra dosis que contenga difteria o tétanos hasta pasados 10 años.
⌂ [19]
10. Precauciones y contraindicaciones
Está contraindicada si hubo una reacción anafiláctica previa a algún componente de la vacuna.
Si en el momento de la administración hay fiebre elevada, se retrasará la vacunación hasta que desaparezca la misma.
La presentación infantil de carga antigénica estándar (D) no se puede administrar a partir de los 7 años de edad, porque se incrementa el riesgo de reacciones adversas, aunque Infanrix-IPV y Tetraxim están a utorizadas hasta los 13 años inclusive.
Si aparece una reacción de tipo Arthus tras la aplicación de la vacuna no debe aplicarse otra dosis hasta, al menos, 10 años después.
En los casos en los que el componente frente a la tosferina está contraindicado en menores de 7 años, al no estar comercializada la presentación DT, se podrá administrar la vacuna Td en sustitución de la vacuna DTPa porque ha sido autorizado por la AEMPS.
A los prematuros se les aplican estas vacunas a la misma edad cronológica que a los niños nacidos a término. No existe contraindicación para administrarla a pacientes inmunocomprometidos, aunque su efectividad puede ser menor y al cesar la inmunosupresión es posible que deban recibir una dosis de refuerzo (ver sección III. Inmunización en circunstancias especiales [24]).
⌂ [19]
11. Bibliografía
- Abdulrasheed N, et al. Recurrent diphtheria outbreaks in Nigeria: A review of the underlying factors and remedies. Immun Inflamm Dis. 2023;11:e1096.
- Agencia Española de Medicamentos y Productos Sanitarios. Informe de la AEMPS sobre el uso de vacunas hexavalentes para la inmunización activa en menores de 7 años [25].
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de la AEMPS sobre el uso las vacunas DTPa-IPV en primovacunación [26]. 22 de marzo de 2023.
- Álvarez García FJ, et al, en representación del Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría: recomendaciones 2026. [27] An Pediatr (Barc). 2026;104:504051.
- Álvarez García F, et al. Difteria. En: Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP). Vacunas en Pediatría. Manual de la AEP 2012, 5.ª ed. Madrid: Exlibris ediciones SL; 2012. p. 291-300.
- American Academy of Pediatrics. Diphtheria. En: Kimberlin DW, Banerjee R, Barnett ED, Lynfield R, Sawyer MH eds. Red Book: 2024-2027. Report of the Committee on Infectious Diseases. 33st ed, Itasca, IL.: American Academy of Pediatrics; 2024. pp. 357-61.
- Centers for Diseases Control and Prevention. Diphtheria [28]. In: The Pink Book. Epidemiology and Prevention of Vaccine-Preventable Diseases, 14th ed, 2021. Updated April 2024.
- Centers for Diseases Control and Prevention. Vaccine Information Statements (VISs). Tdap (Tetanus, Diphtheria, Pertussis) VIS [29].
- Centro Nacional de Epidemiología. Difteria. Informes epidemiológicos de los casos notificados a la RENAVE [30].
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Calendario de Vacunaciones e Inmunizaciones de la Asociación Española de Pediatría. Razones y bases de las recomendaciones 2026 [31]. [Internet]. Madrid: AEP; 2026.
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Fichas técnicas de las vacunas de difteria comercializadas en España [32].
- Comité Asesor de Vacunas e Inmunizaciones de la Asociación Española de Pediatría. Noticia. Difteria en Europa: el brote de 2022 controlado pero el riesgo persiste [33]. 23 junio 2025.
- Consejería de Sanidad del Principado de Asturias. Tétanos-difteria de adulto (Td). En: Vacunación en situaciones especiales. Asturias 2014. Guía de indicaciones y pautas [34]. Editor Huerta González I. Ed: Dirección General de Salud Pública y Participación de la Consejería de Salud y Servicios Sanitarios. Oviedo. 2014. p. 26-31.
- Dolan S, et al. Summary of evidence on the administration of multiple injectable vaccines in infants during a single visit: safety, immunogenicity, and vaccine administration practices [35], J Infect Dis. 2017; 216(Suppl 1): S152-60.
- European Centre for Disease Prevention and Control. Diphtheria. In: ECDC. Annual epidemiological report for 2022 [36]. Stockholm: ECDC; 2024.
- European Centre for Disease Prevention and Control. ECDC Surveillance Atlas of Infectious diseases [37]. Accessed on 26 November 2025.
- European Centre For Disease Prevention and Control. Diphtheria strain involved in outbreaks among vulnerable populations across Europe between 2022 and 2025 [38]. June 2025.
- Hammarlund E, et al. Durability of Vaccine-Induced Immunity Against Tetanus and Diphtheria Toxins: A Cross-sectional Analysis. Clin Infect Dis. 2016;62:1111-8.
- Hoefer A, et al. Corynebacterium diphtheriae Outbreak in Migrant Populations in Europe. N Engl J Med. 2025;392:2334-5.
- Immunization against infectious disease 'The Green Book'. Diphtheria [39]. Updated June 2025.
- Jones CE, et al. Routine Vaccination Coverage — Worldwide, 2023 [40]. MMWR Morb Mortal Wkly Rep. 2024;73:978-84.
- Liang JL, et al. Prevention of Pertussis, Tetanus, and Diphtheria with Vaccines in the United States: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2018;67:1-44.
- Ministerio de Sanidad. Coberturas de Vacunación [21]. Datos estadísticos. 2024.
- Ministerio de Sanidad. Consejo Interterritorial. Segundo estudio de seroprevalencia en España [41].
- Ponencia de Programa y Registro de Vacunaciones. Calendario acelerado de vacunaciones. [42] Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Consumo y Bienestar Social, julio 2023. Actualizado en enero de 2025.
- RENAVE. Protocolo de Vigilancia de la Difteria [43].
- RENAVE. Situación de la difteria en España. Características microbiológicas, clínicas y epidemiológicas de las cepas de C. diphtheriae, C. belfantii, C. rouxii y C. ulcerans identificadas en España, 2014-2020 [44]. Octubre 2021.
- Torres-Jiménez I, et al. Vigilancia de difteria. Casos notificados a la Red Nacional de Vigilancia Epidemiológica (RENAVE) España 2014–2024 [45]. Boletín Epidemiológico Semanal. 2025;33:96-106.
- The Australian Immunisation Handbook. Diphtheria [46]. Updated October 2025.
- Truelove SA., et al. Clinical and Epidemiological Aspects of Diphtheria: A Systematic Review and Pooled Analysis. Clin Infect Dis 2020;71:89-97.
- UK Health Security Agency. Diphtheria: cases among asylum seekers in England, monthly data tables [47]. Updated July 2025.
- World Health Organization. Diphtheria [48]. Julio 2024.
- World Health Organization. Diphtheria. Immunization coverage [49]. 2025.
- World Health Organization. Diphtheria. Preguntas y respuestas [50]. 2023.
- World Health Organization. Diphtheria vaccine: WHO position paper - August 2017 [51]. Wkly Epidemiol Rec. 2017;92:417-35.
- World Health Organization. Vaccine-preventable disease update: reported diphtheria cases in the WHO European Region, 2022: 10 October 2022 [52]. January 2023.
⌂ [19]
12. Enlaces de interés
- American Academy of Pediatrics. Healthy children. Diphtheria [53]
- Calendario de vacunaciones e inmunizaciones de la Asociación Española de Pediatría 2026 [31]
- CDC. Diphtheria [54]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Calendarios españoles [55]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Enfermedades inmunoprevenibles: Difteria [56]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Fichas técnicas de vacunas frente a difteria [32]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Las vacunas una a una... y un anticuerpo. Vacuna de la difteria [57]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Noticias sobre la difteria [58]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Preguntas frecuentes sobre la vacunación frente a la DTP/Tdp/Td [59]
- Comité Asesor de Vacunas e Inmunizaciones de la AEP. Vacunación acelerada [60]
- European Centre for Disease Prevention and Control (ECDC). Diphtheria [61]
- Ministerio de Sanidad. Información para el viajero: tétanos y difteria [62]
- WHO. Immunization, vaccines and biologicals. Diphtheria [50]
⌂ [19]
13. Historial de actualizaciones
| 30 de agosto de 2018 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2019 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2020 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2021 | Nuevas citas bibliográficas y enlaces de interés |
| 12 de noviembre de 2021 | Se añade Tetraxim en la tabla 21.1 |
| 1 de enero de 2022 | Actualización del apartado "Epidemiología de la enfermedad". Nuevas citas bibliográficas y enlaces de interés |
| 1 de julio de 2022 | Actualización del apartado 8 sobre Hexyon y la vacuna de la varicela |
| 25 de enero de 2023 | Cambio de nombre a Manual de Inmunizaciones |
| 2 de marzo de 2023 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 7 de agosto de 2023 | Actualización del apartado "Indicaciones y esquemas de vacunación" con la reomendación AEMPS de DTPa-VPI. Nueva cita bibliográfica |
| 1 de enero de 2024 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2025 | Nuevas citas bibliográficas y enlaces de interés |
| 1 de abril de 2025 | Modificación enlace de interés de "Vacunación acelerada" |
| 26 de noviembre de 2025 | Actualización de todos los apartados. Nuevas citas bibliográficas y enlaces de interés |
| 1 de enero de 2026 | Actualización del apartado "Epidemiología de la enfermedad". Nuevas citas bibliográficas y enlaces de interés |
-oOo-