Vacunas contra la covid de ARN: mRNA-1273 de Moderna
Fecha de actualización: 9 de enero de 2021
La carrera en busca de vacunas frente a la covid llega a las etapas cruciales, en las que deben publicar sus resultados iniciales de los estudios en fase 3 que se han desarrollado en los últimos meses, lo que se espera que ocurra en las próximas semanas.
Comenzamos aquí un repaso del estado de conocimiento, a día de hoy, de los principales candidatos a vacunas, con la vacuna de ARN de la empresa Moderna, mRNA-1273.
 Vacunas de ARN: mRNA-1273 (Moderna & NIH, EE. UU.)
Vacunas de ARN: mRNA-1273 (Moderna & NIH, EE. UU.)
- Desarrollada por: Moderna & NIH, Cambridge, Massachusetts, EE. UU.
- Socios biotecnológicos: Lonza, Suiza.
- Vacuna basada en ARNm que codifica la proteína S del SARS-CoV-2 en su conformación prefusión (variedad S-2P, con dos sustituciones sucesivas de prolina en las posiciones de aminoácidos 986 y 987), en una nanopartícula lipídica.
Toda la información en una tabla (PDF, 3 páginas, 30/nov 2020).
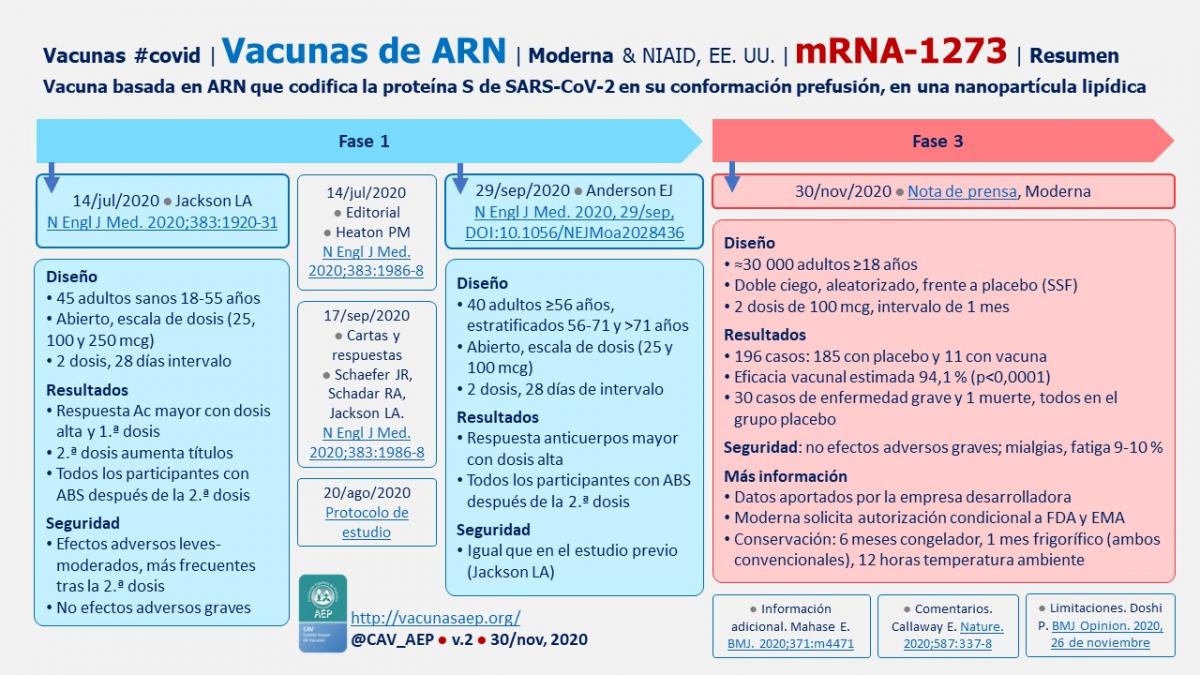
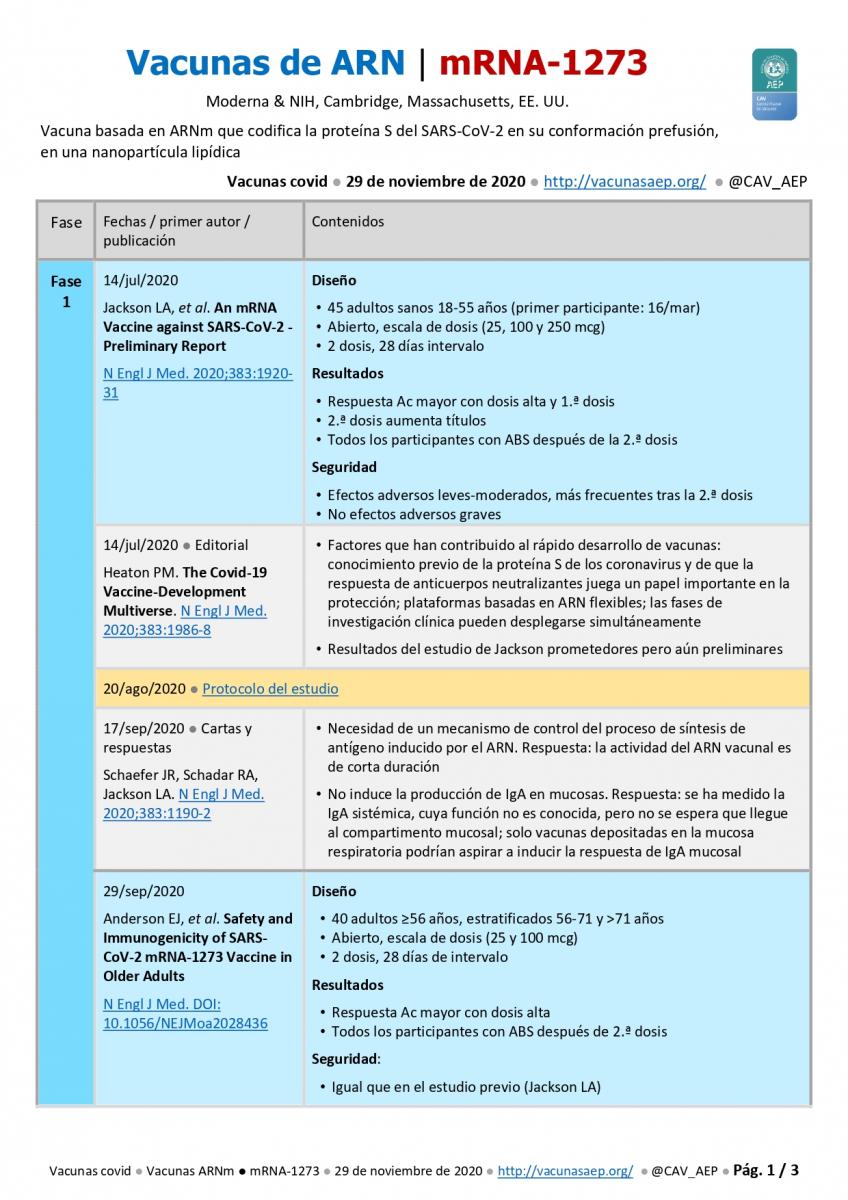
Fase 1
14 de julio de 2020 ● Jackson LA, et al.  An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. N Engl J Med. 2020;383:1920-31.
An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. N Engl J Med. 2020;383:1920-31.
- Diseño: a) 45 adultos sanos 18-55 años (primer participante: 16/mar); b) Abierto, escala de dosis (25, 100 y 250 mcg); c) 2 dosis, 28 días intervalo.
- Resultados: a) Respuesta de anticuerpos mayor con dosis alta y 1.ª dosis; b) 2.ª dosis aumenta títulos; c) Todos los participantes con ABS después de la 2.ª dosis.
- Seguridad: a) Efectos adversos leves-moderados, más frecuentes tras la 2.ª dosis: fiebre 40 %, mialgias, cefaleas y fatiga >50 %; b) No efectos adversos graves.
- ClinicalTrials.gov: NCT04283461.
14 de julio de 2020 ● Editorial ● Heaton PM. The Covid-19 Vaccine-Development Multiverse. N Engl J Med. 2020;383:1986-8.
- Factores que han contribuido al rápido desarrollo de vacunas: conocimiento previo de la proteína S de los coronavirus y de que la respuesta de anticuerpos neutralizantes juega un papel importante en la protección; plataformas basdas en ARN; las fases de investigación clínica pueden desplegarse simultáneamente.
- Resultados del estudio de Jackson prometedores pero aún preliminares,
20 de agosto de 2020 ● Moderna: Protocolo del estudio en fase 3.
17 de septiembre de 2020 ● Cartas y respuestas ● Schaefer JR, Schadar RA, Jackson LA. N Engl J Med. 2020;383:1190-2.
- Necesidad de un mecanismo de control del proceso de síntesis de antígeno inducido por el ARN. Respuesta: la actividad del ARN vacunal es de corta duración.
- No induce la producción de IgA en mucosas. Respuesta: se ha medido la IgA sistémica, cuya función no es conocida, pero no se espera que llegue al compartimento mucosal; solo vacunas depositadas en la mucosa respiratoria podrían aspirar a inducir la respuesta de IgA mucosal.
 29 de septiembre de 2020 ● Anderson EJ, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020;383:2427-38.
29 de septiembre de 2020 ● Anderson EJ, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020;383:2427-38.
- Diseño: a) 40 adultos ≥56 años, estratificados 56-71 y >71 años; b) Abierto, escala de dosis (25 y 100 mcg); c) 2 dosis, 28 días de intervalo.
- Resultados: a) Respuesta Ac mayor con dosis alta; b) Todos los participantes con actividad neutralizante del suero y respuesta celular tipo TH1 después de 2.ª dosis.
- Seguridad: similar al estudio previo (Jackson LA); fiebre 10 %, mialgias, cefaleas y fatiga 80 %.
- ClinicalTrials.gov: NCT04283461.
 3 de diciembre de 2020 ● Widge A, et al. Durability of response after SARS-CoV-2 mRNA-1273 vaccination. N Engl J Med. 2020;384:80-2.
3 de diciembre de 2020 ● Widge A, et al. Durability of response after SARS-CoV-2 mRNA-1273 vaccination. N Engl J Med. 2020;384:80-2.
- Diseño: a) 34 participantes sanos, edad 18-55, 56-70 y ≥71 años; b) 2 dosis de 100 mcg, 4 semanas de intervalo; c) Estudio a 90 días de la segunda dosis.
- Resultados: a) Ac neutralizantes en todos los participantes, aunque con un leve descenso; b) Respuesta celular tipo Th1 a los 43 días de la primera dosis.
Fase 2
 8 de julio de 2020 ● Nota de prensa de Moderna ● Moderna Completes Enrollment of Phase 2 Study of its mRNA Vaccine Against COVID-19 (mRNA-1273).
8 de julio de 2020 ● Nota de prensa de Moderna ● Moderna Completes Enrollment of Phase 2 Study of its mRNA Vaccine Against COVID-19 (mRNA-1273).
- Ha finalizado el reclutamiento de un estudio de fase 2 con 300 participantes de 18-55 años y 50 más mayores de 55 años, con dosis de 50 y 100 mcg.
Fase 3
 16 de noviembre de 2020 ● Nota de prensa de Moderna ● Moderna’s COVID-19 Vaccine Candidate Meets its Primary Efficacy Endpoint in the First Interim Analysis of the Phase 3 COVE Study.
16 de noviembre de 2020 ● Nota de prensa de Moderna ● Moderna’s COVID-19 Vaccine Candidate Meets its Primary Efficacy Endpoint in the First Interim Analysis of the Phase 3 COVE Study.
- Diseño: a) Inicio del reclutamiento el 27/julio, finalizado el 22/octubre; b) ≈30.000 adultos ≥18 años en EE. UU.; c) Doble ciego, aleatorizado, dosis de 100 mcg frente a placebo; d) 2 dosis, intervalo de 1 mes.
- Resultados: a) 95 casos (a partir de 2 semanas después de la 2.ª dosis): 90 en el grupo del placebo y 5 en el grupo de vacuna; Eefctividad vacunal estimada 94,5 % (p<0,0001); 11 casos enfermedad grave en el grupo placebo y ninguno en el grupo de vacuna.
- Seguridad: a) No efectos adversos graves; b) Mialgias 8,9 %, fatiga 9,7 %.
- Más información: a) Limitación: análisis provisional, datos aportados en nota de prensa; b) Moderna preve solicitar autorización de emergencia a la FDA al alcanzar 151 casos una vez que, al menos, la mitad de los participantes hayan superado los 2 meses de seguimiento.
El estudio está registrado en ClinicalTrials.gov con la referencia: NCT04470427.
16 de noviembre de 2020 ● Noticias ● Mahase E. News. Covid-19: Moderna vaccine is nearly 95% effective, trial involving high risk and elderly people shows. BMJ. 2020;371:m4471.
- Información adicional: a) Resultado principal: prevención de enfermedad sintomática; secundario: prevención de enfermedad grave; b) Entre los participantes hay más de 7000 ≥65 años y más de 5000 <65 años con enfermedades crónicas; 37·% son hispanos y/o negros; c) De los 95 casos, 15 eran ≥65 años; d) Conservación de la vacuna prevista: hasta 6 meses en congelador y hasta 30 días en frigorífico, ambos convencionales; e) Permanece la incógnita de si previene la transmisión.
16 de noviembre de 2020 ● Opinión ● Callaway E. COVID vaccine excitement builds as Moderna reports third positive result. Nature. 2020;587:337-8.
- Comentarios: a) Resultados alentadores y en cierto modo inesperados; b) Al final del estudio la eficacia será menor, pero quizás no mucho; c) Informa, aunque parcialmente, de eficacia en la prevención de enfermedad grave; d) Persisten incertidumbres: duración, ¿cuántas de las 5 infecciones en vacunados ocurrieron en mayores de 65 años?
22 de noviembre de 2020 ● Noticias ● Grady D. Early Data Show Moderna’s Coronavirus Vaccine Is 94.5% Effective. The New York Times, 22 de noviembre de 2020.
- Información adicional: a) Placebo usado en estudio de fase 3: suero salino; b) Moderna ha declarado que cobrará a los gobiernos de 32 a 37 dólares por dosis, aunque con el de EE. UU. ya ha comprometido un coste de 25 $ por dosis; c) Conservación: estable hasta 12 horas a temperatura ambiente; d) Moderna solicitará la aprobación de emergencia, además de la FDA estadounidense, en RU, Canadá y Unión Europea.
26 de noviembre de 2020 ● Opinión ● Doshi P. Pfizer and Moderna’s “95% effective” vaccines - let’s be cautious and first see the full data. BMJ, Opinion, 26 de noviembre.
- Limitaciones de los datos conocidos: a) Datos de reducción del riesgo relativo (RRA parece ser <1%); de prevención de cualquier forma de enfermedad, no la grave ni la transmisión; a un plazo corto (<3 meses); b) Tampoco informa de eficacia en colectivos especialmente frágiles; niños, adolescentes e inmunodeprimidos excluidos; c) La información difundida puede haber comprometido el cegamiento; d) No se asegura que se hacen PDIA en presencia de cualquier síntoma compatible; e) El uso de fármacos para aliviar efectos secundarios de la vacuna/placebo pueden enmascarar síntomas de infección por SARS-CoV-2; f) Los estudios deben proseguir aun después de la eventual aprobación de emergencia; g) No se ha dado a conocer la información que se proporciona a los participantes.
 30 de noviembre de 2020 ● Nota de prensa de Moderna ● Moderna Announces Primary Efficacy Analysis in Phase 3 COVE Study for Its COVID-19 Vaccine Candidate and Filing Today with U.S. FDA for Emergency Use Authorization.
30 de noviembre de 2020 ● Nota de prensa de Moderna ● Moderna Announces Primary Efficacy Analysis in Phase 3 COVE Study for Its COVID-19 Vaccine Candidate and Filing Today with U.S. FDA for Emergency Use Authorization.
Ampliación del análisis intermedio del 16 de noviembre:
- Resultados: a) 196 casos, de ellos 185 en el grupo placebo y 11 en el de la vacuna; b) Eficacia vacunal estimada: 94,1 %; c) 30 casos graves y una muerte, todos en el grupo placebo.
- Seguridad: no efectos adversos graves.
 30 de diciembre de 2020 ● Baden LR, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020, 30/dec. DOI: 10.1056/NEJMoa2035389.
30 de diciembre de 2020 ● Baden LR, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020, 30/dec. DOI: 10.1056/NEJMoa2035389.
- Editorial. Haynes BF. A New Vaccine to Battle Covid-19. N Engl J Med. 2020, 30/dec. DOI: 10.1056/NEJMoa2035557.
- Revisión. Castells MC, et al. Maintaining Safety with SARS-CoV-2 Vaccines. N Engl J Med. 2020, 30/dic. DOI: 10.1056/NEJMra2035343.
- Comentario. Doshi P. Pfizer and Moderna’s “95% effective” vaccines—we need more details and the raw data. The BMJ Opinion, 4/ene de 2021.
Aprobación por las agencias regulatorias
1 de diciembre de 2020 ● Moderna planea solicitar a la FDA y a la EMA una autorización condicional ● Nota de prensa de la AEMPS y la EMA ● La EMA recibe la solicitud de autorización condicional de las vacunas contra la COVID-19 de BioNTech/Pfizer y Moderna. Fecha prevista para la evaluación y decisión fial: 12 de enero de 2021.
 17 de diciembre de 2020 ● Reunión del Vaccines and Related Biological Products Advisory Committee de la FDA: documentos preparatorios de la propia FDA y de Moderna. Según CIDRAP, el VRBPSC dió el visto bueno y recomendó a la FDA aprobar el producto. Finalmente, la FDA ha aprobado el uso de emergencia de la vacuna mRNA-1273 (18/dic de 2020).
17 de diciembre de 2020 ● Reunión del Vaccines and Related Biological Products Advisory Committee de la FDA: documentos preparatorios de la propia FDA y de Moderna. Según CIDRAP, el VRBPSC dió el visto bueno y recomendó a la FDA aprobar el producto. Finalmente, la FDA ha aprobado el uso de emergencia de la vacuna mRNA-1273 (18/dic de 2020).
- Ficha técnica estadounidense de la vacuna mRNA-1273 de Moderna. Prospecto con información para los vacunados y sus cuidadores.
- Resumen de los datos disponibles. The Medical Letter, 22/dic de 2020.
 6 de enero de 2021 ● La EMA recomienda la autorización de la vacuna mRNA-1273 de Moderna. La Comisión Europea emite una autorización condicional para la comercialización de la vacuna.
6 de enero de 2021 ● La EMA recomienda la autorización de la vacuna mRNA-1273 de Moderna. La Comisión Europea emite una autorización condicional para la comercialización de la vacuna.
- Ficha técnica (versión inicial en inglés, PDF de 31 páginas).
 8 de enero de 2021 ● MHRA. Regulatory approval of COVID-19 Vaccine Moderna.
8 de enero de 2021 ● MHRA. Regulatory approval of COVID-19 Vaccine Moderna.
- Comentario. Mahase E. Covid-19: UK approves Moderna vaccine to be given as two doses 28 days apart. BMJ. 2021;372:n74.
-oOo-
Más información:
- The covid-19 messenger RNA vaccine from Moderna: as with the tozinameran vaccine (Comirnaty, Pfizer/BioNTech), limited data and unanswered questions. Prescrire, 06/ene de 2021.
- Welcome, 2 de diciembre de 2020. Seven vital questions about RNA Covid-19 vaccines.
- Early data show Moderna's COVID vaccine 94.5% effective. CIDRAP, 16 de noviembre de 2020.
- Draft landscape of COVID-19 candidate vaccines. OMS, 2 de noviembre de 2020.
- The Treatments and Vaccines Considered for COVID-19. The Medical Letter, 4 de diciembre de 2020.
- Otras noticias sobre las vacunas del covid en esta web.
- CAV-AEP, 18 de octubre de 2020: ¿Cómo seguir la evolución del desarrollo de las vacunas de la covid?
- Goodman JL, et al. Answering Key Questions About COVID-19 Vaccines. JAMA. 2020;324(20):2027-8 (Traducción al español por el Grupo de Trabajo COVID-19 de la Región de Murcia en APS).
- The COVID vaccine challenges that lie ahead. As positive results emerge at last, researchers must help the world to address vaccine hesitancy, supply logistics and pricing. Nature. 2020;587:522.
- M. Ansede. La empresa Moderna anuncia que su vacuna contra la covid tiene casi un 95% de eficacia. La compañía y los Institutos Nacionales de la Salud de EE. UU. aseguran que no han detectado ningún caso de enfermedad grave entre los vacunados. El País, Ciencia, 16 de noviembre de 2020.
- N. Domínguez, A. Galocha. ARN, la molécula que puede evitar la pandemia. El País, 28 de noviembre de 2020.