Los primeros casos de COVID-19 se notificaron, en China, el último día de 2019. El día 11 de marzo de 2020, la OMS confirmó [2] que la extensión de la enfermedad había alcanzado los niveles de pandemia. Según el situation report de la OMS [3] del 21 de julio de 2020, el recuento de casos y víctimas de la COVID-19 en el mundo, es:
- 14.562.550 casos registrados, 213.637 en las últimas 24 horas.
- 607.781 muertes, de ellas 4083 en las últimas 24 horas.
- Todos los continentes están afectados.
La pandemia está sometiendo a los sistemas sanitarios de todo el mundo a un gran, aunque variable, estrés que tiene como consecuencia una importante interferencia en la provisión de los demás servicios de salud (entre ellos, los programas de vacunación [4]), que junto a los efectos económicos añadidos, hacen prever un impacto en salud extraordinario por un tiempo prolongado.
Hasta la fecha se ha puesto en marcha una intensísima investigación en busca de una vacuna frente al SARS-CoV-2. Se hace, a continuación, una reseña de la situación actual y los datos publicados hasta la fecha.
Requisitos básicos de una vacuna frente a la COVID-19
 [5]Una vacuna ideal frente a la COVID-19 debería reunir los siguientes requisitos (Folegatti PM, et al. Lancet. 2020, 20 de julio [6]):
[5]Una vacuna ideal frente a la COVID-19 debería reunir los siguientes requisitos (Folegatti PM, et al. Lancet. 2020, 20 de julio [6]):
- Efectiva con una o dos dosis.
- Protección en los grupos poblacionales prioritarios: edad mayor de 65 años, personas con comorbilidades e inmunodeprimidos.
- Duración de la protección de, al menos, 6 meses.
- Capaz de reducir la transmisión comunitaria de la infección.
- Susceptible de ser producida en gran escala a un coste asequible y en un tiempo limitado.
Candidatos a vacuna frente a la COVID-19 en investigación
Según el informe de la OMS [7] a fecha del 21 de julio de 2020:
- 24 productos en investigación clínica. De estos, 7 productos en fases 2 y 3.
- 142 productos en investigación preclínica. Estre estos se encuentran 5 proyectos españoles:
- Vector viral no replicante, MVA. Centro Nacional de Biotecnología (CNB-CSIC), Madrid.
- ARN. CNB-CSIC, Madrid.
- ARNm. IDIBAPS, Hospital Clínic, Barcelona.
- Partícula similar a virus (VLP) VIH. IrsiCaixa AIDS Research, IRTA-CreSA, Barcelona Supercomputing Centre, Grifols.
 [8]Partícula similar a virus (VLP) lentivirus y baculovirus. Navarrabiomed, oncoimmunology group, Navarra.
[8]Partícula similar a virus (VLP) lentivirus y baculovirus. Navarrabiomed, oncoimmunology group, Navarra.
The New York Times. Coronavirus vaccine tracker, 21 de julio de 2020
Según el Coronavirus vaccine tracker de The New York Times [8], a fecha del 21 de julio de 2020, los estudios en marcha se muestran en la figura adjunta.
Productos en fases de investigación clínica más avanzadas
 [9]Los productos cuyo desarrollo se encuentra más avanzado [7] y han publicado resultados, a fecha del 21 de julio de 2020, son:
[9]Los productos cuyo desarrollo se encuentra más avanzado [7] y han publicado resultados, a fecha del 21 de julio de 2020, son:
- Cuatro productos han iniciado estudios en fase 3: dos vacunas inactivadas, una de ellas adyuvada con aluminio, ChAdOx1 (AZD1222) y mRNA-1273.
- Tres productos han mostrado resultados de las investigaciones en fases 1 y 2: ChAdOx1 (AZD1222), Ad5-vectores COVID-19 y mRNA-1273.
En la imagen adjunta (y el PDF descargable [10]) se muestran los productos en investigación, en fases 2 y 3 y los datos que han sido publicados.
Resultados publicados
Hasta la fecha se han publicado resultados de:
- Vacunas de vectores virales sin capacidad de replicación:
- ChAdOx1, fase 1/2 (Folegatti PM, et al. Lancet. 2020, 20 de julio [6]).
- Ad5-vectored COVID-19, fase 1 (Lancet. 2020;395:1845-54 [11]) y fase 2 (Zhu FC, et al. Lancet. 2020, 20 de julio [12]).
- Vacuna de RNA: mRNA-1273, fase 1 (Jackson LA, et al. N Eng J Med. 2020, 14 de julio [13]).
Se comentan a continuación los resultados mostrados por el grupo de la Universidad de Oxford con el producto candidato ChAdOx1 (AZD1222), recientemente publicados (Folegatti PM, et al. Lancet. 2020, 20 de julio [6]).
En un próximo texto se comentarán los resultados de los investigadores chinos (Zhu FC, et al. Lancet. 2020, 20 de julio [12]).
Candidato a vacuna de la Universidad de Oxford (ChAdOx1, AZD1222)
Las vacunas basadas en adenovirus vectores tienen un gran potencial, y la tecnología disponible podría asegurar una elevada capacidad de producción. Hay ya una vacuna autorizada y en uso desarrollada con esta plataforma tecnológica, la vacuna contra el ébola Ervebo (rVSV-ZEBOV). Los adenovirus usados como vectores han sido modificados genéticamente con dos objetivos: reducir o anular la capacidad de replicación en el huésped vacunado y asegurar la expresión en la superficie de los antígenos diana.
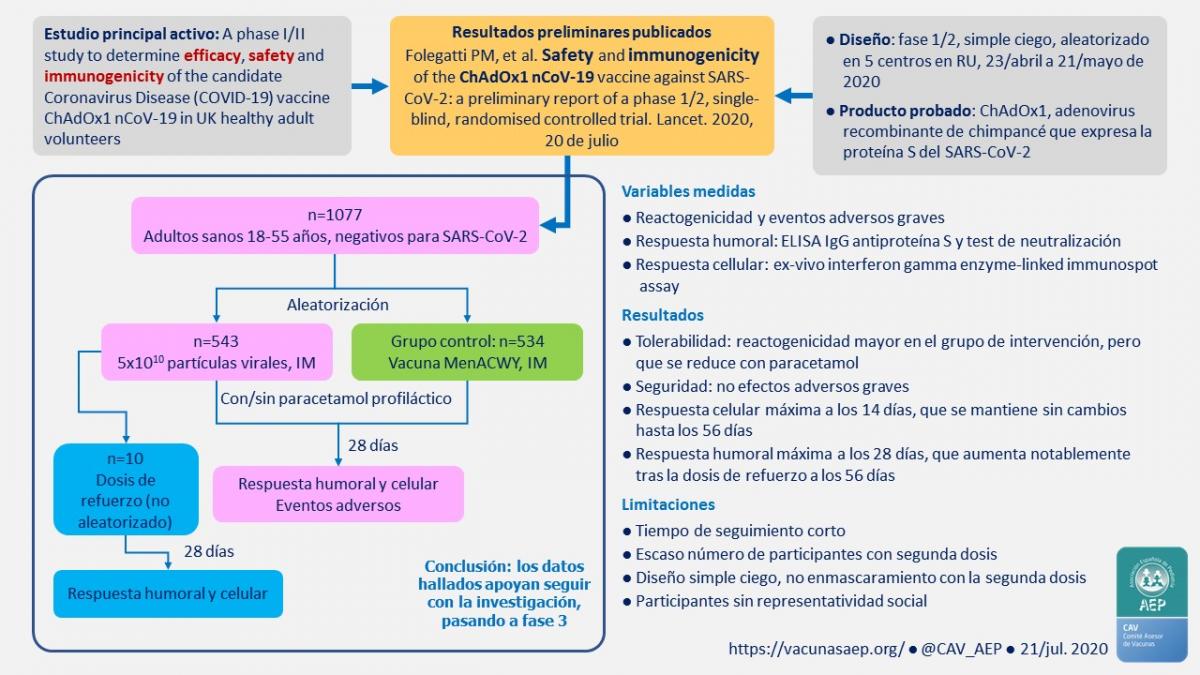
Estudio principal
Título: A phase I/II study to determine efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19 in UK healthy adult volunteers.
Objetivos principales:
- Eficacia en la prevención de infecciones COVID-19 confirmadas con PCR, en los 6 meses siguientes a la vacunación.
- Reactogenicidad y tolerancia de la vacunación, seguimiento de efectos adversos graves durante 6 meses después de la vacunación.
Registros:
- EU Clinical Trials Register: EU-2020-001072-15 [14].
- International Standard Randomised Controlled Trial Number (ISRCTN [15], OMS & ICMJE [16]): ISRCTN15281137 [17].
- ClinicalTrials.gov: NCT04324606 [18].
Entidades promotoras
- Universidad de Oxford. Oxford Vaccine Trials [19].
- Financiación y soporte: UK Research and Innovation, CEPI, NIH Research y German Center for Infection Research.
Resultados preliminares publicados
 [20]Folegatti PM, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020, 20 de julio [6] (ver imagen inicial).
[20]Folegatti PM, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020, 20 de julio [6] (ver imagen inicial).
Objetivos: evaluación de la reactogenicidad, seguridad e inmunogenicidad.
Diseño: fase 1/2, simple ciego, aleatorizado, en 5 centros del Reino Unido (Bristol, Londres [2], Oxford y Southampton).
Producto probado:
- ChAdOx1 (AZD1222), adenovirus de chimpancé que expresa la proteína S de SARS-CoV-2.
- Dosis: 5x1010 partículas virales, IM, en una o dos dosis con 28 días de intervalo (este subgrupo sin cegamiento).
Grupo control: vacuna Nimenrix, IM.
Participantes: 1077 individuos sanos de 18-55 años, sin datos virológicos ni clínicos de COVID-19. Mujeres gestantes excluidas.
- Grupo de intervención, n=543. De estos, 10 individuos seleccionados sin aleatorización recibieron una segunda dosis de refuerzo 28 días después.
- Grupo control, n=534.
Resultados de reactogenicidad y seguridad:
- Reacciones locales y sistémicas más frecuentes en el grupo de intervención con ChAdOx1 (p<0,05): dolor, sensación febril, resfriado, cefalea, mialgia, malestar.
- Recibieron paracetamol (1 g c/6 horas, 4 dosis) 56 en el grupo de intervención y 57 en el de control. El paracetamol redujo significativamente (p<0,05) la reactogenicidad en las 48 h siguientes a la vacuna.
- No efectos adversos graves.
Resultados: respuesta celular:
- Pico en el día 14 (n=43): promedio 856 células formadoras de colonias por millón de células mononucleares en sangre periférica (rango intercuartílico: 493-1802). La respuesta se mantuvo hasta el día 56 sin cambios, incluso en los que recibieron una dosis de refuerzo.
Resultados: respuesta humoral:
- Pico en el día 28 (n=127): IgG antiproteína S 157 UI Elisa (96-317). Día 56, tras dosis de refuerzo (n=10): 639 UI (360-792).
- Día 28 (n=35): anticuerpos neutralizantes (MNA80 y PRNT50) 91-100 %. Día 56, tras dosis de refuerzo (n=10): 100 %.
Limitaciones:
- Tiempo de seguimiento corto.
- Bajo número de participantes en el subgrupo que recibió una dosis de refuerzo.
- Simple ciego (cegamiento para el equipo investigador).
- Participantes sin representatividad social; la mayoría eran adultos jóvenes sanos y blancos.
Conclusiones de los autores:
 [21]ChAdOx1 es seguro, bien tolerado e inmunógeno.
[21]ChAdOx1 es seguro, bien tolerado e inmunógeno.- La reactogenicidad queda reducida por el paracetamol.
- Una dosis provoca una respuesta humoral y celular relevantes; y una dosis de refuerzo incrementa la cantidad de anticuerpos neutralizantes.
- Estos resultados apoyan seguir con la investigación, de una y dos dosis, en poblaciones más amplias, con rangos de edad mayores, población expuesta a SARS-CoV-2, etc.
Los investigadores de la Universidad de Oxford ya han anunciado el comienzo de estudios en fase 3 en Brasil [22], Sudáfrica [23] y Reino Unido.
Comentario final
Resultados prometedores pero muy preliminares (los de ambos trabajos). Los resultados de ambos están alineados. La tecnología de los adenovirus como vectores tiene mucho potencial (ya ha mostrado resultados con una de las vacunas del ébola, rVSV-ZEBOV). La seguridad debe ser un elemento clave, a pesar de la urgencia del momento (Bar-Zeev N, et al. Lancet. 2020; 20 de julio [21]). Por otro lado, quedan importantes preguntas por responder, como son lo relativo a la eficacia y la duración de la protección (un estudio ha mostrado una rápida caída de la respuesta humoral tras la infección leve [Ibarrondo FJ, et al. N Eng J Med. 2020, 21 de julio [24]]).
Las dificultades no se limitan al terreno científico, pues queda convencer a la población de las bondades de las eventuales vacunas que puedan llegar al final del camino. Como ha dicho R. Horton, el mayor reto tecnológico que la humanidad ha abordado nunca llega en un momento en el que la confianza en la ciencia y en las autoridades es frágil (Lancet. 2020;396(10246):226 [25]).
-oOo-
Otras referencias
- Correspondence. A SARS-CoV-2 mRNA Vaccine - Preliminary Report. NEJM. 2020, August 19. Doi:10.1056/NEJMc2026616 [26].
Más información:
- Science and Technology Daily, 23 de julio de 2020. Las vacunas contra el COVID-19, a cargo de un equipo chino y un equipo británico, demuestran ser seguras y efectivas: The Lancet [27].
- Universidad de Oxford, 20 de julio de 2020. New study reveals Oxford coronavirus vaccine produces strong immune response [28].
- M. Herper, et al. Stat, 20 de julio de 2020. Studies provide glimpse at efficacy of Covid-19 vaccines from Oxford-AstraZeneca and CanSino [29].
- J. Gallagher. BBC, 20 de julio de 2020. Coronavirus: Oxford vaccine triggers immune response [30].
- UK Research and Innovation, 20 de julio de 2020. Oxford trial funded by UKRI offers new hope for a COVID vaccine [31].
- J. Jiménez. Xataka, 20 de julio de 2020. La vacuna de Oxford contra el coronavirus también consigue desarrollar anticuerpos: la carrera de la vacuna está más reñida que nunca [32].
- M. Ansede. El País, Materia, 23 de julio de 2020. “Nos lanzamos de cabeza a por la vacuna” [33].
- M. Ansede. El País, Materia, 20 de julio de 2020. La vacuna experimental de Oxford ofrece resultados prometedores en un ensayo con mil personas [34].
- P. Íñigo. El Mundo, Salud, 20 de julio de 2020. Las vacunas de Oxford y China generan una buena respuesta inmune en los ensayos iniciales [35].
- Salazar. ABC, Sociedad, 20 de julio de 2020. Los primeros resultados de la vacuna de Oxford concluyen que es segura y capaz de entrenar al sistema inmune [36].
- R. Ashfield. The Conversation, 20 de julio de 2020. Oxford immunologist on coronavirus vaccine: our early results look highly promising [37].
- CAV, 10 de junio de 2020. Vacunas de la COVID-19: una carrera rápida y con muchos aspirantes, pero con un final aún lejano [38].
- Otras noticias anteriores sobre el SARS-CoV-2 y sus vacunas [39] en esta web.