Los primeros casos de infección por el nuevo coronavirus SARS-CoV-2 se notificaron en enero de 2020. La OMS declaró la pandemia de COVID-19 [1] el pasado 11 de marzo de 2020. Desde entonces la rápida sucesión de hechos y el avance de la enfermedad ha sido extraordinario. Hasta la fecha se han registrado en el mundo más de 7 millones de casos confirmados y más de 408.000 muertes (OMS, 10 de junio de 2020 [2]).
La elevada tasa de transmisión de la enfermedad y su capacidad para producir formas graves y mortalidad importante en determinados grupos de población (personas de mayor edad y portadores de enfermedades previas respiratorias o cardiovasculares) ha llevado a los sistemas sanitarios y sociales a situaciones de estrés extremo. La falta de tratamientos y vacunas eficaces ha traido la necesidad de forzar medidas generales de protección individual y colectiva como el confinamiento, el distanciamiento físico, el uso de mascarillas faciales y el refuerzo de las medidas higiénicas, que, en conjunto, han cambiado ya el mundo tal como lo hemos conocido hasta ahora. Las incógnitas respecto al futuro son grandes y muy preocupantes en el terreno de la salud y en el del desarrollo económico y social de todo el planeta, pues la única medida de control eficaz hasta el momento, el distanciamiento físico, amenaza con acabar o modificar las formas de interacción humana dominantes hasta ahora.
En este contexto, el desarrollo de una vacuna eficaz resulta ser una necesidad real y una prioridad social y política, reconocida ya por todos los sectores sociales. El mundo espera una vacuna que pueda cambiar el sombrío panorama que impone el distanciamiento social.
Han pasado apenas 5 meses y ya se ha puesto en marcha una enorme maquinaria social y científica; grandes cantidades de fondos económicos y varios cientos de estudios y ensayos clínicos tratan de ampliar el conocimiento de la enfermedad y su agente causal y de encontrar fármacos eficaces para prevenir la enfermedad o evitar la progresión de la infección y tratar sus formas graves. En el campo de las vacunas, más de 100 productos candidatos han iniciado el complicado proceso de desarrollo: ha comenzado la carrera por encontrar la vacuna que prevenga la COVID-19. La ansiedad inicial que ha llevado a un cierto caos, debiera dejar paso a una mayor coordinación de los esfuerzos de los equipos de investigación, de forma que pudiera sincronizarse en busca de una mayor eficacia y eficiencia (objetivo difícil por los intereses políticos y económicos implicados).
Contenido: ►1.- OMS: candidatos en estudio [3] | Estudios en fase clínica | Estudios españoles en fase preclínica. ►2.- Registro europeo de ensayos clínicos [4]. ►3.- Proyectos de investigación promovidos por el Instituto de Salud Carlos III [5]. ►4.- Candidato a vacuna: vector viral no replicante ChAdOx1 [6] (Reino Unido) | Estudio en fase 2/3 | Estudio en fase 1/2. ►5.- Candidato a vacuna: vector viral no replicante Ad5 [7] (China) | Estudios en fase 2 | Estudios en fase 1 | Datos publicados. ►6.- Candidato a vacuna: ARNm [8] (EE. UU.) | Estudios en fase 2 | Estudios en fase 1. ►7.- Cuestiones importantes pendientes [9].
⌂ [10]
OMS: candidatos a vacuna frente al SARS-CoV-2
La OMS está haciendo un seguimiento de los estudios [11] puestos en marcha con el propósito de encontrar una vacuna frente al SARS-CoV-2. En el informe correspondiente al 9 de junio de 2020 [12] informa de la existencia de un total de 136 estudios en marcha (10 en investigación clínica y otros 126 en fases preclínicas, de estos últimos, cuatro en España).
Estudios en fases de investigación clínica
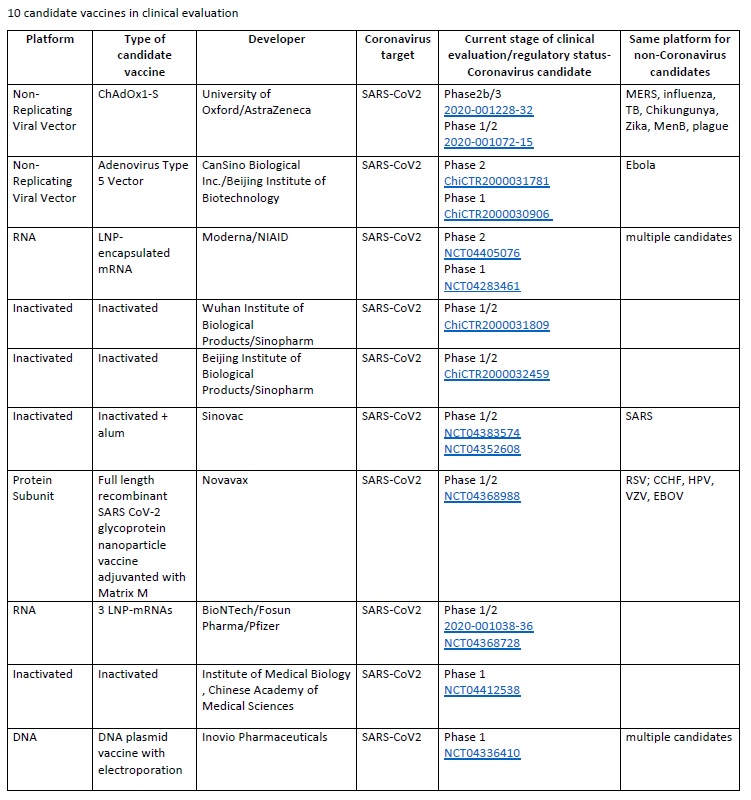 [12]De estos, solo 10 se encuentran en fase clínica (ver imagen adjunta, extraída del documento de la OMS, el 9 de junio de 2020):
[12]De estos, solo 10 se encuentran en fase clínica (ver imagen adjunta, extraída del documento de la OMS, el 9 de junio de 2020):
- 2 con un adenovirus recombinante como vector.
- 2 de ARNm.
- 4 inactivadas, una de ellas adyuvada con aluminio.
- 1 con subunidades adyuvada con MatrixM.
- 1 de ADN en plásmido mediante electroporación.
Tres de estas son las que se encuentran más avanzadas (ver tabla adjunta).
| Candidatos a vacunas frente a la COVID-19 con estudios en fase clínica más avanzados | |||
|---|---|---|---|
| Producto | Instituciones y empresas impulsoras | Fase actual y registro | |
| Plataforma | Tipo | ||
| Vector viral no replicante | ChAdOx1-S | Universidad de Oxford (RU), AstraZeneca |
Fase 2b/3: 2020-001228-32 [13] Fase 1/2: 2020-001072-15 [14] y NCT04324606 [15] |
| Adenovirus tipo 5 (Ad5) | Beijing Institute of Biotechnology (China), CanSino |
Fase 2: ChiCTR2000031781 [16] y NCT04341389 [17] Fase 1: ChiCTR2000030906 [18] y NCT04313127 [19] |
|
| ARN | ARNm en nanopartículas lipídicas | NIAID (EE. UU.), Moderna |
Fase 2: NCT04405076 [20] Fase 1: NCT04283461 [21] |
| Fuente: OMS, 9 de junio de 2020 [12] | |||
Estudios españoles en fase preclínica
Entre los 126 estudios en fase preclínica referenciados por la OMS, figuran cuatro españoles (ver tabla adjunta).
| Candidatos a vacunas frente a la COVID-19 con estudios en fase preclínica en España | ||
|---|---|---|
| Producto | Instituciones y empresas impulsoras | |
| Plataforma | Tipo | |
| Vector viral no replicante | MVA-S | Instituto de Investigación Biomédicas Augusto PI i Sunyer (IDIBAPS), Hospital Clínic, Barcelona |
| MVA | Centro Nacional de Biotecnología (CNB-CSIC), Madrid | |
| ARN | ARNm | Instituto de Investigación Biomédicas Augusto PI i Sunyer (IDIBAPS), Hospital Clínic, Barcelona |
| ARNm | Centro Nacional de Biotecnología (CNB-CSIC), Madrid | |
| Fuente: OMS, 9 de junio de 2020 [12] | ||
⌂ [10]
Registro europeo de ensayos clínicos
En el EU Clinical Trials Register [22], a fecha del 8 de junio, figuran 8 proyectos con la categoría “vaccine COVID-19”, de los que seis están relacionados con el papel de la vacuna BCG (Dinamarca, Francia, Grecia, Holanda, Hungría y Polonia) y los dos restantes corresponden al candidato a vacuna de la Universidad de Oxford (ChAdOx1-S).
⌂ [10]
Proyectos de investigación promovidos por el Instituto de Salud Carlos III
En la web del Instituto de Salud Carlos III (ISCIII) se informa de que se han financiado 124 proyectos de investigación [23] asignados al Fondo COVID-19 dotado con 24 millones de euros [24] (consultado el 9 de junio de 2020).
De todos ellos, nueve relacionados con el desarrollo de vacunas frente al SARS-CoV-2, todos ellos enmarcados en el contexto de la investigación preclínica.
| Proyectos de investigación sobre vacunas frente a la COVID-19 financiados por el ISCIII | ||
|---|---|---|
| Ref. ISCIII | Institución promotora | Materia de estudio |
| 00050 | Universidad de Santiago de Compostela | Micro-nanoesferas de muNS-Mi [25] |
| 00297 | Universidad de Santiago de Compostela | ARNm en vectores peptídicos |
| 00820 | Universidad de Zaragoza | BCG/MTBVAC |
| 00151 | Centro Nacional de Biotecnología (CNB-CSIS), Madrid | Virus vaccinia MVA |
| 00214 | Instituto de Investigación Biomédicas Augusto PI i Sunyer (IDIBAPS), Barcelona | ARNm/MVA |
| 00237 | Fundación Miguel Servet / Navarra-Biomed | Plataformas de desarrollo |
| 00901 | Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria | Virus vaccinia MVA |
| 01100 | Universidad Ramón Llull | ARNm en manopartículas poliméricas |
| 00660 | Instituto de investigación del SIDA-IRSICAIXA | Inmunología |
| Fuente: Instituto de Salud Carlos III, 9 de junio de 2020 [23] | ||
En unas recientes declaraciones del ministro de Ciencia e Investigación [26], Pedro Duque, menciona la existencia de 10 proyectos de investigación sobre vacunas financiados con fondos públicos, de los cuales destacan los dos dirigidos por el CNS-CSIS. Del proyecto dirigido por M. Esteban, dice Duque que a final de este año estará en condiciones de emprender los estudios clínicos. Y del proyecto de L. Enjuanes, la vacuna en estudio es “mucho más completa” y se podría contar con prototipos para estudiar en modelos animales a final de este año. También, usando un lenguaje coloquial, mencionó que "estamos tirándole a todo por si acaso".
⌂ [10]
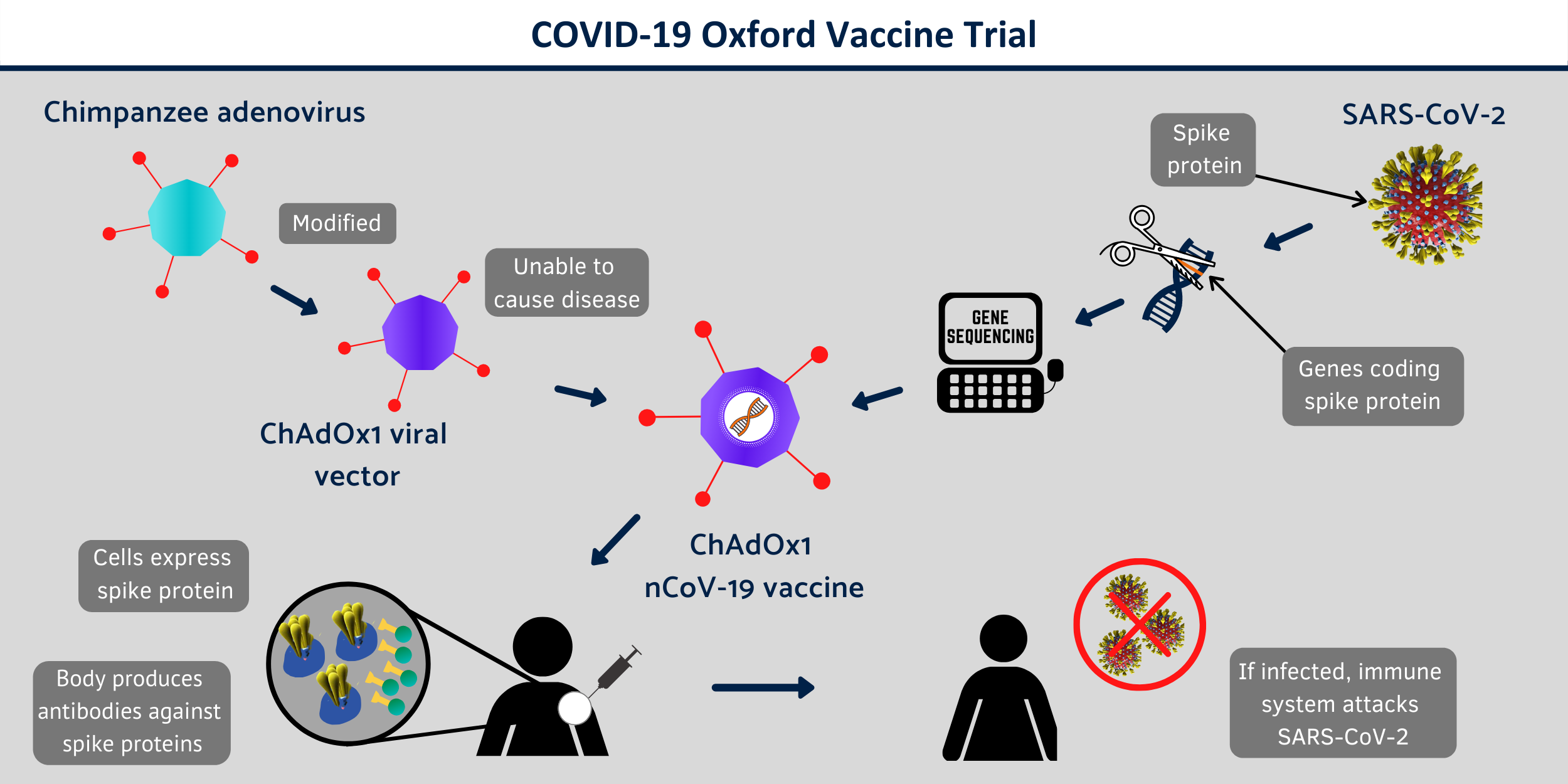
Candidato a vacuna: vector viral no replicante ChAdOx1 (Reino Unido)
[27]Vacuna atenuada con un adenovirus del chimpancé recombinante con escasa capacidad de replicación, que expresa la glicoproteína S (“spike”) del SARS-CoV-2.
COVID-19 Oxford Vaccine Trial
La Universidad de Oxford promueve uno de los candidatos a vacuna frente al SARS-CoV-2 más prometedores (ChAdOx1 nCoV-19). La web del proyecto [27] recoge información sobre los estudios en marcha dirigidos por Andrew Pollard.
 Ensayo clínico en fase 2/3 para determinar la eficacia, seguridad e inmunogenicidad de ChAdOx1 nCoV-19
Ensayo clínico en fase 2/3 para determinar la eficacia, seguridad e inmunogenicidad de ChAdOx1 nCoV-19
- Registro europeo de ensayos clínicos: EUCTR 2020-001228-32 [13].
- Información general [28] en la web del COVID-19 Oxford Vaccine Trial.
- Objetivos principales: evaluar la eficacia de ChAdOx1 nCoV-19 contra la COVID-19 en adultos (18-55 años); evaluar la seguridad en niños (5-11 años) y adultos.
- Objetivos secundarios: seguridad, tolerabilidad y reactogenicidad; eficacia frente a COVID-19 grave y no grave. Respuesta humoral y celular; seguridad de una dosis de refuerzo en ≥56 años de edad; explorar la inmunología del SARS-CoV-2.
- Ensayo controlado, aleatorizado y simple ciego. Comparador: Nimenrix y Menveo.
- Participantes: 10.260 (60 niños de 5-11 años, 10.000 de 18-64 años de edad (se excluyen las mujeres gestantes) y 200 ≥65 años). Reclutamiento en marcha.
Ensayo clínico en fase 1/2 para evaluar la eficacia, seguridad e inmunogenicidad de ChAdOx1 nCoV-19 en voluntarios adultos
- Registro europeo de ensayos clínicos: EUCTR 2020-001072-15 [14]. ClinicalTYrials.gov: NCT04324606 [15].
- Información general [29] en la web del COVID-19 Oxford Vaccine Trial.
- Objetivos principales: evaluar la seguridad y eficacia de ChAdOx1 nCoV-19.
- Objetivos secundarios: seguridad, tolerabilidad y reactogenicidad; eficacia frente a COVID-19 grave y no grave. Respuesta humoral y celular; seguridad de una dosis de refuerzo en ≥56 años de edad; explorar la inmunología del SARS-CoV-2.
- Ensayo controlado, aleatorizado y simple ciego. Comparador: Nimenrix y Menveo.
- Participantes: 18-64 años, 1112 personas. Reclutamiento finalizado.
⌂ [10]
Candidato a vacuna: vector viral no replicante Ad5 (China)
Vacuna atenuada con un adenovirus humano (Ad5) recombinante con escasa capacidad de replicación, que expresa la glicoproteína S (“spike”) del SARS-CoV-2.
Promovido y financiado por el Insitute of Biotechnology, Academy of Military Medical Sciences, PLA of China, el Jiangsu Provincial Center for Disease Control and Prevention y CanSino Biologics Inc. Según el registro chino de ensayos clínicos hay dos estudios en marcha (consultado el 9 de junio de 2020).
Ensayo clínico en fase 2, para evaluar la seguridad e inmunogenicidad de una vacuna recombinante frente al nuevo coronavirus, basada en un vector de adenovirus, en adultos mayores de 18 años de edad
- Chinese Clinical Trails Registry: ChiCTR2000031781 [16]. ClinicalTrials.gov: NCT04341389 [17].
- Objetivo: evaluación de la seguridad e inmunogenicidad de una vacuna recombinante (vector adenovirus) frente a la enfermedad por el nuevo coronavirus, en adultos sanos mayores de 18 años de edad.
- Ensayo controlado, aleatorizado y doble ciego.
- Participantes: 500 personas con >18 años de edad. Reclutamiento aun no comenzado.
Ensayo clínico en fase 1, para determinar la seguridad y tolerabilidad de distintas formulaciones de una vacuna recombinante frente al nuevo coronavirus, basada en un vector de adenovirus, en adultos mayores de 18 a 60 años de edad
- Chinese Clinical Trails Registry: ChiCTR2000030906 [18]. ClinicalTrials-gov: NCT04313127 [19].
- Objetivo: evaluación de la seguridad y tolerancia en adultos de 18 a 60 años, de tres formulaciones (dosis) del producto en estudio.
- Estudio abierto, no aleatorizado.
- Participantes: 108 en total, 36 para cada una de las tres dosis probadas (baja, media y alta). Reclutamiento finalizado (comenzóy publicados los primeros resultados obtenidos.
Datos publicados
Se han publicado recientemente los primeros resultados obtenidos en el estudio en fase 1 mencionado antes (Lancet. 2020;395(10240):1845-54 [31]).
Algunos de los aspectos más relevantes son:
- Se incluyen 108 individuos de 18-60 años, divididos en tres grupos, a los que se inyecta por vía IM una dosis baja, media y alta del producto en estudio. Los participantes no habían estado expuestos al virus SARS-CoV-2 antes ni durante el estudio (durante este permanecieron en un hotel dedicado especícamente a ello).
- Se comprueba en todos los casos que se produce una respuesta de inmunidad celular a los 14 días y que el pico de la respuesta humoral se alcanza a los 28 días, si bien la inmunogenicidad es mayor con la dosis alta, también la reactogenicidad lo es (en el estudio en fase 2 en curso se han usado las dosis baja y media).
- La respuesta, tanto la humoral como la celular, fue menor en los individuos con anticuerpos frente a adenovirus preexistentes (44-56 % entre los participantes de este estudio).
- Los parámetros de protección no son conocidos, por lo que no es posible predecir la protección conferida por las respuestas observadas en el estudio.
- Las limitaciones del estudio condicionan en buena parte la interpretación de los datos: estudio limitado al seguimiento durante los 28 días siguientes a la vacunación, escaso número de participantes, ausencia de grupo control. También que los mayores de 60 años fueran excluidos (además entre los participantes solo un 16 % tenian más de 50 años), cuando serían la principal población-diana al ser el grupo etáreo más afectado por la infección. La eficacia en este y otros grupos de edad son objeto de estudio en el ensayo en fase 2 en marcha.
- Quedan pendientes de aclarar cuestiones importantes, como la ya citada, el papel de la inmunidad previa a adenovirus tipo 5, y la respuesta inflamatoria incrementada por anticuerpos no neutralizantes en personas vacunadas y expuestas al SARS-CoV-2 después de la vacunación.
Se trata, pues, de datos muy preliminares pero que permiten seguir explorando esta línea de investigación (Lancet. 2020;395(10240):1815-6 [32]).
⌂ [10]
Candidato a vacuna: ARNm (EE. UU.)
Vacuna basada en ácido nucleicos (mRNA-1273) desarrollada por el empresa estadounidense ModernaTX, Inc. Usa un ARNm encapsulado en nanopartículas lipídicas (LNP) que codifica la expresión de la proteína S (“spike”) SARS-CoV-2, completa en su formato prefusión.
Ensayo clínico en fase 2, para evaluar la seguridad, reactogenicidad e inmunogenicidad de la vacuna mRNA-1273 en adultos mayores de 18 años
- Registro en ClinicalTrials.gov: NCT04405076 [20].
- Objetivo: evaluar la seguridad, reactogenicidad e inmunogenicidad de dos formulaciones (50 y 100 mcg) del producto mRNA-1273 en adultos de 18-54 años y en ≥55 años de edad.
- Ensayo controlado, aleatorizado y doble ciego. Comparador: placebo con suero salino.
- Participantes: 600 personas de 18 o más años de edad. Reclutando participantes.
Ensayo clínico en fase 1 para evaluar la saguridad e inmunogenicidad de distintas formulaciones del producto mRNA-1273 en adultos sanos de 18 o más años de edad
- Registro en ClinicalTrials.gov: NCT04283461 [21].
- Evaluar la seguridad e inmunogenicidad de una pauta de dos dosis con 28 días de separación del producto mRNA-1273 en 5 formulaciones o dosis.
- Ensayo abierto, no aleatorizado.
- Participantes: 155 personas de 18 o más años de edad. Reclutando participantes.
⌂ [10]
Cuestiones importantes pendientes
Se necesitan vacunas eficaces y seguras, y pronto
Se necesitan de forma urgente vacunas eficaces para controlar la difusión o al menos para paliar el impacto de la pandemia actual. Pero, además, estas vacunas han de ser seguras. Todo esto lleva tiempo [33] y forzar los tiempos de desarrollo, sacrificando parcialmente la seguridad, puede llevar a un desatre, que podría, además comprometer la confianza global en las vacunaciones y los sistemas de regulación de las mismas (JAMA. 2020, 26 de mayo [34]).
Las autoridades y los equipos de investigación de los países que lideran la carrera por la vacuna de la COVID-19 con frecuencia emiten declaraciones anunciando grandes resultados en un corto plazo de tiempo [35], lo cual no se corresponde con la realidad de la investigación, y promueven la percepción de que contar con una vacuna es un objetivo al alcance de la mano en poco tiempo, incluso a lo largo de este 2020. A la vez, aun sin vacunas hoy día, ya hay quienes propagan [36] sus "seguros" peligros y males. Hay infecciones, como las del VIH y el VRS, sometidas a una intensa investigación desde hace bastantes años sin que se hayan conseguido avances relevantes. En otros casos, el desarrollo de una vacuna lleva un tiempo de 10 a 15 años, por lo que contar con una vacuna suficientemente eficaz y segura a lo largo de 2021 sería un gran éxito y un hito sin precedentes.
Estrategias de vacunación
El debate de las estrategias de vacunación también está sobre la mesa, buscando optimizar el impacto en los grupos poblacionales más afectados, las personas de mayor edad, que son también personas en las que la respuesta inmune puede ser subóptima, así como otros grupos prioritarios como los sanitarios, a la vez que debe sortearse las dificultades impuestas por las dudas y la desinformación (JAMA. 2020, 18 de mayo [37]).
Logística
Otro reto de enormes dificultades lo constituye la propia fabricación y distribución de millones de dosis vacunales en todos los continentes en un tiempo récord. Los países y las empresas tratan de prepararse para ello, y en este terreno se cuenta con las ventajas que proporcionan las novedosas plataformas de producción de las nuevas vacunas basadas en ácidos nucleícos (ADN y ARN) y en vectores virales, que permitirían una producción masiva en tiempo y costes más contenidos.
El control de la pandemia se está pareciendo a un juego estratégico político-económico
La mayor parte de los proyectos de investigación en torno a las vacunas frente al SARS-CoV-2 están liderados por empresas privadas y por países con mejor estatus económico, con Estados Unidos y China a la cabeza, que junto con Rusia [38] y la Unión Europea [39], pugnan por asegurarse un acceso preferente a las futuras vacunas. Por una parte, financiando con importantes aportaciones económicas [40] investigaciones propias, y, por otra, como en el caso de EE. UU. tejiendo alianzas con fabricantes de otras latitudes (acuerdo de EE. UU. con el proyecto de la Universidad de Oxford y AstraZeneca [41]).
Aspectos éticos
Los acuerdos de acceso preferente a las futuras vacunas plantean enormes brechas éticas, pues aunque la pandemia afecta a todo el planeta, serán los países más endebles los que sufrirán el mayor impacto. Asegurar el acceso a las vacunas a un coste asequible es el objetivo por los que se mueven ya diversas entidades.
Estas son algunas de las incógnitas que plantea el desarrollo de las vacunas frente a la COVID-19, pero no las únicas (Lancet. 2020, 6 de junio [42]), lo que constituye una empresa de extraordinaria envergadura y dificultad, que esperamos tenga un buen final.
-oOo-
Más información:
- OMS. Draft landscape of COVID-19 candidate vaccines [11].
- Vaccine Centre at the London School of Hygiene & Tropical Medicine. COVID-19 vaccine development pipeline [43].
- STAT´s Covid-19 drugs and vaccines tracker [44].
- New York Times, 10 de junio de 2020. Coronavirus Vaccine Tracker [45].
- Craven J, RAPS. COVID-19 vaccine tracker [46].
- Whyte J, Offit PA. The COVID Vaccine Timeline: Is 12-18 Months Realistic? Medscape, 4 de mayo de 2020 [47].
- Oakes K. COVID-19 Vaccine Race a Balance of Safety and Speed. Medscape, 20 de abril de 2020 [48].
- WHO vaccine pipeline tracker [49].
- Lurie N, et al. Developing Covid-19 Vaccines at Pandemic Speed. N Engl J Med. 2020;382:1969-73 [50].
- Chen WH, et al. The SARS-CoV-2 Vaccine Pipeline: an Overview. Current Tropical Med Rep. 2020;7:61-4 [51].
- Le TT, et al. The COVID-19 vaccine development landscape. Nature Rev Drugs Discovery. 2020;19:305-6 [52].
- Otras noticias anteriores sobre investigación en vacunas [53] en esta web.
- Otras noticias anteriores sobre coronavirus [54] en esta web.
Otras referencias:
- OMS, 15 de julio de 2020 [55]. More than 150 countries engaged in COVID-19 vaccine global access facility.
- Jackson LA, et al. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. N Eng J Med. 2020, 14 de julio [56]. Comentario en CIDRAP, 15 de julio de 2020 [57].
- Heaton PM. The Covid-19 Vaccine-Development Multiverse. N Eng J Med. 2020, 14 de julio [58].
- AEMPS, 9 de julio de 2020 [59]. España formará parte del proceso de producción de la vacuna contra la COVID-19 que desarrolla Moderna. ABC, 9 de julio de 2020 [60]. ROVI y Moderna fabricarán en Madrid el llenado y acabado de la «vacuna Covid-19». Escogen las instalaciones en la capital de España para desarrollar la llamada ARNm-1273.
- Madhi S. COVID-19 vaccine trial in South Africa: everything you need to know. The Conversation, 8 de julio de 2020 [61].
- Skeptical Raptor. Coronavirus – COVID-19 vaccines [62].
- Vaxopedia. COVID-19 Vaccines update [63].
- Lowe D. In the pipeline [64]. Science Transltional Medicine.
- Ganiyu AO. Pressure is on to develop a COVID-19 vaccine, but corners can’t be cut. The Conversation, 7 de julio de 2020 [65].
- Nguyen LC, et al. Evaluating use cases for human challenge trials in accelerating SARS-CoV-2 vaccine development. Clin Infect Dis. 2020, 6 de julio [66].
- O’Callaghan KP, et al. Developing a SARS-CoV-2 Vaccine at Warp Speed. JAMA. 2020, 6 de julio [67].
- Lurie N, et al. The Development of COVID-19 Vaccines. Safeguards Needed. JAMA. 2020, 6 de julio [68].
- Pfizer, BioNTech release encouraging data on COVID vaccine candidate. CIDRAP, 2 de julio de 2020 [69].
- Deming ME, et al. Accelerating Development of SARS-CoV-2 Vaccines — The Role for Controlled Human Infection Models. N Engl J Med. 2020, 1 de julio [70].
- Brunk D. Phase 3 COVID-19 Vaccine Trials Launching in July, Expert Says. Medscape, 1 de julio de 2020 [71].
- McKenna M. Where Should Covid-19 Vaccines Be Tested? It's a Moving Target. Wired, 1 de julio de 2020 [72].
- Reuters, 30 de junio de 2020 [73]. CanSino's COVID-19 vaccine candidate approved for military use in China.
- Mahase E. Covid-19: Oxford team begins vaccine trials in Brazil and South Africa to determine efficacy. BMJ. 2020;369:m2612 [74].
- Fuller DH, et al. Amplifying RNA Vaccine Development. N Engl J Med 2020; 382:2469-71 [75].
- The COCONEL Group. A future vaccination campaign against COVID-19 at risk of vaccine hesitancy and politicisation. Lancet Infect Dis. 2020;20(7):769-70 [76].
- Gupta T, et al. Potential adjuvants for the development of a SARS-CoV-2 vaccine based on experimental results from similar coronaviruses. Int Immunopharmacology. 2020, 18 de junio [77].
- Velavan TP, et al. Herd Immunity and Vaccination of children for COVID19. Int J Infect Dis. 2020, 23 de junio [78].
- Mello MM, et al. Ensuring Uptake of Vaccines against SARS-CoV-2. N Engl J Med. 2020, 26 de jun [79].
- Wise C. Covid-19: Health and care workers will be “highest priority” for vaccination, says JCVI. BMJ. 2020;369:m2477 [80].
- Bollyky TJ, et al. The Equitable Distribution of COVID-19 Therapeutics and Vaccines. JAMA. 2020;323(24):2462-3 [81].
- Trogen B, et al. Adverse Consequences of Rushing a SARS-CoV-2 VaccineImplications for Public Trust. JAMA. 2020;323(24):2460-1 [34].
- DeRoo SS, et al. Planning for a COVID-19 Vaccination Program. JAMA. 2020;323(24):2458-9 [37].
- Collins FS, et al. Accelerating COVID-19 Therapeutic Interventions and Vaccines (ACTIV)An Unprecedented Partnership for Unprecedented Times. JAMA. 2020;323(24):2455-7 [82].
- Ansede M, Galocha A. El sueño de la vacuna española contra la covid. El País, 21 de junio de 2020 [83].
- Global governance for COVID-19 vaccines. Lancet. 2020;395(10241):1883 [84].
- Usher AD. COVID-19 vaccines for all? Lancet. 2020;395(10240):1822-3 [85].
- Mullard A. COVID-19 vaccine development pipeline gears up. Lancet. 2020, 6 de junio [42].
- Rubin R. Challenge Trials—Could Deliberate Coronavirus Exposure Hasten Vaccine Development? JAMA. 2020;324(1):12-4 [86].
- Developing a vaccine for covid-19. BMJ. 2020;369:m1790 [87].
- Doheny K. COVID-19: latest updates. Medscape, 10 de junio de 2020 [88].
- Council for International Organizations of Medical Sciences (CIOMS). 2016 International ethical guidelines for health-related research involving humans [89].